「Shank」の版間の差分
Marikohayashi (トーク | 投稿記録) 細編集の要約なし |
Marikohayashi (トーク | 投稿記録) 細編集の要約なし |
||
| 1行目: | 1行目: | ||
Shank<br>英:Shank (SH3 and multiple ankyrin repeat domains protein)<br>同義語:ProSAP (Proline-rich synapse-associated protein), CortBP (Cortactin-binding protein), Somatostatin receptor-interacting protein (SSTRIP), GKAP/SAPAP-interacting protein, SPANK, Synamon<br><br> Shankは、多くの蛋白質と相互作用する2000個以上のアミノ酸からなる巨大な足場蛋白質である.選択的スプライシングによりさまざまな遺伝子産物が得られるが、最も長いものはアンキリンリピート、SH3ドメイン、PDZドメイン、プロリンリッチ配列、SAMドメインからなる.それぞれのドメインが相互作用する蛋白質を持つので、結合蛋白質は多岐にわたる.自閉症との関連が指摘されている. <br> | Shank<br>英:Shank (SH3 and multiple ankyrin repeat domains protein)<br>同義語:ProSAP (Proline-rich synapse-associated protein), CortBP (Cortactin-binding protein), Somatostatin receptor-interacting protein (SSTRIP), GKAP/SAPAP-interacting protein, SPANK, Synamon<br><br> Shankは、多くの蛋白質と相互作用する2000個以上のアミノ酸からなる巨大な足場蛋白質である.選択的スプライシングによりさまざまな遺伝子産物が得られるが、最も長いものはアンキリンリピート、SH3ドメイン、PDZドメイン、プロリンリッチ配列、SAMドメインからなる.それぞれのドメインが相互作用する蛋白質を持つので、結合蛋白質は多岐にわたる.自閉症との関連が指摘されている. <br> | ||
(見出しは==で囲んで下さい.)<br>==GFPとは==<br>(はじめに解説用語について定義をしてください。)<br> 緑色蛍光蛋白質とは、オワンクラゲAequorea victoria由来の分子量約27,000の緑色の蛍光を発する蛋白質である。1960年代に下村脩により発光蛋白質であるエクオリンの精製の過程で同定された。エクオリンは生体内で緑色発光を示すが、精製標品は青色発光を示す。そのため、生体内ではエクオリンとGFPが複合体を作りエクオリンのエネルギーがGFPに移行する事により緑色の発光をすると考えられている。<br>(図は以下の様に入力します。) | (見出しは==で囲んで下さい.)<br>==GFPとは==<br>(はじめに解説用語について定義をしてください。)<br> 緑色蛍光蛋白質とは、オワンクラゲAequorea victoria由来の分子量約27,000の緑色の蛍光を発する蛋白質である。1960年代に下村脩により発光蛋白質であるエクオリンの精製の過程で同定された。エクオリンは生体内で緑色発光を示すが、精製標品は青色発光を示す。そのため、生体内ではエクオリンとGFPが複合体を作りエクオリンのエネルギーがGFPに移行する事により緑色の発光をすると考えられている。<br>(図は以下の様に入力します。) | ||
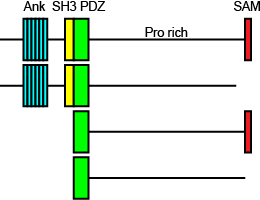
[[Image:Shank.png|frame|right|300px|図1 Shank ドメイン構造と選択的スプライシング産物]] | |||
図1 Shank ドメイン構造と選択的スプライシング産物 | |||
<br>図2 Shank PDZ ドメインによるダイマー形成とGKAPとの相互作用 12954649 | <br>図2 Shank PDZ ドメインによるダイマー形成とGKAPとの相互作用 12954649 | ||
| 7行目: | 11行目: | ||
図3 Shank PDZ ドメインとbetaPIXとの相互作用 20117114 | 図3 Shank PDZ ドメインとbetaPIXとの相互作用 20117114 | ||
<br>図4 Shank SAM ドメインの結晶構造 16439662 <br><br>Tsienらによる。<br> | <br>図4 Shank SAM ドメインの結晶構造 16439662 <br><br>Tsienらによる。<br><br> | ||
(内部リンク(脳科学関係の用語)、Wikipediaへのリンク(それ以外の用語)は初出時のみ、以下の様に入れて下さい。リンク先がない場合は、赤字になりますが、後で編集部で調整致します。)<br>また、[[Förster共鳴エネルギー移動]](FRET)などを応用し[[wikipedia:jp:センサー|センサー]]としての応用も可能で<br>(文献は次の様にPubmed IDで入力して下さい。)<br><ref><pubmed> 16242400 </pubmed></ref><br>発色団形成のメカニズム | (内部リンク(脳科学関係の用語)、Wikipediaへのリンク(それ以外の用語)は初出時のみ、以下の様に入れて下さい。リンク先がない場合は、赤字になりますが、後で編集部で調整致します。)<br>また、[[Förster共鳴エネルギー移動]](FRET)などを応用し[[wikipedia:jp:センサー|センサー]]としての応用も可能で<br>(文献は次の様にPubmed IDで入力して下さい。)<br><ref><pubmed> 16242400 </pubmed></ref><br>発色団形成のメカニズム | ||
| 19行目: | 23行目: | ||
(次のように入力すると自動的に参考文献リストが出来ます)<br><references /><br>↑ O SHIMOMURA, F H JOHNSON, Y SAIGA<br>Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. <br>J Cell Comp Physiol: 1962, 59();223-39 [PubMed:13911999] [WorldCat.org] <br>↑ Atsushi Miyawaki<br>Innovations in the imaging of brain functions using fluorescent proteins. <br>Neuron: 2005, 48(2);189-99 [PubMed:16242400] [WorldCat.org] [DOI] <br>↑ Ben N G Giepmans, Stephen R Adams, Mark H Ellisman, Roger Y Tsien<br>The fluorescent toolbox for assessing protein location and function. <br>Science: 2006, 312(5771);217-24 [PubMed:16614209] [WorldCat.org] [DOI] | (次のように入力すると自動的に参考文献リストが出来ます)<br><references /><br>↑ O SHIMOMURA, F H JOHNSON, Y SAIGA<br>Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. <br>J Cell Comp Physiol: 1962, 59();223-39 [PubMed:13911999] [WorldCat.org] <br>↑ Atsushi Miyawaki<br>Innovations in the imaging of brain functions using fluorescent proteins. <br>Neuron: 2005, 48(2);189-99 [PubMed:16242400] [WorldCat.org] [DOI] <br>↑ Ben N G Giepmans, Stephen R Adams, Mark H Ellisman, Roger Y Tsien<br>The fluorescent toolbox for assessing protein location and function. <br>Science: 2006, 312(5771);217-24 [PubMed:16614209] [WorldCat.org] [DOI] | ||
(執筆者:林 真理子、担当編集委員:柚崎 通介) | (執筆者:林 真理子、担当編集委員:柚崎 通介) | ||
<br> | <br> | ||
2012年5月23日 (水) 15:29時点における版
Shank
英:Shank (SH3 and multiple ankyrin repeat domains protein)
同義語:ProSAP (Proline-rich synapse-associated protein), CortBP (Cortactin-binding protein), Somatostatin receptor-interacting protein (SSTRIP), GKAP/SAPAP-interacting protein, SPANK, Synamon
Shankは、多くの蛋白質と相互作用する2000個以上のアミノ酸からなる巨大な足場蛋白質である.選択的スプライシングによりさまざまな遺伝子産物が得られるが、最も長いものはアンキリンリピート、SH3ドメイン、PDZドメイン、プロリンリッチ配列、SAMドメインからなる.それぞれのドメインが相互作用する蛋白質を持つので、結合蛋白質は多岐にわたる.自閉症との関連が指摘されている.
(見出しは==で囲んで下さい.)
==GFPとは==
(はじめに解説用語について定義をしてください。)
緑色蛍光蛋白質とは、オワンクラゲAequorea victoria由来の分子量約27,000の緑色の蛍光を発する蛋白質である。1960年代に下村脩により発光蛋白質であるエクオリンの精製の過程で同定された。エクオリンは生体内で緑色発光を示すが、精製標品は青色発光を示す。そのため、生体内ではエクオリンとGFPが複合体を作りエクオリンのエネルギーがGFPに移行する事により緑色の発光をすると考えられている。
(図は以下の様に入力します。)
図1 Shank ドメイン構造と選択的スプライシング産物
図2 Shank PDZ ドメインによるダイマー形成とGKAPとの相互作用 12954649
図3 Shank PDZ ドメインとbetaPIXとの相互作用 20117114
図4 Shank SAM ドメインの結晶構造 16439662
Tsienらによる。
(内部リンク(脳科学関係の用語)、Wikipediaへのリンク(それ以外の用語)は初出時のみ、以下の様に入れて下さい。リンク先がない場合は、赤字になりますが、後で編集部で調整致します。)
また、Förster共鳴エネルギー移動(FRET)などを応用しセンサーとしての応用も可能で
(文献は次の様にPubmed IDで入力して下さい。)
<ref><pubmed> 16242400 </pubmed></ref>
発色団形成のメカニズム
蛋白質が翻訳されると補酵素等の非存在下でSer65–Tyr66–Gly67のアミノ酸残基の自己脱水縮合により発色団が形成される。X線構造解析の結果からはこの発光団を囲むようにしてβシートが存在し(β-canあるいはβ-barrel構造とも呼ばれる)、周囲の環境から発色団を分離している。そのため、GFPの蛍光は比較的外的環境の影響を受けにくいが、酸性域では蛍光強度が低下することが有る。基本的には単量体であるが、高濃度の場合は2量体を形成する傾向もある。
GFP関連分子
GFP色変異体
(小見出しは===で囲んで下さい.以下更に細目を作りたいときには、=を増やして下さい.)
===GFP色変異体===
セリン65をスレオニンに置き換えることでGFPの蛍光強度が向上するという発見を嚆矢とし、GFPに様々な変異を入れ、緑色ばかりではなく、青色から黄色までの変異体を作られている。
GFPを利用したセンサー蛋白質
GFPを用い、様々な細胞内現象を蛍光を使って読み出すためのセンサーが開発されている。
一番始めに報告されたのは、細胞内カルシウム濃度を測定することができるCameleonであった。これは、カルシウム結合タンパク質の立体構造変化をシアン蛍光タンパク質と黄色蛍光タンパク質間のFRETを用い読み出すのものであった。
これをきっかけに、様々なセンサータンパク質がこれまで開発されている。
他種動物由来GFP様蛋白質
GFPの変異体でもっとも長波長の傾向を示す変異体でも黄色(ピーク波長525 nm付近)までであった。GFPとの二重染色のためには、赤色蛍光タンパク質が望ましかったが、GFPを変異体させることからは赤色蛍光タンパク質の作成は成功しなかった。
Lukyanovらのグループは様々な腔腸動物を調べ、Discoma sp.由来のDsRedが、赤色蛍光を示す蛍光蛋白質である事を初めて報告した。元々は蛍光を示さないタンパク質であったが、変異を導入することにより赤色蛍光を持つようになった。当初報告されたDsRedは四量体であったが、変異をいれ単量体にしたmRFPやその波長の変異体が現在までに開発されている。mOrange, mCherry, mStrawberryなど、果物の名前が付けられた物が多く、mFruitsシリーズとしても知られる[3]。
関連項目
(関連する項目を記入して下さい。現在のところ、脳科学辞典の項目として存在しなくても構いません。)
赤色蛍光蛋白質
*赤色蛍光蛋白質
青色蛍光蛋白質
シアン蛍光蛋白質
黄色蛍光蛋白質
Cameleon
G-CaMP
参考文献
(次のように入力すると自動的に参考文献リストが出来ます)
<references />
↑ O SHIMOMURA, F H JOHNSON, Y SAIGA
Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea.
J Cell Comp Physiol: 1962, 59();223-39 [PubMed:13911999] [WorldCat.org]
↑ Atsushi Miyawaki
Innovations in the imaging of brain functions using fluorescent proteins.
Neuron: 2005, 48(2);189-99 [PubMed:16242400] [WorldCat.org] [DOI]
↑ Ben N G Giepmans, Stephen R Adams, Mark H Ellisman, Roger Y Tsien
The fluorescent toolbox for assessing protein location and function.
Science: 2006, 312(5771);217-24 [PubMed:16614209] [WorldCat.org] [DOI]
(執筆者:林 真理子、担当編集委員:柚崎 通介)
Shank (SH3 and multiple ankyrin repeat domains protein) [別名:ProSAP (Proline-rich synapse-associated protein) / CortBP (Cortactin-binding protein) / Somatostatin receptor-interacting protein (SSTRIP) / GKAP/SAPAP-interacting protein / SPANK / Synamon]1-3).
==サブタイプとドメイン構造==
Shankには異なった遺伝子にコードされるShank1、2、3がある.Shankのドメイン構造はアミノ端から、アンキリンリピート、SH3 (Src homology 3)ドメイン、PDZ (PSD-95, Dlg, Zo-1)ドメイン、1000残基以上に及ぶプロリン、セリン、グリシンに富む配列、SAM (Sterile alpha motif)からなる(図4).選択的スプライシングにより、アンキリンリピートやSH3ドメイン、SAMドメインを欠くものもある.
Shank分子内、あるいはShank分子間の相互作用としては、アンキリンリピートとSH3ドメインが相互作用する 15496675 ほか、PDZドメインはホモ二量体を12954649、SAMドメインは多量体を 16439662 形成する.このPDZドメインによるホモ二量体形成には、PDZドメイン本来の蛋白質結合部位は関与しないので、二量体を形成しても、他のPDZリガンドは結合できる.一方、結晶化されたSAMドメインは一周6分子の螺旋状ポリマーを形成しており、更にこの螺旋が側面で会合して、Zn2+イオンに依存性の二次元の広がりをもつシートを形成する(図3).但し、SAMドメインの大きさはShank全長の3%にしか相当しないので、上流の長い配列も含めて大きなポリマーを形成できるかどうかは不明である.
==Shankと相互作用する蛋白質==
受容体:グルタミン酸受容体のうち、三量体型GTP結合蛋白質(G蛋白質)を介してホスホリパーゼCを活性化するmGluR1α,mGluR5のC末端と、GluRδ2のC末端付近の細胞内領域の内部配列がShankのPDZドメインに結合する. このうち、mGluR1α, mGluR5のC末端側の細胞内領域のプロリンを含む配列がShank結合蛋白質であるHomerのEVH1ドメインにも結合する .更に、ShankのPDZドメインには同じくG蛋白質共役型受容体であるソマトスタチンレセプターⅡもアゴニスト依存的に結合する.
シナプス足場蛋白質:GKAP(Guanylate kinase associated protein)[別名SAPAP(SAP-90/PSD-95 associated protein)/DAP (DLG-associated protein)]のC末端もShankのPDZドメインに結合する.GKAPのN末側にある14アミノ酸からなる繰り返し配列は、PSD-95、S-SCAM(synaptic scaffolding molecule)などのMAGUK(Membrane associated guanylate kinase)ファミリー蛋白質のグアニル酸キナーゼドメインに結合する.PSD-95はNMDA型グルタミン酸受容体に直接結合するほか、TARP (transmembrane AMPA receptor regulatory protein)を介してAMPA型グルタミン酸と相互作用する.
GKAPのように、受容体に結合するPSD-95などのMAGUKファミリー蛋白質とShankとの橋渡しをする蛋白質には、他にIRS-p53(Insulin receptor substrate p53)がある.IRS-p53はN末側に糸状側枝のような細胞表面の突起を形成する細胞膜の内側に結合する性質を持つI-BAR (Inverted Bin-Amphiphysin-RVS)ドメイン、中央付近に低分子量GTP結合蛋白質であるCdc42に結合するCRIB(Cdc42/Rac interactive binding motif)、C末付近にSH3ドメイン、C末にPDZドメイン結合モチーフをもつ.C末がPSD-95に、SH3ドメインがShankのプロリン配列に結合することで、PSD-95とShankを架橋できる.この相互作用は、活性型のCdc42によって促進されるが、Shank1との相互作用の結果、IRS-p53による糸状側枝の形成は抑制される.
HomerはN端側のEVH1ドメインでShankのプロリン配列に結合する一方、C端側のコイルドコイルで逆平行四量体を形成するので、Shankを架橋してポリマーを形成することができる.実際に細胞内では、Shankは状況に応じてその結合蛋白質も含めた複雑な高次複合体を形成しているのではないかと推測される.
細胞骨格:アクチン結合蛋白質と相互作用することで、受容体を含むシナプス後肥厚と細胞骨格をつなぐ働きを持つ.アクチン結合蛋白質でのうち、Abp1(Actin binding protein 1)とコートアクチンのSH3ドメインがプロリン配列に結合する.また、上記のIRS-p53も、N末側のI-BARドメインがアクチン結合活性をもつ.
SPAR(Spine associated Rap-GAP)はその名の通りRasファミリー低分子量GTP結合蛋白質であるRapのGTP水解を促すだけでなく、アクチン結合活性をもち、かつPSD-95のグアニル酸キナーゼドメインに結合する多機能な蛋白質である.PSD-Zip70およびProSAPip (ProSAP interacting protein)はコイルドコイルに富むSPAR結合蛋白質であるが、そのC末端がShankのPDZドメインに結合する.これもまた、PSD-95とShankをつなぐルートの一つである.
この他、Shankのアンキリンリピートに結合し、多量体を形成するSharpin、ShankのPDZドメインに結合する一方、DH(Dbl homology)ドメイン、PH(pleckstrin homology)ドメインによりRac1/Cdc42を活性化、更にSH3ドメインによりRac1/Cdc42のエフェクターであるPAK (p21 activated kinase)とも結合するβPIXなどの結合蛋白質も同定されている.
==発現分布==
いずれのサブタイプも脳に広範に発現している。また、末梢臓器にも発現していることが知られている。細胞レベルでは、シナプス後部、特にシナプス後肥厚(PSD)に多く分布している.
生理機能
Shankを神経細胞に過剰発現すると樹状突起棘の肥大化が起こり、特にShank結合蛋白質であるHomerとの共発現は樹状突起棘を更に大きくする 4) .さらに、本来、樹状突起棘を持たない抑制性の小脳顆粒細胞にShankを導入すると、 NMDA型やAMPA型のグルタミン酸受容体をもつ樹状突起棘を形成するようになる15814786.Shank分子間のドメイン間相互作用によりオリゴマーを形成するShankと、両端に2つずつのリガンド結合部位をもつ逆平行4量体を形成するHomerは互いに架橋して、高次のネットワーク構造を形成することから、このShankとHomerの高次複合体がPSDの骨格となると考えられる.
さらに、上記のShank結合蛋白質の顔ぶれは、Shankがシナプス後膜近傍で、他の1,2の蛋白質を介した間接的な相互作用を含めて、神経伝達物質受容体、アクチン細胞骨格、低分子量GTP結合蛋白質と相互作用していることを示す.このことから、ShankはPSDにおけるハブとして、シナプス伝達から樹状突起棘の形態制御に至る、神経可塑性の鍵を握る分子であると考えることができる.
==Shank遺伝子の異常==
自閉症のごく一部の患者でShank2ならびに3の変異が報告されている.また、シナプスの形成に関与し、Shankにも結合するシナプス接着分子であるニューロリギンのうちNLGN3およびNLGN4の変異も自閉症に関与することが報告されており、シナプス形成の異常が発症の原因となっていることが示唆されている.また、脆弱X症候群など、シナプスの形成不全が背景にある疾患で、自閉症の症状を伴うものもある5).
Shank1のノックアウトマウスでは、樹状突起棘やシナプス後肥厚がやや小さくなり、シナプス伝達効率が低下していた .また、Shankに結合するGKAPやHomerの樹状突起棘やシナプス後肥厚に対する局在が減少していた.行動面では、不安に関連した行動がよく見られ、文脈的恐怖条件付け試験の成績は良くなかった反面、海馬長期増強現象(LTP)と空間学習の成績は野生型より向上していた.こういった研究結果を解釈する際には、Shankには3つのサブタイプがあるので、単独のノックアウトや変異の場合、他のサブタイプによる補完が行われる可能性があることを念頭に置く必要がある.
SHANK1 (SH3 and multiple ankyrin repeat domains protein); SPANK-1; SSTRIP (Somatostatin receptor-interacting protein); synamon, proline-rich synapse-associated protein, GKAP/SAPAP-interacting protein SHANK2; AUTS17; CORTBP1; CTTNBP1; ProSAP1; SHANK; SPANK-3 Cortactin-binding protein 1 Short name=CortBP1 Proline-rich synapse-associated protein 1 Shank1 Shankの複雑なドメイン構造を反映して、多数の結合タンパク質が知られている。 DLGAP1/GKAP 10488079, 10433268 PDZ domain – C term Phospholipse beta 3 15632121 PDZ domain – C term G protein-coupled alpha-latrotoxin receptor CL1 10958799 PDZ domain – C term somatostatin receptor subtype 2 10551867 PDZ domain – C term Na+/H+ exchanger 3 16293618 PDZ domain – C term cystic fibrosis transmembrane conductance regulator 14679199 PDZ domain – C term Cortactin 10433268, 9742101 Proline-rich – SH3. Multimerization of SAM 10433268 Homer 10433269 Proline-rich – EVH1 Spectrin-alpha 11509555 Ankyrin repeats Sharpin 11178875 Ankyrin repeats IRSp53 12504591 Proline-rich – SH3 GluR delta 2 15207857 C-term-PDZ Dynamin 2 11583995. Proline-rich – Proline-rich
Abp1 15014124 Proline-rich – SH3 ProSAPiP1 16522626 PDZ domain – C term GluA1 16606358 PDZ domain – C term mGluR1,5 10433269 PDZ domain – C term βPIX 12626503 PDZ domain – C term dendrite arborization and synapse maturation 1 (Dasm1) 15340156 PDZ domain – C term 神経細胞に発現することで、スパイン形成を誘導し、また、スパインサイズを大きくする。結合タンパク質Homerとの共発現でこの作用はさらに顕著になる。 このようなスパイン形成における機能は、Shank自身がSAMドメインを介してポリマーを形成すること、また、Homerとの相互作用によりポリマーを形成することで、構造的な役割を担うことで説明できる。 自閉症との関連 自閉症との関連については、Shank3が最初に報告されたが、17173049、その後、Shank2 20531469, Shank1 22503632についても報告されている。Phelan–McDermid 症候群は染色体22q13部位の欠失によるもので、Shank3 の異常が原因の一つと考えられている。また、Shank3のノックアウトマウスは社会的相互作用の欠如や過剰な毛繕いなど自閉症様の表現型を呈する21423165。また、自閉症患者にみられるShank3のC末の欠失変異体は、優性にShank3のプロテアーゼ分解を促進して、シナプスの形成を阻害する21565394。