Signal Transducers and Activator of Transcription 3
英:Signal Transducers and Activator of Transcription 3、英略語:STAT3
シグナル伝達と転写活性化を行うことで、分化や生存、増殖などを調節するタンパク質の一群、Signal Transducers and Activator of Transcription (STAT) ファミリー分子の一つ。これまでSTATファミリー分子としては、STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6の7種類が報告されている[1][2]。STAT3は非活性化状態時では細胞質に局在するが、活性化したJanus kinase(JAK)によってチロシンリン酸化を受け、核内移行し目的遺伝子を活性化する転写因子となる。この活性化経路はJAK/STAT経路と呼ばれている[3]。
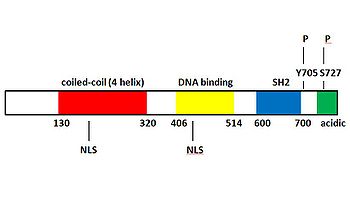
STAT3の構造と活性化のメカニズム
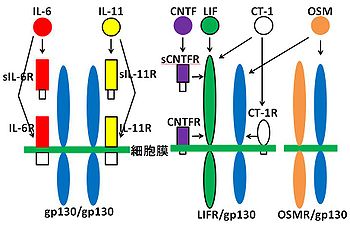
免疫系に作用するサイトカインとして同定されたinterleukin-6(IL-6)は、信号伝達に必須な受容体コンポーネントとして膜タンパク質glyco protein(gp130)を共通に利用するIL-6ファミリーサイトカインの一つである。IL-6ファミリーサイトカインは他にも、interleukin-11(IL-11)、oncostatin M、Leukemia Inhibitory Factor(LIF)、Ciliary Neurotrophic Factor(CNTF)などが含まれる[4])。IL-6ファミリーサイトカインは細胞膜上のサイトカイン受容体複合体中のサイトカイン特異的結合鎖と結合することで、gp130を含む信号伝達鎖の二量体化がおこる(図2)。gp130はIL-6ファミリーサイトカイン共通かつ必須の信号伝達因子である。その後、信号伝達鎖の細胞内領域に会合するJAKが活性化され、信号伝達鎖の細胞内領域中のチロシン残基をリン酸化する。リン酸化されたチロシン残基に、転写因子STAT3が自身のSH2ドメインを介して会合、近接したJAKによりチロシンリン酸化(チロシン705)を受けることで活性化する[5]。チロシンリン酸化されたSTAT3分子はホモ二量体あるいは異なるSTATファミリー分子間でヘテロ二量体を形成し核へ移行した後、目的遺伝子の転写を制御する。JAK/STAT3経路はIL-6ファミリーやinsulin-like growth factor-1 (IGF-1) など複数のサイトカインや増殖因子の刺激により活性化することが知られている[6][7][8]。図1にSTAT3の構造を示す。マウスSTAT3は770アミノ酸残基から構成され、DNA結合ドメインやリン酸化チロシン残基に結合するSH2(src homology 2)ドメインを持つ。またリン酸化を受けることでSTAT3の活性に関わる705番目のチロシンと727番目のセリンを有する。
神経系での働き①:脳内におけるアストロサイト分化誘導
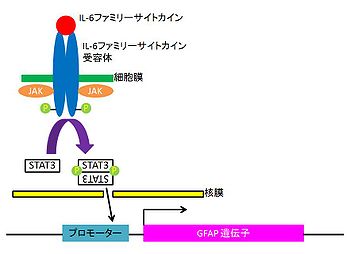
IL-6ファミリーサイトカインの刺激により活性化したSTAT3は転写活性化因子としてグリア線維性酸性タンパク質glial fibrillary acidic protein (GFAP)のプロモーターに結合し、転写を促進する。GFAPはアストロサイトで特異的に発現するタンパク質であり、これまで神経幹細胞Neural stem cell (NSC) の培養系にIL-6ファミリーサイトカインを添加すると、JAK/STAT3経路を活性化することでアストロサイトへの分化が促進されることが明らかとなっている(図3)[4][6]。また、STAT3をシグナル経路下流の転写因子とするIL-6ファミリーサイトカインとSmadをシグナル経路下流の転写因子とする骨形成因子bone morphogenetic protein (BMP)群(TGF-βスーパーファミリー)の両者は別々の受容体システムを介し、相乗的にアストロサイトの分化を誘導[9]することが明らかにされている。そのメカニズムとして転写活性化の補助的役割を果たす核内転写共役因子p300がサイトカイン刺激に応答して、二量体化したSTAT3のN末端と、ヘテロオリゴマー化したsmad1のC末端と、それぞれ同時に結合しSTAT3/p300/smad1複合体が形成される。これにより二種類サイトカインシグナルが核内で統合され、目的遺伝子GFAPの相乗的発現が起こる。
神経系での働き②:神経幹細胞増殖制御
通常のSTAT3遺伝子欠損(ノックアウト, KO)マウスは発生の比較的初期に死に至るので、マウス脳内におけるSTAT3 KOの影響の解析は難しい[10]。そこで、神経系細胞特異的にSTAT3遺伝子を欠損(コンディショナルノックアウト, cKO)するトランスジェニックマウスを用いて解析した結果、STAT3 cKOマウスの海馬歯状回において、NSCの数が、野生型マウスに比べ減少していることが明らかになった[11]。またニューロンに対して栄養因子として作用するCNTFは、gp130を介したシグナル伝達によりNSCの自己増殖を制御するという報告がなされている[12][13][14]。さらに、CNTF KOマウスの歯状回で、NSCの数が野生型マウスと比較して減少しているというSTAT3 cKOマウスと類似の結果が得られたことから、CNTFは受容体と結合し、下流のJAK/STAT3経路を活性化することで、NSCの自己増殖を制御すると考えられている[11]。
神経系での働き③:てんかん発作誘導性神経細胞死における神経保護作用
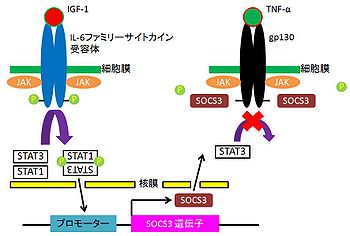
成体マウスにおいて興奮性アミノ酸の一種、カイニン酸kainic acid (KA)投与によるてんかん誘導に際し、抗てんかん薬として知られるcarbamazepine (CBZ)を投与すると、海馬のCA3領域において、ニューロン死の割合がKA投与のみの個体に比べ低いことが分かった。また、KA+CBZ投与マウスのCA3ニューロンにおいて、STAT3の発現レベルがmRNA、タンパク質、においても上昇しており、活性化を表すチロシンリン酸化STAT3の増加も見られている。加えて、神経保護タンパク質として知られているB-cell lymphoma-extra large (Bcl-xl) もまた、KA+CBZ投与マウスのCA3ニューロン内で発現レベルが高まっている上、CT-1の刺激によってSTAT3とSTAT1のヘテロ二量体がBcl-xl遺伝子に直接結合し、発現制御を行うという報告[15]から、CBZのシグナルを受けてJAK/STAT3経路が活性化し、Bcl-xlなどの抗アポトーシス分子の発現を誘導することで、てんかんによるニューロン死への保護効果が上昇することが示唆されている[7]。しかし、CBZシグナルがどのようなメカニズムでJAK/STAT3経路が活性化しているかはいまだ明らかになっていない。炎症性サイトカインである腫瘍壊死因子tumor necrosis factor-α (TNF-α)は神経疾患、または炎症反応中の脳で、神経細胞毒性を持ち[16]、高濃度添加によりニューロン死が観察される。TNF-αによりgp130へSrc homology protein-tyrosine phosphatase 2 (SHP2)がリクルートされることで、gp130、SHP2共にリン酸化を受ける。TNF-αのシグナルは活性化したgp130を介し、JAK/STAT3経路で伝達される[17]。一方、インスリン様成長因子insulin-like growth factor-1 (IGF-1)は頭部外傷など、脳内の炎症反応により多量に発現し、神経保護作用を発揮する[18][19]。加えて、TNF-αのみ添加したニューロン群より、IGF-1とTNF-αを添加したニューロン群においてニューロン死の割合が低かったことから、IGF-1はTNF-αにより誘導されるニューロン死の阻害という作用を有することが明らかになった。この神経保護効果は、JAK/STAT3経路がIGF-1により活性化し、STAT3とSTAT1のヘテロ二量体がサイトカイン抑制シグナル分子supressors of cytokine signaling 3 (SOCS-3)の転写を誘導するためだと考えられる。発現したSOCS-3はSH2ドメインを持ち、TNF-αによって活性化したgp130内、リン酸化チロシン残基に結合、近接したJAKを抑制する、という負のフィードバック制御によりSTAT3の活性化を阻害、TNF-αシグナルを抑制し神経細胞死を阻害する(図4)[8][20]。
神経系での働き④:脊髄損傷時の反応性アストロサイト分化誘導
脊髄に損傷が起こると炎症反応が発生し、損傷部周辺の細胞は炎症性サイトカインを多量に分泌する。これらの刺激により損傷部周辺でGFAP強陽性となる反応性アストロサイトの出現が観察される[21]。反応性アストロサイトは集合しグリア瘢痕を形成する[22]。グリア瘢痕は損傷部の物理的な防壁となり、損傷部を外部環境刺激から守ることで中枢神経系を再統合する役割を持つ[23]。しかし、グリア瘢痕は、Chondroitin sulfate proteoglycans (CSPGs) などの軸索伸長阻害因子を分泌し、損傷部周辺ニューロンの軸索再伸長を阻害するため、神経軸索再生が抑制される[24]。軸索損傷を起こしたマウスへ、IL-6ファミリー受容体の機能を阻害する分子IL-6 receptor monoclonal antibody (MR16-1)を添加すると、損傷部の反応性アストロサイトの数が減少し、神経機能の回復が観察された。また、アストロサイト特異的にSTAT3遺伝子を欠損させたマウスに脊髄損傷を起こしても、反応性アストロサイトが出現せず、グリア瘢痕が形成できない[25]。これらのことからIL-6ファミリーサイトカイン刺激によるJAK/STAT3経路の活性化によって、反応性アストロサイトの分化が誘導されることが示唆された[26]。
総括
紹介した以外にも、STAT3の神経系における働きは複数あり、それらを総合すると、JAK/STAT3経路は神経系の発達、形成に重要な役割を担う情報伝達経路と言える。また、単純に神経発達や形成に重要な因子となるタンパク質の発現を誘導するのみならず、自らの経路のシグナルを抑制するタンパク質発現もまた誘導することから、STAT3は神経保護にも必須の因子と考えられる。
参考文献
- ↑
Ihle, J.N. (1996).
STATs: signal transducers and activators of transcription. Cell, 84(3), 331-4. [PubMed:8608586] [WorldCat] [DOI] - ↑
O'Shea, J.J., Notarangelo, L.D., Johnston, J.A., & Candotti, F. (1997).
Advances in the understanding of cytokine signal transduction: the role of Jaks and STATs in immunoregulation and the pathogenesis of immunodeficiency. Journal of clinical immunology, 17(6), 431-47. [PubMed:9418183] [WorldCat] [DOI] - ↑
Ivashkiv, L.B., & Hu, X. (2004).
Signaling by STATs. Arthritis research & therapy, 6(4), 159-68. [PubMed:15225360] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Gyotoku, E., Morita, E., Kameyoshi, Y., Hiragun, T., Yamamoto, S., & Hide, M. (2001).
The IL-6 family cytokines, interleukin-6, interleukin-11, oncostatin M, and leukemia inhibitory factor, enhance mast cell growth through fibroblast-dependent pathway in mice. Archives of dermatological research, 293(10), 508-14. [PubMed:11820727] [WorldCat] [DOI] - ↑
Nakashima, K., & Taga, T. (1998).
gp130 and the IL-6 family of cytokines: signaling mechanisms and thrombopoietic activities. Seminars in hematology, 35(3), 210-21. [PubMed:9685167] [WorldCat] - ↑ 6.0 6.1
Nakashima, K., Yanagisawa, M., Arakawa, H., & Taga, T. (1999).
Astrocyte differentiation mediated by LIF in cooperation with BMP2. FEBS letters, 457(1), 43-6. [PubMed:10486560] [WorldCat] [DOI] - ↑ 7.0 7.1
Park, H.J., Kim, S.K., Chung, J.H., & Kim, J.W. (2013).
Protective effect of carbamazepine on kainic acid-induced neuronal cell death through activation of signal transducer and activator of transcription-3. Journal of molecular neuroscience : MN, 49(1), 172-81. [PubMed:22772901] [WorldCat] [DOI] - ↑ 8.0 8.1
Yadav, A., Kalita, A., Dhillon, S., & Banerjee, K. (2005).
JAK/STAT3 pathway is involved in survival of neurons in response to insulin-like growth factor and negatively regulated by suppressor of cytokine signaling-3. The Journal of biological chemistry, 280(36), 31830-40. [PubMed:15998644] [WorldCat] [DOI] - ↑
Nakashima, K., Yanagisawa, M., Arakawa, H., Kimura, N., Hisatsune, T., Kawabata, M., ..., & Taga, T. (1999).
Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science (New York, N.Y.), 284(5413), 479-82. [PubMed:10205054] [WorldCat] [DOI] - ↑
Takeda, K., Noguchi, K., Shi, W., Tanaka, T., Matsumoto, M., Yoshida, N., ..., & Akira, S. (1997).
Targeted disruption of the mouse Stat3 gene leads to early embryonic lethality. Proceedings of the National Academy of Sciences of the United States of America, 94(8), 3801-4. [PubMed:9108058] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Müller, S., Chakrapani, B.P., Schwegler, H., Hofmann, H.D., & Kirsch, M. (2009).
Neurogenesis in the dentate gyrus depends on ciliary neurotrophic factor and signal transducer and activator of transcription 3 signaling. Stem cells (Dayton, Ohio), 27(2), 431-41. [PubMed:19023034] [WorldCat] [DOI] - ↑
Bauer, S., Kerr, B.J., & Patterson, P.H. (2007).
The neuropoietic cytokine family in development, plasticity, disease and injury. Nature reviews. Neuroscience, 8(3), 221-32. [PubMed:17311007] [WorldCat] [DOI] - ↑
Gearing, D.P., Comeau, M.R., Friend, D.J., Gimpel, S.D., Thut, C.J., McGourty, J., ..., & Mosley, B. (1992).
The IL-6 signal transducer, gp130: an oncostatin M receptor and affinity converter for the LIF receptor. Science (New York, N.Y.), 255(5050), 1434-7. [PubMed:1542794] [WorldCat] [DOI] - ↑
Davis, S., Aldrich, T.H., Stahl, N., Pan, L., Taga, T., Kishimoto, T., ..., & Yancopoulos, G.D. (1993).
LIFR beta and gp130 as heterodimerizing signal transducers of the tripartite CNTF receptor. Science (New York, N.Y.), 260(5115), 1805-8. [PubMed:8390097] [WorldCat] [DOI] - ↑
Stephanou, A., Brar, B.K., Knight, R.A., & Latchman, D.S. (2000).
Opposing actions of STAT-1 and STAT-3 on the Bcl-2 and Bcl-x promoters. Cell death and differentiation, 7(3), 329-30. [PubMed:10866494] [WorldCat] [DOI] - ↑
Cheng, B., Christakos, S., & Mattson, M.P. (1994).
Tumor necrosis factors protect neurons against metabolic-excitotoxic insults and promote maintenance of calcium homeostasis. Neuron, 12(1), 139-53. [PubMed:7507336] [WorldCat] [DOI] - ↑
Bode, J.G., Schweigart, J., Kehrmann, J., Ehlting, C., Schaper, F., Heinrich, P.C., & Häussinger, D. (2003).
TNF-alpha induces tyrosine phosphorylation and recruitment of the Src homology protein-tyrosine phosphatase 2 to the gp130 signal-transducing subunit of the IL-6 receptor complex. Journal of immunology (Baltimore, Md. : 1950), 171(1), 257-66. [PubMed:12817006] [WorldCat] [DOI] - ↑
Doré, S., Kar, S., & Quirion, R. (1997).
Rediscovering an old friend, IGF-I: potential use in the treatment of neurodegenerative diseases. Trends in neurosciences, 20(8), 326-31. [PubMed:9246719] [WorldCat] [DOI] - ↑
Guan, J., Bennet, L., Gluckman, P.D., & Gunn, A.J. (2003).
Insulin-like growth factor-1 and post-ischemic brain injury. Progress in neurobiology, 70(6), 443-62. [PubMed:14568359] [WorldCat] - ↑
Starr, R., & Hilton, D.J. (1999).
Negative regulation of the JAK/STAT pathway. BioEssays : news and reviews in molecular, cellular and developmental biology, 21(1), 47-52. [PubMed:10070253] [WorldCat] [DOI] - ↑
Johansson, C.B., Momma, S., Clarke, D.L., Risling, M., Lendahl, U., & Frisén, J. (1999).
Identification of a neural stem cell in the adult mammalian central nervous system. Cell, 96(1), 25-34. [PubMed:9989494] [WorldCat] [DOI] - ↑
Takahashi, M., Arai, Y., Kurosawa, H., Sueyoshi, N., & Shirai, S. (2003).
Ependymal cell reactions in spinal cord segments after compression injury in adult rat. Journal of neuropathology and experimental neurology, 62(2), 185-94. [PubMed:12578228] [WorldCat] [DOI] - ↑
Stichel, C.C., & Müller, H.W. (1998).
The CNS lesion scar: new vistas on an old regeneration barrier. Cell and tissue research, 294(1), 1-9. [PubMed:9724451] [WorldCat] [DOI] - ↑
David, S., & Lacroix, S. (2003).
Molecular approaches to spinal cord repair. Annual review of neuroscience, 26, 411-40. [PubMed:12626698] [WorldCat] [DOI] - ↑
Herrmann, J.E., Imura, T., Song, B., Qi, J., Ao, Y., Nguyen, T.K., ..., & Sofroniew, M.V. (2008).
STAT3 is a critical regulator of astrogliosis and scar formation after spinal cord injury. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(28), 7231-43. [PubMed:18614693] [PMC] [WorldCat] [DOI] - ↑
Okada, S., Nakamura, M., Mikami, Y., Shimazaki, T., Mihara, M., Ohsugi, Y., ..., & Okano, H. (2004).
Blockade of interleukin-6 receptor suppresses reactive astrogliosis and ameliorates functional recovery in experimental spinal cord injury. Journal of neuroscience research, 76(2), 265-76. [PubMed:15048924] [WorldCat] [DOI]