「ZOファミリー」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 34行目: | 34行目: | ||
ZOファミリーの発現は主に上皮組織や間葉系組織で観察される。ZO-1の組織発現は、受精後から生体まで、幅広く報告されている。一方、ZO-2およびZO-3の組織発現については、胎生期から生後直後の時期に関する報告がほとんどである。 | ZOファミリーの発現は主に上皮組織や間葉系組織で観察される。ZO-1の組織発現は、受精後から生体まで、幅広く報告されている。一方、ZO-2およびZO-3の組織発現については、胎生期から生後直後の時期に関する報告がほとんどである。 | ||
ZOファミリーの中で、組織発現に関する報告が最も多いのがZO-1である。ほとんどの上皮組織と血管に発現が見られる。中枢神経系においては、発生期の終脳・間脳・中脳・後脳・脊髄およびその髄膜、末梢では後根神経節などに発現している。ZO-2は、下顎臼歯間充織や女性生殖器を構成する上皮組織、泌尿器系の上皮組織などで発現が報告されている。また、中枢神経系では、発生期の後脳や脊髄で発現が確認されている。ZO-3は主に口腔上皮や下顎臼歯間充織、生殖器・泌尿器系組織の上皮で発現が確認されている<ref>[ | ZOファミリーの中で、組織発現に関する報告が最も多いのがZO-1である。ほとんどの上皮組織と血管に発現が見られる。中枢神経系においては、発生期の終脳・間脳・中脳・後脳・脊髄およびその髄膜、末梢では後根神経節などに発現している。ZO-2は、下顎臼歯間充織や女性生殖器を構成する上皮組織、泌尿器系の上皮組織などで発現が報告されている。また、中枢神経系では、発生期の後脳や脊髄で発現が確認されている。ZO-3は主に口腔上皮や下顎臼歯間充織、生殖器・泌尿器系組織の上皮で発現が確認されている<ref>[http://www.informatics.jax.org/ Mouse Genome Informatics]</ref>。 | ||
===神経組織における発現と機能=== | ===神経組織における発現と機能=== | ||
2016年4月18日 (月) 13:42時点における版
岩下 美里、*小曽戸 陽一
Korea Brain Research Institute(韓国)Mechanoneuroscience Lab
DOI:10.14931/bsd.7030 原稿受付日:2016年3月21日 原稿完成日:2016年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
*:責任著者
名称の由来:Zonula occludent family
同義語:tight junction protein
ZOファミリータンパク質はタイトジャンクションを構成する主要な分子である。細胞や組織のアピカル側に局在し、細胞極性形成に関わると考えられ ている。また、タイトジャンクションだけでなく、アドヘレンスジャンクションやギャップジャンクションにも局在が見られることから、広く細胞間結合構造の 維持に関与する分子であると考えられる。近年では、細胞内シグナル伝達分子や転写調節因子として働き、細胞増殖を調節するという報告もなされている。脳神 経系では、発生期の神経上皮組織において神経前駆細胞の極性形成に関わる。また、ギャップ結合を介したグリア細胞同士の細胞間コミュニケーションへの関与 も示唆されている。一方、血液脳関門や血液脳脊髄液関門などの組織と体液の境界領域において、様々な物質の透過を調節するバリアとして機能し、脳神経系の 恒常性の維持に寄与している。
| Tight junction protein 2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
ファイル:Protein TJP2 PDB 2csj.png PDB rendering based on 2csj. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | TJP2; C9DUPq21.11; DFNA51; DUP9q21.11; PFIC4; X104; ZO2 | ||||||||||||
| External IDs | OMIM: 607709 MGI: 1341872 HomoloGene: 3541 GeneCards: TJP2 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 9414 | 21873 | |||||||||||
| Ensembl | ENSG00000119139 | ENSMUSG00000024812 | |||||||||||
| UniProt | Q9UDY2 | Q9Z0U1 | |||||||||||
| RefSeq (mRNA) | NM_001170414 | NM_001198985 | |||||||||||
| RefSeq (protein) | NP_001163885 | NP_001185914 | |||||||||||
| Location (UCSC) |
Chr 9: 69.12 – 69.26 Mb |
Chr 19: 24.09 – 24.23 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
| Tight junction protein 3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | TJP3; ZO-3; ZO3 | ||||||||||||
| External IDs | OMIM: 612689 MGI: 1351650 HomoloGene: 8458 GeneCards: TJP3 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 27134 | 27375 | |||||||||||
| Ensembl | ENSG00000105289 | ENSMUSG00000034917 | |||||||||||
| UniProt | O95049 | E9QL54 | |||||||||||
| RefSeq (mRNA) | NM_001267560 | NM_001282095 | |||||||||||
| RefSeq (protein) | NP_001254489 | NP_001269024 | |||||||||||
| Location (UCSC) |
Chr 19: 3.71 – 3.75 Mb |
Chr 10: 81.27 – 81.29 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
ZOファミリーとは
ZO ファミリータンパク質は、上皮組織の密着結合に含まれるタンパク質として同定された表在性膜タンパク質である[1] [2]。多細胞生物の上皮組織では、上皮細胞が互いに接着したシート状構造を呈する。上皮シート構造の形成・維持には、頂端側に存在する密着結合・接着結合・デスモソーム結合といった、細胞間結合構造が重要な役割を果たしている。ZOファミリータンパク質は、細胞間結合構造の裏打ちタンパクとして働き、主に(1)細胞間結合構造の形成と維持、(2)物質透過の制御、(3)細胞極性形成などの役割を担っている。近年では、ZOタンパク質が核内に移動し、細胞内シグナル伝達や転写調節を担うことも報告されている[3]。
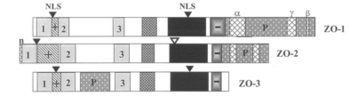
構造
ZOファミリータンパク質(図1)は、membrane-associated guanylate kinase(MAGUK)ファミリーに分類される。分子量220kDaのZO-1[2] [4]、160kDaのZO-2[5] [6]、130kDaの ZO-3[7]の3種類がある。これらに共通の構造として、3個のPDZドメイン、1個のSrc homology 3(SH3)ドメイン、1個のグアニル酸キナーゼドメインが挙げられる。また、プロリンリッチ領域が、ZO-1、ZO-2ではカルボキシル末端側、ZO-3では第2PDZドメインと第3PDZドメインの間に存在する[1]。また、ZO-1およびZO-3は2つの核局在シグナル領域を、ZO-2は核局在シグナル領域と核外移行シグナル領域をひとつずつ持っている[1] [8]。
3種のZOタンパク質を区別するのはC末端領域の構造である(図1)。ZO-1とZO-2のC末領域には選択的スプライシング部位があり、多様なスプライスバリアントが存在する[9] [10]。ZO-1には3カ所、ZO-2には2カ所が報告されているが、ZO-3には選択的スプライシング部位がない[1]。 スプライスバリアントの多様性が、組織や細胞における発現の違いに反映されると考えられる[1]。
ZOファミリータンパク質の主な結合パートナーは、膜タンパク質、細胞骨格、カドヘリンと複合体を形成するタンパク群(カテニン)、およびZOファミリータンパク質である。細胞膜側で膜タンパク質と、細胞質側で細胞骨格、カテニン、ZOファミリーと結合する。
密着結合にはクローディン、オクルディンといった膜貫通型タンパク質が存在する[11]。各ZOファミリータンパク質は、第一PDZドメインを介して膜貫通型タンパク質であるクローディンと結合する。オクルディンとの結合部位は、ZO-1ではGUKドメイン、ZO-2では第一PDZドメインからGUKドメインまでの、C末端を除いた領域である。ギャップ結合には、膜貫通型タンパクであるコネクシンファミリータンパク質が存在する。ZOファミリータンパク質は、PDZドメインを介してこれらと結合する[12]。
一方、密着結合部位の細胞質側では、ZOファミリータンパク質はC末端側を介して細胞骨格であるF-アクチンと結合する[9] [10]。接着結合部位では、ZO-1はGUKドメインを介してα-cateninと、ZO-2はC末端を除く部位でα-cateninと、ZO-3はC末端側でP120 cateninと結合する[4] [13]。また、ZOタンパク間の結合は、PDZドメインを介して行われる。
組織発現
ZOファミリーの発現は主に上皮組織や間葉系組織で観察される。ZO-1の組織発現は、受精後から生体まで、幅広く報告されている。一方、ZO-2およびZO-3の組織発現については、胎生期から生後直後の時期に関する報告がほとんどである。
ZOファミリーの中で、組織発現に関する報告が最も多いのがZO-1である。ほとんどの上皮組織と血管に発現が見られる。中枢神経系においては、発生期の終脳・間脳・中脳・後脳・脊髄およびその髄膜、末梢では後根神経節などに発現している。ZO-2は、下顎臼歯間充織や女性生殖器を構成する上皮組織、泌尿器系の上皮組織などで発現が報告されている。また、中枢神経系では、発生期の後脳や脊髄で発現が確認されている。ZO-3は主に口腔上皮や下顎臼歯間充織、生殖器・泌尿器系組織の上皮で発現が確認されている[14]。
神経組織における発現と機能
神経系形成初期
発生期の神経上皮では、脳室面が頂端(apical)側となる。ZO-1は神経系形成初期に神経板の脳室面において発現が見られる。神経板ではZO-1はオクルディンと結合し、機能的な密着結合を形成している。神経管閉鎖時には脳室面におけるオクルディンの発現が消失するが、ZO-1の発現は維持される[15]。脳室面では、接着結合の構成タンパク質であるN-カドヘリン[16]が発現してくる。
神経発生期
神経管閉鎖後の神経上皮組織では、神経前駆細胞から神経細胞が産生されるようになる。このとき、ZO-1は脳室面に発現が見られ[17]、細胞レベルでは神経前駆細胞のapical processに発現している。神経前駆細胞が分裂するとき、ZO-1陽性のapical processが2つの娘細胞に分配される。apical processとbasal processを受け継いだ娘細胞は、自己複製能をもつ神経前駆細胞となる。一方で、apical processのみ受け継いだ娘細胞は、神経細胞もしくはbasal progenitorとなってSVZで分裂し、2つの神経細胞を産生する[18]。したがって、ZO-1は、神経前駆細胞のapical-basalの極性形成に寄与すると考えられる。
グリア細胞
アストロサイトやオリゴデンドロサイトにおいて、ZO-1はギャップ結合に局在が見られる[19] [20] [21] [22]。ギャップ結合では、コネクシンファミリーに属するタンパク質(Cx-)と結合する[23] 。アストロサイトのギャップ結合では、ZO-1はCx30、Cx43と結合する[12] [20]。オリゴデンドロサイトのギャップ結合では、ZO-1はコネクシンCx47と結合する[22]。しかし、ギャップ結合形成におけるZO-1の役割は明らかになっていない。ZO-1がコネクシンの細胞内膜輸送に関与し、ギャップ結合のターンオーバーを担うという報告もあるが、まだ検証の余地を残している[24] [25] [26]。
血液脳関門
血液脳関門(Blood-brain barrier;BBB)は、血管内皮細胞(endothelial cell)、アストロサイト(astrocyte) 、周皮細胞(pericyte)から構成される。最も内腔に位置する血管内皮細胞同士は密着結合で強固につながっている[27]。この構造により、不要な物質や薬物、病原体の中枢神経系への進入を防いでいる。BBBにおける密着結合にはオクルディン、クローディン-1およびクローディン-5が局在する[28] [29]。ZO-1は細胞質側からこれらに結合し、密着結合を支えている。また、ZO-1はアクチンとも結合し、内皮細胞の形態保持に関わっている[7]。
脈絡叢
脈絡叢は一層の上皮細胞からなる。側脳室、第3脳室、第4脳室に存在し、脳脊髄液(CSF)を産生・分泌する。頂端膜側は脳脊髄液に接し、基底膜側で血管に接している。脈絡叢の頂端膜側には密着結合が存在し、血液脳脊髄液関門(blood-CSF barrier)を形成する。密着結合の細胞質側でZO-1はクローディン-1、2、11およびオクルディンと結合し[30]、血液-脳脊髄液間の物質の移動を制御することで脳の恒常性を維持している。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6
González-Mariscal, L., Betanzos, A., & Avila-Flores, A. (2000).
MAGUK proteins: structure and role in the tight junction. Seminars in cell & developmental biology, 11(4), 315-24. [PubMed:10966866] [WorldCat] [DOI] - ↑ 2.0 2.1
Stevenson, B.R., Siliciano, J.D., Mooseker, M.S., & Goodenough, D.A. (1986).
Identification of ZO-1: a high molecular weight polypeptide associated with the tight junction (zonula occludens) in a variety of epithelia. The Journal of cell biology, 103(3), 755-66. [PubMed:3528172] [PMC] [WorldCat] [DOI] - ↑
Bauer, H., Zweimueller-Mayer, J., Steinbacher, P., Lametschwandtner, A., & Bauer, H.C. (2010).
The dual role of zonula occludens (ZO) proteins. Journal of biomedicine & biotechnology, 2010, 402593. [PubMed:20224657] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Itoh, M., Nagafuchi, A., Yonemura, S., Kitani-Yasuda, T., Tsukita, S., & Tsukita, S. (1993).
The 220-kD protein colocalizing with cadherins in non-epithelial cells is identical to ZO-1, a tight junction-associated protein in epithelial cells: cDNA cloning and immunoelectron microscopy. The Journal of cell biology, 121(3), 491-502. [PubMed:8486731] [PMC] [WorldCat] [DOI] - ↑
Gumbiner, B., Lowenkopf, T., & Apatira, D. (1991).
Identification of a 160-kDa polypeptide that binds to the tight junction protein ZO-1. Proceedings of the National Academy of Sciences of the United States of America, 88(8), 3460-4. [PubMed:2014265] [PMC] [WorldCat] [DOI] - ↑
Jesaitis, L.A., & Goodenough, D.A. (1994).
Molecular characterization and tissue distribution of ZO-2, a tight junction protein homologous to ZO-1 and the Drosophila discs-large tumor suppressor protein. The Journal of cell biology, 124(6), 949-61. [PubMed:8132716] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Haskins, J., Gu, L., Wittchen, E.S., Hibbard, J., & Stevenson, B.R. (1998).
ZO-3, a novel member of the MAGUK protein family found at the tight junction, interacts with ZO-1 and occludin. The Journal of cell biology, 141(1), 199-208. [PubMed:9531559] [PMC] [WorldCat] [DOI] - ↑
González-Mariscal, L., Islas, S., Contreras, R.G., García-Villegas, M.R., Betanzos, A., Vega, J., ..., & Valdés, J. (1999).
Molecular characterization of the tight junction protein ZO-1 in MDCK cells. Experimental cell research, 248(1), 97-109. [PubMed:10094817] [WorldCat] [DOI] - ↑ 9.0 9.1
Fanning, A.S., Jameson, B.J., Jesaitis, L.A., & Anderson, J.M. (1998).
The tight junction protein ZO-1 establishes a link between the transmembrane protein occludin and the actin cytoskeleton. The Journal of biological chemistry, 273(45), 29745-53. [PubMed:9792688] [WorldCat] [DOI] - ↑ 10.0 10.1
Itoh, M., Nagafuchi, A., Moroi, S., & Tsukita, S. (1997).
Involvement of ZO-1 in cadherin-based cell adhesion through its direct binding to alpha catenin and actin filaments. The Journal of cell biology, 138(1), 181-92. [PubMed:9214391] [PMC] [WorldCat] [DOI] - ↑
Umeda, K., Ikenouchi, J., Katahira-Tayama, S., Furuse, K., Sasaki, H., Nakayama, M., ..., & Tsukita, S. (2006).
ZO-1 and ZO-2 independently determine where claudins are polymerized in tight-junction strand formation. Cell, 126(4), 741-54. [PubMed:16923393] [WorldCat] [DOI] - ↑ 12.0 12.1
Giepmans, B.N., & Moolenaar, W.H. (1998).
The gap junction protein connexin43 interacts with the second PDZ domain of the zona occludens-1 protein. Current biology : CB, 8(16), 931-4. [PubMed:9707407] [WorldCat] [DOI] - ↑
Rajasekaran, A.K., Hojo, M., Huima, T., & Rodriguez-Boulan, E. (1996).
Catenins and zonula occludens-1 form a complex during early stages in the assembly of tight junctions. The Journal of cell biology, 132(3), 451-63. [PubMed:8636221] [PMC] [WorldCat] [DOI] - ↑ Mouse Genome Informatics
- ↑
Aaku-Saraste, E., Hellwig, A., & Huttner, W.B. (1996).
Loss of occludin and functional tight junctions, but not ZO-1, during neural tube closure--remodeling of the neuroepithelium prior to neurogenesis. Developmental biology, 180(2), 664-79. [PubMed:8954735] [WorldCat] [DOI] - ↑
Hatta, K., & Takeichi, M. (1986).
Expression of N-cadherin adhesion molecules associated with early morphogenetic events in chick development. Nature, 320(6061), 447-9. [PubMed:3515198] [WorldCat] [DOI] - ↑
Kadowaki, M., Nakamura, S., Machon, O., Krauss, S., Radice, G.L., & Takeichi, M. (2007).
N-cadherin mediates cortical organization in the mouse brain. Developmental biology, 304(1), 22-33. [PubMed:17222817] [WorldCat] [DOI] - ↑
Konno, D., Shioi, G., Shitamukai, A., Mori, A., Kiyonari, H., Miyata, T., & Matsuzaki, F. (2008).
Neuroepithelial progenitors undergo LGN-dependent planar divisions to maintain self-renewability during mammalian neurogenesis. Nature cell biology, 10(1), 93-101. [PubMed:18084280] [WorldCat] [DOI] - ↑
Inagaki, M., Irie, K., Deguchi-Tawarada, M., Ikeda, W., Ohtsuka, T., Takeuchi, M., & Takai, Y. (2003).
Nectin-dependent localization of ZO-1 at puncta adhaerentia junctions between the mossy fiber terminals and the dendrites of the pyramidal cells in the CA3 area of adult mouse hippocampus. The Journal of comparative neurology, 460(4), 514-24. [PubMed:12717711] [WorldCat] [DOI] - ↑ 20.0 20.1
Penes, M.C., Li, X., & Nagy, J.I. (2005).
Expression of zonula occludens-1 (ZO-1) and the transcription factor ZO-1-associated nucleic acid-binding protein (ZONAB)-MsY3 in glial cells and colocalization at oligodendrocyte and astrocyte gap junctions in mouse brain. The European journal of neuroscience, 22(2), 404-18. [PubMed:16045494] [WorldCat] [DOI] - ↑
Howarth, A.G., Hughes, M.R., & Stevenson, B.R. (1992).
Detection of the tight junction-associated protein ZO-1 in astrocytes and other nonepithelial cell types. The American journal of physiology, 262(2 Pt 1), C461-9. [PubMed:1539634] [WorldCat] [DOI] - ↑ 22.0 22.1
Li, X., Ionescu, A.V., Lynn, B.D., Lu, S., Kamasawa, N., Morita, M., ..., & Nagy, J.I. (2004).
Connexin47, connexin29 and connexin32 co-expression in oligodendrocytes and Cx47 association with zonula occludens-1 (ZO-1) in mouse brain. Neuroscience, 126(3), 611-30. [PubMed:15183511] [PMC] [WorldCat] [DOI] - ↑
Giepmans, B.N. (2004).
Gap junctions and connexin-interacting proteins. Cardiovascular research, 62(2), 233-45. [PubMed:15094344] [WorldCat] [DOI] - ↑
Lauf, U., Giepmans, B.N., Lopez, P., Braconnot, S., Chen, S.C., & Falk, M.M. (2002).
Dynamic trafficking and delivery of connexons to the plasma membrane and accretion to gap junctions in living cells. Proceedings of the National Academy of Sciences of the United States of America, 99(16), 10446-51. [PubMed:12149451] [PMC] [WorldCat] [DOI] - ↑
Gaietta, G., Deerinck, T.J., Adams, S.R., Bouwer, J., Tour, O., Laird, D.W., ..., & Ellisman, M.H. (2002).
Multicolor and electron microscopic imaging of connexin trafficking. Science (New York, N.Y.), 296(5567), 503-7. [PubMed:11964472] [WorldCat] [DOI] - ↑
Hunter, A.W., Jourdan, J., & Gourdie, R.G. (2003).
Fusion of GFP to the carboxyl terminus of connexin43 increases gap junction size in HeLa cells. Cell communication & adhesion, 10(4-6), 211-4. [PubMed:14681018] [WorldCat] - ↑
Ballabh, P., Braun, A., & Nedergaard, M. (2004).
The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiology of disease, 16(1), 1-13. [PubMed:15207256] [WorldCat] [DOI] - ↑
Morita, K., Sasaki, H., Furuse, M., & Tsukita, S. (1999).
Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. The Journal of cell biology, 147(1), 185-94. [PubMed:10508865] [PMC] [WorldCat] [DOI] - ↑
Liebner, S., Fischmann, A., Rascher, G., Duffner, F., Grote, E.H., Kalbacher, H., & Wolburg, H. (2000).
Claudin-1 and claudin-5 expression and tight junction morphology are altered in blood vessels of human glioblastoma multiforme. Acta neuropathologica, 100(3), 323-31. [PubMed:10965803] [WorldCat] [DOI] - ↑
Wolburg, H., Wolburg-Buchholz, K., Liebner, S., & Engelhardt, B. (2001).
Claudin-1, claudin-2 and claudin-11 are present in tight junctions of choroid plexus epithelium of the mouse. Neuroscience letters, 307(2), 77-80. [PubMed:11427304] [WorldCat] [DOI]