グルココルチコイド
| |
|---|---|
| |
| Systematic (IUPAC) name | |
| (11β)-11,17,21-trihydroxypregn-4-ene-3,20-dione | |
| Clinical data | |
| Pregnancy cat. | C |
| Legal status | Rx only (U.S.) (excluding 1–2% strength topical) |
| Routes | Oral tablets, intravenous, topical |
| Identifiers | |
| CAS number | 50-23-7 |
| ATC code | A01AC03 A07EA02 (WHO) C05AA01 (WHO) D07AA02 (WHO) H02AB09 (WHO) S01BA02 (WHO) S01CB03 (WHO) S02BA01 (WHO) |
| PubChem | CID 5754 |
| DrugBank | DB07886 |
| ChemSpider | 5551 |
| UNII | WI4X0X7BPJ |
| KEGG | D00088 |
| ChEBI | CHEBI:17650 |
| ChEMBL | CHEMBL389621 |
| Chemical data | |
| Formula | C21H30O5 |
| Mol. mass | 362.460 g/mol |
| SMILES | eMolecules & PubChem |
| |
| | |
英語:glucocorticoid 独語:Glucocorticoid 仏語:glucocorticoïde
(要約を御願い致します)
グルココルチコイドとは
副腎皮質ホルモンの1つである皮質ステロイド(コルチコステロイド、corticosteroid)は、糖質、タンパク質、脂質、電解質などの代謝や免疫反応などに関与する重要なホルモンである。さらに、ストレス負荷により身体の神経・内分泌制御機構が働くことによりコルチコステロイドの分泌が亢進し、ストレス応答の制御に関わるなど生体のホメオスターシス維持に重要な役割を果たしている。コルチコステロイドはグルココルチコイドとミネラルコルチコイドの2つに大別され、前者は副腎皮質の束状帯の細胞で、後者は球状帯の細胞で作られる。グルココルチコイドの中で最も生理作用が強いものは、霊長類においてはコルチゾールであり、実験動物としてよく用いられるラットやマウスにおいてはコルチコステロンである。
分泌制御
物理的、精神的などストレスの種類に関わらず、ストレスは室傍核に神経細胞におけるコルチコトロピン放出ホルモン(corticotropin-releasing hormone(CRH))の産生を高める。産生されたCRHは、神経細胞の軸索を通って下垂体茎周辺の毛細血管に放出され、下垂体前葉に運ばれ、前葉細胞のadrenocorticotropic hormone (ACTH)分泌細胞に作用し、ACTHの分泌を促進する。ACTHは血流に乗り、副腎皮質に至り、束状帯細胞に働きかけて細胞内情報伝達系を活性化し、コレステロールからプログネノロンの転換を促進し、グルココルチコイドの産生を促す。分泌されたグルココルチコイドは脂溶性であるため、血液脳関門による制御を受けずに脳内に入り、神経系の細胞に直接作用し、CRH、ACTHの分泌制御に留まらず、グルココルチコイド自身の分泌制御をも行うという、多重のループ機構を形成している。
このように、脳はグルココルチコイドの分泌制御に重要な役割を演じているが、海馬におけるグルココルチコイド受容体の存在が明らかにされて以来[1]、グルココルチコイドの脳内作用についての研究が進み、多くの知見が集積されてきている[2]。例えば、ストレスに伴うグルココルチコイドの分泌亢進は、様々な脳の機能障害を引き起こすが、その脳内反応には、CRH、ノルアドレナリンやセロトニンなどのモノアミン系、グルタミン酸などの興奮性アミノ酸、サイトカインなどが関与することが、新たに知られるようになった。そしてこれらの制御には、従来から考えられてきたhypothalamo-pituitary-adrenal(HPA)axis(ご説明を御願い致します)に加え、さらにその上位に位置する海馬や前頭前皮質のグルココルチコイド受容体を介したフィードバック機構が重要な役割を担っていると考えられるようになってきた[3]。
受容体
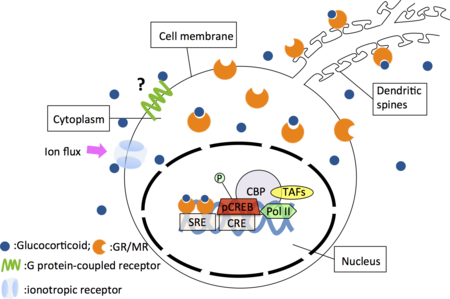
脳内のコルチコステロイド受容体には2種類あることが、受容体結合実験により明らかにされ[4]、各々タイプI、タイプII受容体と呼ばれた。その後これら2種類の受容体タンパク質のcDNA がクローニングされ[5] [6]、タイプI受容体がミネラルコルチコイド受容体(MR)、タイプII受容体がグルココルチコイド受容体(GR)に相当することが示された。これらの受容体はいずれもホルモン誘導性の転写制御因子であり、ホルモンとの結合により活性化されて受容体タンパク質の立体構造が変化し、熱ショックタンパク質90等が解離し、その結果、核移行シグナルが活性化して核内へ移行すると考えられている。活性化された受容体は2量体を形成し、特異的なDNA配列を認識・結合し、基本転写因子をリクルートことによって転写を開始するが、その際、基本転写因子群とともに、転写共役因子群が必須であることが明らかとなってきている。これら転写共役因子はホルモンの組織特異的作用を規定することが示唆されており、グルココルチコイド受容体の脳内での機能を解明していく上で非常に重要な因子のひとつと考えられる。さらに、GRとグルココルチコイドの複合体はAP-1(c-Junのホモ二量体あるいはc-Fosとのヘテロ二量体)やNFkBと相互作用することでこれらの遺伝子転写を抑制する(図)。
受容体の脳内分布と細胞内局在
GRは脳内の幅広い領域に分布するが、特に多く認められる部位は以下の通りである[7]。
大脳皮質のII/III層やIV層、とくに頭頂葉や側頭葉の連合野と視覚野においてはIV層、前嗅核、嗅結節の錐体細胞、梨状葉の錐体細胞、嗅内核(嗅内野でしょうか?)、海馬のCA1とCA2の錐体細胞、歯状回の顆粒細胞、扁桃体の中心核、分界条床核、視床の外側背側核、後外側核、内側膝状体、外側膝状体、視床下部では内側視索前野、前腹側室周囲核、室傍核小細胞性領域、弓状核、腹内側核、背内側核、腹前乳頭体核、脳幹では台形体核、青斑核、背側縫線核、小脳の顆粒細胞層である。
これらの領域では免疫組織化学法とin situハイブリダイゼーション法の所見が一致している。両者の方法で分布の異なる部位は小脳プルキンエ細胞層や海馬CA3などが挙げられる。分布の異なる理由として、部位間の受容体タンパク質とmRNAの合成、代謝回転の差などが類推されるが、明確な論拠は未だ示されていない。
これに対し、MRは脳内のかなり限られた領域にのみ分布する。MRの存在する部位としては、海馬、特にCA1、CA2、外側中隔野、内側・中心扁桃体、大脳皮質II層、小脳、脳幹の一部の神経細胞が挙げられる。
GRおよびMRの細胞内局在に関しては、免疫組織化学法を用いた実験により、両受容体とも正常ラットでは主として核内に分布すると考えられているが、大脳皮質の錐体細胞や海馬においては、細胞質にもその分布が報告されている[8]。また、両側副腎を摘出(ADX)して血中コルチコステロンを除去すると、GRの核内免疫活性が消失することが示されている[9]。近年green fluorescent protein (GFP)を受容体のtag分子として用いる方法が開発され、細胞を固定・透過化することなく、生きている細胞内で受容体の局在を解析することが可能となった。その結果、培養神経細胞および非神経細胞の両者においてGRはリガンドの非存在下では主として細胞質に分布し、リガンドの添加により速やかに核内へ移行することが明らかとなった[10]。
一方、近年の研究から従来の核内での転写因子としての作用に加えて、グルココルチコイドは急性作用にも関与することが報告されており、従来のGRが膜に存在して作用するのか、新たなGタンパク質共役受容体が存在するのかが議論されている。こうしたグルココルチコイドの急性作用には、エンドカンナビノイド、NMDA型グルタミン酸受容体、GABA受容体等を介した作用も報告されている[11]。
受容体の性状
GRおよびMRの両受容体はステロイドホルモンに対して異なる結合親和性(Kd)を示す。MRはグルココルチコイドやアルドステロンに対する親和性が高く(Kd: 0.5 nM)、合成のグルココルチコイドであるデキサメサゾンには数分の一の低い親和性を示す。一方、GRはグルココルチコイドに対する親和性は低いが(Kd:5nM)、デキサメサゾンには高い親和性を示す。
このような両受容体のグルココルチコイドに対する親和性の差は、生体において生理的、非生理的状況下における内因性グルココルチコイドによる受容体の占有率の差に反映されてくると考えられる。すなわち、血中のグルココルチコイド量が低値の場合はグルココルチコイドに高い親和性を示すMRが結合し、グルココルチコイド量が高い場合には親和性の低いGRが結合すると考えられている[12]。グルココルチコイドの日内変動に特に敏感である海馬において、GRはグルココルチコイド最低濃度時には30%程度しか活性化されていない一方で、親和性の高いMRはグルココルチコイドの日内変動にかかわらず常に60%以上活性化されていることが示されている。
海馬とグルココルチコイドホルモン
HPA axisの調節
海馬はグルココルチコイドホルモンに対して脳内で最も感受性の高い部位であり、GR、MRともに豊富に存在すること、また同一細胞において両者が共存すること、などが報告されている。こうしたことからグルココルチコイドによりネガテイブフィードバックを受けるHPA axisの調節に海馬が関与することが示されている。一般的には、海馬がHPA axisを抑制的に作用する[13]のに対し、扁桃体が促進作用を示すことが知られている[14]。種々のストレス条件下における海馬の傷害によりコルチゾールの分泌が上昇する。さらに、グルココルチコイドの海馬への直接投与実験によっても、従来の海馬によるHPAaxisのフィードバック制御と同等な効果がみられることが示されている。また海馬と同様に、分界条床核や視索前野を経由して視床下部へ至る線維連絡をもつ内側前頭前皮質(帯状回)もHPAaxisの制御に重要な役割を果たすことがわかってきた[15]。
HPAaxisの活性化には海馬や前頭前皮質のGRあるいはMRの減少が起因することが報告されている。海馬のMRは平常時のACTHやグルココルチコイドレベルの維持に、また前頭前皮質のGRはACTHの分泌に、それぞれ関与するとされているが、海馬のGRとMRの発現レベルとHPAaxis活性との関連が、海馬に対するグルココルチコイドのフィードバックを意味するものか、あるいはHPAaxisが神経系によるストレス応答に適合するように働くグルココルチコイドの調節作用を示すのかは未だ明確ではない。しかしながら、CRHやバソプレッシンなどの視床下部からの出力系を制御する神経活動に対するステロイドの調節に関して、海馬が主として働いている事実は、HPAaxisの制御に海馬が中心的な役割を果たしていることを裏付ける重要な根拠である。
海馬の神経活動に対するグルココルチコイドの作用
海馬の神経活動に対するグルココルチコイドの作用については、とくにCA1細胞の活動に対するGRおよびMRの作用が検討されてきた。両側副腎提出(ADX)によりCA1細胞の興奮性は上昇するが、グルココルチコイドは投与後比較的早期にはMRを介して興奮性に、1〜2時間後にはGRを介して抑制的に作用することが報告されている[2]。CA1細胞に対してノルアドレナリンはβ受容体を介して興奮性に、セロトニンは5HT1A受容体を介して抑制性に作用するが、グルココルチコイドはGRを介してノルアドレナリンによる興奮性入力を阻害し、かつMRを介してセロトニンによる抑制性入力を抑えることが認められている。
海馬CA1の錐体細胞への主たる興奮性入力は興奮性アミノ酸であるが、これらに対してもグルココルチコイドは低濃度では促進的に、高濃度では抑制的に働くことが知られている[12]。以上のことから、GRとMRのグルココルチコイドに対する親和性の差を反映して、グルココルチコイドは神経細胞の活動に対して二相性の作用を発揮すると考えられる。すなわち、生理的状況下では高親和性のMRが活性化されて神経細胞の興奮性が高まり、ストレス時や日内変動ピーク時など血中グルココルチコイド濃度が高くなると低親和性のGRが活性化され、神経細胞の興奮性が抑制されるという機構が推測される。
関連項目
(関連する項目がございましたら、ご指摘下さい)
参考文献
(御送り頂いたテキストから間違えなく情報が移されているか、御確認下さい。特に(2)と(12)は大丈夫でしょうか。)
- ↑
McEwen, B.S., Weiss, J.M., & Schwartz, L.S. (1968).
Selective retention of corticosterone by limbic structures in rat brain. Nature, 220(5170), 911-2. [PubMed:4301849] [WorldCat] [DOI] - ↑ 2.0 2.1
de Kloet, E.R., Karst, H., & Joëls, M. (2008).
Corticosteroid hormones in the central stress response: quick-and-slow. Frontiers in neuroendocrinology, 29(2), 268-72. [PubMed:18067954] [WorldCat] [DOI] - ↑
McEwen, B.S. (1999).
Stress and hippocampal plasticity. Annual review of neuroscience, 22, 105-22. [PubMed:10202533] [WorldCat] [DOI] - ↑
Reul, J.M., & de Kloet, E.R. (1985).
Two receptor systems for corticosterone in rat brain: microdistribution and differential occupation. Endocrinology, 117(6), 2505-11. [PubMed:2998738] [WorldCat] [DOI] - ↑
Hollenberg, S.M., Weinberger, C., Ong, E.S., Cerelli, G., Oro, A., Lebo, R., ..., & Evans, R.M. (1985).
Primary structure and expression of a functional human glucocorticoid receptor cDNA. Nature, 318(6047), 635-41. [PubMed:2867473] [PMC] [WorldCat] [DOI] - ↑
Arriza, J.L., Weinberger, C., Cerelli, G., Glaser, T.M., Handelin, B.L., Housman, D.E., & Evans, R.M. (1987).
Cloning of human mineralocorticoid receptor complementary DNA: structural and functional kinship with the glucocorticoid receptor. Science (New York, N.Y.), 237(4812), 268-75. [PubMed:3037703] [WorldCat] [DOI] - ↑
Morimoto, M., Morita, N., Ozawa, H., Yokoyama, K., & Kawata, M. (1996).
Distribution of glucocorticoid receptor immunoreactivity and mRNA in the rat brain: an immunohistochemical and in situ hybridization study. Neuroscience research, 26(3), 235-69. [PubMed:9121734] [WorldCat] [DOI] - ↑
Ahima, R., Krozowski, Z., & Harlan, R. (1991).
Type I corticosteroid receptor-like immunoreactivity in the rat CNS: distribution and regulation by corticosteroids. The Journal of comparative neurology, 313(3), 522-38. [PubMed:1770174] [WorldCat] [DOI] - ↑
Hu, Z., Yuri, K., Ozawa, H., Lu, H., & Kawata, M. (1997).
The in vivo time course for elimination of adrenalectomy-induced apoptotic profiles from the granule cell layer of the rat hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(11), 3981-9. [PubMed:9151715] [WorldCat] - ↑
Nishi, M., & Kawata, M. (2006).
Brain corticosteroid receptor dynamics and trafficking: Implications from live cell imaging. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 12(2), 119-33. [PubMed:16514009] [WorldCat] [DOI] - ↑
Sakamoto, H., Takahashi, H., Matsuda, K., Nishi, M., Takanami, K., Ogoshi, M., ..., & Kawata, M. (2012).
Rapid signaling of steroid hormones in the vertebrate nervous system. Frontiers in bioscience (Landmark edition), 17, 996-1019. [PubMed:22201787] [WorldCat] [DOI] - ↑ 12.0 12.1
Popoli, M., Yan, Z., McEwen, B.S., & Sanacora, G. (2011).
The stressed synapse: the impact of stress and glucocorticoids on glutamate transmission. Nature reviews. Neuroscience, 13(1), 22-37. [PubMed:22127301] [PMC] [WorldCat] [DOI] - ↑
Jacobson, L., & Sapolsky, R. (1991).
The role of the hippocampus in feedback regulation of the hypothalamic-pituitary-adrenocortical axis. Endocrine reviews, 12(2), 118-34. [PubMed:2070776] [WorldCat] [DOI] - ↑
Bohus, B., Koolhaas, J.M., Luiten, P.G., Korte, S.M., Roozendaal, B., & Wiersma, A. (1996).
The neurobiology of the central nucleus of the amygdala in relation to neuroendocrine and autonomic outflow. Progress in brain research, 107, 447-60. [PubMed:8782536] [WorldCat] [DOI] - ↑
Jankord, R., & Herman, J.P. (2008).
Limbic regulation of hypothalamo-pituitary-adrenocortical function during acute and chronic stress. Annals of the New York Academy of Sciences, 1148, 64-73. [PubMed:19120092] [PMC] [WorldCat] [DOI]
(執筆者:西 真弓 担当編集委員:尾藤晴彦)