ニューレグリン
那波 宏之(初版)
新潟大学 脳研究所 基礎神経科学部門 分子神経生物学分野
森 大輔(改訂第2版)
DOI:10.14931/bsd.116 原稿受付日:2011年10月26日 原稿完成日:2014年XX月XX日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
| Neuregulin 2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | NRG2; DON1; HRG2; NTAK | ||||||||||||
| External IDs | OMIM: 603818 HomoloGene: 75024 GeneCards: NRG2 Gene | ||||||||||||
| |||||||||||||
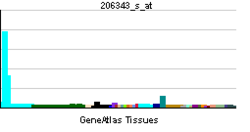
| RNA expression pattern | |||||||||||||
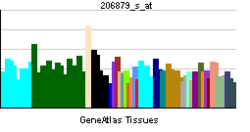 | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 9542 | 100042150 | |||||||||||
| Ensembl | ENSG00000158458 | ENSMUSG00000060275 | |||||||||||
| UniProt | O14511 | n/a | |||||||||||
| RefSeq (mRNA) | NM_001184935.1 | NM_001167891.1 | |||||||||||
| RefSeq (protein) | NP_001171864.1 | NP_001161363.1 | |||||||||||
| Location (UCSC) |
Chr 5: 139.23 – 139.42 Mb |
Chr 18: 36.18 – 36.36 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
| Neuregulin 3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | NRG3; HRG3; pro-NRG3 | ||||||||||||
| External IDs | OMIM: 605533 MGI: 1097165 HomoloGene: 32051 GeneCards: NRG3 Gene | ||||||||||||
| |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 10718 | 18183 | |||||||||||
| Ensembl | ENSG00000185737 | ENSMUSG00000041014 | |||||||||||
| UniProt | P56975 | O35181 | |||||||||||
| RefSeq (mRNA) | NM_001010848.3 | NM_008734 | |||||||||||
| RefSeq (protein) | NP_001010848.2 | NP_032760 | |||||||||||
| Location (UCSC) |
Chr 10: 83.63 – 84.75 Mb |
Chr 14: 39.18 – 40.29 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
| Neuregulin 4 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||
| Symbols | NRG4; DKFZp779N0541; DKFZp779N1944; HRG4 | ||||||||||
| External IDs | OMIM: 610894 MGI: 1933833 HomoloGene: 12921 GeneCards: NRG4 Gene | ||||||||||
| |||||||||||
| Orthologs | |||||||||||
| Species | Human | Mouse | |||||||||
| Entrez | 145957 | 83961 | |||||||||
| Ensembl | ENSG00000169752 | ENSMUSG00000032311 | |||||||||
| UniProt | Q8WWG1 | Q9WTX4 | |||||||||
| RefSeq (mRNA) | NM_138573 | NM_032002.2 | |||||||||
| RefSeq (protein) | NP_612640 | NP_114391.1 | |||||||||
| Location (UCSC) |
Chr 15: 76.23 – 76.35 Mb |
Chr 9: 55.07 – 55.17 Mb | |||||||||
| PubMed search | [7] | [8] | |||||||||
英:Neuregulin、英略語:NRG
ニューレグリンは、Neu/Her2/ErbB2受容体に相互作用して、そのチロシンリン酸化を増大させる44kDaの糖タンパク質として最初に同定された。その後、これらの配列に高い相同性を持つ遺伝子スクリーニングが行われ、現在までに、NRG1、NRG2、NRG3、NRG4の各遺伝子が単離されている。これらのニューレグリンファミリーは、いずれも上皮成長因子(EGF)様ドメインを遺伝子内に有しており、成熟型のニューレグリンは上皮成長因子受容体(EGFR)/Her/ErbB受容体を活性化するリガンドとして機能する。ニューレグリンによるこれらの受容体の活性化は、中枢神経系のみならずさまざまな器官や組織において、個体の発生や成長、維持に重要な役割を担っている。成体においてもその機能は重要であり、ニューレグリン遺伝子の調節不全は、乳がんなど悪性腫瘍の形成、統合失調症や双極性障害のような精神神経疾患の発症など多くの病態に関与すると言われている。
サブタイプ
ニューレグリン1-4は、細胞内で前駆体型として産生される。そのほとんどがI型膜貫通タンパク質の構造をとっている。ニューレグリンファミリーの各遺伝子産物には、非常に多くのアイソフォームが存在するが、全てのアイソフォームはEGF様ドメインを有している。特に解析の進んでいるニューレグリン1(NRG1)について、これまでプロモーターの違いによって1型-6型のアイソフォームが存在している。さらにこれらのアイソフォームは、多様なスプライシングを受けるために、結果として非常に多くのアイソフォームが形成される(詳細は後述)。このため、ニューレグリン1は、その発見および研究背景の違いから、neu differentiation factor(NDF)、heregulin(Her)、glia growth factor(GGF)、acetylcholine receptor inducing activity(ARIA)、breast cancer cell differentiation factor p45(p45)などの別称を有することとなっている。
構造
先述の通り、ニューレグリン1には多数のアイソフォームが存在することが報告されている。ニューレグリン1には6種類の異なるプロモーターと、N末端側のアミノ酸配列領域を持つアイソフォームが存在する。ニューレグリン1の3型はプロリンに富んだ領域を持ち、2回膜貫通型の膜タンパク質である。それ以外のニューレグリン1、およびニューレグリン2,3,4はIgドメインを持ち、1回膜貫通型の膜タンパク質である。全てのニューレグリンはEGF様ドメインを有しているが、このドメインのアミノ酸配列の違いからα型とβ型が存在している。さらにEGF様ドメインから膜貫通ドメイン間の配列の違いや細胞内ドメインの構造の違いにより多様なアイソフォームを形成している。
ニューレグリン前駆体は小胞体膜を起点として、ゴルジ体を経過して細胞内輸送され、通常は細胞膜表面に繋留されている。しかし、多くの分泌因子に特徴的な膜輸送のシグナル配列は、2型ニューレグリン1以外には存在していないため、前駆体型ニューレグリンの細胞内輸送機構とプロセッシング機構には不明な点が多い。細胞膜表面のニューレグリンは、細胞外刺激に反応して、ADAM19、TACE、BACEなどのメタロプロテアーゼによって剪断(プロセッシング)され、EGF様ドメインを有する細胞外領域が、細胞外へと分泌されて、Her/ErbBシグナルを活性化する。残りの細胞内領域は核に入り、特定の遺伝子の転写因子として機能することが報告されている。
分布
ニューレグリンファミリーのメッセンジャーRNAの発現分布については、発生中のマウスを中心として解析されている。一方、タンパク質レベルの発現解析も行われているが、アイソフォームの多様性の問題があり、未知の点が多い。それに対して、ニューレグリンの受容体となるErbB3やErbB4の発現パターンについてはよく知られており、最近の報告では、抑制性のGABA作動性ニューロンにおいても強く発現していることがわかっている。
ニューレグリン1は、発生過程で神経系およびその他の器官でも幅広く発現している(表1)。成体においても、中枢神経系、末梢神経系、心臓、消化器官など幅広く発現している。中枢神経系においては、海馬、とくにCA2、CA3領域、白質の神経細胞、大脳皮質の3層、5層、脳幹、小脳、特にプルキンエ細胞において強く発現している[1]。
| NRG1 1型 | NRG1 2型 | NRG1 3型 | ErbB3 | ErbB4 | |||||||||||
| マウス胚 | 12日胚 | 15日胚 | 18日胚 | 12日胚 | 15日胚 | 18日胚 | 12日胚 | 15日胚 | 18日胚 | 12日胚 | 15日胚 | 18日胚 | 12日胚 | 15日胚 | 18日胚 |
| 終脳 | |||||||||||||||
| 脳室帯 | + | + | + | ++ | ++ | ++ | − | ++ | ++ | − | − | − | − | − | ++ |
| 皮質 | − | − | − | + | + | + | + | ++ | ++ | − | − | − | ++ | ++ | ++ |
| 海馬 | / | / | − | / | / | − | / | / | ++ | / | / | − | / | / | ++ |
| 嗅脳 | / | / | + | + | + | + | / | + | + | − | − | + | ++ | ++ | ++ |
| 線条体 | / | − | − | / | + | ++ | / | + | ++ | / | − | − | / | ++ | + |
| 前障 | / | / | − | / | / | ++ | / | / | − | / | / | − | / | / | ++ |
| 中脳 | − | + | + | + | + | ++ | + | ++ | + | − | − | + | ++ | ++ | ++ |
| 小脳 | |||||||||||||||
| 皮質 | / | / | − | / | / | − | / | / | − | / | / | − | / | / | ++ |
| 髄 | / | / | − | / | / | + | / | / | + | / | / | − | / | / | ++ |
| 脳橋・延髄 | − | − | − | + | + | + | + | − | − | − | − | − | ++ | ++ | ++ |
| 脊髄 | − | + | + | + | ++ | ++ | ++ | ++ | ++ | − | − | − | ++ | ++ | ++ |
| 脈絡叢 | / | − | − | / | − | − | / | − | − | / | − | − | / | − | − |
| 下垂体 | / | − | − | / | ++ | ++ | / | ++ | ++ | / | + | − | / | + | ++ |
| 鼻腔 | |||||||||||||||
| 未分化上皮 | − | / | / | / | / | ++ | / | / | ++ | / | / | − | / | / | |
| 嗅上皮 | / | − | − | / | − | − | / | ++ | ++ | / | ++ | ++ | / | − | − |
| 呼吸上皮 | / | − | + | / | − | − | / | − | − | / | ++ | ++ | / | − | − |
| 網膜 | |||||||||||||||
| 未分化上皮 | − | / | / | − | / | / | − | / | / | − | / | / | − | / | / |
| 顆粒層 | / | − | − | / | − | − | / | − | − | / | − | − | / | − | − |
| 神経節細胞 | / | − | − | / | − | + | / | + | + | / | − | − | / | − | + |
| 内耳 | |||||||||||||||
| 未分化上皮 | − | / | / | − | / | / | − | / | / | − | / | / | − | / | / |
| 感覚上皮 | / | − | − | / | − | − | / | − | − | / | + | + | / | − | + |
| 交感神経節 | − | − | − | − | − | − | + | + | + | + | + | + | − | − | − |
| 骨格筋 | − | − | − | + | + | + | − | − | − | ++ | ++ | + | + | + | + |
| 心臓 | |||||||||||||||
| 心筋 | − | − | − | − | − | − | − | − | − | − | − | − | ++ | ++ | ++ |
| クッションまたは弁 | − | − | − | − | − | − | − | − | − | ++ | + | + | − | + | ++ |
| 心内膜 | + | + | + | − | − | − | + | + | + | − | − | − | − | − | − |
(ニューレグリン2−4についても御記述ください)
機能
受容体とシグナル伝達
成熟型NRG1はアイソフォームに違いからその構造が非常に多岐にわたっているが、共通領域のEGF様ドメインはEGFR/ErbB受容体ファミリー分子であるErbB3、ErbB4受容体に結合するリガンドとして結合し、その受容体のチロシンキナーゼ活性を上昇させる。GFR/ErbB受容体ファミリーは共通した構造をもち、リガンドと結合して、ヘテロあるいはホモ二量体を形成する細胞外領域、細胞膜貫通領域、チロシンキナーゼ活性をもつ細胞内領域からなる。細胞外領域にリガンドが結合すると、受容体の酵素部が活性化するとともに、相互アフィニテイーが上がり、二量体を形成が促進される。通常、二量体を形成すると、相手側のErbB分子の細胞内領域をチロシンリン酸化する。ErbB2受容体のリガンドは知られていないが、ErbB3やErbB4とヘテロ二量体を形成することが出来るため、ニューレグリンはErbB2の活性化を行うことが出来る。ニューレグリンの他にErbB3受容体のリガンドはCaleb/NGC、ErbB4受容体のリガンドはHB-EGF、β-cellulin、Epiregulin、Epigenが知られている。
ニューレグリン1に親和性の高いErbB4分子は、神経細胞のなかで多くはPSD-95と結合し後シナプス部位に蓄積している。先述の通り、PSD-95分子を介してNMDA型グルタミン酸受容体とシグナル分子複合体を形成し、ErbB4シグナルは直接的にNMDA受容体の活性を調節しているとされている。ニューレグリン1もしくは電気刺激により、メタロプロテアーゼによるErbB4の細胞内ドメインの切断を促進し、核内に移行し分化や細胞死の誘導をする。
生理機能
(この項目整理が必要かと思います) ニューレグリン1のEGF様ドメイン領域のペプチドは、さまざまな生理活性を持つことが知られている。その生理機能を列挙すると、 ①細胞接着調節 ②ErbB受容体の活性化(二量体化) ③神経冠細胞の発生 ④創傷治癒 ⑤心室心筋細胞の分化 ⑥細胞の形態形成 ⑦運動行動 ⑧横紋筋の分化 ⑨心筋分化 ⑩シナプス形成 ⑪グリア細胞の分化 ⑫乳腺の分化 ⑬細胞間情報伝達 ⑭心筋細胞の増殖の調節 ⑮神経系の発生 ⑯細胞遊走 ⑰神経伝達物質代謝プロセス ⑱ホモ二量体化 ⑲MAPKKKカスケードの調節 ⑳神経の運命決定 ㉑細胞増殖の正の調節 ㉒胎児発生 ㉓分泌の負の調節 ㉔Rasシグナル伝達の正の調節 ㉕プロテインキナーゼBのシグナル伝達の調節 ㉖末梢神経の発生 ㉗転写調節 などが知られている。総じて、上皮細胞、グリア細胞、神経細胞、シュワン細胞、骨格筋細胞、心筋細胞の発生と分化の機能を持つ。
神経発生
ニューレグリンによるErbB4受容体の活性化は古くから提唱されていた興奮性神経回路形成のみではなく(この知見に関しても詳しく御記述をお願いいたします)、抑制性のGABA作動性神経回路の形成にも機能を持つことが報告されている。この報告の中で、ニューレグリン1の添加により、パルブアルブミン陽性介在ニューロンの軸索の伸長と樹状突起のブランチ形成、シナプス形成が促進されることが証明されている。そして、NRG1-ErbB4シグナルが、錐体細胞からGABA介在ニューロンへの適切な入力と、GABAインターニューロンから錐体細胞への適切な入力の、双方向の調節に必要であることが報告されている。
神経堤細胞の分化の過程において、ニューレグリン1が骨形成誘導因子(BMP)の刺激によって背側大動脈周辺で発現が誘導され、ケモカインであるSDF1とともに、交感神経-副腎髄質前駆細胞の移動と分化の制御を司っていることが証明された。
ノックアウトマウス
ニューレグリン1遺伝子のノックアウトマウスは、約10のグループにより作製、表現型が解析されている。これらの中で代表的なものは、全てのEGF様ドメインを破壊したノックアウトマウスと、1回膜貫通型ニューレグリンに共通のイムノグロブリンドメインを破壊したノックアウトマウスである。いずれの場合も、10.5日胚にて、心臓の形成不全により致死となる。上皮成長因子EGFなど、他のEGFR/ErbB受容体のリガンドのノックアウトマウスと比較して、ニューレグリン1ノックアウトマウスの表現型は極めて重篤である。ヘテロノックアウトマウスでは、中枢神経および末梢神経で、グリア細胞からの供給される髄鞘が減少し、髄鞘形成および軸索の成熟が阻害される。反対に、ニューレグリン強発現マウスでは髄鞘が厚くなる。タイプ3アイソフォームのみ欠損させたマウスでは、出生後に呼吸不全によって致死となる。このマウスでは、シュワン細胞やオリゴデンドロサイトによる髄鞘形成が、野生型のそれと比較して弱くなる。
ニューレグリン2遺伝子のノックアウトマウスは、Brittoらが作製した。少し成長の遅延が見られる他は、繁殖可能でありほとんど正常である。
ニューレグリン3、ニューレグリン4遺伝子のノックアウトマウスについては報告されていない。
疾患との関わり
ニューレグリン1がErbB4受容体を活性化し、Srcキナーゼの活性を抑制することにより、NMDA型グルタミン酸受容体のリン酸化が低下し、NMDA受容体の機能が抑制されるという、統合失調症のグルタミン酸仮説に合致するモデルが提唱された。統合失調症にも関連する、ErbB4の多型が認められている。
また骨芽腫や乳がんの多くでニューレグリン1の高発現が見られ、ErbBシグナルの過剰な活性化による形質転換と相関している。
関連項目
参考文献
- ↑
Law, A.J., Shannon Weickert, C., Hyde, T.M., Kleinman, J.E., & Harrison, P.J. (2004).
Neuregulin-1 (NRG-1) mRNA and protein in the adult human brain. Neuroscience, 127(1), 125-36. [PubMed:15219675] [WorldCat] [DOI]
Britto, J.M., Lukehurst, S., Weller, R., Fraser, C., Qiu, Y., Hertzog, P., & Busfield, S.J. (2004).
Generation and characterization of neuregulin-2-deficient mice. Molecular and cellular biology, 24(18), 8221-6.
[PubMed:15340081]
[PMC]
[WorldCat]
[DOI]
Citri, A., & Yarden, Y. (2006).
EGF-ERBB signalling: towards the systems level. Nature reviews. Molecular cell biology, 7(7), 505-16.
[PubMed:16829981]
[WorldCat]
[DOI]
Corfas, G., Roy, K., & Buxbaum, J.D. (2004).
Neuregulin 1-erbB signaling and the molecular/cellular basis of schizophrenia. Nature neuroscience, 7(6), 575-80.
[PubMed:15162166]
[WorldCat]
[DOI]
Fazzari, P., Paternain, A.V., Valiente, M., Pla, R., Luján, R., Lloyd, K., ..., & Rico, B. (2010).
Control of cortical GABA circuitry development by Nrg1 and ErbB4 signalling. Nature, 464(7293), 1376-80.
[PubMed:20393464]
[WorldCat]
[DOI]
Gumà, A., Martínez-Redondo, V., López-Soldado, I., Cantó, C., & Zorzano, A. (2010).
Emerging role of neuregulin as a modulator of muscle metabolism. American journal of physiology. Endocrinology and metabolism, 298(4), E742-50.
[PubMed:20028964]
[WorldCat]
[DOI]
Mei, L., & Xiong, W.C. (2008).
Neuregulin 1 in neural development, synaptic plasticity and schizophrenia. Nature reviews. Neuroscience, 9(6), 437-52.
[PubMed:18478032]
[PMC]
[WorldCat]
[DOI]
Meyer, D., & Birchmeier, C. (1995).
Multiple essential functions of neuregulin in development. Nature, 378(6555), 386-90.
[PubMed:7477375]
[WorldCat]
[DOI]
Pitcher, G.M., Kalia, L.V., Ng, D., Goodfellow, N.M., Yee, K.T., Lambe, E.K., & Salter, M.W. (2011).
Schizophrenia susceptibility pathway neuregulin 1-ErbB4 suppresses Src upregulation of NMDA receptors. Nature medicine, 17(4), 470-8.
[PubMed:21441918]
[PMC]
[WorldCat]
[DOI]
Rico, B., & Marín, O. (2011).
Neuregulin signaling, cortical circuitry development and schizophrenia. Current opinion in genetics & development, 21(3), 262-70.
[PubMed:21295966]
[WorldCat]
[DOI]
Saito, D., Takase, Y., Murai, H., & Takahashi, Y. (2012).
The dorsal aorta initiates a molecular cascade that instructs sympatho-adrenal specification. Science (New York, N.Y.), 336(6088), 1578-81.
[PubMed:22723422]
[WorldCat]
[DOI]
Stefansson, H., Sigurdsson, E., Steinthorsdottir, V., Bjornsdottir, S., Sigmundsson, T., Ghosh, S., ..., & Stefansson, K. (2002).
Neuregulin 1 and susceptibility to schizophrenia. American journal of human genetics, 71(4), 877-92.
[PubMed:12145742]
[PMC]
[WorldCat]
[DOI]