カテコールアミン
徳岡 宏文、一瀬 宏
東京工業大学
DOI:10.14931/bsd.1890 原稿受付日:2012年6月5日 原稿完成日:2013年8月12日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:catecholamine 独:Katecholamine, Catecholamine, Brenzcatechinamine 仏:catécholamine
同義語:カテコラミン
カテコールアミンとは
カテコールアミンとは本来カテコール基とアミノ基をもつ化合物であるが、神経科学においては主に神経伝達物質として機能するドーパミン、ノルアドレナリン(またはノルエピネフリン)、アドレナリン(またはエピネフリン)の3つを指す。生合成経路上はドーパミン、ノルアドレナリン、アドレナリンの順に合成され、各細胞における最終的な産物の決定は合成酵素の有無によって決まる。またトランスポーターや代謝分解に関わる酵素の多くが共通している。このように、機能は異なるものの、共通のタンパク質が代謝に関与している。各物質についてはそれぞれの項(ドーパミン、ノルアドレナリン、アドレナリン)およびモノアミンの項を参照のこと。ここでは主要な共通する特徴、および補足事項を記す。
構造
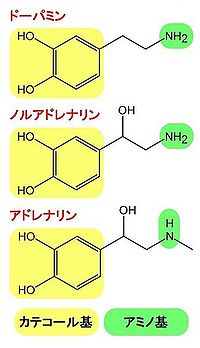
カテコール基およびアミノ基をもつ(図1)。
カテコールアミン神経伝達物質に共通する特徴
合成
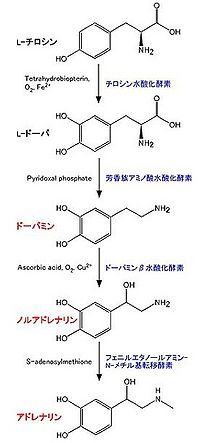
生合成経路は図2の通りである。このうち、チロシン水酸化酵素が律速酵素とされる。チロシン水酸化酵素(tyrosine hydroxylase (TH)、EC 1.14.16.2)はチロシンよりL-DOPA (L-3,4-dihydroxyphenylalanine)を合成する[1] [2] [3]。反応には、テトラヒドロビオプテリン (tetrahydrobiopterin), O2, Fe2+が必要。その活性制御は、主にタンパク質の量と、リン酸化による。全てのカテコールアミン産生細胞に存在する。
補因子であるテトラヒドロビオプテリン(tetrahydrobiopterin)はGTPより合成される。律速酵素はGTPシクロヒドラーゼI(GTP cyclohydrolase I)である[4]。
代謝分解
カテコールアミンの代謝分解には次の二つの酵素が重要である。
- モノアミン酸化酵素(monoamine oxidase, MAO):MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在し、細胞内のドーパミンおよびノルアドレナリン(再取込みされたものを含む)の分解に関与する。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる[5][6]。
- カテコール-O-メチル基転移酵素(catechol-O-methyltransferase, COMT):COMTはカテコール基のメタ位の水酸基にメチル基を転移させる。腎臓や肝臓に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている[7]。
関連項目
参考文献
- ↑
Nagatsu, T. (1989).
The human tyrosine hydroxylase gene. Cellular and molecular neurobiology, 9(3), 313-21. [PubMed:2575455] [WorldCat] [DOI] - ↑
Dunkley, P.R., Bobrovskaya, L., Graham, M.E., von Nagy-Felsobuki, E.I., & Dickson, P.W. (2004).
Tyrosine hydroxylase phosphorylation: regulation and consequences. Journal of neurochemistry, 91(5), 1025-43. [PubMed:15569247] [WorldCat] [DOI] - ↑
Daubner, S.C., Le, T., & Wang, S. (2011).
Tyrosine hydroxylase and regulation of dopamine synthesis. Archives of biochemistry and biophysics, 508(1), 1-12. [PubMed:21176768] [PMC] [WorldCat] [DOI] - ↑
Thöny, B., Auerbach, G., & Blau, N. (2000).
Tetrahydrobiopterin biosynthesis, regeneration and functions. The Biochemical journal, 347 Pt 1, 1-16. [PubMed:10727395] [PMC] [WorldCat] - ↑
Youdim, M.B., Edmondson, D., & Tipton, K.F. (2006).
The therapeutic potential of monoamine oxidase inhibitors. Nature reviews. Neuroscience, 7(4), 295-309. [PubMed:16552415] [WorldCat] [DOI] - ↑
Vitalis, T., Fouquet, C., Alvarez, C., Seif, I., Price, D., Gaspar, P., & Cases, O. (2002).
Developmental expression of monoamine oxidases A and B in the central and peripheral nervous systems of the mouse. The Journal of comparative neurology, 442(4), 331-47. [PubMed:11793338] [WorldCat] [DOI] - ↑
Chen, J., Song, J., Yuan, P., Tian, Q., Ji, Y., Ren-Patterson, R., ..., & Weinberger, D.R. (2011).
Orientation and cellular distribution of membrane-bound catechol-O-methyltransferase in cortical neurons: implications for drug development. The Journal of biological chemistry, 286(40), 34752-60. [PubMed:21846718] [PMC] [WorldCat] [DOI]