「シナプスタグ仮説」の版間の差分
細 →発展 |
Daisukeokada (トーク | 投稿記録) 細編集の要約なし |
||
| (4人の利用者による、間の54版が非表示) | |||
| 1行目: | 1行目: | ||
シナプスタグ仮説 synaptic tagging hypothesis, synaptic tag hypothesis | |||
シナプスタグとは、新規タンパク質合成に依存する後期シナプス可塑性が起きるシナプスを決定する入力依存的な仕組みで、仮説として提案され<sup>[1,2]</sup>、近年実証された<sup>[3]</sup>。 | |||
狭義のシナプスタグ仮説 狭義のシナプスタグ仮説は、FreyとMorrisの行った二経路実験における連合性後期長期増強の成立を説明するための仮説である [1,2]。二経路実験とは、ラット海馬急性切片でCA1野Schaffer側枝を二箇所刺激し、独立した二経路の集合シナプス電位を一つの記録電極から測定する手法である(図1)。 | |||
[[Image:図1二経路実験.jpg|図1 二経路実験の配置 海馬急性切片に刺激電極S1S2と記録電極Rを置く。]]<br> 図1 二経路実験の配置 海馬急性切片に刺激電極S1S2と記録電極Rを置く。<br> | |||
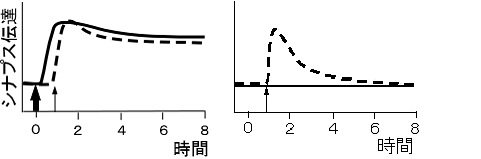
一方の刺激電極S1に長く持続する後期長期増強を起こす電気刺激を与えた後、他方の刺激電極S2から持続の短い初期長期増強を起こす刺激を与えた。S1経路では予想通り入力特異的な後期長期増強が見られた。一方S2経路には、予想(初期長期増強が起きる)に反して後期長期増強が見られた(図2)。S2の変化は連合性後期長期増強と呼ばれる。 | |||
[[Image:図2連合性後期可塑性.jpg]]<br> | |||
図2 連合性後期可塑性 太矢印でS1に後期可塑性を起こす刺激、細矢印でS2に初期可塑性を起こす刺激を与えた。S1の集合シナプス後電位の時間変化が実線、S2のものが破線。<br> | |||
<br> 長期記憶の細胞機構とされる後期可塑性の成立には、長期記憶同様に、新規タンパク質の合成が必要である。これらの新規タンパク質がシナプス部で示す機能により後期可塑性が発現すると考えられる。細胞体で新規合成されたタンパク質がシナプス部で入力依存的に機能するためには、入力を受けたシナプス特異的に新規タンパク質が機能する仕組み、即ち後期可塑性の入力特異性機構、が必要である。図2の実験は、S1だけでなくS2刺激を受けたシナプスでも入力特異性機構が作動したことを示している。 FreyとMorrisは連合性後期長期増強を起こす仕組みとして主に次の三つの可能性を検討し、シナプスタグ仮説が結果をうまく説明すると提唱した<sup>[1,2]</sup>。<br> | |||
1)局所合成。即ち樹状突起に局在するmRNAが活動依存的に翻訳される。<br> | |||
2)メイル仮説。細胞体で合成されたタンパク質には予め目的地がコードされている、もしくは目的地特異的な輸送ルートで活動シナプスに運ばれる。<br> | |||
3)シナプスタグ仮説。細胞体で新規合成された後期可塑性関連タンパク質が機能できるシナプスでは、何らかの生化学的活性が活性化しており、この活性によって後期長期増強の発現が可能になる。この仮想活性をシナプスタグと呼ぶ。<br> | |||
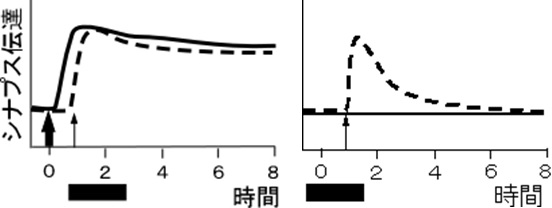
二経路実験で、S1に後期長期増強を起こす刺激を与えた後、タンパク質合成を阻害した状態でS2に初期長期増強を起こす刺激を与えた場合も、両経路に後期長期増強が見られた(図3)。つまり、S2シナプス近傍の局所合成は不要であること、及び、S1刺激で合成されたタンパク質がS2シナプスに運ばれたことを示している。細胞体で合成されたタンパク質は全てのシナプスに使用のチャンスがある状態で輸送されることになるので、メイル仮説は否定される。一方、シナプスタグ仮説によれば、細胞体で合成されたシナプスタンパク質は輸送途上では目的地を持たず全ての樹状突起を輸送されており、シナプスタグが活性化したシナプスに取り込まれて機能する。この実験結果は、S1とS2の両シナプスではシナプスタグが活性化しているので新規合成タンパク質が機能し後期可塑性が発現したと説明できる。FreyとMorrisらは更にS1とS2の順番を入れ替える実験を行い、S2の弱い刺激の後でタンパク合成を起こしても連合性後期長期増強が起きることも見出した<sup>[4]</sup>。 | |||
[[Image:図3シナプスタグ仮説.jpg]]<br> | |||
図3 四角の時点でタンパク質合成阻害剤を与えてもS1S2経路ともに後期可塑性がおきた。この結果はシナプスタグ仮説を支持する。<br> | |||
<br> 以上から、後期可塑性の入力特異性機構としてシナプスタグ仮説が有力視され、シナプスタグは以下の性質を持つと思われた<sup>[2]</sup>。 <br> | |||
1. 初期可塑性が起きたシナプスでNMDA受容体依存的かつ入力特異的に活性化される。 <br> | |||
2. 細胞体で新規合成されたタンパク質はシナプスタグの活性化されたシナプスでのみ機能できる。<br> | |||
3. 細胞体で新規合成されたタンパク質は目的地を持たずに樹状突起を輸送される。 <br> | |||
4. シナプスタグの活性化にはタンパク質合成は不要である。<br> | |||
5. シナプスタグは一度活性化されるとしばらく活性を保つ。 <br> | |||
シナプスタグ仮説の実証のために、ラット海馬培養神経細胞において仮説が示唆するような動きをするタンパク質があるかどうか調べた。すると、細胞体を出発したVesl-1S (Homer-1a) タンパク質は全ての樹状突起を輸送されるがスパイン内には入らず、NMDA受容体刺激があったシナプスにだけ入ることが観察された<sup>[3]</sup>。Vesl-1Sは後期長期増強時に細胞体で発現誘導されるタンパク質で、シナプス部long-form Veslタンパク質が作るネットワークを壊すことでシナプス可塑性を起こすきっかけを作るとされる最初期遺伝子産物である <sup>[5]</sup>。Vesl-1Sタンパク質の樹状突起からスパイン内への移動がシナプス入力により制御されていることはシナプスタグの上記性質を全て満たしており、シナプスタグという仕組みが実証された。 しかし、シナプスタグの分子的実体や、活性化のシグナル等は不明なままである。二経路実験は更に、連合性後期可塑性成立に関与する分子として、PKM zeta<sup>[6]</sup>、 PKA、 MEK1/2、 CaMKⅡ<sup>[7]</sup>、neuropsin<sup>[8]</sup> など明らかにした。一般に後期可塑性は、少なくとも、先行する初期可塑性、新規タンパク質合成、シナプスタグ機構、シナプス部での新規タンパク質の機能発現等の複数の内部過程により起きると考えられている。二経路実験ではこれら複数の過程を経た最終結果である連合性可塑性の有無を測定するので、ある分子が連合性後期可塑性に必要だとしても、それがシナプスタグの仕組みに関与するかどうかを二経路実験から決定することはできない。この問題はシナプスタグの定義や後期可塑性の表現機構に直結しており、現時点ではこの区別は難しい。 細胞体で合成され樹状突起を非特異的に輸送されるタンパク質は、シナプス部での機能に先立ってシナプスに取り込まれる (capture)。この二つの過程を分けてsynaptic tagging and capture という語が用いられることがある。[3]の結果は、Capture が入力特異的に起きるということなので、capture がtaggingの機能を持つとも言える。一方、captureされたタンパク質が機能して可塑性を起こすために、シナプス部、特にPSD部の分子集合体の修飾が必要ならば、この修飾もシナプスタグである。Frey とMorrisの初期の実験で考えられたsensitization 仮説はこの方向の考え方であった<sup>[4]</sup>。後期可塑性に伴って新規に発現誘導される遺伝子は少なくとも 100 近くに及ぶ<sup>[9]</sup>。新規タンパク質の機能やシナプス部への局在・活性化の機構はタンパク質毎に異なるだろうから、シナプスタグはタンパク質毎に異なる仕組みである可能性が考えられる。局所合成によりシナプス内の環境が調節された後に、最初期遺伝子産物群、さらに遅れてやってくる遺伝子産物群などが作用することで可塑性が起きると考えれば、captureとtaggingは入れ子構造になるので厳密に区別できないのではないだろうか。 | |||
シナプスタグ仮説の広がり シナプス前線維が運ぶ情報はシナプス後細胞が興奮すれば次の細胞に伝えられる。この興奮しやすさの制御がシナプス可塑性の機能である。細胞が受ける複数の入力の統合によりその細胞が発火するかどうかが決まるので、シナプス可塑性により増強されたシナプスは発火に貢献する確率が高くなり、そのシナプスが運んでいる情報が次に伝えられやすくなる。この連鎖により、ある入力で一定の神経回路が作動するようになる。シナプス可塑性を起こすシナプスを決めるということは、シナプスを選ぶことにより伝える情報を選ぶということである。シナプス可塑性は記憶などの脳高次機能を担う神経回路網の経験依存的形成に関わる重要な細胞レベルの仕組みとして研究が盛んである。そして、シナプスタグは後期シナプス可塑性の仕組みの一部として、何を覚えるかなど情報の選別に関わる仕組みと考えられる。このため、より高次レベルの研究においても、タグという言葉が使われる傾向にある。狭義のシナプスタグ以外のタグには以下のようなものがある。 <br> | |||
1)局所合成 <br> | |||
後期シナプス可塑性に必要な新規タンパク質の一部は、樹状突起やスパインに局在するmRNAを用いて合成される。ラット海馬で二経路実験を用いた測定では連合性可塑性に局所合成は必要ではない(図3)が<sup>[1]</sup>、条件によってはPKM zetaなどの局所合成に依存している<sup>[10]</sup>。<br> | |||
局所合成はアメフラシでは後期可塑性の主要なメカニズムと考えられシナプスタグに相当する仕組みも報告されている<sup>[11]</sup>。<br> | |||
後期可塑性で発現誘導されるタンパク質は多岐に亘る。局所合成と細胞体での新規合成はおそらく共に必要であるが、前者はmRNAが既存で、しかもシナプス近傍で起きるのに対し、後者はmRNAの転写から始まりシナプス入力による転写開始シグナルが細胞核に伝わる時間と転写後翻訳を経てシナプス近傍まで輸送される時間が必要である。従って、これら二つの機構を併用することで、異なる種類のタンパク質が異なるタイミングで後期可塑性に貢献できると思われる。<br> | |||
シナプス可塑性の入力特異性は厳密ではなく、周囲のシナプスが影響を受けることが報告されている<sup>[12]</sup>。局所合成されシグナル伝達を担う分子が一定のコンパートメント内のシナプスに影響を与えると、コンパートメント単位での可塑性clustered plasticityが起きる可能性があり、実験的にも確認されている<sup>[13,14]</sup>。 <br> | |||
2)inverse tag <br> | |||
後期可塑性を起こす強いシナプス入力があった細胞内で、活動の低かったシナプスには特異的に後期長期抑圧がおきる。これにはArc/Arg3.1タンパク質が関与しており、カルシウム活動が低くカルモジュリンが活性化していないシナプスではカルシウムカルモジュリン依存性キナーゼⅡβがArc/Arg3.1タンパク質を結合し蓄積することが可塑的変化を起こす「逆シナプスタグ」として働き、その結果GluR1受容体の表面発現が減少する長期抑圧が起きることが報告されている <sup>[15]</sup>。 <br> | |||
3)behavioral tag <br> | |||
二つの海馬依存的行動タスクを、一つは短期記憶を作るような条件で、他方は長期記憶を作るような条件を用いて、同時にトレーニングすると、両タスクで長期記憶が形成された<sup>[16]</sup>。二経路実験をそのまま行動実験に移したような実験パラダイムなので、この連合性長期記憶を起こす仕組みはbehavioral tagと呼ばれている。二つの記憶をコードする細胞集成体に共通して活動する細胞があることが前提になると考えられるが、詳細は分かっていない。 <br> | |||
4)システム固定化 <br> | |||
海馬で獲得された記憶の一部は時間が経つと想起に海馬活動が不要になり、皮質の活動により想起されるようになる。この移行をシステム固定化、皮質依存になった記憶を遠隔記憶と言う。システム固定化の仕組みの詳細はまだ不明だが、初めに海馬が各モダリティ担当の皮質に情報を送り返し、遠隔記憶の想起時に活動する神経回路網を皮質に作ると考えられる。この時、複数の皮質に分散したシステム固定化後の記憶が一つの記憶として想起できるためには、これらが目印によってつながっている必要がある。この目印が「タグ」という言葉で表現されている<sup>[17]</sup>。 | |||
<br> | |||
文献 <br> | |||
1. U. Frey, R. G. M. Morris, Nature 385, 533 (1997). <br> | |||
2. U. Frey, R. G. M. Morris, Trends Neurosci. 21, 181 (1998). <br> | |||
3. D. Okada, F. Ozawa, K. Inokuchi, Science 324, 904 (2009) <br> | |||
< | |||
4. U. Frey, R. G. M. Morris, Neuropharmacology 37, 545 (1998). <br> | |||
5. Y. Inoue, H. Udo, K. Inokuchi, H. Sugiyama, Neuroscience 150, 841-852 (2007). <br> | |||
6. S. Sajikumar, S. Navakkode, T. C. Sacktor, J. U. Frey, J. Neurosci. 25, 5750-5756 (2005). <br> | |||
7. S. Sajikumar, S. Navakkode, J. U. Frey, J. Neurosci. 27, 5068-5080 (2007) <br> | |||
8. Y. Ishikawa, Y. Horii, H. Tamura, S. Shiosaka, J. Neurosci. 28, 843 (2008) <br> | |||
9. R. Matsuo, A. Murayama, Y. Saitoh, Y. Sakaki, K. Inokuchi, J. Neurochem.74, 2239-2249 (2000). <br> | |||
10. P. Serrano, Y. Yao, T. C. Sacktor, J. Neurosci 25, 1979 (2005) <br> | |||
11. D. O. Wang, S. M. Kim, Y. Zhao, H. Hwang, S. K. Miura, W. S. Sossin, K. C. Martin, Science 324, 1536 (2009) <br> | |||
12. F. Engert, T. Bonhoeffer, Nature 388, 279 (1997) <br> | |||
13. A. Govindarajan, R. J. Kelleher, S. Tonegawa, Nature Rev. Neurosci. 7, 575 (2006) <br> | |||
14. A. Govindarajan, I. Israely, S. Y. Huang, S. Tonegawa, Neuron 69, 132 (2011).<br> | |||
15. H. Okuno, K. Akashi, Y. Ishii, N. Yagishita-Kyo, K. Suzuki, M. Nonaka, T. Kawashima, H. Fujii, S. Takemoto-Kimura, M. Abe, R. Natsume, S. Chowdhury, K. Sakimura, P. F. Worley, H. Bito, Cell 149, 886 (2012) <br> | |||
16. F. Ballarini, D. Moncada, M. C, Martinez, N. Alen, H. Viola, Proc. Natl. Acad. Sci. USA 106, 14599 (2009) <br> | |||
17. E. Lesburgueres, O. L. Gobbo, S. Alaux-Cantin, A. Hambuchen, P. Trifilieff, B. Bontempi, Science 331, 924 (2011) | |||
関連語 | |||
シナプスキャプチャーSynaptic capture | |||
後期シナプス可塑性 late-phase synaptic plasticity | |||
連合性シナプス可塑性 associative synaptic plasticity | |||
<br> | |||
(執筆者: 岡田大助 、担当編集委員: 尾藤晴彦) | |||
2012年6月5日 (火) 17:06時点における版
シナプスタグ仮説 synaptic tagging hypothesis, synaptic tag hypothesis
シナプスタグとは、新規タンパク質合成に依存する後期シナプス可塑性が起きるシナプスを決定する入力依存的な仕組みで、仮説として提案され[1,2]、近年実証された[3]。
狭義のシナプスタグ仮説 狭義のシナプスタグ仮説は、FreyとMorrisの行った二経路実験における連合性後期長期増強の成立を説明するための仮説である [1,2]。二経路実験とは、ラット海馬急性切片でCA1野Schaffer側枝を二箇所刺激し、独立した二経路の集合シナプス電位を一つの記録電極から測定する手法である(図1)。
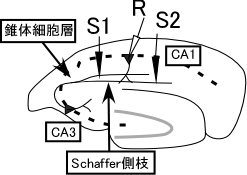
図1 二経路実験の配置 海馬急性切片に刺激電極S1S2と記録電極Rを置く。
一方の刺激電極S1に長く持続する後期長期増強を起こす電気刺激を与えた後、他方の刺激電極S2から持続の短い初期長期増強を起こす刺激を与えた。S1経路では予想通り入力特異的な後期長期増強が見られた。一方S2経路には、予想(初期長期増強が起きる)に反して後期長期増強が見られた(図2)。S2の変化は連合性後期長期増強と呼ばれる。
図2 連合性後期可塑性 太矢印でS1に後期可塑性を起こす刺激、細矢印でS2に初期可塑性を起こす刺激を与えた。S1の集合シナプス後電位の時間変化が実線、S2のものが破線。
長期記憶の細胞機構とされる後期可塑性の成立には、長期記憶同様に、新規タンパク質の合成が必要である。これらの新規タンパク質がシナプス部で示す機能により後期可塑性が発現すると考えられる。細胞体で新規合成されたタンパク質がシナプス部で入力依存的に機能するためには、入力を受けたシナプス特異的に新規タンパク質が機能する仕組み、即ち後期可塑性の入力特異性機構、が必要である。図2の実験は、S1だけでなくS2刺激を受けたシナプスでも入力特異性機構が作動したことを示している。 FreyとMorrisは連合性後期長期増強を起こす仕組みとして主に次の三つの可能性を検討し、シナプスタグ仮説が結果をうまく説明すると提唱した[1,2]。
1)局所合成。即ち樹状突起に局在するmRNAが活動依存的に翻訳される。
2)メイル仮説。細胞体で合成されたタンパク質には予め目的地がコードされている、もしくは目的地特異的な輸送ルートで活動シナプスに運ばれる。
3)シナプスタグ仮説。細胞体で新規合成された後期可塑性関連タンパク質が機能できるシナプスでは、何らかの生化学的活性が活性化しており、この活性によって後期長期増強の発現が可能になる。この仮想活性をシナプスタグと呼ぶ。
二経路実験で、S1に後期長期増強を起こす刺激を与えた後、タンパク質合成を阻害した状態でS2に初期長期増強を起こす刺激を与えた場合も、両経路に後期長期増強が見られた(図3)。つまり、S2シナプス近傍の局所合成は不要であること、及び、S1刺激で合成されたタンパク質がS2シナプスに運ばれたことを示している。細胞体で合成されたタンパク質は全てのシナプスに使用のチャンスがある状態で輸送されることになるので、メイル仮説は否定される。一方、シナプスタグ仮説によれば、細胞体で合成されたシナプスタンパク質は輸送途上では目的地を持たず全ての樹状突起を輸送されており、シナプスタグが活性化したシナプスに取り込まれて機能する。この実験結果は、S1とS2の両シナプスではシナプスタグが活性化しているので新規合成タンパク質が機能し後期可塑性が発現したと説明できる。FreyとMorrisらは更にS1とS2の順番を入れ替える実験を行い、S2の弱い刺激の後でタンパク合成を起こしても連合性後期長期増強が起きることも見出した[4]。
図3 四角の時点でタンパク質合成阻害剤を与えてもS1S2経路ともに後期可塑性がおきた。この結果はシナプスタグ仮説を支持する。
以上から、後期可塑性の入力特異性機構としてシナプスタグ仮説が有力視され、シナプスタグは以下の性質を持つと思われた[2]。
1. 初期可塑性が起きたシナプスでNMDA受容体依存的かつ入力特異的に活性化される。
2. 細胞体で新規合成されたタンパク質はシナプスタグの活性化されたシナプスでのみ機能できる。
3. 細胞体で新規合成されたタンパク質は目的地を持たずに樹状突起を輸送される。
4. シナプスタグの活性化にはタンパク質合成は不要である。
5. シナプスタグは一度活性化されるとしばらく活性を保つ。
シナプスタグ仮説の実証のために、ラット海馬培養神経細胞において仮説が示唆するような動きをするタンパク質があるかどうか調べた。すると、細胞体を出発したVesl-1S (Homer-1a) タンパク質は全ての樹状突起を輸送されるがスパイン内には入らず、NMDA受容体刺激があったシナプスにだけ入ることが観察された[3]。Vesl-1Sは後期長期増強時に細胞体で発現誘導されるタンパク質で、シナプス部long-form Veslタンパク質が作るネットワークを壊すことでシナプス可塑性を起こすきっかけを作るとされる最初期遺伝子産物である [5]。Vesl-1Sタンパク質の樹状突起からスパイン内への移動がシナプス入力により制御されていることはシナプスタグの上記性質を全て満たしており、シナプスタグという仕組みが実証された。 しかし、シナプスタグの分子的実体や、活性化のシグナル等は不明なままである。二経路実験は更に、連合性後期可塑性成立に関与する分子として、PKM zeta[6]、 PKA、 MEK1/2、 CaMKⅡ[7]、neuropsin[8] など明らかにした。一般に後期可塑性は、少なくとも、先行する初期可塑性、新規タンパク質合成、シナプスタグ機構、シナプス部での新規タンパク質の機能発現等の複数の内部過程により起きると考えられている。二経路実験ではこれら複数の過程を経た最終結果である連合性可塑性の有無を測定するので、ある分子が連合性後期可塑性に必要だとしても、それがシナプスタグの仕組みに関与するかどうかを二経路実験から決定することはできない。この問題はシナプスタグの定義や後期可塑性の表現機構に直結しており、現時点ではこの区別は難しい。 細胞体で合成され樹状突起を非特異的に輸送されるタンパク質は、シナプス部での機能に先立ってシナプスに取り込まれる (capture)。この二つの過程を分けてsynaptic tagging and capture という語が用いられることがある。[3]の結果は、Capture が入力特異的に起きるということなので、capture がtaggingの機能を持つとも言える。一方、captureされたタンパク質が機能して可塑性を起こすために、シナプス部、特にPSD部の分子集合体の修飾が必要ならば、この修飾もシナプスタグである。Frey とMorrisの初期の実験で考えられたsensitization 仮説はこの方向の考え方であった[4]。後期可塑性に伴って新規に発現誘導される遺伝子は少なくとも 100 近くに及ぶ[9]。新規タンパク質の機能やシナプス部への局在・活性化の機構はタンパク質毎に異なるだろうから、シナプスタグはタンパク質毎に異なる仕組みである可能性が考えられる。局所合成によりシナプス内の環境が調節された後に、最初期遺伝子産物群、さらに遅れてやってくる遺伝子産物群などが作用することで可塑性が起きると考えれば、captureとtaggingは入れ子構造になるので厳密に区別できないのではないだろうか。
シナプスタグ仮説の広がり シナプス前線維が運ぶ情報はシナプス後細胞が興奮すれば次の細胞に伝えられる。この興奮しやすさの制御がシナプス可塑性の機能である。細胞が受ける複数の入力の統合によりその細胞が発火するかどうかが決まるので、シナプス可塑性により増強されたシナプスは発火に貢献する確率が高くなり、そのシナプスが運んでいる情報が次に伝えられやすくなる。この連鎖により、ある入力で一定の神経回路が作動するようになる。シナプス可塑性を起こすシナプスを決めるということは、シナプスを選ぶことにより伝える情報を選ぶということである。シナプス可塑性は記憶などの脳高次機能を担う神経回路網の経験依存的形成に関わる重要な細胞レベルの仕組みとして研究が盛んである。そして、シナプスタグは後期シナプス可塑性の仕組みの一部として、何を覚えるかなど情報の選別に関わる仕組みと考えられる。このため、より高次レベルの研究においても、タグという言葉が使われる傾向にある。狭義のシナプスタグ以外のタグには以下のようなものがある。
1)局所合成
後期シナプス可塑性に必要な新規タンパク質の一部は、樹状突起やスパインに局在するmRNAを用いて合成される。ラット海馬で二経路実験を用いた測定では連合性可塑性に局所合成は必要ではない(図3)が[1]、条件によってはPKM zetaなどの局所合成に依存している[10]。
局所合成はアメフラシでは後期可塑性の主要なメカニズムと考えられシナプスタグに相当する仕組みも報告されている[11]。
後期可塑性で発現誘導されるタンパク質は多岐に亘る。局所合成と細胞体での新規合成はおそらく共に必要であるが、前者はmRNAが既存で、しかもシナプス近傍で起きるのに対し、後者はmRNAの転写から始まりシナプス入力による転写開始シグナルが細胞核に伝わる時間と転写後翻訳を経てシナプス近傍まで輸送される時間が必要である。従って、これら二つの機構を併用することで、異なる種類のタンパク質が異なるタイミングで後期可塑性に貢献できると思われる。
シナプス可塑性の入力特異性は厳密ではなく、周囲のシナプスが影響を受けることが報告されている[12]。局所合成されシグナル伝達を担う分子が一定のコンパートメント内のシナプスに影響を与えると、コンパートメント単位での可塑性clustered plasticityが起きる可能性があり、実験的にも確認されている[13,14]。
2)inverse tag
後期可塑性を起こす強いシナプス入力があった細胞内で、活動の低かったシナプスには特異的に後期長期抑圧がおきる。これにはArc/Arg3.1タンパク質が関与しており、カルシウム活動が低くカルモジュリンが活性化していないシナプスではカルシウムカルモジュリン依存性キナーゼⅡβがArc/Arg3.1タンパク質を結合し蓄積することが可塑的変化を起こす「逆シナプスタグ」として働き、その結果GluR1受容体の表面発現が減少する長期抑圧が起きることが報告されている [15]。
3)behavioral tag
二つの海馬依存的行動タスクを、一つは短期記憶を作るような条件で、他方は長期記憶を作るような条件を用いて、同時にトレーニングすると、両タスクで長期記憶が形成された[16]。二経路実験をそのまま行動実験に移したような実験パラダイムなので、この連合性長期記憶を起こす仕組みはbehavioral tagと呼ばれている。二つの記憶をコードする細胞集成体に共通して活動する細胞があることが前提になると考えられるが、詳細は分かっていない。
4)システム固定化
海馬で獲得された記憶の一部は時間が経つと想起に海馬活動が不要になり、皮質の活動により想起されるようになる。この移行をシステム固定化、皮質依存になった記憶を遠隔記憶と言う。システム固定化の仕組みの詳細はまだ不明だが、初めに海馬が各モダリティ担当の皮質に情報を送り返し、遠隔記憶の想起時に活動する神経回路網を皮質に作ると考えられる。この時、複数の皮質に分散したシステム固定化後の記憶が一つの記憶として想起できるためには、これらが目印によってつながっている必要がある。この目印が「タグ」という言葉で表現されている[17]。
文献
1. U. Frey, R. G. M. Morris, Nature 385, 533 (1997).
2. U. Frey, R. G. M. Morris, Trends Neurosci. 21, 181 (1998).
3. D. Okada, F. Ozawa, K. Inokuchi, Science 324, 904 (2009)
4. U. Frey, R. G. M. Morris, Neuropharmacology 37, 545 (1998).
5. Y. Inoue, H. Udo, K. Inokuchi, H. Sugiyama, Neuroscience 150, 841-852 (2007).
6. S. Sajikumar, S. Navakkode, T. C. Sacktor, J. U. Frey, J. Neurosci. 25, 5750-5756 (2005).
7. S. Sajikumar, S. Navakkode, J. U. Frey, J. Neurosci. 27, 5068-5080 (2007)
8. Y. Ishikawa, Y. Horii, H. Tamura, S. Shiosaka, J. Neurosci. 28, 843 (2008)
9. R. Matsuo, A. Murayama, Y. Saitoh, Y. Sakaki, K. Inokuchi, J. Neurochem.74, 2239-2249 (2000).
10. P. Serrano, Y. Yao, T. C. Sacktor, J. Neurosci 25, 1979 (2005)
11. D. O. Wang, S. M. Kim, Y. Zhao, H. Hwang, S. K. Miura, W. S. Sossin, K. C. Martin, Science 324, 1536 (2009)
12. F. Engert, T. Bonhoeffer, Nature 388, 279 (1997)
13. A. Govindarajan, R. J. Kelleher, S. Tonegawa, Nature Rev. Neurosci. 7, 575 (2006)
14. A. Govindarajan, I. Israely, S. Y. Huang, S. Tonegawa, Neuron 69, 132 (2011).
15. H. Okuno, K. Akashi, Y. Ishii, N. Yagishita-Kyo, K. Suzuki, M. Nonaka, T. Kawashima, H. Fujii, S. Takemoto-Kimura, M. Abe, R. Natsume, S. Chowdhury, K. Sakimura, P. F. Worley, H. Bito, Cell 149, 886 (2012)
16. F. Ballarini, D. Moncada, M. C, Martinez, N. Alen, H. Viola, Proc. Natl. Acad. Sci. USA 106, 14599 (2009)
17. E. Lesburgueres, O. L. Gobbo, S. Alaux-Cantin, A. Hambuchen, P. Trifilieff, B. Bontempi, Science 331, 924 (2011)
関連語
シナプスキャプチャーSynaptic capture
後期シナプス可塑性 late-phase synaptic plasticity
連合性シナプス可塑性 associative synaptic plasticity
(執筆者: 岡田大助 、担当編集委員: 尾藤晴彦)