「コフィリン」の版間の差分
Kazumasaohashi (トーク | 投稿記録) 細編集の要約なし |
|||
| (3人の利用者による、間の22版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:cofilin | |||
== 概要 == | |||
コフィリンは、1980年代にニワトリやブタの脳の抽出液から[[アクチン]]線維の脱重合を促進する蛋白質として同定、精製された<ref><pubmed>6893966</pubmed></ref><ref><pubmed>6894753</pubmed></ref><ref name="ref1"><pubmed>6509022</pubmed></ref>。コフィリンは、単量体アクチン(G-アクチン)、アクチン線維(F-アクチン)に結合し、F-アクチンを切断・脱重合する活性をもつ20 kDaのアクチン結合蛋白質である。生存に必須であり、酵母からヒトまで高度に保存されている。コフィリンは、F-アクチンのターンオーバーを促進することで細胞のアクチン骨格のダイナミクスを生み出す働きを持ち、細胞の生存に必須な基本的なアクチン骨格の制御因子の一つである<ref name="ref2"><pubmed>17338919</pubmed></ref><ref name="ref3"><pubmed>20133134</pubmed></ref><ref name="ref4"><pubmed>21850706</pubmed></ref>。また、様々な細胞内シグナル分子によって活性が制御され、アクチン骨格の時空間的な再構築に寄与する<ref name="ref3" /><ref name="ref5"><pubmed>23153585 </pubmed></ref>。 | |||
== 構造 == | == 構造 == | ||
コフィリンは、単量体アクチン(G-アクチン)、アクチン線維(F-アクチン)に結合し、F-アクチンを切断・脱重合する活性をもつ166残基、20 kDaの蛋白質である。5本のβシートをコアに4本のαへリックス構造が球状の構造を囲む球状の構造をしており[http://pfam.sanger.ac.uk/family/PF00241]、アクチン分子のサブドメイン1と3の間の溝に結合する。配列における相同性は認められないが、F-アクチンの切断とキャッピング活性をもつゲルゾリンファミリーと類似した立体構造をとる<ref><pubmed>8674111</pubmed></ref><ref><pubmed>12207032</pubmed></ref><ref><pubmed>14627701</pubmed></ref><ref name="ref4" />。 | |||
== サブファミリー == | == サブファミリー == | ||
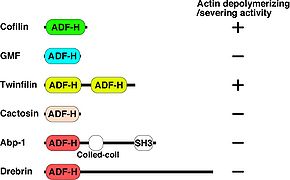
コフィリンは種間で高く保存され、ヒトでは同じ機能をもつファミリーとして非筋肉型コフィリン(別名n-cofilin, cofilin-1)、筋肉型コフィリン(別名m-cofilin, cofilin-2)、Actin depolymerizing factor (ADF)(別名デストリン(Destrin))の3種類が存在する<ref name="ref2" /><ref name="ref4" />。これら3種類の蛋白質はほぼ同じ働きであるが、コフィリンはpH依存的にF-アクチンの脱重合活性が変化し、ADFの活性はpH変化の影響を受けにくいことが報告されている<ref><pubmed>4055781</pubmed></ref><ref><pubmed>15170350</pubmed></ref>。 コフィリンの構造と類似したドメインを有するスーパーファミリーとして、Glia maturation factor (GMF), Twifilin, Abp1/Drebrin, Cactosinの4種が各々サブファミリーを形成している。これらの中でコフィリンと同様にアクチンの脱重合活性を持つことが報告されているものはTwinfilinだけである。また、GMF以外はF-アクチンとの結合能を持つ。GMFはArp2/3複合体に結合する(図1)<ref name="ref4" /><ref><pubmed>20517925</pubmed></ref>。 | |||
== 発現分布、細胞内局在 == | == 発現分布、細胞内局在 == | ||
[[Image:脳科学辞典cofilin図1.jpg|thumb|right| | コフィリンは、真核細胞全てに存在する生存に必須の蛋白質であり、アクチン結合蛋白質の中で最も存在量の多い蛋白質の一つで細胞内に数μモルの濃度で存在する。発現分布は、非筋肉型コフィリン, 筋肉型コフィリン, ADFの3種類のいずれかが全ての細胞に発現しており、筋肉では、主に筋肉型コフィリンが主に発現している<ref><pubmed>8195165</pubmed></ref>。筋組織以外では非筋肉型コフィリンとADFが主に発現している | ||
[[Image:脳科学辞典cofilin図1.jpg|thumb|right|290x180px|図1. ADF-Hドメインをもつコフィリンのサブファミリー]] | |||
<ref name="ref6"><pubmed>11809832</pubmed></ref><ref name="ref2" />。コフィリンはトロポミオシンやミオシンと競合的にF-アクチンに結合するため<ref name="ref1" /></ref><ref><pubmed>11901171</pubmed></ref>、コフィリンが多く存在するラメリポディアや局在がほとんど見られないストレスファイバーなど、アクチン骨格への結合量はア | |||
クチン骨格構造によって異なる。しかし、コフィリンの活性阻害実験から、細胞内のアクチン骨格構造はすべてコフィリンの結合により脱重合されることでター | |||
ンオーバーしていると考えられる<ref><pubmed>15548599</pubmed></ref><ref><pubmed>21868383</pubmed></ref>。 | |||
<br> | |||
<br> | |||
<br> | |||
<br> | |||
==== | == 機能 == | ||
アクチン骨格再構築おける機能 | |||
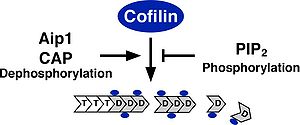
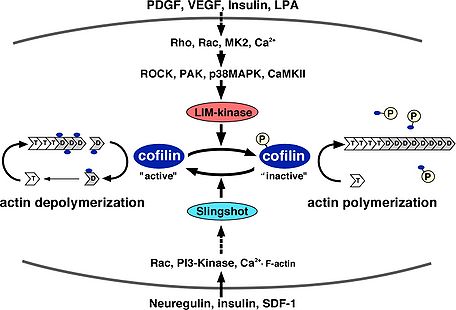
細胞内における基本的なコフィリンの機能は、F-アクチンを切断・脱重合し、重合するためのG-アクチンを供給することでアクチン骨格の流動性を生みだす働きである。そのため、コフィリンの活性化はF-アクチンを切断・脱重であるにも関わらずラメリポディア形成などのアクチン重合に必須である。コフィリンは、試験管内の実験により、F-アクチン, G-アクチンどちらにも結合する。また、ADP結合型のアクチンに対してより高い親和性を持ち、ADPの加水分解とリン酸の放出が進んだ古いF-アクチンを切断・脱重合する<ref name="ref7"><pubmed>9087445</pubmed></ref><ref name="ref6" />。F-アクチンの脱重合と切断は異なる作用で、F-アクチンのマイナス端からアクチンの脱重合する活性とF-アクチンの側面に結合し切断する作用があると考えられている<ref name="ref7" /><ref><pubmed>9265645</pubmed></ref><ref><pubmed>11285275</pubmed></ref>。細胞内で主に起こるF-アクチンの切断・脱重合の作用機序については未だ議論があるが、コフィリンの結合によりF-アクチンのらせん構造がよりねじれた状態になりアクチン分子間の結合が不安定となり切断されやすくなると考えられる<ref name="ref8"><pubmed>17018289</pubmed></ref>。また、コフィリンの濃度がある程度以上濃くなるとF-アクチン全ての結合部位にコフィリンが結合しF-アクチンが逆に安定化する。コフィリンの濃度が高い状態ではコフィリンがアクチンの核化を促進するモデルも提唱されている<ref name="ref8" />。コフィリンは、細胞内のG-アクチンに結合し、ATP/ADP交換を阻害して重合させないようにする隔離作用もあると考えられている<ref><pubmed>8399167</pubmed></ref><ref><pubmed>8399168</pubmed></ref>。コフィリンのアクチン脱重合・切断活性に対する制御は、ホスファチジルイノシトール4,5ビスリン酸(PIP2)との結合によるアクチンへの結合阻害、3番目のセリン残基のリン酸化によるアクチンへの結合阻害、Actin interacting protein 1 (Aip1),アデニル酸シクラーゼ結合蛋白質(CAP)との結合による活性促進の制御が報告されている(図2)<ref name="ref2" /><ref name="ref4" />。PIP2との結合によるコフィリンの活性阻害では、細胞への刺激依存的なPhospholipase C (PLC)の活性化によってPIP2が分解されコフィリンの活性化を促進しラメリポディア形成などが促進されることが報告されている<ref><pubmed>15337778</pubmed></ref><ref><pubmed>18086920</pubmed></ref>。コフィリンを不活性化する3番目のセリン残基のリン酸化を行う特異的な[[蛋白質リン酸化酵素]]としてLIMキナーゼファミリー(LIMK1, LIMK2, TESK1, TESK2)が同定されている<ref><pubmed>9655398</pubmed></ref><ref><pubmed>11294912</pubmed></ref>。LIMキナーゼファミリーは、N末端にLIMドメインを持つLIMK1, LIMK2とLIMドメインは持たないがキナーゼドメインの相同性が高く保存されたTESK1, TESK2が存在する。LIMK1は発達過程の中枢神経系に高発現している<ref name="ref5" />。これに対して、特異的なコフィリンの[[蛋白質脱リン酸化酵素]]としてSlingshotファミリー(Slingshot-1, Slingshot-2, Slingshot-3)が同定されている<ref><pubmed>11832213</pubmed></ref>。これ以外にprotein phosphatase 1 (PP1), protein phosphatase 2A(PP2A)、ハロ酸デヒドロゲナーゼの一つで蛋白質脱リン酸化酵素として働くChronophinが脱リン酸化酵素として働くことが報告されている<ref><pubmed>11093160</pubmed></ref><ref><pubmed>15580268</pubmed></ref><ref name="ref5" />。コフィリンのリン酸化制御は、進化的にショウジョウバエ以降で保存されており、線虫、酵母にはLIMキナーゼ、Slingshotに相同な遺伝子は存在しない。LIMキナーゼは、Rhoファミリー低分子量G蛋白質、Ca2+シグナル、p38MAPキナーゼなど様々な上流シグナルによって活性が制御されている。SlingshotもCa2+シグナル、Rhoファミリー低分子量G蛋白質、PI3キナーゼ、F-アクチンとの結合によって活性化される(図3)<ref name="ref5" />。また、Phospholipase D1 (PLD1)に対してリン酸化コフィリンが結合しPLD1を活性化することでRacの活性化を促進することも報告されている<ref><pubmed>17853892</pubmed></ref>。個体においては、角膜疾患マウスの原因遺伝子としてADF遺伝子の点変異が同定されている<ref><pubmed>12700171</pubmed></ref>。また、コフィリンのノックアウトマウスは胎生致死となる<ref name="ref9"><pubmed>17875668</pubmed></ref>。その他に、コフィリンはアポトーシスの初期においてミトコンドリアに局在しアポトーシスを誘導することが報告されている<ref><pubmed>14634665</pubmed></ref>。 | |||
== 神経細胞における役割 == | |||
[[Image:脳科学辞典cofilin図2.jpg|thumb|right|300x130px|図2. コフィリンの活性制御]] | |||
神経組織や神経細胞においてコフィリンは、神経細胞の移動、形態、軸索、[[樹状突起]]の伸展・退縮、[[樹状突起スパイン]]の形態などをアクチン骨格の制御を介して関与すると考えられる。コフィリンとADFのコンディショナルノックアウトマウスの解析では、非筋肉型のコフィリン遺伝子(n-cofilin)のノックアウトによって脳の発生過程において神経細胞の移動や分裂に異常が見られ | |||
、こ | |||
れに対して、ADF遺伝子ノックアウトでは、脳の発生には影響しないことが報告されている<ref name="ref9" />。脳の発生後のコフィリンの機能を解析するために、CaMKII-Creラインのマウスを用いたコンディショナル | |||
ノックアウトマウスを用いた研究がさ | |||
れている。このマウスでは、海馬錐体細胞の樹状突起スパインが増加し、[[長期増強]](LTP)と[[長期抑圧]](LTD)の誘導が抑制された。これはAMPA受容体の刺激依存的な細胞膜上の側方移動が抑制されたためだと考えられている | |||
<ref name="ref10"><pubmed>20407421</pubmed></ref>。これらの遺伝子ノックアウトマウスでは、相補的に他のアイソフォームのコフィリン/ADFの発現が上昇しており、標的組織におけるコフィリンファミリーの活性低下の影 | |||
[[Image:脳科学辞典cofilin図3.jpg|thumb|right|460x310px|図3. コフィリンのリン酸化による活性制御とシグナル伝達機構]] | |||
== | 響を見ていると考えられる<ref name="ref9" /><ref name="ref10" />。 また、神経細胞に対する様々な刺激におけるコフィリンのリン酸化による活性制御の役割が研究されている<ref><pubmed>18397729</pubmed></ref><ref><pubmed>22566410</pubmed></ref><ref name="ref5" />。最初に、海馬スライスを用いた研究によってLTP誘導時に海馬分子層の樹状突起スパインにおいてコフィリンのリン酸化が誘導されアクチン重合が促進することが報告された<ref><pubmed>12741991</pubmed></ref>。その後、コフィリンのリン酸化を阻害するペプチドを用いた実験などから | ||
LTP誘導時において刺激依存的な樹状突起スパインにおけるコフィリンのリン酸化によるアクチン重合が必要であることが報告されている<ref><pubmed>15572107</pubmed></ref><ref><pubmed>17989307</pubmed></ref>。また、LIMキナーゼ遺伝子ノックアウトマウスの解析から、海馬神経細胞の樹状突起の先端の成長円錐の形態異常、海馬や皮質神経細胞の樹状突起スパインの形態が細長くなること、海馬におけるLTPに異常があることが報告されている<ref><pubmed>12123613</pubmed></ref>。神経突起の伸展・退縮における機能については、NGFによる後根神経節(DRG)細胞の[[軸索伸長]]にはLIMキナーゼとSlingshotの働きが共に必要であること<ref><pubmed>17360713</pubmed></ref>、また、ネトリン1(Netrin-1)によるDRG細胞の軸索伸長にコフィリンの脱リン酸化が必要であることが報告されている<ref><pubmed>20506164</pubmed></ref>。これに対して、マウスの後根神経節細胞のセマホリンによる軸索の退縮にLIMキナーゼの活性化によるコフィリンのリン酸化が必要であることが報告 | |||
され<ref><pubmed>11276226</pubmed></ref>、その後、Slit-2、Nogo-66による神経突起退縮にもLIMキナーゼの活性化によるコフィリンのリン酸化が必要であることが報告されている<ref><pubmed>16421320</pubmed></ref><ref><pubmed>16423696</pubmed></ref>。カエルの脊髄神経細胞の軸索のBMPによる誘因と反発においては、LIMキナーゼとSlingshotの活性のバランスによって制御されることが報告されている<ref><pubmed>17606869</pubmed></ref>。また、マウス大脳皮質細胞の樹状突起形成において、BMP受容体にLIMキナーゼが直接結合し活性化されることが樹状突起形成促進に必要であること<ref><pubmed>15538389</pubmed></ref>、ショウジョウバエにおいてBMPタイプII受容体にLIMキナーゼが結合し神経筋接合部のシナプスの安定化に寄与することが報告されている<ref><pubmed>16129399</pubmed></ref>。 | |||
== 神経疾患との関わり == | |||
コフィリンは酸化ストレスなどでコフィリン分子間のジスルフィド結合が形成され、細胞内にアクチンとの異常なロッド状の複合体を形成する<ref><pubmed>3474653</pubmed></ref><ref name="ref11"><pubmed>22573689</pubmed></ref>。アルツハイマー病におけるアミロイドβペプチドの集積によって形成されるロッドにおいてもコフィリンとアクチンの複合体の存在することが明らかにされている<ref><pubmed>8580423</pubmed></ref><ref name="ref12"><pubmed>10980704</pubmed></ref>。海馬神経細胞に対するグルタミン酸の過剰な刺激によってもコフィリンによるロッドが形成されることからアルツハイマー病の神経細胞死の原因の一つであることが示唆されている<ref name="ref12" /><ref name="ref11" />。コフィリンのリン酸化の活性制御については、LIMキナーゼ遺伝子が[[ウイリアムズ症候群]]に見られる空間認知機能の障害の原因遺伝子であることが報告されている<ref><pubmed>8689688</pubmed></ref>。 | |||
== | == 関連語 == | ||
アクチン ウイリアムズ症候群 細胞骨格 軸索伸長 樹状突起 樹状突起スパイン 蛋白質リン酸化酵素 蛋白質脱リン酸化酵素 長期増強 長期抑圧 | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2012年12月29日 (土) 22:25時点における版
英語名:cofilin
概要
コフィリンは、1980年代にニワトリやブタの脳の抽出液からアクチン線維の脱重合を促進する蛋白質として同定、精製された[1][2][3]。コフィリンは、単量体アクチン(G-アクチン)、アクチン線維(F-アクチン)に結合し、F-アクチンを切断・脱重合する活性をもつ20 kDaのアクチン結合蛋白質である。生存に必須であり、酵母からヒトまで高度に保存されている。コフィリンは、F-アクチンのターンオーバーを促進することで細胞のアクチン骨格のダイナミクスを生み出す働きを持ち、細胞の生存に必須な基本的なアクチン骨格の制御因子の一つである[4][5][6]。また、様々な細胞内シグナル分子によって活性が制御され、アクチン骨格の時空間的な再構築に寄与する[5][7]。
構造
コフィリンは、単量体アクチン(G-アクチン)、アクチン線維(F-アクチン)に結合し、F-アクチンを切断・脱重合する活性をもつ166残基、20 kDaの蛋白質である。5本のβシートをコアに4本のαへリックス構造が球状の構造を囲む球状の構造をしており[1]、アクチン分子のサブドメイン1と3の間の溝に結合する。配列における相同性は認められないが、F-アクチンの切断とキャッピング活性をもつゲルゾリンファミリーと類似した立体構造をとる[8][9][10][6]。
サブファミリー
コフィリンは種間で高く保存され、ヒトでは同じ機能をもつファミリーとして非筋肉型コフィリン(別名n-cofilin, cofilin-1)、筋肉型コフィリン(別名m-cofilin, cofilin-2)、Actin depolymerizing factor (ADF)(別名デストリン(Destrin))の3種類が存在する[4][6]。これら3種類の蛋白質はほぼ同じ働きであるが、コフィリンはpH依存的にF-アクチンの脱重合活性が変化し、ADFの活性はpH変化の影響を受けにくいことが報告されている[11][12]。 コフィリンの構造と類似したドメインを有するスーパーファミリーとして、Glia maturation factor (GMF), Twifilin, Abp1/Drebrin, Cactosinの4種が各々サブファミリーを形成している。これらの中でコフィリンと同様にアクチンの脱重合活性を持つことが報告されているものはTwinfilinだけである。また、GMF以外はF-アクチンとの結合能を持つ。GMFはArp2/3複合体に結合する(図1)[6][13]。
発現分布、細胞内局在
コフィリンは、真核細胞全てに存在する生存に必須の蛋白質であり、アクチン結合蛋白質の中で最も存在量の多い蛋白質の一つで細胞内に数μモルの濃度で存在する。発現分布は、非筋肉型コフィリン, 筋肉型コフィリン, ADFの3種類のいずれかが全ての細胞に発現しており、筋肉では、主に筋肉型コフィリンが主に発現している[14]。筋組織以外では非筋肉型コフィリンとADFが主に発現している
[15][4]。コフィリンはトロポミオシンやミオシンと競合的にF-アクチンに結合するため[3]</ref>[16]、コフィリンが多く存在するラメリポディアや局在がほとんど見られないストレスファイバーなど、アクチン骨格への結合量はア
クチン骨格構造によって異なる。しかし、コフィリンの活性阻害実験から、細胞内のアクチン骨格構造はすべてコフィリンの結合により脱重合されることでター
機能
アクチン骨格再構築おける機能 細胞内における基本的なコフィリンの機能は、F-アクチンを切断・脱重合し、重合するためのG-アクチンを供給することでアクチン骨格の流動性を生みだす働きである。そのため、コフィリンの活性化はF-アクチンを切断・脱重であるにも関わらずラメリポディア形成などのアクチン重合に必須である。コフィリンは、試験管内の実験により、F-アクチン, G-アクチンどちらにも結合する。また、ADP結合型のアクチンに対してより高い親和性を持ち、ADPの加水分解とリン酸の放出が進んだ古いF-アクチンを切断・脱重合する[19][15]。F-アクチンの脱重合と切断は異なる作用で、F-アクチンのマイナス端からアクチンの脱重合する活性とF-アクチンの側面に結合し切断する作用があると考えられている[19][20][21]。細胞内で主に起こるF-アクチンの切断・脱重合の作用機序については未だ議論があるが、コフィリンの結合によりF-アクチンのらせん構造がよりねじれた状態になりアクチン分子間の結合が不安定となり切断されやすくなると考えられる[22]。また、コフィリンの濃度がある程度以上濃くなるとF-アクチン全ての結合部位にコフィリンが結合しF-アクチンが逆に安定化する。コフィリンの濃度が高い状態ではコフィリンがアクチンの核化を促進するモデルも提唱されている[22]。コフィリンは、細胞内のG-アクチンに結合し、ATP/ADP交換を阻害して重合させないようにする隔離作用もあると考えられている[23][24]。コフィリンのアクチン脱重合・切断活性に対する制御は、ホスファチジルイノシトール4,5ビスリン酸(PIP2)との結合によるアクチンへの結合阻害、3番目のセリン残基のリン酸化によるアクチンへの結合阻害、Actin interacting protein 1 (Aip1),アデニル酸シクラーゼ結合蛋白質(CAP)との結合による活性促進の制御が報告されている(図2)[4][6]。PIP2との結合によるコフィリンの活性阻害では、細胞への刺激依存的なPhospholipase C (PLC)の活性化によってPIP2が分解されコフィリンの活性化を促進しラメリポディア形成などが促進されることが報告されている[25][26]。コフィリンを不活性化する3番目のセリン残基のリン酸化を行う特異的な蛋白質リン酸化酵素としてLIMキナーゼファミリー(LIMK1, LIMK2, TESK1, TESK2)が同定されている[27][28]。LIMキナーゼファミリーは、N末端にLIMドメインを持つLIMK1, LIMK2とLIMドメインは持たないがキナーゼドメインの相同性が高く保存されたTESK1, TESK2が存在する。LIMK1は発達過程の中枢神経系に高発現している[7]。これに対して、特異的なコフィリンの蛋白質脱リン酸化酵素としてSlingshotファミリー(Slingshot-1, Slingshot-2, Slingshot-3)が同定されている[29]。これ以外にprotein phosphatase 1 (PP1), protein phosphatase 2A(PP2A)、ハロ酸デヒドロゲナーゼの一つで蛋白質脱リン酸化酵素として働くChronophinが脱リン酸化酵素として働くことが報告されている[30][31][7]。コフィリンのリン酸化制御は、進化的にショウジョウバエ以降で保存されており、線虫、酵母にはLIMキナーゼ、Slingshotに相同な遺伝子は存在しない。LIMキナーゼは、Rhoファミリー低分子量G蛋白質、Ca2+シグナル、p38MAPキナーゼなど様々な上流シグナルによって活性が制御されている。SlingshotもCa2+シグナル、Rhoファミリー低分子量G蛋白質、PI3キナーゼ、F-アクチンとの結合によって活性化される(図3)[7]。また、Phospholipase D1 (PLD1)に対してリン酸化コフィリンが結合しPLD1を活性化することでRacの活性化を促進することも報告されている[32]。個体においては、角膜疾患マウスの原因遺伝子としてADF遺伝子の点変異が同定されている[33]。また、コフィリンのノックアウトマウスは胎生致死となる[34]。その他に、コフィリンはアポトーシスの初期においてミトコンドリアに局在しアポトーシスを誘導することが報告されている[35]。
神経細胞における役割
神経組織や神経細胞においてコフィリンは、神経細胞の移動、形態、軸索、樹状突起の伸展・退縮、樹状突起スパインの形態などをアクチン骨格の制御を介して関与すると考えられる。コフィリンとADFのコンディショナルノックアウトマウスの解析では、非筋肉型のコフィリン遺伝子(n-cofilin)のノックアウトによって脳の発生過程において神経細胞の移動や分裂に異常が見られ
、こ
れに対して、ADF遺伝子ノックアウトでは、脳の発生には影響しないことが報告されている[34]。脳の発生後のコフィリンの機能を解析するために、CaMKII-Creラインのマウスを用いたコンディショナル
ノックアウトマウスを用いた研究がさ
れている。このマウスでは、海馬錐体細胞の樹状突起スパインが増加し、長期増強(LTP)と長期抑圧(LTD)の誘導が抑制された。これはAMPA受容体の刺激依存的な細胞膜上の側方移動が抑制されたためだと考えられている
[36]。これらの遺伝子ノックアウトマウスでは、相補的に他のアイソフォームのコフィリン/ADFの発現が上昇しており、標的組織におけるコフィリンファミリーの活性低下の影
響を見ていると考えられる[34][36]。 また、神経細胞に対する様々な刺激におけるコフィリンのリン酸化による活性制御の役割が研究されている[37][38][7]。最初に、海馬スライスを用いた研究によってLTP誘導時に海馬分子層の樹状突起スパインにおいてコフィリンのリン酸化が誘導されアクチン重合が促進することが報告された[39]。その後、コフィリンのリン酸化を阻害するペプチドを用いた実験などから
LTP誘導時において刺激依存的な樹状突起スパインにおけるコフィリンのリン酸化によるアクチン重合が必要であることが報告されている[40][41]。また、LIMキナーゼ遺伝子ノックアウトマウスの解析から、海馬神経細胞の樹状突起の先端の成長円錐の形態異常、海馬や皮質神経細胞の樹状突起スパインの形態が細長くなること、海馬におけるLTPに異常があることが報告されている[42]。神経突起の伸展・退縮における機能については、NGFによる後根神経節(DRG)細胞の軸索伸長にはLIMキナーゼとSlingshotの働きが共に必要であること[43]、また、ネトリン1(Netrin-1)によるDRG細胞の軸索伸長にコフィリンの脱リン酸化が必要であることが報告されている[44]。これに対して、マウスの後根神経節細胞のセマホリンによる軸索の退縮にLIMキナーゼの活性化によるコフィリンのリン酸化が必要であることが報告
され[45]、その後、Slit-2、Nogo-66による神経突起退縮にもLIMキナーゼの活性化によるコフィリンのリン酸化が必要であることが報告されている[46][47]。カエルの脊髄神経細胞の軸索のBMPによる誘因と反発においては、LIMキナーゼとSlingshotの活性のバランスによって制御されることが報告されている[48]。また、マウス大脳皮質細胞の樹状突起形成において、BMP受容体にLIMキナーゼが直接結合し活性化されることが樹状突起形成促進に必要であること[49]、ショウジョウバエにおいてBMPタイプII受容体にLIMキナーゼが結合し神経筋接合部のシナプスの安定化に寄与することが報告されている[50]。
神経疾患との関わり
コフィリンは酸化ストレスなどでコフィリン分子間のジスルフィド結合が形成され、細胞内にアクチンとの異常なロッド状の複合体を形成する[51][52]。アルツハイマー病におけるアミロイドβペプチドの集積によって形成されるロッドにおいてもコフィリンとアクチンの複合体の存在することが明らかにされている[53][54]。海馬神経細胞に対するグルタミン酸の過剰な刺激によってもコフィリンによるロッドが形成されることからアルツハイマー病の神経細胞死の原因の一つであることが示唆されている[54][52]。コフィリンのリン酸化の活性制御については、LIMキナーゼ遺伝子がウイリアムズ症候群に見られる空間認知機能の障害の原因遺伝子であることが報告されている[55]。
関連語
アクチン ウイリアムズ症候群 細胞骨格 軸索伸長 樹状突起 樹状突起スパイン 蛋白質リン酸化酵素 蛋白質脱リン酸化酵素 長期増強 長期抑圧
参考文献
- ↑
Bamburg, J.R., Harris, H.E., & Weeds, A.G. (1980).
Partial purification and characterization of an actin depolymerizing factor from brain. FEBS letters, 121(1), 178-82. [PubMed:6893966] [WorldCat] [DOI] - ↑
Mabuchi, I. (1981).
Purification from starfish eggs of a protein that depolymerizes actin. Journal of biochemistry, 89(4), 1341-4. [PubMed:6894753] [WorldCat] - ↑ 3.0 3.1
Nishida, E., Maekawa, S., & Sakai, H. (1984).
Cofilin, a protein in porcine brain that binds to actin filaments and inhibits their interactions with myosin and tropomyosin. Biochemistry, 23(22), 5307-13. [PubMed:6509022] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3
Ono, S. (2007).
Mechanism of depolymerization and severing of actin filaments and its significance in cytoskeletal dynamics. International review of cytology, 258, 1-82. [PubMed:17338919] [WorldCat] [DOI] - ↑ 5.0 5.1
Bernstein, B.W., & Bamburg, J.R. (2010).
ADF/cofilin: a functional node in cell biology. Trends in cell biology, 20(4), 187-95. [PubMed:20133134] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4
Poukkula, M., Kremneva, E., Serlachius, M., & Lappalainen, P. (2011).
Actin-depolymerizing factor homology domain: a conserved fold performing diverse roles in cytoskeletal dynamics. Cytoskeleton (Hoboken, N.J.), 68(9), 471-90. [PubMed:21850706] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3 7.4
Mizuno, K. (2013).
Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular signalling, 25(2), 457-69. [PubMed:23153585] [WorldCat] [DOI] - ↑
Hatanaka, H., Ogura, K., Moriyama, K., Ichikawa, S., Yahara, I., & Inagaki, F. (1996).
Tertiary structure of destrin and structural similarity between two actin-regulating protein families. Cell, 85(7), 1047-55. [PubMed:8674111] [WorldCat] [DOI] - ↑
Paavilainen, V.O., Merckel, M.C., Falck, S., Ojala, P.J., Pohl, E., Wilmanns, M., & Lappalainen, P. (2002).
Structural conservation between the actin monomer-binding sites of twinfilin and actin-depolymerizing factor (ADF)/cofilin. The Journal of biological chemistry, 277(45), 43089-95. [PubMed:12207032] [WorldCat] [DOI] - ↑
Pope, B.J., Zierler-Gould, K.M., Kühne, R., Weeds, A.G., & Ball, L.J. (2004).
Solution structure of human cofilin: actin binding, pH sensitivity, and relationship to actin-depolymerizing factor. The Journal of biological chemistry, 279(6), 4840-8. [PubMed:14627701] [WorldCat] [DOI] - ↑
Yonezawa, N., Nishida, E., & Sakai, H. (1985).
pH control of actin polymerization by cofilin. The Journal of biological chemistry, 260(27), 14410-2. [PubMed:4055781] [WorldCat] - ↑
Chen, H., Bernstein, B.W., Sneider, J.M., Boyle, J.A., Minamide, L.S., & Bamburg, J.R. (2004).
In vitro activity differences between proteins of the ADF/cofilin family define two distinct subgroups. Biochemistry, 43(22), 7127-42. [PubMed:15170350] [WorldCat] [DOI] - ↑
Nakano, K., Kuwayama, H., Kawasaki, M., Numata, O., & Takaine, M. (2010).
GMF is an evolutionarily developed Adf/cofilin-super family protein involved in the Arp2/3 complex-mediated organization of the actin cytoskeleton. Cytoskeleton (Hoboken, N.J.), 67(6), 373-82. [PubMed:20517925] [WorldCat] [DOI] - ↑
Ono, S., Minami, N., Abe, H., & Obinata, T. (1994).
Characterization of a novel cofilin isoform that is predominantly expressed in mammalian skeletal muscle. The Journal of biological chemistry, 269(21), 15280-6. [PubMed:8195165] [WorldCat] - ↑ 15.0 15.1
Vartiainen, M.K., Mustonen, T., Mattila, P.K., Ojala, P.J., Thesleff, I., Partanen, J., & Lappalainen, P. (2002).
The three mouse actin-depolymerizing factor/cofilins evolved to fulfill cell-type-specific requirements for actin dynamics. Molecular biology of the cell, 13(1), 183-94. [PubMed:11809832] [PMC] [WorldCat] [DOI] - ↑
Ono, S., & Ono, K. (2002).
Tropomyosin inhibits ADF/cofilin-dependent actin filament dynamics. The Journal of cell biology, 156(6), 1065-76. [PubMed:11901171] [PMC] [WorldCat] [DOI] - ↑
Hotulainen, P., Paunola, E., Vartiainen, M.K., & Lappalainen, P. (2005).
Actin-depolymerizing factor and cofilin-1 play overlapping roles in promoting rapid F-actin depolymerization in mammalian nonmuscle cells. Molecular biology of the cell, 16(2), 649-64. [PubMed:15548599] [PMC] [WorldCat] [DOI] - ↑
Ohashi, K., Fujiwara, S., Watanabe, T., Kondo, H., Kiuchi, T., Sato, M., & Mizuno, K. (2011).
LIM kinase has a dual role in regulating lamellipodium extension by decelerating the rate of actin retrograde flow and the rate of actin polymerization. The Journal of biological chemistry, 286(42), 36340-51. [PubMed:21868383] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Carlier, M.F., Laurent, V., Santolini, J., Melki, R., Didry, D., Xia, G.X., ..., & Pantaloni, D. (1997).
Actin depolymerizing factor (ADF/cofilin) enhances the rate of filament turnover: implication in actin-based motility. The Journal of cell biology, 136(6), 1307-22. [PubMed:9087445] [PMC] [WorldCat] [DOI] - ↑
McGough, A., Pope, B., Chiu, W., & Weeds, A. (1997).
Cofilin changes the twist of F-actin: implications for actin filament dynamics and cellular function. The Journal of cell biology, 138(4), 771-81. [PubMed:9265645] [PMC] [WorldCat] [DOI] - ↑
Galkin, V.E., Orlova, A., Lukoyanova, N., Wriggers, W., & Egelman, E.H. (2001).
Actin depolymerizing factor stabilizes an existing state of F-actin and can change the tilt of F-actin subunits. The Journal of cell biology, 153(1), 75-86. [PubMed:11285275] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1
Andrianantoandro, E., & Pollard, T.D. (2006).
Mechanism of actin filament turnover by severing and nucleation at different concentrations of ADF/cofilin. Molecular cell, 24(1), 13-23. [PubMed:17018289] [WorldCat] [DOI] - ↑
Hawkins, M., Pope, B., Maciver, S.K., & Weeds, A.G. (1993).
Human actin depolymerizing factor mediates a pH-sensitive destruction of actin filaments. Biochemistry, 32(38), 9985-93. [PubMed:8399167] [WorldCat] [DOI] - ↑
Hayden, S.M., Miller, P.S., Brauweiler, A., & Bamburg, J.R. (1993).
Analysis of the interactions of actin depolymerizing factor with G- and F-actin. Biochemistry, 32(38), 9994-10004. [PubMed:8399168] [WorldCat] [DOI] - ↑
Mouneimne, G., Soon, L., DesMarais, V., Sidani, M., Song, X., Yip, S.C., ..., & Condeelis, J. (2004).
Phospholipase C and cofilin are required for carcinoma cell directionality in response to EGF stimulation. The Journal of cell biology, 166(5), 697-708. [PubMed:15337778] [PMC] [WorldCat] [DOI] - ↑
van Rheenen, J., Song, X., van Roosmalen, W., Cammer, M., Chen, X., Desmarais, V., ..., & Condeelis, J.S. (2007).
EGF-induced PIP2 hydrolysis releases and activates cofilin locally in carcinoma cells. The Journal of cell biology, 179(6), 1247-59. [PubMed:18086920] [PMC] [WorldCat] [DOI] - ↑
Yang, N., Higuchi, O., Ohashi, K., Nagata, K., Wada, A., Kangawa, K., ..., & Mizuno, K. (1998).
Cofilin phosphorylation by LIM-kinase 1 and its role in Rac-mediated actin reorganization. Nature, 393(6687), 809-12. [PubMed:9655398] [WorldCat] [DOI] - ↑
Toshima, J., Toshima, J.Y., Amano, T., Yang, N., Narumiya, S., & Mizuno, K. (2001).
Cofilin phosphorylation by protein kinase testicular protein kinase 1 and its role in integrin-mediated actin reorganization and focal adhesion formation. Molecular biology of the cell, 12(4), 1131-45. [PubMed:11294912] [PMC] [WorldCat] [DOI] - ↑
Niwa, R., Nagata-Ohashi, K., Takeichi, M., Mizuno, K., & Uemura, T. (2002).
Control of actin reorganization by Slingshot, a family of phosphatases that dephosphorylate ADF/cofilin. Cell, 108(2), 233-46. [PubMed:11832213] [WorldCat] [DOI] - ↑
Ambach, A., Saunus, J., Konstandin, M., Wesselborg, S., Meuer, S.C., & Samstag, Y. (2000).
The serine phosphatases PP1 and PP2A associate with and activate the actin-binding protein cofilin in human T lymphocytes. European journal of immunology, 30(12), 3422-31. [PubMed:11093160] [WorldCat] [DOI] - ↑
Gohla, A., Birkenfeld, J., & Bokoch, G.M. (2005).
Chronophin, a novel HAD-type serine protein phosphatase, regulates cofilin-dependent actin dynamics. Nature cell biology, 7(1), 21-9. [PubMed:15580268] [WorldCat] [DOI] - ↑
Han, L., Stope, M.B., de Jesús, M.L., Oude Weernink, P.A., Urban, M., Wieland, T., ..., & Schmidt, M. (2007).
Direct stimulation of receptor-controlled phospholipase D1 by phospho-cofilin. The EMBO journal, 26(19), 4189-202. [PubMed:17853892] [PMC] [WorldCat] [DOI] - ↑
Ikeda, S., Cunningham, L.A., Boggess, D., Hawes, N., Hobson, C.D., Sundberg, J.P., ..., & Nishina, P.M. (2003).
Aberrant actin cytoskeleton leads to accelerated proliferation of corneal epithelial cells in mice deficient for destrin (actin depolymerizing factor). Human molecular genetics, 12(9), 1029-37. [PubMed:12700171] [WorldCat] [DOI] - ↑ 34.0 34.1 34.2
Bellenchi, G.C., Gurniak, C.B., Perlas, E., Middei, S., Ammassari-Teule, M., & Witke, W. (2007).
N-cofilin is associated with neuronal migration disorders and cell cycle control in the cerebral cortex. Genes & development, 21(18), 2347-57. [PubMed:17875668] [PMC] [WorldCat] [DOI] - ↑
Chua, B.T., Volbracht, C., Tan, K.O., Li, R., Yu, V.C., & Li, P. (2003).
Mitochondrial translocation of cofilin is an early step in apoptosis induction. Nature cell biology, 5(12), 1083-9. [PubMed:14634665] [WorldCat] [DOI] - ↑ 36.0 36.1
Rust, M.B., Gurniak, C.B., Renner, M., Vara, H., Morando, L., Görlich, A., ..., & Witke, W. (2010).
Learning, AMPA receptor mobility and synaptic plasticity depend on n-cofilin-mediated actin dynamics. The EMBO journal, 29(11), 1889-902. [PubMed:20407421] [PMC] [WorldCat] [DOI] - ↑
Bamburg, J.R., & Bernstein, B.W. (2008).
ADF/cofilin. Current biology : CB, 18(7), R273-5. [PubMed:18397729] [WorldCat] [DOI] - ↑
Saneyoshi, T., & Hayashi, Y. (2012).
The Ca2+ and Rho GTPase signaling pathways underlying activity-dependent actin remodeling at dendritic spines. Cytoskeleton (Hoboken, N.J.), 69(8), 545-54. [PubMed:22566410] [WorldCat] [DOI] - ↑
Fukazawa, Y., Saitoh, Y., Ozawa, F., Ohta, Y., Mizuno, K., & Inokuchi, K. (2003).
Hippocampal LTP is accompanied by enhanced F-actin content within the dendritic spine that is essential for late LTP maintenance in vivo. Neuron, 38(3), 447-60. [PubMed:12741991] [WorldCat] [DOI] - ↑
Zhou, Q., Homma, K.J., & Poo, M.M. (2004).
Shrinkage of dendritic spines associated with long-term depression of hippocampal synapses. Neuron, 44(5), 749-57. [PubMed:15572107] [WorldCat] [DOI] - ↑
Wang, X.B., Yang, Y., & Zhou, Q. (2007).
Independent expression of synaptic and morphological plasticity associated with long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(45), 12419-29. [PubMed:17989307] [PMC] [WorldCat] [DOI] - ↑
Meng, Y., Zhang, Y., Tregoubov, V., Janus, C., Cruz, L., Jackson, M., ..., & Jia, Z. (2002).
Abnormal spine morphology and enhanced LTP in LIMK-1 knockout mice. Neuron, 35(1), 121-33. [PubMed:12123613] [WorldCat] [DOI] - ↑
Endo, M., Ohashi, K., & Mizuno, K. (2007).
LIM kinase and slingshot are critical for neurite extension. The Journal of biological chemistry, 282(18), 13692-702. [PubMed:17360713] [WorldCat] [DOI] - ↑
Marsick, B.M., Flynn, K.C., Santiago-Medina, M., Bamburg, J.R., & Letourneau, P.C. (2010).
Activation of ADF/cofilin mediates attractive growth cone turning toward nerve growth factor and netrin-1. Developmental neurobiology, 70(8), 565-88. [PubMed:20506164] [PMC] [WorldCat] [DOI] - ↑
Aizawa, H., Wakatsuki, S., Ishii, A., Moriyama, K., Sasaki, Y., Ohashi, K., ..., & Yahara, I. (2001).
Phosphorylation of cofilin by LIM-kinase is necessary for semaphorin 3A-induced growth cone collapse. Nature neuroscience, 4(4), 367-73. [PubMed:11276226] [WorldCat] [DOI] - ↑
Hsieh, S.H., Ferraro, G.B., & Fournier, A.E. (2006).
Myelin-associated inhibitors regulate cofilin phosphorylation and neuronal inhibition through LIM kinase and Slingshot phosphatase. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(3), 1006-15. [PubMed:16421320] [PMC] [WorldCat] [DOI] - ↑
Piper, M., Anderson, R., Dwivedy, A., Weinl, C., van Horck, F., Leung, K.M., ..., & Holt, C. (2006).
Signaling mechanisms underlying Slit2-induced collapse of Xenopus retinal growth cones. Neuron, 49(2), 215-28. [PubMed:16423696] [PMC] [WorldCat] [DOI] - ↑
Wen, Z., Han, L., Bamburg, J.R., Shim, S., Ming, G.L., & Zheng, J.Q. (2007).
BMP gradients steer nerve growth cones by a balancing act of LIM kinase and Slingshot phosphatase on ADF/cofilin. The Journal of cell biology, 178(1), 107-19. [PubMed:17606869] [PMC] [WorldCat] [DOI] - ↑
Lee-Hoeflich, S.T., Causing, C.G., Podkowa, M., Zhao, X., Wrana, J.L., & Attisano, L. (2004).
Activation of LIMK1 by binding to the BMP receptor, BMPRII, regulates BMP-dependent dendritogenesis. The EMBO journal, 23(24), 4792-801. [PubMed:15538389] [PMC] [WorldCat] [DOI] - ↑
Eaton, B.A., & Davis, G.W. (2005).
LIM Kinase1 controls synaptic stability downstream of the type II BMP receptor. Neuron, 47(5), 695-708. [PubMed:16129399] [WorldCat] [DOI] - ↑
Nishida, E., Iida, K., Yonezawa, N., Koyasu, S., Yahara, I., & Sakai, H. (1987).
Cofilin is a component of intranuclear and cytoplasmic actin rods induced in cultured cells. Proceedings of the National Academy of Sciences of the United States of America, 84(15), 5262-6. [PubMed:3474653] [PMC] [WorldCat] [DOI] - ↑ 52.0 52.1
Bernstein, B.W., Shaw, A.E., Minamide, L.S., Pak, C.W., & Bamburg, J.R. (2012).
Incorporation of cofilin into rods depends on disulfide intermolecular bonds: implications for actin regulation and neurodegenerative disease. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(19), 6670-81. [PubMed:22573689] [PMC] [WorldCat] [DOI] - ↑
Maciver, S.K., & Harrington, C.R. (1995).
Two actin binding proteins, actin depolymerizing factor and cofilin, are associated with Hirano bodies. Neuroreport, 6(15), 1985-8. [PubMed:8580423] [WorldCat] [DOI] - ↑ 54.0 54.1
Minamide, L.S., Striegl, A.M., Boyle, J.A., Meberg, P.J., & Bamburg, J.R. (2000).
Neurodegenerative stimuli induce persistent ADF/cofilin-actin rods that disrupt distal neurite function. Nature cell biology, 2(9), 628-36. [PubMed:10980704] [WorldCat] [DOI] - ↑
Frangiskakis, J.M., Ewart, A.K., Morris, C.A., Mervis, C.B., Bertrand, J., Robinson, B.F., ..., & Keating, M.T. (1996).
LIM-kinase1 hemizygosity implicated in impaired visuospatial constructive cognition. Cell, 86(1), 59-69. [PubMed:8689688] [WorldCat] [DOI]