「Dab1」の版間の差分
Takaohonda (トーク | 投稿記録) 細 氏名の入力ミスを訂正 |
Takaohonda (トーク | 投稿記録) 細編集の要約なし |
||
| (4人の利用者による、間の73版が非表示) | |||
| 1行目: | 1行目: | ||
{{GNF_Protein_box | |||
| Name = Disabled homolog 1 (Drosophila) | |||
| image = Dab1_1NTV.png | |||
| image_source = Dab1_1NTV.png | |||
| Name = Disabled 1 | |||
| image = | |||
| image_source = | |||
| PDB = | | PDB = | ||
| HGNCid = 2661 | | HGNCid = 2661 | ||
| 46行目: | 39行目: | ||
| Mm_Uniprot = P97318 | | Mm_Uniprot = P97318 | ||
| path = PBB/1600 | | path = PBB/1600 | ||
}} | }} | ||
英語名: disabled 1、Dab1 遺伝子名: disabled homolog 1、またはdisabled 1、遺伝子シンボル:Dab1、またはDAB1 | |||
Dab1は中枢神経系において神経細胞を正常な位置に配置するのに必須の細胞内シグナル伝達分子で、さらに神経細胞の樹状突起の発達等にも関与していると考えられている。dab1遺伝子の欠損は大脳新皮質、海馬、小脳、脊髄等の層構造・核構造を形成する部位の神経細胞の配置に異常を引き起こす。同様な異常は、reelerマウスと呼ばれる主にカハールレティウス(Cajal-Retzius)細胞から分泌されるReelinに遺伝子変異のある自然発症変異マウスや、ApoER2/VLDLRのダブルノックアウトマウスでも報告されている。ReelinはApoER2/VLDLRに結合し、ApoER2/VLDLRの細胞内ドメインにはDab1が結合すること等から、細胞外のReelinがApoER2/VLDLRにより受容され、Dab1が細胞内でシグナルを伝達していると考えられている。また、Reelin刺激によってリン酸化を受けるDab1のチロシン5カ所をフェニルアラニンに変異させたマウスでは、dab1遺伝子の変異と同じ神経細胞の配置異常が引き起こされることから、Dab1のチロシンリン酸化はシグナル伝達に必須であることが示されている。チロシンリン酸化されたDab1により活性化される経路が調べられ、中でもCrk/CrkL-C3G-Rap1経路が、N-cadherinやIntegrin <math>\alpha</math>5<math>\beta</math>1の制御を行うことで神経細胞の移動調節を行っている可能性が示唆されている。 | |||
== 歴史的推移 == | == 歴史的推移 == | ||
1997年、チロシンキナーゼSrcに結合するタンパク質が探索され、当時未知のタンパク質であった、disabled-1 homolog 1 (Dab1)(Drosophilaで同定されていたdisabled-1遺伝子と相同性があった為命名)が同定された<ref name="ref1"><pubmed>9009273</pubmed></ref>。Dab1は N末端領域にPTBドメインを持つアダプタータンパク質で、Srcによりリン酸化されることが明らかになった<ref name="ref1" />。dab1ノックアウトマウスが作成された所、大脳新皮質、海馬、小脳において神経細胞の配置異常が観察された<ref><pubmed>9338785</pubmed></ref>。この表現型は1951年に報告され、その原因遺伝子reelinが1995年に明らかにされた、リーラー(reeler)マウスの表現型(リーラーフェノタイプ)<ref>'''Two new mutants trembler and reeler, with neurological actionss in the house mouse'''<br>J. Genet..: 1951, 51, 192-201[http://link.springer.com/article/10.1007%2FBF02996215 論文掲載サイト]</ref>と酷似していた。さらに、リーラーフェノタイプ示すことが知られていたyotariマウスとscramblerマウスの原因遺伝子がdab1であることが明らかになり<ref><pubmed>9338784</pubmed></ref>、dab1とreelinとの関連性が示唆された。実際、reelerマウスでは、(1)Dab1のmRNA量は変化しないが、タンパク質量が上昇していること、<ref><pubmed>9716537</pubmed></ref>、(2)Reelinは脳表層に分布するカハールレティウス(Cajal-Retzius)細胞に主に発現が観察されるが、Dab1はそれに隣接する神経細胞に発現が観察され、相補的な発現パターンになっていること<ref><pubmed>9716537</pubmed></ref>、(3)Reelin刺激によりDab1のチロシンリン酸化が観察されること<ref><pubmed>10090720</pubmed></ref>等から、Dab1はReelinシグナルを細胞内で伝達する役割を果たしているのではないかと推定された。 | |||
2000年になり、low density lipoprotein receptor-related protein 8 (LRP8またはApoER2)とvery low density lipoprotein receptor(VLDLR)のダブルノックアウトマウスが、リーラーフェノタイプになること<ref name=ref2><pubmed>10380922</pubmed></ref>が明らかになり、さらに生化学的結合実験等により、ApoER2とVLDLRがReelinのレセプターであることが示された<ref><pubmed>10571241</pubmed></ref><ref><pubmed>10571240</pubmed></ref>。またApoER2とVLDLRの細胞内ドメインのNPxYモチーフにDab1のPTBドメインを介して結合出来る事が示され、Dab1はReelinシグナルをApoER2、VLDLRを介して受け取る事が示唆された<ref name=ref2 />。また同年、活性化型Srcによってチロシンリン酸化を受ける可能性のある5つのチロシンが同定され、この5つのチロシンリン酸化部位全てをフェニルアラニンに変異させたノックインマウスが、リーラーフェノタイプになる事が示された<ref><pubmed>10959835</pubmed></ref>。この実験結果により、Dab1のチロシンリン酸化はReelinシグナルにとって必須であることが示された。 | |||
2003年以降、チロシンリン酸化されたDab1に結合する様々なタンパク質が報告され、現在までにPI3K<ref><pubmed>12882964</pubmed></ref>、SOCS3<ref><pubmed>17974915</pubmed></ref>、Nck<math>\beta</math><ref><pubmed>14517291</pubmed></ref>、Lis1<ref><pubmed>14578885</pubmed></ref>、SFKs<ref name="ref1" /><ref><pubmed>18981215</pubmed></ref>、Crkファミリータンパク質(Crk、CrkL)<ref><pubmed>15062102</pubmed></ref><ref><pubmed>15316068</pubmed></ref><ref><pubmed>15110774</pubmed></ref>がDab1のチロシンリン酸化依存的に結合することが報告されている。このうちCrkとCrkLダブルノックアウトマウス<ref><pubmed>19074029</pubmed></ref>、C3Gのジーントラップ系統マウス<ref><pubmed>18506028</pubmed></ref>、及びSrcとFynのダブルノックアウトマウス<ref><pubmed>16162939</pubmed></ref>においてはリーラーフェノタイプ様の異常が生じることが報告されている。 | |||
2004年には、dab1欠損マウスの海馬歯状回の顆粒細胞の樹状突起が野生型に比べて突起の数が減少していること<ref name=Niu><pubmed>14715136</pubmed></ref>、dab1欠損マウス由来の培養海馬神経細胞の樹状突起が短くなり、枝分かれの数も減少すること<ref name=Niu />が報告された。また、2006年、Dab1のノックダウン実験により、神経細胞の樹状突起形成が阻害されること<ref><pubmed>16467525</pubmed></ref>、生後、時期特異的にdab1にノックアウトした場合、海馬の樹状突起形成が阻害される<ref><pubmed>18477607</pubmed></ref>ことが、報告され、dab1は神経細胞の移動過程以外にも、神経細胞の樹状突起の発達にも関与することが示唆された。 | |||
2011年から現在にかけて、Dab1の下流分子としてN-cadherin<ref><pubmed>21315259</pubmed></ref><ref><pubmed>21516100</pubmed></ref>と<math>\alpha</math>5<math>\beta</math>1 Integrin<ref><pubmed></pubmed></ref>が神経細胞の移動を制御しいている可能性が示唆されている。これまでの観察で、培養神経細胞のReelin刺激が、Dab1リン酸化を介してCrk-C3G-Rap1パスウェイを活性化すること<ref><pubmed></pubmed></ref>が報告されていたことから、Rap1のエフェクター分子が調べられた。その結果、Reelin-Dab1シグナルはN-cadherinを介して神経細胞のロコモーションと呼ばれる移動過程<ref><pubmed></pubmed></ref>を、Integrin a5b1を介してターミナルトランスロケーションと呼ばれる移動過程に関与している<ref><pubmed></pubmed></ref>可能性が示唆された。 | |||
== 分子構造 == | |||
[[Image:Fig1 Dab1 primary structure.png|thumb|500px|<b>図1 Dab1のドメイン構造</b>]] | |||
マウスではオルタナティブスプライシングにより13種のバリアントが存在することが報告されている<ref><pubmed>22586277</pubmed></ref>が、発達過程の中枢神経系では555アミノ酸を持つバリアント、Dab1 p80が最も多く発現している<ref><pubmed></pubmed></ref>。Dab1(p80)はN末端側からPhosphotyrosine-binding (PTB) domain、チロシンリン酸化部位を持つ細胞内タンパク質である(図1)。PTBドメインは、細胞内ドメインにNPxYモチーフを持つ膜タンパク質と結合する。これまでに、ApoER2<ref name=ref2 />、VLDLR<ref name=ref2 />、mPcdh18<ref><pubmed>11716507</pubmed></ref>、APP<ref><pubmed>10373567</pubmed></ref>、APLP1<ref name=app><pubmed>10460257</pubmed></ref>、 APLP2<ref name=app />との結合が報告されている。これらの結合にはNPxYモチーフのチロシン残基のリン酸化は必要としない。PTBドメインにはplekstrin homology (PH)ドメイン様構造が含まれており、リン脂質(PtdIns4P and PtdIns4,5P2)に結合することが出来る。また、PTBドメインのN末端側には核移行シグナル(Nuclear localization Signal: NLS)、PTBドメインのC末端側に二つの核外移行シグナル(Nuclear Export Signal: NES)を持っており、核と細胞質間を移行する能力を有している<ref><pubmed></pubmed></ref>。PTBドメインのC末端側、分子の中程にチロシンリン酸化を受ける部位が5カ所(Y185、Y198、Y200、Y220、Y232)同定されており<ref><pubmed></pubmed></ref>、このうちの4つがシグナルの伝達に重要な役割を果たしている事が明らかにされている<ref><pubmed></pubmed></ref>。4つのチロシンリン酸化サイトは配列の相同性からYQXI配列を持つ2つ(Y185、Y198)とYXVP配列を持つ二つ(Y220、Y232)に分けられる。 興奮性神経細胞の移動に関しては、YQXI配列を持つY185とY198の間、およびYXVP配列を持つY220とY232の間で冗長性を持つ。一方、両相同染色体にY185・Y198変異を持つマウスと、Y220・Y232に変異を持つマウスではそれぞれリーラーフェノタイプを示す。一方、片方の相同染色体でY185・Y198に変異を持ち、もう片方の相同染色体のY220・Y232に変異を持つ変異マウスではリーラーフェノタイプを示さないことから、Y185・Y198とY220・Y232はそれぞれ独立の機能を持ち、さらに相互依存する関係であることが示されている。Y200の生理的役割は不明である。 | |||
== サブファミリー == | == サブファミリー == | ||
ほ乳類ではDab2が存在しており、細胞表面分子のターンオーバー、エンドサイトーシス等に関与していることが知られている。 | |||
== 発現様式 == | |||
in situ hybridizationにより、dab1 mRNAの発現分布を調べた報告によると、発生期のマウス大脳新皮質では、胎生11.5日目の神経上皮細胞に弱く発現が観察される。胎生12.5日目には皮質板での強い発現が顕著になり、VZでの弱い発現も引き続き観察される。その後、P0にかけて、強い皮質板での発現が維持されるが、VZでの発現は弱くなり、IMZの上部での弱い発現が観察されるようになる。アダルトのマウスでもP0に比べて弱くはなるが、CPにおいて発現が観察される。Dab1の発現部位は、Reelinを発現しているCajal-Retzius細胞が存在する辺縁帯と相互排他的発現パターンになっている。海馬では妊娠12.5日目には神経上皮細胞に弱くdab1のmRNAが観察され、妊娠14.5日目までに海馬の辺縁帯、錐体細胞層、脳室帯の三層が別れ、錐体細胞層に強い発現が観察されるようになる。また隣り合う歯状回の顆粒細胞層にもdab1の発現が観察される。海馬についてもP3でもdab1の発現は維持される。海馬においても、大脳新皮質と同様、Dab1の発現領域はReelinを発現するCajal-Retzius細胞の存在する辺縁帯に隣接した領域で観察される。小脳については、妊娠13.5日目の脳室帯、外顆粒層、分化帯に発現が見られ、妊娠18.5日目から生後3日では、プルキンエ細胞層で発現が観察される。また、妊娠18.5日目ではReelinを強く発現する顆粒細胞が存在する、外顆粒層に隣接してプルキンエ細胞層が存在し、小脳においても相補的な発現パターンを示す。 | |||
Dab1のタンパク質がどの様な細胞に、どのような細胞内分布で発現しているのかは、免疫組織化学染色が難しく、詳しくは知られていないが、免疫組織化学染色に成功しているグループによる報告によれば、Dab1は主には、大脳新皮質や海馬では興奮性神経細胞、小脳ではプルキンエ細胞に発現していると考えられている。 | |||
BGEM http://www.stjudebgem.org/web/view/probe/viewProbeDetails.php?id=1 | |||
ALLEN http://developingmouse.brain-map.org/data/search/gene/index.html?term=dab1 | |||
<br> | |||
== Dab1の機能 == | |||
前述の通り、dab1のノックアウトマウス及び、自然変異マウスで、大脳新皮質、海馬、小脳、脊髄等の興奮性神経細胞移動が障害されていることから、Dab1は層構造・核構造を形成する興奮性神経細胞移動において大変重要な役割を行ってると考えられている。抑制性神経細胞については相反する報告がなされており、結論が得られていない。他の組織・臓器における機能についてはいくつか報告があるのみで、あまりよくわかっていない。 | |||
=== 大脳新皮質発生で観察されるDab1欠損による発生異常 === | |||
[[Image:Migration.png|thumb|700px|<b>図2 大脳新皮質の正常発生とReelin、Dab1、ApoER2VLDLR dKOマウスの発生異常</b>]] | |||
大脳新皮質の興奮性神経細胞は脳室帯で誕生後、脳の表面方向に放射状に移動し、最初期に誕生した神経細胞で形成されるプレプレートと呼ばれる細胞層の間に入り込んで、これをカハールレティウス(Cajal-Retzius)細胞を含む辺縁帯とサブプレートと呼ばれる二つの層に分離する(プレプレートスプリッティング)(図2B, iからii)。神経細胞は辺縁帯の直下で移動を終了し、樹状突起を発達させて最終分化を行なう。神経細胞は次々に脳室帯で誕生して脳表面方向に移動するが、誕生時期の遅い神経細胞は誕生時期の早い神経細胞を追い越し、より脳の表層側に配置されるようになる(図2B, iii)。この細胞配置の仕組みは“インサイドアウト”様式と呼ばれ、ほ乳類の大脳新皮質でのみ観察される特徴的な細胞構築様式である。 | |||
Dab1欠損マウスでは神経細胞は正常に産生されるが、神経細胞はプレプレートの間に入ることが出来ず、プレプレートスプリッティングが起らない。その為辺縁帯が存在しない。後続の神経細胞は正常に移動出来ずに、脳表面から深層に積み重なって行き、“アウトサイドイン”と呼ばれる異常な異常な層構造を形成するようになり、大体の層構造が逆転する異常が観察される。異常な層構造中には、インターナルプレキシフォームゾン(internal plexiform zone)と呼ばれる細胞密度の低い領域が散在し、この部分に視床からサブプレートに投射するアクソンが走行し、また、興奮性神経細胞からは樹状突起がこの領域に向かい展開される。 | |||
=== Dab1の大脳新皮質神経発生における機能 === | |||
dab1欠損により引き起こされるこれらの神経細胞の移動障害が、dab1が欠損した細胞自身の障害によるものなのか、あるいは、dab1を欠損した周囲の細胞によって引き起こされた二次的な原因によるものなのか、あるいは両方なのか、Dab1の機能を解明する上で、焦点となった。この問題を解決するため、野生型Dab1を持つ細胞とDab1を欠損した細胞のキメラマウスが作成された。その結果、野生型のDab1を持つ細胞群がDab1を欠損した細胞群の上に配置されるような大脳新皮質(スーパーコルテックス)が形成される一方、少数の野生型細胞がDab1欠損細胞群中に取り込まれることが示された。この結果より、Dab1欠損による細胞の移動障害は主には細胞内因性の障害によって引き起こされているが、一部は周囲の細胞の障害にも影響されていることが示唆された。また、dab1を欠損したyotariマウスにdab1をin utero エレクトロポレーション(electroporation)法により、導入してやることにより、Dab1をレスキューした場合においてもdab1を導入された神経細胞はDab1を欠損した神経細胞を追い越して、脳表層まで到達し、プレプレートスプリッティングも引き起こすことから、dab1欠損による移動障害が主には細胞内在性に引き起こされていることが示唆されている。 | |||
では、Dab1の欠損により、何が一次的に障害されているのか?、この問題を解明する為に、周囲の細胞が正常な環境下で、一部の神経細胞でのみDab1の機能を阻害し、dab1の欠損によりどんな移動障害が引き起こされるのかが詳細に観察された。大脳新皮質の興奮性神経細胞は誕生時期の違いにより、異なる移動過程を経ることが知られている。早生まれの神経細胞は脳室帯(ventricular zone)で誕生した後、もともと脳の表層にアンカリングしてあった、突起を用いて細胞体を引き上げるsomal translocationと呼ばれる形式で、移動する。一方、遅生まれの神経細胞は脳室帯で誕生した後、脳室下帯(subventricular zone)の直上で多極性の形態(多極性細胞)をとり、突起を出したり縮めたりしながら多極性移動(multipolar migration)と呼ばれる移動を行い、その後、紡錘形の形態にトランスフォームして脳表面にlocomotionと呼ばれる方式で移動する。さらに、脳表面付近では神経細胞の進行方向に長く伸びた先導突起(leading process)と呼ばれる突起を辺縁帯(marginal zone)付近まで伸ばし、核を引き上げる様に移動するターミナルトランスロケーションと呼ばれる移動様式により移動を行う。in utero electroporationによってdab1のノックダウンが行われた結果、dab1がノックダウンされた神経細胞は脳の表層近くまで移動するが、移動の最終過程であるターミナルトランスロケーションと樹状突起の発達が障害されていることが示された。この実験結果ではターミナルトランスロケーションも阻害されていることから、樹状突起形成の発達障害はその二次的な影響との可能性も考えられるが、海馬において生後3日からに次期特異的にdab1をノックアウトした場合に、樹状突起形成に異常が生じること、dab1ノックアウトマウスから得られた神経細胞を培養した場合にも樹状突起の形成に障害が生じることから、dab1には樹状突起形成を促進する働きがあることが示唆された。また、dab1のコンディショナルノックアウトマウスを用いた実験では、早生まれの細胞ではsomal translocationが阻害され、遅生まれの細胞ではteriminal translocationが阻害されていることが示された。また、Dab1のチロシンリン酸化非依存的にDab1に結合する分子として、Notch、Dab2IP、N-WASP、mPcdh18、APP、APLP1、 APLP2、が知られている。 | |||
[[Image:Dab1 signaling pathway.png|thumb|700px|<b>図3 大脳新皮質層形成時におけるDab1を介するシグナル伝達系の模式図</b>]] | |||
一方Dab1が神経細胞移動を制御する分子メカニズムについてはN-cadherinとIntegrinが関与していることが実験的に示唆されている。大脳新皮質神経細胞のReelin刺激により、Dab1のチロシンリン酸化が起こり、ここにCrkを介するC3Gの活性化、続くRap1の活性化が起こることが培養細胞を用いた実験により知られていた為、Rap1のエフェクターとして既に知られていたN-cadherinの関与が調べられた。実験では、Rap1の不活性化因子であるRap1GAPを強制発現させることにより、Rap1を不活性化した。これにより、神経細胞の移動が障害され、皮質板に侵入する神経細胞の割合が減少する。Rap1はN-cadherinの細胞内から細胞表面への輸送に関わっていることが知られていたことから、Rap1GAPとN-cadherinを同時に発現させた所、Rap1GAPによる神経細胞の移動障害が抑制されることが示唆された。この結果により、間接的ではあるが、Reelin-Dab1シグナルがRap1を介してN-cadherinの細胞表面への輸送制御を行うことにより、神経細胞移動を制御している可能性が示唆された。 | |||
一方、Rap1の阻害タンパク質SpaIをin utero electroporationにより発現させた場合、発現量が多い場合、多極性移動からロコモーションへの変換を阻害し、弱い場合は原皮質帯(primitive cortical zone、PCZ)と呼ばれる部位への神経細胞の移動を阻害することから、Rap1は神経細胞の移動を多くのステップで制御している可能性が示された。のneuN陰性の活性化型Integrin beta 1を認識する抗体がターミナルトランスロケーションが起る原皮質帯(primitive cortical zone、PCZ)と呼ばれる部位に多いこと、reelerマウスやyotariマウスではIntegrin beta1の活性化が観察されないこと、Integrinのリガンドであるfibronectinが辺縁帯に多いこと等から、IntegrinがReelin-dab1シグナル依存性にターミナルトランスロケーションを制御する分子の候補となった。Reelin刺激した神経細胞はfibronectinに対する接着性が上昇すること等から、Rap1の下流分子として知られていた | |||
しかしながら、N-cadhelinをリーラーマウスに導入しただけでは、神経細胞の移動がレスキューされないし、また、Integrin beta1のノックアウトマウスやコンディショナルノックアウトマウスではリーラーフェノタイプにはならないことから、これらの働きは部分的であるか、このような実験条件では完全にはレスキューできないことが示唆されている。 | |||
<br> | |||
== 関連語 == | |||
Reelin, ApoER2, VLDLR | |||
== 参考文献 == | |||
<references /> | |||
(執筆者:本田岳夫、仲嶋一範、担当編集委員:大隅典子) | |||
2013年1月17日 (木) 15:42時点における版
英語名: disabled 1、Dab1 遺伝子名: disabled homolog 1、またはdisabled 1、遺伝子シンボル:Dab1、またはDAB1
Dab1は中枢神経系において神経細胞を正常な位置に配置するのに必須の細胞内シグナル伝達分子で、さらに神経細胞の樹状突起の発達等にも関与していると考えられている。dab1遺伝子の欠損は大脳新皮質、海馬、小脳、脊髄等の層構造・核構造を形成する部位の神経細胞の配置に異常を引き起こす。同様な異常は、reelerマウスと呼ばれる主にカハールレティウス(Cajal-Retzius)細胞から分泌されるReelinに遺伝子変異のある自然発症変異マウスや、ApoER2/VLDLRのダブルノックアウトマウスでも報告されている。ReelinはApoER2/VLDLRに結合し、ApoER2/VLDLRの細胞内ドメインにはDab1が結合すること等から、細胞外のReelinがApoER2/VLDLRにより受容され、Dab1が細胞内でシグナルを伝達していると考えられている。また、Reelin刺激によってリン酸化を受けるDab1のチロシン5カ所をフェニルアラニンに変異させたマウスでは、dab1遺伝子の変異と同じ神経細胞の配置異常が引き起こされることから、Dab1のチロシンリン酸化はシグナル伝達に必須であることが示されている。チロシンリン酸化されたDab1により活性化される経路が調べられ、中でもCrk/CrkL-C3G-Rap1経路が、N-cadherinやIntegrin 51の制御を行うことで神経細胞の移動調節を行っている可能性が示唆されている。
歴史的推移
1997年、チロシンキナーゼSrcに結合するタンパク質が探索され、当時未知のタンパク質であった、disabled-1 homolog 1 (Dab1)(Drosophilaで同定されていたdisabled-1遺伝子と相同性があった為命名)が同定された[1]。Dab1は N末端領域にPTBドメインを持つアダプタータンパク質で、Srcによりリン酸化されることが明らかになった[1]。dab1ノックアウトマウスが作成された所、大脳新皮質、海馬、小脳において神経細胞の配置異常が観察された[2]。この表現型は1951年に報告され、その原因遺伝子reelinが1995年に明らかにされた、リーラー(reeler)マウスの表現型(リーラーフェノタイプ)[3]と酷似していた。さらに、リーラーフェノタイプ示すことが知られていたyotariマウスとscramblerマウスの原因遺伝子がdab1であることが明らかになり[4]、dab1とreelinとの関連性が示唆された。実際、reelerマウスでは、(1)Dab1のmRNA量は変化しないが、タンパク質量が上昇していること、[5]、(2)Reelinは脳表層に分布するカハールレティウス(Cajal-Retzius)細胞に主に発現が観察されるが、Dab1はそれに隣接する神経細胞に発現が観察され、相補的な発現パターンになっていること[6]、(3)Reelin刺激によりDab1のチロシンリン酸化が観察されること[7]等から、Dab1はReelinシグナルを細胞内で伝達する役割を果たしているのではないかと推定された。
2000年になり、low density lipoprotein receptor-related protein 8 (LRP8またはApoER2)とvery low density lipoprotein receptor(VLDLR)のダブルノックアウトマウスが、リーラーフェノタイプになること[8]が明らかになり、さらに生化学的結合実験等により、ApoER2とVLDLRがReelinのレセプターであることが示された[9][10]。またApoER2とVLDLRの細胞内ドメインのNPxYモチーフにDab1のPTBドメインを介して結合出来る事が示され、Dab1はReelinシグナルをApoER2、VLDLRを介して受け取る事が示唆された[8]。また同年、活性化型Srcによってチロシンリン酸化を受ける可能性のある5つのチロシンが同定され、この5つのチロシンリン酸化部位全てをフェニルアラニンに変異させたノックインマウスが、リーラーフェノタイプになる事が示された[11]。この実験結果により、Dab1のチロシンリン酸化はReelinシグナルにとって必須であることが示された。
2003年以降、チロシンリン酸化されたDab1に結合する様々なタンパク質が報告され、現在までにPI3K[12]、SOCS3[13]、Nck[14]、Lis1[15]、SFKs[1][16]、Crkファミリータンパク質(Crk、CrkL)[17][18][19]がDab1のチロシンリン酸化依存的に結合することが報告されている。このうちCrkとCrkLダブルノックアウトマウス[20]、C3Gのジーントラップ系統マウス[21]、及びSrcとFynのダブルノックアウトマウス[22]においてはリーラーフェノタイプ様の異常が生じることが報告されている。
2004年には、dab1欠損マウスの海馬歯状回の顆粒細胞の樹状突起が野生型に比べて突起の数が減少していること[23]、dab1欠損マウス由来の培養海馬神経細胞の樹状突起が短くなり、枝分かれの数も減少すること[23]が報告された。また、2006年、Dab1のノックダウン実験により、神経細胞の樹状突起形成が阻害されること[24]、生後、時期特異的にdab1にノックアウトした場合、海馬の樹状突起形成が阻害される[25]ことが、報告され、dab1は神経細胞の移動過程以外にも、神経細胞の樹状突起の発達にも関与することが示唆された。
2011年から現在にかけて、Dab1の下流分子としてN-cadherin[26][27]と51 Integrin[28]が神経細胞の移動を制御しいている可能性が示唆されている。これまでの観察で、培養神経細胞のReelin刺激が、Dab1リン酸化を介してCrk-C3G-Rap1パスウェイを活性化すること[29]が報告されていたことから、Rap1のエフェクター分子が調べられた。その結果、Reelin-Dab1シグナルはN-cadherinを介して神経細胞のロコモーションと呼ばれる移動過程[30]を、Integrin a5b1を介してターミナルトランスロケーションと呼ばれる移動過程に関与している[31]可能性が示唆された。
分子構造
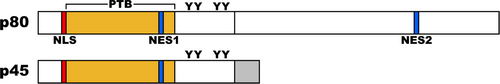
マウスではオルタナティブスプライシングにより13種のバリアントが存在することが報告されている[32]が、発達過程の中枢神経系では555アミノ酸を持つバリアント、Dab1 p80が最も多く発現している[33]。Dab1(p80)はN末端側からPhosphotyrosine-binding (PTB) domain、チロシンリン酸化部位を持つ細胞内タンパク質である(図1)。PTBドメインは、細胞内ドメインにNPxYモチーフを持つ膜タンパク質と結合する。これまでに、ApoER2[8]、VLDLR[8]、mPcdh18[34]、APP[35]、APLP1[36]、 APLP2[36]との結合が報告されている。これらの結合にはNPxYモチーフのチロシン残基のリン酸化は必要としない。PTBドメインにはplekstrin homology (PH)ドメイン様構造が含まれており、リン脂質(PtdIns4P and PtdIns4,5P2)に結合することが出来る。また、PTBドメインのN末端側には核移行シグナル(Nuclear localization Signal: NLS)、PTBドメインのC末端側に二つの核外移行シグナル(Nuclear Export Signal: NES)を持っており、核と細胞質間を移行する能力を有している[37]。PTBドメインのC末端側、分子の中程にチロシンリン酸化を受ける部位が5カ所(Y185、Y198、Y200、Y220、Y232)同定されており[38]、このうちの4つがシグナルの伝達に重要な役割を果たしている事が明らかにされている[39]。4つのチロシンリン酸化サイトは配列の相同性からYQXI配列を持つ2つ(Y185、Y198)とYXVP配列を持つ二つ(Y220、Y232)に分けられる。 興奮性神経細胞の移動に関しては、YQXI配列を持つY185とY198の間、およびYXVP配列を持つY220とY232の間で冗長性を持つ。一方、両相同染色体にY185・Y198変異を持つマウスと、Y220・Y232に変異を持つマウスではそれぞれリーラーフェノタイプを示す。一方、片方の相同染色体でY185・Y198に変異を持ち、もう片方の相同染色体のY220・Y232に変異を持つ変異マウスではリーラーフェノタイプを示さないことから、Y185・Y198とY220・Y232はそれぞれ独立の機能を持ち、さらに相互依存する関係であることが示されている。Y200の生理的役割は不明である。
サブファミリー
ほ乳類ではDab2が存在しており、細胞表面分子のターンオーバー、エンドサイトーシス等に関与していることが知られている。
発現様式
in situ hybridizationにより、dab1 mRNAの発現分布を調べた報告によると、発生期のマウス大脳新皮質では、胎生11.5日目の神経上皮細胞に弱く発現が観察される。胎生12.5日目には皮質板での強い発現が顕著になり、VZでの弱い発現も引き続き観察される。その後、P0にかけて、強い皮質板での発現が維持されるが、VZでの発現は弱くなり、IMZの上部での弱い発現が観察されるようになる。アダルトのマウスでもP0に比べて弱くはなるが、CPにおいて発現が観察される。Dab1の発現部位は、Reelinを発現しているCajal-Retzius細胞が存在する辺縁帯と相互排他的発現パターンになっている。海馬では妊娠12.5日目には神経上皮細胞に弱くdab1のmRNAが観察され、妊娠14.5日目までに海馬の辺縁帯、錐体細胞層、脳室帯の三層が別れ、錐体細胞層に強い発現が観察されるようになる。また隣り合う歯状回の顆粒細胞層にもdab1の発現が観察される。海馬についてもP3でもdab1の発現は維持される。海馬においても、大脳新皮質と同様、Dab1の発現領域はReelinを発現するCajal-Retzius細胞の存在する辺縁帯に隣接した領域で観察される。小脳については、妊娠13.5日目の脳室帯、外顆粒層、分化帯に発現が見られ、妊娠18.5日目から生後3日では、プルキンエ細胞層で発現が観察される。また、妊娠18.5日目ではReelinを強く発現する顆粒細胞が存在する、外顆粒層に隣接してプルキンエ細胞層が存在し、小脳においても相補的な発現パターンを示す。
Dab1のタンパク質がどの様な細胞に、どのような細胞内分布で発現しているのかは、免疫組織化学染色が難しく、詳しくは知られていないが、免疫組織化学染色に成功しているグループによる報告によれば、Dab1は主には、大脳新皮質や海馬では興奮性神経細胞、小脳ではプルキンエ細胞に発現していると考えられている。
BGEM http://www.stjudebgem.org/web/view/probe/viewProbeDetails.php?id=1
ALLEN http://developingmouse.brain-map.org/data/search/gene/index.html?term=dab1
Dab1の機能
前述の通り、dab1のノックアウトマウス及び、自然変異マウスで、大脳新皮質、海馬、小脳、脊髄等の興奮性神経細胞移動が障害されていることから、Dab1は層構造・核構造を形成する興奮性神経細胞移動において大変重要な役割を行ってると考えられている。抑制性神経細胞については相反する報告がなされており、結論が得られていない。他の組織・臓器における機能についてはいくつか報告があるのみで、あまりよくわかっていない。
大脳新皮質発生で観察されるDab1欠損による発生異常
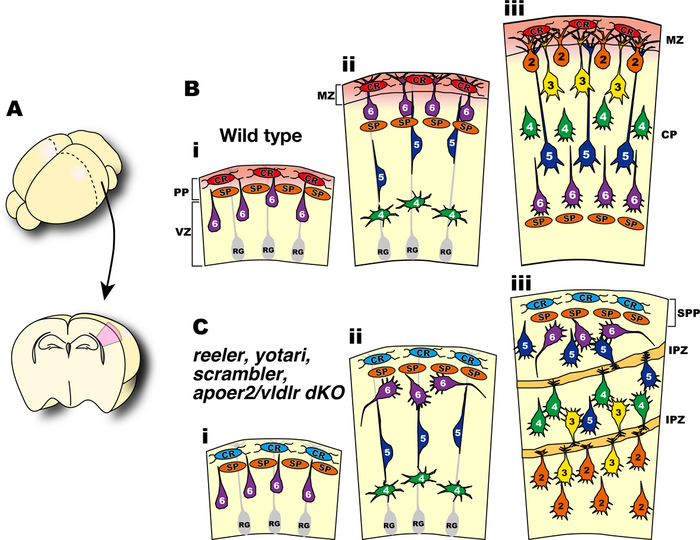
大脳新皮質の興奮性神経細胞は脳室帯で誕生後、脳の表面方向に放射状に移動し、最初期に誕生した神経細胞で形成されるプレプレートと呼ばれる細胞層の間に入り込んで、これをカハールレティウス(Cajal-Retzius)細胞を含む辺縁帯とサブプレートと呼ばれる二つの層に分離する(プレプレートスプリッティング)(図2B, iからii)。神経細胞は辺縁帯の直下で移動を終了し、樹状突起を発達させて最終分化を行なう。神経細胞は次々に脳室帯で誕生して脳表面方向に移動するが、誕生時期の遅い神経細胞は誕生時期の早い神経細胞を追い越し、より脳の表層側に配置されるようになる(図2B, iii)。この細胞配置の仕組みは“インサイドアウト”様式と呼ばれ、ほ乳類の大脳新皮質でのみ観察される特徴的な細胞構築様式である。
Dab1欠損マウスでは神経細胞は正常に産生されるが、神経細胞はプレプレートの間に入ることが出来ず、プレプレートスプリッティングが起らない。その為辺縁帯が存在しない。後続の神経細胞は正常に移動出来ずに、脳表面から深層に積み重なって行き、“アウトサイドイン”と呼ばれる異常な異常な層構造を形成するようになり、大体の層構造が逆転する異常が観察される。異常な層構造中には、インターナルプレキシフォームゾン(internal plexiform zone)と呼ばれる細胞密度の低い領域が散在し、この部分に視床からサブプレートに投射するアクソンが走行し、また、興奮性神経細胞からは樹状突起がこの領域に向かい展開される。
Dab1の大脳新皮質神経発生における機能
dab1欠損により引き起こされるこれらの神経細胞の移動障害が、dab1が欠損した細胞自身の障害によるものなのか、あるいは、dab1を欠損した周囲の細胞によって引き起こされた二次的な原因によるものなのか、あるいは両方なのか、Dab1の機能を解明する上で、焦点となった。この問題を解決するため、野生型Dab1を持つ細胞とDab1を欠損した細胞のキメラマウスが作成された。その結果、野生型のDab1を持つ細胞群がDab1を欠損した細胞群の上に配置されるような大脳新皮質(スーパーコルテックス)が形成される一方、少数の野生型細胞がDab1欠損細胞群中に取り込まれることが示された。この結果より、Dab1欠損による細胞の移動障害は主には細胞内因性の障害によって引き起こされているが、一部は周囲の細胞の障害にも影響されていることが示唆された。また、dab1を欠損したyotariマウスにdab1をin utero エレクトロポレーション(electroporation)法により、導入してやることにより、Dab1をレスキューした場合においてもdab1を導入された神経細胞はDab1を欠損した神経細胞を追い越して、脳表層まで到達し、プレプレートスプリッティングも引き起こすことから、dab1欠損による移動障害が主には細胞内在性に引き起こされていることが示唆されている。
では、Dab1の欠損により、何が一次的に障害されているのか?、この問題を解明する為に、周囲の細胞が正常な環境下で、一部の神経細胞でのみDab1の機能を阻害し、dab1の欠損によりどんな移動障害が引き起こされるのかが詳細に観察された。大脳新皮質の興奮性神経細胞は誕生時期の違いにより、異なる移動過程を経ることが知られている。早生まれの神経細胞は脳室帯(ventricular zone)で誕生した後、もともと脳の表層にアンカリングしてあった、突起を用いて細胞体を引き上げるsomal translocationと呼ばれる形式で、移動する。一方、遅生まれの神経細胞は脳室帯で誕生した後、脳室下帯(subventricular zone)の直上で多極性の形態(多極性細胞)をとり、突起を出したり縮めたりしながら多極性移動(multipolar migration)と呼ばれる移動を行い、その後、紡錘形の形態にトランスフォームして脳表面にlocomotionと呼ばれる方式で移動する。さらに、脳表面付近では神経細胞の進行方向に長く伸びた先導突起(leading process)と呼ばれる突起を辺縁帯(marginal zone)付近まで伸ばし、核を引き上げる様に移動するターミナルトランスロケーションと呼ばれる移動様式により移動を行う。in utero electroporationによってdab1のノックダウンが行われた結果、dab1がノックダウンされた神経細胞は脳の表層近くまで移動するが、移動の最終過程であるターミナルトランスロケーションと樹状突起の発達が障害されていることが示された。この実験結果ではターミナルトランスロケーションも阻害されていることから、樹状突起形成の発達障害はその二次的な影響との可能性も考えられるが、海馬において生後3日からに次期特異的にdab1をノックアウトした場合に、樹状突起形成に異常が生じること、dab1ノックアウトマウスから得られた神経細胞を培養した場合にも樹状突起の形成に障害が生じることから、dab1には樹状突起形成を促進する働きがあることが示唆された。また、dab1のコンディショナルノックアウトマウスを用いた実験では、早生まれの細胞ではsomal translocationが阻害され、遅生まれの細胞ではteriminal translocationが阻害されていることが示された。また、Dab1のチロシンリン酸化非依存的にDab1に結合する分子として、Notch、Dab2IP、N-WASP、mPcdh18、APP、APLP1、 APLP2、が知られている。
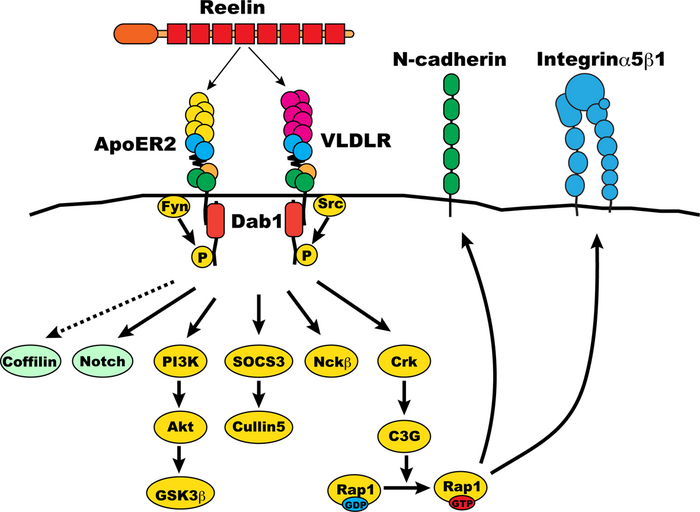
一方Dab1が神経細胞移動を制御する分子メカニズムについてはN-cadherinとIntegrinが関与していることが実験的に示唆されている。大脳新皮質神経細胞のReelin刺激により、Dab1のチロシンリン酸化が起こり、ここにCrkを介するC3Gの活性化、続くRap1の活性化が起こることが培養細胞を用いた実験により知られていた為、Rap1のエフェクターとして既に知られていたN-cadherinの関与が調べられた。実験では、Rap1の不活性化因子であるRap1GAPを強制発現させることにより、Rap1を不活性化した。これにより、神経細胞の移動が障害され、皮質板に侵入する神経細胞の割合が減少する。Rap1はN-cadherinの細胞内から細胞表面への輸送に関わっていることが知られていたことから、Rap1GAPとN-cadherinを同時に発現させた所、Rap1GAPによる神経細胞の移動障害が抑制されることが示唆された。この結果により、間接的ではあるが、Reelin-Dab1シグナルがRap1を介してN-cadherinの細胞表面への輸送制御を行うことにより、神経細胞移動を制御している可能性が示唆された。
一方、Rap1の阻害タンパク質SpaIをin utero electroporationにより発現させた場合、発現量が多い場合、多極性移動からロコモーションへの変換を阻害し、弱い場合は原皮質帯(primitive cortical zone、PCZ)と呼ばれる部位への神経細胞の移動を阻害することから、Rap1は神経細胞の移動を多くのステップで制御している可能性が示された。のneuN陰性の活性化型Integrin beta 1を認識する抗体がターミナルトランスロケーションが起る原皮質帯(primitive cortical zone、PCZ)と呼ばれる部位に多いこと、reelerマウスやyotariマウスではIntegrin beta1の活性化が観察されないこと、Integrinのリガンドであるfibronectinが辺縁帯に多いこと等から、IntegrinがReelin-dab1シグナル依存性にターミナルトランスロケーションを制御する分子の候補となった。Reelin刺激した神経細胞はfibronectinに対する接着性が上昇すること等から、Rap1の下流分子として知られていた
しかしながら、N-cadhelinをリーラーマウスに導入しただけでは、神経細胞の移動がレスキューされないし、また、Integrin beta1のノックアウトマウスやコンディショナルノックアウトマウスではリーラーフェノタイプにはならないことから、これらの働きは部分的であるか、このような実験条件では完全にはレスキューできないことが示唆されている。
関連語
Reelin, ApoER2, VLDLR
参考文献
- ↑ 1.0 1.1 1.2
Howell, B.W., Gertler, F.B., & Cooper, J.A. (1997).
Mouse disabled (mDab1): a Src binding protein implicated in neuronal development. The EMBO journal, 16(1), 121-32. [PubMed:9009273] [PMC] [WorldCat] [DOI] - ↑
Howell, B.W., Hawkes, R., Soriano, P., & Cooper, J.A. (1997).
Neuronal position in the developing brain is regulated by mouse disabled-1. Nature, 389(6652), 733-7. [PubMed:9338785] [WorldCat] [DOI] - ↑ Two new mutants trembler and reeler, with neurological actionss in the house mouse
J. Genet..: 1951, 51, 192-201論文掲載サイト - ↑
Sheldon, M., Rice, D.S., D'Arcangelo, G., Yoneshima, H., Nakajima, K., Mikoshiba, K., ..., & Curran, T. (1997).
Scrambler and yotari disrupt the disabled gene and produce a reeler-like phenotype in mice. Nature, 389(6652), 730-3. [PubMed:9338784] [WorldCat] [DOI] - ↑
Rice, D.S., Sheldon, M., D'Arcangelo, G., Nakajima, K., Goldowitz, D., & Curran, T. (1998).
Disabled-1 acts downstream of Reelin in a signaling pathway that controls laminar organization in the mammalian brain. Development (Cambridge, England), 125(18), 3719-29. [PubMed:9716537] [WorldCat] - ↑
Rice, D.S., Sheldon, M., D'Arcangelo, G., Nakajima, K., Goldowitz, D., & Curran, T. (1998).
Disabled-1 acts downstream of Reelin in a signaling pathway that controls laminar organization in the mammalian brain. Development (Cambridge, England), 125(18), 3719-29. [PubMed:9716537] [WorldCat] - ↑
Howell, B.W., Herrick, T.M., & Cooper, J.A. (1999).
Reelin-induced tyrosine [corrected] phosphorylation of disabled 1 during neuronal positioning. Genes & development, 13(6), 643-8. [PubMed:10090720] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Trommsdorff, M., Gotthardt, M., Hiesberger, T., Shelton, J., Stockinger, W., Nimpf, J., ..., & Herz, J. (1999).
Reeler/Disabled-like disruption of neuronal migration in knockout mice lacking the VLDL receptor and ApoE receptor 2. Cell, 97(6), 689-701. [PubMed:10380922] [WorldCat] [DOI] - ↑
Hiesberger, T., Trommsdorff, M., Howell, B.W., Goffinet, A., Mumby, M.C., Cooper, J.A., & Herz, J. (1999).
Direct binding of Reelin to VLDL receptor and ApoE receptor 2 induces tyrosine phosphorylation of disabled-1 and modulates tau phosphorylation. Neuron, 24(2), 481-9. [PubMed:10571241] [WorldCat] [DOI] - ↑
D'Arcangelo, G., Homayouni, R., Keshvara, L., Rice, D.S., Sheldon, M., & Curran, T. (1999).
Reelin is a ligand for lipoprotein receptors. Neuron, 24(2), 471-9. [PubMed:10571240] [WorldCat] [DOI] - ↑
Howell, B.W., Herrick, T.M., Hildebrand, J.D., Zhang, Y., & Cooper, J.A. (2000).
Dab1 tyrosine phosphorylation sites relay positional signals during mouse brain development. Current biology : CB, 10(15), 877-85. [PubMed:10959835] [WorldCat] [DOI] - ↑
Bock, H.H., Jossin, Y., Liu, P., Förster, E., May, P., Goffinet, A.M., & Herz, J. (2003).
Phosphatidylinositol 3-kinase interacts with the adaptor protein Dab1 in response to Reelin signaling and is required for normal cortical lamination. The Journal of biological chemistry, 278(40), 38772-9. [PubMed:12882964] [WorldCat] [DOI] - ↑
Feng, L., Allen, N.S., Simo, S., & Cooper, J.A. (2007).
Cullin 5 regulates Dab1 protein levels and neuron positioning during cortical development. Genes & development, 21(21), 2717-30. [PubMed:17974915] [PMC] [WorldCat] [DOI] - ↑
Pramatarova, A., Ochalski, P.G., Chen, K., Gropman, A., Myers, S., Min, K.T., & Howell, B.W. (2003).
Nck beta interacts with tyrosine-phosphorylated disabled 1 and redistributes in Reelin-stimulated neurons. Molecular and cellular biology, 23(20), 7210-21. [PubMed:14517291] [PMC] [WorldCat] [DOI] - ↑
Assadi, A.H., Zhang, G., Beffert, U., McNeil, R.S., Renfro, A.L., Niu, S., ..., & Clark, G.D. (2003).
Interaction of reelin signaling and Lis1 in brain development. Nature genetics, 35(3), 270-6. [PubMed:14578885] [WorldCat] [DOI] - ↑
Feng, L., & Cooper, J.A. (2009).
Dual functions of Dab1 during brain development. Molecular and cellular biology, 29(2), 324-32. [PubMed:18981215] [PMC] [WorldCat] [DOI] - ↑
Ballif, B.A., Arnaud, L., Arthur, W.T., Guris, D., Imamoto, A., & Cooper, J.A. (2004).
Activation of a Dab1/CrkL/C3G/Rap1 pathway in Reelin-stimulated neurons. Current biology : CB, 14(7), 606-10. [PubMed:15062102] [WorldCat] [DOI] - ↑
Chen, K., Ochalski, P.G., Tran, T.S., Sahir, N., Schubert, M., Pramatarova, A., & Howell, B.W. (2004).
Interaction between Dab1 and CrkII is promoted by Reelin signaling. Journal of cell science, 117(Pt 19), 4527-36. [PubMed:15316068] [WorldCat] [DOI] - ↑
Huang, Y., Magdaleno, S., Hopkins, R., Slaughter, C., Curran, T., & Keshvara, L. (2004).
Tyrosine phosphorylated Disabled 1 recruits Crk family adapter proteins. Biochemical and biophysical research communications, 318(1), 204-12. [PubMed:15110774] [WorldCat] [DOI] - ↑
Park, T.J., & Curran, T. (2008).
Crk and Crk-like play essential overlapping roles downstream of disabled-1 in the Reelin pathway. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(50), 13551-62. [PubMed:19074029] [PMC] [WorldCat] [DOI] - ↑
Voss, A.K., Britto, J.M., Dixon, M.P., Sheikh, B.N., Collin, C., Tan, S.S., & Thomas, T. (2008).
C3G regulates cortical neuron migration, preplate splitting and radial glial cell attachment. Development (Cambridge, England), 135(12), 2139-49. [PubMed:18506028] [WorldCat] [DOI] - ↑
Kuo, G., Arnaud, L., Kronstad-O'Brien, P., & Cooper, J.A. (2005).
Absence of Fyn and Src causes a reeler-like phenotype. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(37), 8578-86. [PubMed:16162939] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Niu, S., Renfro, A., Quattrocchi, C.C., Sheldon, M., & D'Arcangelo, G. (2004).
Reelin promotes hippocampal dendrite development through the VLDLR/ApoER2-Dab1 pathway. Neuron, 41(1), 71-84. [PubMed:14715136] [WorldCat] [DOI] - ↑
Olson, E.C., Kim, S., & Walsh, C.A. (2006).
Impaired neuronal positioning and dendritogenesis in the neocortex after cell-autonomous Dab1 suppression. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(6), 1767-75. [PubMed:16467525] [PMC] [WorldCat] [DOI] - ↑
Matsuki, T., Pramatarova, A., & Howell, B.W. (2008).
Reduction of Crk and CrkL expression blocks reelin-induced dendritogenesis. Journal of cell science, 121(11), 1869-75. [PubMed:18477607] [PMC] [WorldCat] [DOI] - ↑
Franco, S.J., Martinez-Garay, I., Gil-Sanz, C., Harkins-Perry, S.R., & Müller, U. (2011).
Reelin regulates cadherin function via Dab1/Rap1 to control neuronal migration and lamination in the neocortex. Neuron, 69(3), 482-97. [PubMed:21315259] [PMC] [WorldCat] [DOI] - ↑
Jossin, Y., & Cooper, J.A. (2011).
Reelin, Rap1 and N-cadherin orient the migration of multipolar neurons in the developing neocortex. Nature neuroscience, 14(6), 697-703. [PubMed:21516100] [PMC] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑
Gao, Z., Poon, H.Y., Li, L., Li, X., Palmesino, E., Glubrecht, D.D., ..., & Godbout, R. (2012).
Splice-mediated motif switching regulates disabled-1 phosphorylation and SH2 domain interactions. Molecular and cellular biology, 32(14), 2794-808. [PubMed:22586277] [PMC] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑
Homayouni, R., Rice, D.S., & Curran, T. (2001).
Disabled-1 interacts with a novel developmentally regulated protocadherin. Biochemical and biophysical research communications, 289(2), 539-47. [PubMed:11716507] [WorldCat] [DOI] - ↑
Howell, B.W., Lanier, L.M., Frank, R., Gertler, F.B., & Cooper, J.A. (1999).
The disabled 1 phosphotyrosine-binding domain binds to the internalization signals of transmembrane glycoproteins and to phospholipids. Molecular and cellular biology, 19(7), 5179-88. [PubMed:10373567] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1
Homayouni, R., Rice, D.S., Sheldon, M., & Curran, T. (1999).
Disabled-1 binds to the cytoplasmic domain of amyloid precursor-like protein 1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(17), 7507-15. [PubMed:10460257] [PMC] [WorldCat] - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
(執筆者:本田岳夫、仲嶋一範、担当編集委員:大隅典子)