「塩素チャネル」の版間の差分
細 →種類 |
細編集の要約なし |
||
| (3人の利用者による、間の61版が非表示) | |||
| 1行目: | 1行目: | ||
英: chloride channel | |||
同義語: アニオンチャネル、クロライドチャネル、Cl<sup>−</sup>チャネル、塩素イオンチャネル | |||
塩素チャネルとは、細胞膜に組み込まれたイオンチャネルの一種で、主に塩化物イオン(Cl<sup>−</sup>)を受動的に透過させる。ほとんどの塩素チャネルは、Cl<sup>−</sup>以外のI<sup>−</sup>・Br<sup>−</sup>・F<sup>−</sup>等の無機陰イオン(アニオン)にも透過性を示し、またNO<sub>3</sub><sup>−</sup>・SCN<sup>−</sup>・HCO<sub>3</sub><sup>−</sup>やグルタミン酸・アスパラギン酸等のアミノ酸アニオンにも透過性を示すものも多いことから、一般にアニオンチャネルとも呼ばれる。細胞膜電位・細胞内カルシウムイオン濃度・細胞容積の変化や、リガンドの結合あるいはcAMP依存性のリン酸化反応に応答して開口する塩素チャネルがある。神経系において最もよく知られる塩素チャネルは、神経細胞の興奮・抑制調節に関与するリガンド作動性塩素チャネル(GABAA受容体、GABAC受容体、グリシン受容体)であるが、このチャネルについては他項目(GABA受容体、グリシン受容体)を参照されたい。リガンド作動性以外の塩素チャネルについて、現在のところ特異的な阻害薬がほとんど無い。塩素チャネルは神経系を含むあらゆる種類の細胞に発現し、膜電位や細胞容積の調節、細胞の移動・増殖や細胞死(アポトーシス)、分泌などの細胞の基本機能に広く関与しており、チャネル異常による遺伝性疾患も数多く知られている。 | |||
<br> | |||
== 種類 == | |||
哺乳類の神経系に発現している塩素チャネルは以下の5つに大別される。 | |||
=== ClC塩素チャネル === | |||
塩素チャネルとして最初にシビレエイ(学名 ''Torpedo marmorata'')の発電器官からクローニングされた遺伝子ファミリーに属するものである<ref name="ref1"><pubmed>18307107</pubmed></ref>。哺乳類では9種類知られており、そのうち神経系に発現が知られているのは主にClC-2・-3・-4・-6・-7である。ClC-2は主に形質膜に分布して電位感受性塩素チャネルとして機能し、その他のClC-3・-4・-6・-7は主に細胞内小胞膜に分布し、チャネルというよりは、むしろCl<sup>-</sup>/H<sup>+</sup>-交換輸送体として機能すると考えられている。<br> | |||
<br> | |||
=== カルシウム依存性塩素チャネル(calcium-activated chloride channel; CaCC) === | |||
細胞内Ca<sup>2+</sup>濃度の上昇に応じて活性化される塩素チャネルである。古くから神経系の細胞を含む、様々な細胞種で確認されていた最も典型的なCaCCの主な責任分子が、近年Anoctamin/TMEM16ファミリーのAno1/TMEM16A及びAno2/TMEM16Bであることが確定した<ref name="ref2"><pubmed>22090471</pubmed></ref><ref name="ref3"><pubmed>19827947</pubmed></ref>。また、卵黄状黄斑ジストロフィ(ベスト病)の原因遺伝子として主に網膜色素上皮に発現し、神経系全般にも或る程度の発現が認められているBestrophinファミリー(Best1-4)もCaCC活性を持つことが知られている<ref name="ref4"><pubmed>18391176</pubmed></ref>。(なお、かつてCaCCの候補として挙げられていたCLCA及びTTYHファミリーのCaCCとしての機能については、現在否定的な見解が占める。)<br> | |||
<br> | |||
=== 細胞容積感受性塩素チャネル (volume-regulated chloride channel) === | |||
典型的には細胞容積の増大に伴い開口する塩素チャネルである。神経系の細胞を含む、あらゆる細胞種で容積増大により最も多く活性化されるのが、細胞容積感受性外向整流性アニオンチャネル(volume-sensitive outwardly rectifying anion channel; VSOR)と呼ばれるものであるが、その分子実体はまだ解明されていない<ref name="ref5"><pubmed>19171657</pubmed></ref>。その他、マキシアニオンチャネル(maxi-anion channel)<ref name="ref6"><pubmed>19340557</pubmed></ref>と呼ばれるものや、上述のClC-2・Best1も容積感受性があることが知られている。<br> | |||
<br> | |||
=== CFTR(cystic fibrosis transmembrane conductance regulator)塩素チャネル === | |||
嚢胞性線維症(cystic fibrosis)の原因遺伝子として同定されたCFTRは、神経系でも或る程度の発現が報告されている。cAMP依存性リン酸化酵素(PKA)によるリン酸化を通じて活性化される塩素チャネルである<ref name="ref7"><pubmed>18304008</pubmed></ref>。<br> | |||
<br> | |||
=== リガンド作動性塩素チャネル === | |||
他項目(GABA受容体、グリシン受容体)を参照。 | |||
<br> | |||
== 構造 == | |||
=== ClC塩素チャネル === | |||
[[Image:ClC.JPG|thumb|right|623x182px|'''図1 ClCチャネル'''<br> 1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ(<ref name=ref8><pubmed>19153558</pubmed></ref>より転載)。]] ClCチャネルは、1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった(図1)。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質で凡そ共通のものと考えられている。チャネルとCl<sup>-</sup>/H<sup>+</sup>-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。 | |||
<br> | |||
=== カルシウム依存性塩素チャネル === | |||
==== Anoctamin/TMEM16ファミリー ==== | |||
[[Image:CaCC.JPG|thumb|right|245x249px|'''図2 カルシウム依存性塩素チャネルの一つAno1(TMEM16A)チャネルの構造'''<br>細胞質側にN末端とC末端を持ち、8回膜貫通領域から成る構造が示唆されている。(<ref name=ref8 />より転載)。]] Ano1/TMEM16Aについては、近年二量体を形成していることが示され、アミノ酸疎水性度の解析から、各サブユニットは8回膜貫通領域を持ち、細胞質側に大きなN末端とC末端から成る構造物を持つことが示唆されている(図2)。ポア領域やCa<sup>2+</sup>結合部位及び電位センサー部位は未だ同定されていないが、他のCa<sup>2+</sup>依存性・電位依存性イオンチャネルでよく知られる構造との類似性は認められていない。<br> | |||
==== Bestrophinファミリー ==== | |||
Bestrophinチャネルも少なくとも二量体以上の多量体を形成し、各サブユニットは少なくとも4つの膜貫通領域を持つことが示唆されている。各サブユニットのC末端側に、酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるCa<sup>2+</sup>結合部位がある。Ca<sup>2+</sup>結合後にN末端とC末端領域の相互作用が起こり活性化することが、ヒトBest1で示されている。<br> | |||
<br> | |||
=== 細胞容積感受性塩素チャネル === | |||
細胞容積感受性塩素チャネルとして代表的なVSORやマキシアニオンチャネルの分子実体は未だ明らかになっていないが、様々な大きさのポリエチレングリコールポリマーによるチャネル電流の抑制程度の検討から、それぞれのポアの内径が約0.6 nm、1.3 nmと推定されている<ref name="ref6" /><ref name="ref9"><pubmed>15498575</pubmed></ref>。このことはVSORがグルタミン酸(分子径~0.35 nm)透過性を持つこと、マキシアニオンチャネルがATP(~0.65 nm)透過性を持つことと合致する。 | |||
<br> | |||
=== CFTR塩素チャネル === | |||
[[Image:CFTR.gif|thumb|right|620px|'''図3 CFTRチャネル'''<br>リン酸化領域(R domain)により結ばれた2つの膜貫通領域(MSD)とATP結合領域(NBD)のペアが向かい合ってチャネルが形成される(<ref name=ref8 />より転載)。]] CFTRチャネルは12個の膜貫通部位を持ち、そのうちの6個ずつが1組で1つの膜貫通領域(membrane-spanning (transmembrane) domain; MSD (TMD))を構成し、それぞれのMSDについて細胞質側に1つのATP結合領域(nucleotide-binding domain; NBD)が連結する。さらに、PKA によるリン酸化を受ける調節領域(Rドメイン)が2つのMSD-NBDペアを連結し、それらのペアが向かい合わせの配向を取ることにより、チャネルが形成されると考えられている(図3)。Rドメインがリン酸化を受けた状態でNBDにATPが結合すると、NBDの二量体化に伴ってチャネルゲートが開き、その後ATPの加水分解によりNBD二量体が解離し、チャネルゲートが閉じると考えられている<ref name="ref10"><pubmed>23284076</pubmed></ref>。 <br> | |||
<br> | |||
== 発現 == | |||
=== ClC塩素チャネル === | |||
ClC-2は神経系では広く神経・グリアともに、また胎生期・生後ともに<ref name="ref11"><pubmed>9693808</pubmed></ref>、その発現が認められる。ClC-3・-4・-6・-7も神経系に広く発現しているが、そのほとんどが細胞内小胞膜上(エンドソーム・リソソーム等、ClC-3は一部のシナプス小胞にも)に分布している。 | |||
<br> | |||
=== カルシウム依存性塩素チャネル === | |||
Ano1/TMEM16Aは神経系では主に末梢神経系(後根神経節や交感神経節細胞)に強い発現が認められる。Ano2/TMEM16Bは特に網膜や嗅神経で多く、脳内では大脳皮質・中脳・脳幹部に或る程度の発現が報告されている。<br> BestrophinファミリーのBest1は広く神経・グリア双方で発現が報告されており、Best2は特に嗅神経での発現が認められている。Best3・Best4は神経系でのタンパク質レベルでの発現は未だ確認されていないが、mRNAは脳内の神経・グリア双方で或る程度の発現が確認されている。 | |||
<br> | |||
=== 細胞容積感受性塩素チャネル === | |||
責任分子が未同定であるVSORやマキシアニオンチャネルについて、その発現をmRNAやタンパク質の検出により確認することは現時点では不能だが、機能的には細胞に低浸透圧負荷を与えて膨張させることにより、少なくともVSORについては、その活性は神経・グリア双方で確実に観測される<ref name="ref5" />。マキシアニオンチャネルについても、神経・グリア双方でその活性は報告されているが、低浸透圧負荷の場合はVSOR活性の方が圧倒的に優勢なため、明瞭な観測には予めVSOR活性化を阻害剤で抑制しておく必要がある<ref name="ref6" />。 | |||
<br> | |||
=== CFTR塩素チャネル === | |||
神経系での発現は上皮細胞に比して少ないが、脳内の広範な部位の神経細胞、但し細胞膜上よりもむしろ細胞質内に多くチャネルの発現が認められるとの報告がある<ref name="ref12"><pubmed>19654104</pubmed></ref>。一方、グリアではあまり発現は認められていない。 | |||
<br> | |||
== 機能 == | |||
=== ClC塩素チャネル === | |||
==== ClC-2 ==== | |||
ClC-2は膜電位の過分極や細胞外pHの減少等で活性化される内向き整流性塩素チャネルである。多くの成熟した神経細胞のように細胞内Cl<sup>–</sup>濃度が低い(<10 mM)場合は、抑制性シナプス入力等で誘起される膜電位過分極の維持を通じて、神経細胞の興奮性の抑制に寄与しうる。また、ClC-2 KOマウスでは中枢神経系の白質変性(髄鞘内に多数の液胞形成)が起こることが報告されており、そのことからClC-2チャネルが、他のK<sup>+</sup>チャネルとともに、細胞間隙中の細胞外イオン濃度の恒常性維持に関わっている可能性が示唆されている<ref name="ref1" />。ClC-2は細胞膨張により活性化しうることも知られているが、その後の細胞容積の復元への役割は、同時に活性化されるVSORに比して小さいことがClC-2 KOマウスで示されている。(なお、かつてヒトClC-2の遺伝子(CLCN-2)異常は特発性全般性てんかんの原因となりうることが報告されたが、そのClC-2変異体の機能解析の結果、現在その報告に対しては否定的な見解が占める。) | |||
==== ClC-3・-4・-6・-7 ==== | |||
ClC-4についてはCl<sup>−</sup>/H<sup>+</sup>交換輸送の機能を有することが発現系にて確認されている。その他のClC-3・-6・-7については未だ交換輸送の機能は確定していないが、いずれも主に細胞内小胞膜上に分布していること、そして結晶構造の解かれているバクテリアのClCタンパク質がCl<sup>−</sup>/H<sup>+</sup>交換輸送体であり、その機能に特徴的なアミノ酸配列をClC-3・-4・-6・-7のいずれもが共通に持つことから、いずれもCl<sup>−</sup>/H<sup>+</sup>交換輸送の機能を有すると考えられている。交換輸送の割合はCl<sup>−</sup> : H<sup>+</sup> = 2 : 1と考えられ、小胞内の酸性化促進(小胞性H<sup>+</sup>ポンプの駆動により生ずる電荷移動のCl<sup>−</sup>による中和を通じて)に寄与すると考えられている。ClC-3と-4については、過剰発現により一部細胞膜に発現した際の電流が観測されており、急峻な外向き整流性(高い脱分極でのみ活性化)が確認されている。ClC-3 KOマウスでは網膜と海馬の変性・脱失、ClC-7 KOマウスでも網膜変性やリソソーム蓄積による神経変性が認められることが報告されているが、それぞれのClCの機能との連関は明らかになっていない。 | |||
<br> | |||
=== カルシウム依存性塩素チャネル === | |||
Ano1/TMEM16Aが発現する後根神経節細胞は細胞内Cl<sup>–</sup>濃度が高く(>30 mM)、古くからCaCC活性化による活動電位の後脱分極相の形成が知られている。即ち、この神経でのAno1/TMEM16Aの活性化は膜興奮性を高め、それが例えば発痛物質ブラジキニンの作用後の細胞内Ca<sup>2+</sup>濃度上昇に伴う痛覚神経の発火頻度上昇に関わることが知られている<ref name="ref13"><pubmed>20335661</pubmed></ref>。また、嗅神経の嗅毛では、におい物質のGタンパク質共役型受容体への結合により、cAMP依存性陽イオンチャネルとともにAno2/TMEM16Bが活性化され、ともに脱分極性の電流をもたらすことで嗅神経の発火を誘起することが知られている。但し、Ano2/TMEM16B KOマウスでそのCaCC成分が消失しても、嗅覚自体にはそれほど強い影響を与えないことも報告されている<ref name="ref14"><pubmed>21516098</pubmed></ref>。一方、細胞内Cl<sup>–</sup>濃度が低い(<10 mM)多くの成熟神経細胞では、CaCC活性は膜興奮性を抑制する。例えば海馬の錐体細胞では、活動電位中のCa<sup>2+</sup>流入により活性化されたAno2/TMEM16Bによる活動電位の再分極の促進や、興奮性シナプス入力時のCa<sup>2+</sup>流入により活性化されたAno2/TMEM16Bによるシナプス後電位の抑制が認められている<ref name="ref15"><pubmed>22500639</pubmed></ref>。 <br> Best1については、近年アストログリアの主なCaCCであると報告されると同時に、同チャネルを通じてグルタミン酸やGABAがアストログリアから周囲に放出されることにより、シナプス機能や神経興奮性の調節が行われるとの報告がなされた<ref name="ref16"><pubmed>20929730</pubmed></ref><ref name="ref17"><pubmed>23021213</pubmed></ref>。Best2はかつて嗅神経でのCaCC候補の1つであったが、Best2 KOマウスとWTマウスでCaCCに大きな相違が認められず、後に嗅神経でのCaCCは上記のようにAno2/TMEM16Bによることが確定している。Best3・Best4の神経系での機能は未だ調べられていない。BestrophinチャネルはHCO3<sup>–</sup>に対する透過性が高く、またL型電位依存性Ca<sup>2+</sup>チャネルとの相互作用を介してCa<sup>2+</sup>流入量も変化させうることから、細胞内Ca<sup>2+</sup>動態やpHの恒常性維持にも寄与している可能性が示唆されている<ref name="ref3" /><ref name="ref4" />。 | |||
<br> | |||
=== 細胞容積感受性塩素チャネル === | |||
細胞膨張時の細胞容積感受性塩素チャネル活性化の主たる役割は、細胞内Cl<sup>–</sup>の流出を促して細胞内浸透圧を減少させることにより、細胞容積を元の大きさに戻すこと(調節性容積減少; regulatory volume decrease; RVD)である。但し、その達成にはK<sup>+</sup>流出も同時に起こって電気的中性が保たれることで、持続的な正味の溶質(KCl)の流出が起こる必要がある。生理的範囲の神経活動においても、高頻度神経発火中は神経細胞内に向かって正味NaClの流入が起こり、また活動電位の再分極中に神経から放出されたK<sup>+</sup>がCl<sup>–</sup>とともに隣接するアストログリアに流入することで、双方の細胞とも膨張しうるが、細胞容積感受性塩素チャネルはそれらの膨張の緩和及び容積の復旧に関わると考えられる。<br> VSORは細胞膨張時のみならず、種々の受容体刺激を通じて細胞膨張を伴わずに活性化されうることが知られている。その場合は同様に細胞内溶質が流出することにより、細胞容積の縮小が誘起される。この機序はアポトーシスの必要条件となっていることが知られている<ref name="ref5" />。また、近年この受容体刺激を介するVSOR活性化は、1細胞上で局所的に誘導されうることが判明し<ref name="ref18"><pubmed>21690189</pubmed></ref>、VSOR活性化が局所的な容積調節を伴う細胞の形態変化や移動を駆動する役割を持つことも示唆されている。<br> また、VSORはグルタミン酸、マキシアニオンチャネルはグルタミン酸及びATPに対する透過性を持つことから、これらは細胞間情報伝達にも寄与しうることが知られている<ref name="ref5" /><ref name="ref6" />。 | |||
<br> | |||
=== CFTR塩素チャネル === | |||
嚢胞性線維症では神経系の異常はあまり目立たないか、副次的ないし非特異的と考えられる場合が多いこともあり、CFTRチャネルの神経系における機能や、チャネル異常により誘起されうる病態等については、未だよく分かっていない。 | |||
<br> | |||
{| border="1" | {| width="50%" border="1" cellpadding="1" cellspacing="1" | ||
|- | |- | ||
! scope="col" | | ! scope="col" | | ||
! scope="col" | シングルチャネルコンダクタンス(pS) | ! scope="col" | シングルチャネルコンダクタンス(pS) | ||
! scope="col" | イオン透過性 | ! scope="col" | イオン透過性 | ||
! scope="col" | | ! scope="col" | 遮断薬(阻害剤) | ||
|- | |- | ||
! scope="row" | ClC-2 | |||
| style="text-align: center | | style="text-align:center" | ~3 | ||
| style="text-align: center | | style="text-align:center" | Cl<sup>–</sup> > Br<sup>–</sup> > I<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | Zn<sup>2+</sup>, Cd<sup>2+</sup>, NPPB, 9-AC, DPC | ||
|- | |- | ||
! scope="row" | ClC-3<br>ClC-4 | |||
| style="text-align: center | | style="text-align:center" | n.d. | ||
| style="text-align: center | | style="text-align:center" | Br<sup>–</sup> ≥ Cl<sup>–</sup> > I<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | n.d. | ||
|- | |- | ||
! scope="row" | ClC-6<br>ClC-7 | |||
| style="text-align: center | | style="text-align:center" | n.d. | ||
| style="text-align: center | | style="text-align:center" | n.d. | ||
| style="text-align: center | | style="text-align:center" | n.d. | ||
|- | |- | ||
! scope="row" | Ano1/TMEM16A<br>Ano2/TMEM16B | |||
| style="text-align: center | | style="text-align:center" | ~8 | ||
| style="text-align: center | | style="text-align:center" | I<sup>–</sup> > Br<sup>–</sup> > Cl<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | NFA, DIDS, SITS, NPPB, DPC | ||
|- | |- | ||
! scope="row" | Best1<br>Best2 | |||
| style="text-align: center | | style="text-align:center" | ~2 | ||
| style="text-align: center | | style="text-align:center" | I<sup>–</sup> > Br<sup>–</sup> > Cl<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | NFA, DIDS, NPPB | ||
|- | |- | ||
! scope="row" | VSOR | |||
| style="text-align: center | | style="text-align:center" | 50-80 (脱分極時)<br>10-20 (過分極時) | ||
| style="text-align: center | | style="text-align:center" | I<sup>–</sup> > Br<sup>–</sup> > Cl<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | DIDS, SITS, DNDS, NPPB, NFA, IAA-94, phloretin, DCPIB | ||
|- | |- | ||
! scope="row" | マキシアニオンチャネル | |||
| style="text-align: center | | style="text-align:center" | 300-400 | ||
| style="text-align: center | | style="text-align:center" | I<sup>–</sup> > Br<sup>–</sup> > Cl<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | Gd<sup>3+</sup>, DIDS, SITS, NPPB, アラキドン酸 | ||
|- | |- | ||
| | ! scope="row" | CFTR | ||
| style="text-align: center | | style="text-align:center" | 6-10 | ||
| style="text-align: center | | style="text-align:center" | Br<sup>–</sup> ≥ Cl<sup>–</sup> > I<sup>–</sup> | ||
| style="text-align: center | | style="text-align:center" | CFTR<sub>inh</sub>-172, グリベンクラミド, ロニダミン, DPC, NPPB | ||
|} | |} | ||
9-AC:anthracene-9-carboxylate<br> DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid<br> DIDS:4,4′-diisothiocyanatostilbene-2,2′-disulfonic acid<br> DNDS:4,4'-dinitrostilbene-2,2'-disulfonate<br> DPC:diphenylamine-2-carboxylate<br> IAA-94:indanyloxyacetic acid 94<br> n.d.:未定または検出できず(not determined or detected)<br> NFA:niflumic acid<br> NPPB:5-nitro-2-(3-phenylpropylamino)benzoic acid<br> SITS:4-acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid | 9-AC:anthracene-9-carboxylate<br>DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid<br>DIDS:4,4′-diisothiocyanatostilbene-2,2′-disulfonic acid<br>DNDS:4,4'-dinitrostilbene-2,2'-disulfonate<br>DPC:diphenylamine-2-carboxylate<br>IAA-94:indanyloxyacetic acid 94<br>n.d.:未定または検出できず(not determined or detected)<br>NFA:niflumic acid<br>NPPB:5-nitro-2-(3-phenylpropylamino)benzoic acid<br>SITS:4-acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid | ||
<br> | |||
== 関連項目 == | |||
*[[GABA受容体]] | |||
*[[イオンチャネル]] | |||
*[[活動電位]] | |||
*[[カルシウム]] | |||
*[[カルシウムチャネル]] | |||
*[[カリウムチャネル]] | |||
*[[グリシン]] | |||
*[[グルタミン酸]] | |||
*[[細胞死]] | |||
*[[細胞膜]] | |||
*[[静止膜電位]] | |||
*[[電位依存性チャネル]] | |||
*[[トランスポーター]] | |||
*[[ナトリウムチャネル]] | |||
<br> | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /><br> | ||
<br> | |||
(執筆者:秋田 天平、熊田 竜郎、福田 敦夫 担当編集委員:林 康紀) | |||
2013年3月6日 (水) 15:16時点における版
英: chloride channel
同義語: アニオンチャネル、クロライドチャネル、Cl−チャネル、塩素イオンチャネル
塩素チャネルとは、細胞膜に組み込まれたイオンチャネルの一種で、主に塩化物イオン(Cl−)を受動的に透過させる。ほとんどの塩素チャネルは、Cl−以外のI−・Br−・F−等の無機陰イオン(アニオン)にも透過性を示し、またNO3−・SCN−・HCO3−やグルタミン酸・アスパラギン酸等のアミノ酸アニオンにも透過性を示すものも多いことから、一般にアニオンチャネルとも呼ばれる。細胞膜電位・細胞内カルシウムイオン濃度・細胞容積の変化や、リガンドの結合あるいはcAMP依存性のリン酸化反応に応答して開口する塩素チャネルがある。神経系において最もよく知られる塩素チャネルは、神経細胞の興奮・抑制調節に関与するリガンド作動性塩素チャネル(GABAA受容体、GABAC受容体、グリシン受容体)であるが、このチャネルについては他項目(GABA受容体、グリシン受容体)を参照されたい。リガンド作動性以外の塩素チャネルについて、現在のところ特異的な阻害薬がほとんど無い。塩素チャネルは神経系を含むあらゆる種類の細胞に発現し、膜電位や細胞容積の調節、細胞の移動・増殖や細胞死(アポトーシス)、分泌などの細胞の基本機能に広く関与しており、チャネル異常による遺伝性疾患も数多く知られている。
種類
哺乳類の神経系に発現している塩素チャネルは以下の5つに大別される。
ClC塩素チャネル
塩素チャネルとして最初にシビレエイ(学名 Torpedo marmorata)の発電器官からクローニングされた遺伝子ファミリーに属するものである[1]。哺乳類では9種類知られており、そのうち神経系に発現が知られているのは主にClC-2・-3・-4・-6・-7である。ClC-2は主に形質膜に分布して電位感受性塩素チャネルとして機能し、その他のClC-3・-4・-6・-7は主に細胞内小胞膜に分布し、チャネルというよりは、むしろCl-/H+-交換輸送体として機能すると考えられている。
カルシウム依存性塩素チャネル(calcium-activated chloride channel; CaCC)
細胞内Ca2+濃度の上昇に応じて活性化される塩素チャネルである。古くから神経系の細胞を含む、様々な細胞種で確認されていた最も典型的なCaCCの主な責任分子が、近年Anoctamin/TMEM16ファミリーのAno1/TMEM16A及びAno2/TMEM16Bであることが確定した[2][3]。また、卵黄状黄斑ジストロフィ(ベスト病)の原因遺伝子として主に網膜色素上皮に発現し、神経系全般にも或る程度の発現が認められているBestrophinファミリー(Best1-4)もCaCC活性を持つことが知られている[4]。(なお、かつてCaCCの候補として挙げられていたCLCA及びTTYHファミリーのCaCCとしての機能については、現在否定的な見解が占める。)
細胞容積感受性塩素チャネル (volume-regulated chloride channel)
典型的には細胞容積の増大に伴い開口する塩素チャネルである。神経系の細胞を含む、あらゆる細胞種で容積増大により最も多く活性化されるのが、細胞容積感受性外向整流性アニオンチャネル(volume-sensitive outwardly rectifying anion channel; VSOR)と呼ばれるものであるが、その分子実体はまだ解明されていない[5]。その他、マキシアニオンチャネル(maxi-anion channel)[6]と呼ばれるものや、上述のClC-2・Best1も容積感受性があることが知られている。
CFTR(cystic fibrosis transmembrane conductance regulator)塩素チャネル
嚢胞性線維症(cystic fibrosis)の原因遺伝子として同定されたCFTRは、神経系でも或る程度の発現が報告されている。cAMP依存性リン酸化酵素(PKA)によるリン酸化を通じて活性化される塩素チャネルである[7]。
リガンド作動性塩素チャネル
他項目(GABA受容体、グリシン受容体)を参照。
構造
ClC塩素チャネル
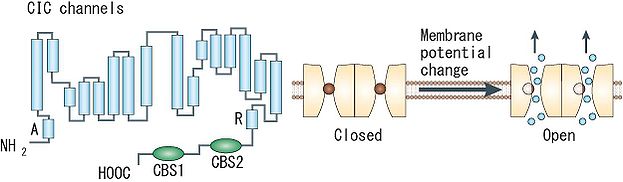
1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ([8]より転載)。
ClCチャネルは、1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった(図1)。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質で凡そ共通のものと考えられている。チャネルとCl-/H+-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。
カルシウム依存性塩素チャネル
Anoctamin/TMEM16ファミリー
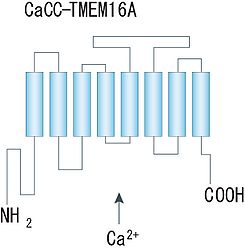
細胞質側にN末端とC末端を持ち、8回膜貫通領域から成る構造が示唆されている。([8]より転載)。
Ano1/TMEM16Aについては、近年二量体を形成していることが示され、アミノ酸疎水性度の解析から、各サブユニットは8回膜貫通領域を持ち、細胞質側に大きなN末端とC末端から成る構造物を持つことが示唆されている(図2)。ポア領域やCa2+結合部位及び電位センサー部位は未だ同定されていないが、他のCa2+依存性・電位依存性イオンチャネルでよく知られる構造との類似性は認められていない。
Bestrophinファミリー
Bestrophinチャネルも少なくとも二量体以上の多量体を形成し、各サブユニットは少なくとも4つの膜貫通領域を持つことが示唆されている。各サブユニットのC末端側に、酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるCa2+結合部位がある。Ca2+結合後にN末端とC末端領域の相互作用が起こり活性化することが、ヒトBest1で示されている。
細胞容積感受性塩素チャネル
細胞容積感受性塩素チャネルとして代表的なVSORやマキシアニオンチャネルの分子実体は未だ明らかになっていないが、様々な大きさのポリエチレングリコールポリマーによるチャネル電流の抑制程度の検討から、それぞれのポアの内径が約0.6 nm、1.3 nmと推定されている[6][9]。このことはVSORがグルタミン酸(分子径~0.35 nm)透過性を持つこと、マキシアニオンチャネルがATP(~0.65 nm)透過性を持つことと合致する。
CFTR塩素チャネル
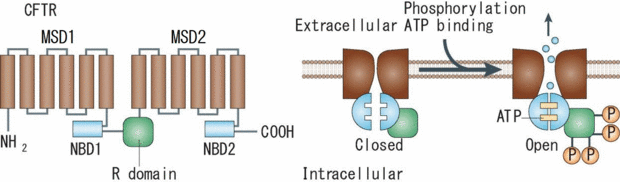
リン酸化領域(R domain)により結ばれた2つの膜貫通領域(MSD)とATP結合領域(NBD)のペアが向かい合ってチャネルが形成される([8]より転載)。
CFTRチャネルは12個の膜貫通部位を持ち、そのうちの6個ずつが1組で1つの膜貫通領域(membrane-spanning (transmembrane) domain; MSD (TMD))を構成し、それぞれのMSDについて細胞質側に1つのATP結合領域(nucleotide-binding domain; NBD)が連結する。さらに、PKA によるリン酸化を受ける調節領域(Rドメイン)が2つのMSD-NBDペアを連結し、それらのペアが向かい合わせの配向を取ることにより、チャネルが形成されると考えられている(図3)。Rドメインがリン酸化を受けた状態でNBDにATPが結合すると、NBDの二量体化に伴ってチャネルゲートが開き、その後ATPの加水分解によりNBD二量体が解離し、チャネルゲートが閉じると考えられている[10]。
発現
ClC塩素チャネル
ClC-2は神経系では広く神経・グリアともに、また胎生期・生後ともに[11]、その発現が認められる。ClC-3・-4・-6・-7も神経系に広く発現しているが、そのほとんどが細胞内小胞膜上(エンドソーム・リソソーム等、ClC-3は一部のシナプス小胞にも)に分布している。
カルシウム依存性塩素チャネル
Ano1/TMEM16Aは神経系では主に末梢神経系(後根神経節や交感神経節細胞)に強い発現が認められる。Ano2/TMEM16Bは特に網膜や嗅神経で多く、脳内では大脳皮質・中脳・脳幹部に或る程度の発現が報告されている。
BestrophinファミリーのBest1は広く神経・グリア双方で発現が報告されており、Best2は特に嗅神経での発現が認められている。Best3・Best4は神経系でのタンパク質レベルでの発現は未だ確認されていないが、mRNAは脳内の神経・グリア双方で或る程度の発現が確認されている。
細胞容積感受性塩素チャネル
責任分子が未同定であるVSORやマキシアニオンチャネルについて、その発現をmRNAやタンパク質の検出により確認することは現時点では不能だが、機能的には細胞に低浸透圧負荷を与えて膨張させることにより、少なくともVSORについては、その活性は神経・グリア双方で確実に観測される[5]。マキシアニオンチャネルについても、神経・グリア双方でその活性は報告されているが、低浸透圧負荷の場合はVSOR活性の方が圧倒的に優勢なため、明瞭な観測には予めVSOR活性化を阻害剤で抑制しておく必要がある[6]。
CFTR塩素チャネル
神経系での発現は上皮細胞に比して少ないが、脳内の広範な部位の神経細胞、但し細胞膜上よりもむしろ細胞質内に多くチャネルの発現が認められるとの報告がある[12]。一方、グリアではあまり発現は認められていない。
機能
ClC塩素チャネル
ClC-2
ClC-2は膜電位の過分極や細胞外pHの減少等で活性化される内向き整流性塩素チャネルである。多くの成熟した神経細胞のように細胞内Cl–濃度が低い(<10 mM)場合は、抑制性シナプス入力等で誘起される膜電位過分極の維持を通じて、神経細胞の興奮性の抑制に寄与しうる。また、ClC-2 KOマウスでは中枢神経系の白質変性(髄鞘内に多数の液胞形成)が起こることが報告されており、そのことからClC-2チャネルが、他のK+チャネルとともに、細胞間隙中の細胞外イオン濃度の恒常性維持に関わっている可能性が示唆されている[1]。ClC-2は細胞膨張により活性化しうることも知られているが、その後の細胞容積の復元への役割は、同時に活性化されるVSORに比して小さいことがClC-2 KOマウスで示されている。(なお、かつてヒトClC-2の遺伝子(CLCN-2)異常は特発性全般性てんかんの原因となりうることが報告されたが、そのClC-2変異体の機能解析の結果、現在その報告に対しては否定的な見解が占める。)
ClC-3・-4・-6・-7
ClC-4についてはCl−/H+交換輸送の機能を有することが発現系にて確認されている。その他のClC-3・-6・-7については未だ交換輸送の機能は確定していないが、いずれも主に細胞内小胞膜上に分布していること、そして結晶構造の解かれているバクテリアのClCタンパク質がCl−/H+交換輸送体であり、その機能に特徴的なアミノ酸配列をClC-3・-4・-6・-7のいずれもが共通に持つことから、いずれもCl−/H+交換輸送の機能を有すると考えられている。交換輸送の割合はCl− : H+ = 2 : 1と考えられ、小胞内の酸性化促進(小胞性H+ポンプの駆動により生ずる電荷移動のCl−による中和を通じて)に寄与すると考えられている。ClC-3と-4については、過剰発現により一部細胞膜に発現した際の電流が観測されており、急峻な外向き整流性(高い脱分極でのみ活性化)が確認されている。ClC-3 KOマウスでは網膜と海馬の変性・脱失、ClC-7 KOマウスでも網膜変性やリソソーム蓄積による神経変性が認められることが報告されているが、それぞれのClCの機能との連関は明らかになっていない。
カルシウム依存性塩素チャネル
Ano1/TMEM16Aが発現する後根神経節細胞は細胞内Cl–濃度が高く(>30 mM)、古くからCaCC活性化による活動電位の後脱分極相の形成が知られている。即ち、この神経でのAno1/TMEM16Aの活性化は膜興奮性を高め、それが例えば発痛物質ブラジキニンの作用後の細胞内Ca2+濃度上昇に伴う痛覚神経の発火頻度上昇に関わることが知られている[13]。また、嗅神経の嗅毛では、におい物質のGタンパク質共役型受容体への結合により、cAMP依存性陽イオンチャネルとともにAno2/TMEM16Bが活性化され、ともに脱分極性の電流をもたらすことで嗅神経の発火を誘起することが知られている。但し、Ano2/TMEM16B KOマウスでそのCaCC成分が消失しても、嗅覚自体にはそれほど強い影響を与えないことも報告されている[14]。一方、細胞内Cl–濃度が低い(<10 mM)多くの成熟神経細胞では、CaCC活性は膜興奮性を抑制する。例えば海馬の錐体細胞では、活動電位中のCa2+流入により活性化されたAno2/TMEM16Bによる活動電位の再分極の促進や、興奮性シナプス入力時のCa2+流入により活性化されたAno2/TMEM16Bによるシナプス後電位の抑制が認められている[15]。
Best1については、近年アストログリアの主なCaCCであると報告されると同時に、同チャネルを通じてグルタミン酸やGABAがアストログリアから周囲に放出されることにより、シナプス機能や神経興奮性の調節が行われるとの報告がなされた[16][17]。Best2はかつて嗅神経でのCaCC候補の1つであったが、Best2 KOマウスとWTマウスでCaCCに大きな相違が認められず、後に嗅神経でのCaCCは上記のようにAno2/TMEM16Bによることが確定している。Best3・Best4の神経系での機能は未だ調べられていない。BestrophinチャネルはHCO3–に対する透過性が高く、またL型電位依存性Ca2+チャネルとの相互作用を介してCa2+流入量も変化させうることから、細胞内Ca2+動態やpHの恒常性維持にも寄与している可能性が示唆されている[3][4]。
細胞容積感受性塩素チャネル
細胞膨張時の細胞容積感受性塩素チャネル活性化の主たる役割は、細胞内Cl–の流出を促して細胞内浸透圧を減少させることにより、細胞容積を元の大きさに戻すこと(調節性容積減少; regulatory volume decrease; RVD)である。但し、その達成にはK+流出も同時に起こって電気的中性が保たれることで、持続的な正味の溶質(KCl)の流出が起こる必要がある。生理的範囲の神経活動においても、高頻度神経発火中は神経細胞内に向かって正味NaClの流入が起こり、また活動電位の再分極中に神経から放出されたK+がCl–とともに隣接するアストログリアに流入することで、双方の細胞とも膨張しうるが、細胞容積感受性塩素チャネルはそれらの膨張の緩和及び容積の復旧に関わると考えられる。
VSORは細胞膨張時のみならず、種々の受容体刺激を通じて細胞膨張を伴わずに活性化されうることが知られている。その場合は同様に細胞内溶質が流出することにより、細胞容積の縮小が誘起される。この機序はアポトーシスの必要条件となっていることが知られている[5]。また、近年この受容体刺激を介するVSOR活性化は、1細胞上で局所的に誘導されうることが判明し[18]、VSOR活性化が局所的な容積調節を伴う細胞の形態変化や移動を駆動する役割を持つことも示唆されている。
また、VSORはグルタミン酸、マキシアニオンチャネルはグルタミン酸及びATPに対する透過性を持つことから、これらは細胞間情報伝達にも寄与しうることが知られている[5][6]。
CFTR塩素チャネル
嚢胞性線維症では神経系の異常はあまり目立たないか、副次的ないし非特異的と考えられる場合が多いこともあり、CFTRチャネルの神経系における機能や、チャネル異常により誘起されうる病態等については、未だよく分かっていない。
| シングルチャネルコンダクタンス(pS) | イオン透過性 | 遮断薬(阻害剤) | |
|---|---|---|---|
| ClC-2 | ~3 | Cl– > Br– > I– | Zn2+, Cd2+, NPPB, 9-AC, DPC |
| ClC-3 ClC-4 |
n.d. | Br– ≥ Cl– > I– | n.d. |
| ClC-6 ClC-7 |
n.d. | n.d. | n.d. |
| Ano1/TMEM16A Ano2/TMEM16B |
~8 | I– > Br– > Cl– | NFA, DIDS, SITS, NPPB, DPC |
| Best1 Best2 |
~2 | I– > Br– > Cl– | NFA, DIDS, NPPB |
| VSOR | 50-80 (脱分極時) 10-20 (過分極時) |
I– > Br– > Cl– | DIDS, SITS, DNDS, NPPB, NFA, IAA-94, phloretin, DCPIB |
| マキシアニオンチャネル | 300-400 | I– > Br– > Cl– | Gd3+, DIDS, SITS, NPPB, アラキドン酸 |
| CFTR | 6-10 | Br– ≥ Cl– > I– | CFTRinh-172, グリベンクラミド, ロニダミン, DPC, NPPB |
9-AC:anthracene-9-carboxylate
DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid
DIDS:4,4′-diisothiocyanatostilbene-2,2′-disulfonic acid
DNDS:4,4'-dinitrostilbene-2,2'-disulfonate
DPC:diphenylamine-2-carboxylate
IAA-94:indanyloxyacetic acid 94
n.d.:未定または検出できず(not determined or detected)
NFA:niflumic acid
NPPB:5-nitro-2-(3-phenylpropylamino)benzoic acid
SITS:4-acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid
関連項目
- GABA受容体
- イオンチャネル
- 活動電位
- カルシウム
- カルシウムチャネル
- カリウムチャネル
- グリシン
- グルタミン酸
- 細胞死
- 細胞膜
- 静止膜電位
- 電位依存性チャネル
- トランスポーター
- ナトリウムチャネル
参考文献
- ↑ 1.0 1.1
Jentsch, T.J. (2008).
CLC chloride channels and transporters: from genes to protein structure, pathology and physiology. Critical reviews in biochemistry and molecular biology, 43(1), 3-36. [PubMed:18307107] [WorldCat] [DOI] - ↑
Huang, F., Wong, X., & Jan, L.Y. (2012).
International Union of Basic and Clinical Pharmacology. LXXXV: calcium-activated chloride channels. Pharmacological reviews, 64(1), 1-15. [PubMed:22090471] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Duran, C., Thompson, C.H., Xiao, Q., & Hartzell, H.C. (2010).
Chloride channels: often enigmatic, rarely predictable. Annual review of physiology, 72, 95-121. [PubMed:19827947] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Hartzell, H.C., Qu, Z., Yu, K., Xiao, Q., & Chien, L.T. (2008).
Molecular physiology of bestrophins: multifunctional membrane proteins linked to best disease and other retinopathies. Physiological reviews, 88(2), 639-72. [PubMed:18391176] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3
Okada, Y., Sato, K., & Numata, T. (2009).
Pathophysiology and puzzles of the volume-sensitive outwardly rectifying anion channel. The Journal of physiology, 587(Pt 10), 2141-9. [PubMed:19171657] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Sabirov, R.Z., & Okada, Y. (2009).
The maxi-anion channel: a classical channel playing novel roles through an unidentified molecular entity. The journal of physiological sciences : JPS, 59(1), 3-21. [PubMed:19340557] [WorldCat] [DOI] - ↑
Riordan, J.R. (2008).
CFTR function and prospects for therapy. Annual review of biochemistry, 77, 701-26. [PubMed:18304008] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Verkman, A.S., & Galietta, L.J. (2009).
Chloride channels as drug targets. Nature reviews. Drug discovery, 8(2), 153-71. [PubMed:19153558] [PMC] [WorldCat] [DOI] - ↑
Ternovsky, V.I., Okada, Y., & Sabirov, R.Z. (2004).
Sizing the pore of the volume-sensitive anion channel by differential polymer partitioning. FEBS letters, 576(3), 433-6. [PubMed:15498575] [WorldCat] [DOI] - ↑
Hwang, T.C., & Kirk, K.L. (2013).
The CFTR ion channel: gating, regulation, and anion permeation. Cold Spring Harbor perspectives in medicine, 3(1), a009498. [PubMed:23284076] [PMC] [WorldCat] [DOI] - ↑
Clayton, G.H., Staley, K.J., Wilcox, C.L., Owens, G.C., & Smith, R.L. (1998).
Developmental expression of C1C-2 in the rat nervous system. Brain research. Developmental brain research, 108(1-2), 307-18. [PubMed:9693808] [WorldCat] [DOI] - ↑
Guo, Y., Su, M., McNutt, M.A., & Gu, J. (2009).
Expression and distribution of cystic fibrosis transmembrane conductance regulator in neurons of the human brain. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society, 57(12), 1113-20. [PubMed:19654104] [PMC] [WorldCat] [DOI] - ↑
Liu, B., Linley, J.E., Du, X., Zhang, X., Ooi, L., Zhang, H., & Gamper, N. (2010).
The acute nociceptive signals induced by bradykinin in rat sensory neurons are mediated by inhibition of M-type K+ channels and activation of Ca2+-activated Cl- channels. The Journal of clinical investigation, 120(4), 1240-52. [PubMed:20335661] [PMC] [WorldCat] [DOI] - ↑
Billig, G.M., Pál, B., Fidzinski, P., & Jentsch, T.J. (2011).
Ca2+-activated Cl− currents are dispensable for olfaction. Nature neuroscience, 14(6), 763-9. [PubMed:21516098] [WorldCat] [DOI] - ↑
Huang, W.C., Xiao, S., Huang, F., Harfe, B.D., Jan, Y.N., & Jan, L.Y. (2012).
Calcium-activated chloride channels (CaCCs) regulate action potential and synaptic response in hippocampal neurons. Neuron, 74(1), 179-92. [PubMed:22500639] [PMC] [WorldCat] [DOI] - ↑
Lee, S., Yoon, B.E., Berglund, K., Oh, S.J., Park, H., Shin, H.S., ..., & Lee, C.J. (2010).
Channel-mediated tonic GABA release from glia. Science (New York, N.Y.), 330(6005), 790-6. [PubMed:20929730] [WorldCat] [DOI] - ↑
Woo, D.H., Han, K.S., Shim, J.W., Yoon, B.E., Kim, E., Bae, J.Y., ..., & Lee, C.J. (2012).
TREK-1 and Best1 channels mediate fast and slow glutamate release in astrocytes upon GPCR activation. Cell, 151(1), 25-40. [PubMed:23021213] [WorldCat] [DOI] - ↑
Akita, T., & Okada, Y. (2011).
Regulation of bradykinin-induced activation of volume-sensitive outwardly rectifying anion channels by Ca2+ nanodomains in mouse astrocytes. The Journal of physiology, 589(Pt 16), 3909-27. [PubMed:21690189] [PMC] [WorldCat] [DOI]
(執筆者:秋田 天平、熊田 竜郎、福田 敦夫 担当編集委員:林 康紀)