「アミロイドーシス」の版間の差分
細編集の要約なし |
Taisuketomita (トーク | 投稿記録) 細編集の要約なし |
||
| (4人の利用者による、間の48版が非表示) | |||
| 1行目: | 1行目: | ||
アミロイドタンパク質 | |||
英:amyloid protein | |||
同義語:アミロイドペプチド、amyloid peptide | |||
アミロイドamyloidは[[wikipedia:ja:コンゴーレッド|コンゴーレッド]]染色でオレンジ色に染まり、[[wikipedia:ja:偏光顕微鏡|偏光顕微鏡]]で緑色偏光を呈し、[[wikipedia:ja:電子顕微鏡|電子顕微鏡]]観察下では7~15nmの繊維構造を呈する物質として定義される。多くの場合、前駆タンパクであるアミロイドタンパク質が折りたたみ障害を引き起こして重合し、[[wikipedia:ja:βシート|βシート]]構造に富む不溶性線維として蓄積・凝集している。 | |||
==アミロイドーシス== | |||
アミロイドが、組織間隙に沈着する疾患を[[wikipedia:ja:アミロイドーシス|アミロイドーシス]] amyloidosisと呼ぶ<ref><pubmed> 22664198 </pubmed></ref>。沈着部位や沈着量により臓器の機能不全が生じる。沈着するアミロイドタンパク質の種類や臓器によって特徴が見られ、特に大きく全身性アミロイドーシスと限局性アミロイドーシスに分類されている。 | |||
===全身性アミロイドーシス=== | ===全身性アミロイドーシス=== | ||
アミロイドタンパク質が血中に存在する場合は全身性アミロイドーシスとなる<ref><pubmed> 23451869 </pubmed></ref>。アミロイドタンパク質としては、モノクローナル免疫グロブリンのL鎖由来のアミロイドALやH鎖由来のアミロイドAH、血清アミロイドAの代謝産物であるアミロイドA、β2ミクログロブリン、トランスサイレチン、ゲルソリン、アポAIが知られている。いずれもアミロイドタンパク質の産生亢進、濃度上昇がアミロイドーシスを惹起していることが知られており、例えばアミロイドALでは免疫グロブリン産生細胞である形質細胞の過剰な増殖や腫瘍化がその原因である。また膠原病やリウマチなどが原因となり全身性慢性炎症を基礎疾患として血清アミロイドAの濃度上昇が継続し、全身性アミロイドーシスを惹起する。さらに腎障害及び血液透析によってβ2ミクログロブリンの排泄、除去が不全となり、10年以上の長期透析の結果アミロイド沈着を招くことが知られている。 | |||
遺伝子変異によって生じる全身性アミロイドーシスとして、家族性アミロイドニューロパチーFamilial amyloid polyneuropathy(FAP)が知られている<ref><pubmed> 22094129 </pubmed></ref>。FAPはトランスサイレチン、ゲルソリン、アポAI、血清アミロイドA遺伝子変異に連鎖し、これらのアミロイドタンパク質が神経節を含む神経系および他の臓器に沈着する。我が国を含めて、特にトランスサイレチン遺伝子変異によるFAPが最も多い<ref><pubmed> 11940682 </pubmed></ref>。通常トランスサイレチンは四量体を形成しているが、遺伝子変異によって生じるアミノ酸置換によって不安定な単量体へ解離しやすくなり、なんらかの機序で重合して線維化すると考えられている。体内のトランスサイレチンは主として肝臓で産生されるが、肝実質にアミロイドは沈着しない。このためFAP患者の肝臓を移植により正常肝に換えることでアミロイドタンパク質である変異トランスサイレチンの消失が期待され、移植後多くの症例でFAPの臨床進行が停止するか,遅延することが確認されている。また2013年には、トランスサイレチンの四量体の解離及び変性を抑制することでアミロイド形成を阻害し、末梢神経障害の進行を抑制するVyndaqel(一般名:[[wikipedia:en:Tafamidis|Tafamidis]])が承認された。 | |||
===限局性アミロイドーシス=== | |||
特定の臓器に限局して沈着を認める場合は限局性アミロイドーシスとなる。臓器に応じて分類され、脳アミロイドーシス<ref><pubmed> 22482447 </pubmed></ref>としては[[アルツハイマー病]]や脳血管アミロイドアンギオパチーで蓄積が見られるアミロイドβタンパク質(Aβ)の他、シスタチンCの遺伝子変異<ref><pubmed> 2900981 </pubmed></ref>がアイスランド型遺伝性アミロイド性脳出血で見出されている。また[[wikipedia:ja:プリオン|プリオンタンパク質]]の蓄積、沈着はクロイツフェルト・ヤコブ病やゲルストマン・ストロイスラー・シャインカー症候群などのプリオン病患者脳で報告されている。さらにBRI2遺伝子の変異によって生じるアミロイドペプチドABri、ADanはそれぞれBritish型、Danish型家族性認知症患者脳において蓄積している<ref><pubmed> 19072909 </pubmed></ref>。BRI2はその最C末端部がFurinによって切断され分泌されているが、終止コドン近傍の遺伝子変異により野生型よりも僅かに長いペプチドが分泌され、これらがアミロイドとして脳実質に蓄積する。 | |||
その他の限局性アミロイドーシスとしては、内分泌アミロイドーシスのアミロイドタンパク質としてはカルシトニン、アミリン、インスリン、心房ナトリウム利尿ペプチドが同定されており、主にこれらのホルモンを分泌する細胞由来の腫瘍内で蓄積・沈着が観察される。また皮膚アミロイドーシスとしてはケラチンが、限局性結節性アミロイドーシスはアミロイドALがアミロイドタンパク質として蓄積することが報告されている。 | |||
==アミロイドβタンパク質(Aβ)== | |||
アルツハイマー病患者脳において蓄積している脳血管アミロイドアンギオパチーや老人斑の生化学的解析から、その主要構成成分がAβであることが明らかとなった<ref><pubmed> 6375662 </pubmed></ref>。その後、cDNAクローニングによりAβは前駆タンパク質であるAmyloid-β precursor protein(APP)の部分断片であること、βセクレターゼおよびγセクレターゼによる連続した二段階切断によって切りだされ[[Image:TTfig1.PNG|thumb|'''図1 Aβ産生経路'''<br>APPはβ及びγセクレターゼによる切断を受ける。]]、細胞外へと分泌されることが示された<ref><pubmed> 20139999 </pubmed></ref>。一方APPにはαセクレターゼおよびγセクレターゼによって切断される代謝経路も存在し、この場合はAβが産生されないため、アルツハイマー病発症に対して予防的な経路と考えられる。 | |||
== | |||
Aβの特徴はその凝集性の高さであり、緩衝液中に高濃度で存在するだけで凝集してアミロイド線維を形成する。人工合成ペプチドを用いた解析から、その線維形成過程は主にAβの一次配列とアミノ酸長に依存することが示されている。特に産生時のγセクレターゼによる切断部位の多様性によって生じる最C末端長の違い<ref><pubmed> 8191290 </pubmed></ref>が、生理的条件下で生じうるAβの凝集性を変化させる要因である<ref><pubmed> 8490014 </pubmed></ref>。また産生後に生じる最N末端の部分分解とピログルタミル化<ref><pubmed> 7857653 </pubmed></ref>も非常に疎水性が上がるため重要であると考えられている。そのためアルツハイマー病患者脳に老人斑として蓄積している最も主要なAβは、3番目のグルタミン酸がピログルタミル化し、最C末端が42番目のアラニンで終わっている<ref><pubmed> 8043280 </pubmed></ref>分子種であると想定されている。さらに興味深いことに家族性アルツハイマー病(FAD)に連鎖する遺伝子変異([http://www.molgen.ua.ac.be/ADMutations/ Alzheimer Disease & Frontotemporal Dementia Mutation Database])の多くはこのAβの産生量[[Image:TTfig2.PNG|thumb|'''図2 Aβ産生量を変化させる遺伝子変異'''<br>β及びγセクレターゼによる切断に影響を与える遺伝子変異。]]もしくは凝集性を高める[[Image:TTfig3.PNG|thumb|'''図3 Aβの凝集性を変化させる遺伝子変異'''<br>Aβ配列内部の変異は凝集性に影響を与える。]]性質を示しており、アルツハイマー病におけるアミロイドカスケード仮説の強い根拠となっている。 | |||
そのためAβを標的とした抗アルツハイマー病戦略は根治療法として期待され、特にセクレターゼ活性制御によるAβ産生メカニズムの抑制、Aβ凝集阻害によるアミロイド形成抑制、そしてAβ除去を促進するアミロイド沈着の抑制を主たる薬効とする治療薬開発が推進されてきた。この中でセクレターゼ活性制御のうちγセクレターゼ阻害薬[[wikipedia:en:Semagacestrat|Semagacestat]]の治験は副作用を生じて開発が中止されたが、現在ではβセクレターゼ阻害薬の治験が精力的に進められている。Aβ凝集阻害については[[wikipedia:en: scyllo-Inositol|scyllo-Inositol]]を用いた治験が行われたが、やはり副作用のため開発中止となった。Aβ除去を目的としたストラテジーについては、特に能動免疫を利用した抗体による治療薬開発が進められている。 | |||
===総Aβ産生量を変化させる遺伝子変異=== | |||
βセクレターゼ活性はBACE1と呼ばれる膜結合型アスパラギン酸プロテアーゼによって担われており、その切断が総Aβ産生量を規定している。βセクレターゼ切断部位近傍に存在するSwedish変異(KM670/671NL)、Italian変異(A673V(Aβ配列としてA2V))は、APPのBACE1に対する親和性を高め、総Aβ産生量を上昇させる。またβセクレターゼの切断部位にはAβ配列内にもう一つ存在し、β’切断部位と呼称されている。この切断はN末端が短いAβ産生につながるが、β’切断部位の変異であるLeuven変異(E682K(Aβ配列としてE11K))がβ’切断を抑制し、結果的に総Aβ産生量を増加させる効果を持つ。一方ごく最近、アイスランド国民の全ゲノムシーケンシング解析からアルツハイマー病および老化に伴う認知機能低下に対して予防的に作用するrare variantとしてAβ産生を40%低下させるIcelandic変異(A673T(Aβ配列としてA2T))が同定された<ref><pubmed> 22801501 </pubmed></ref>。この変異はβセクレターゼによる切断効率を低下させることが示されている。 | |||
これまでにBACE1遺伝子変異は報告されていないが、アルツハイマー病患者脳や脳脊髄液中でBACE1タンパク質<ref><pubmed> 12514700 </pubmed></ref>や活性<ref><pubmed> 12223024 </pubmed></ref><ref><pubmed> 14978286 </pubmed></ref>の上昇が報告されている。すなわち、老化に伴うBACE1活性の変動が孤発性アルツハイマー病発症機序に影響を与えている可能性が示唆されている。また最近になり、神経細胞における主たるαセクレターゼであるADAM10の機能欠失型変異が見出され、非Aβ産生経路の抑制がアルツハイマー病を惹起することも示された<ref><pubmed> 24055016 </pubmed></ref>。 | |||
=== | ===凝集性の高いAβ42の産生比率を変化させる遺伝子変異=== | ||
APP配列内のAβ配列近傍に存在するFAD変異は、Aβそのものに影響を与えないが、その産生量を変化させる。AβのC末側に存在するIranian変異(T714A)、Austrian変異(T714I)、German変異(V715A)、French変異(V715M)、Florida変異(I716V)、Iberian変異(I716F)、London変異(V717Iの他、L、F、G)、Australian変異(L723P)、Belgian変異(K724N)などは、γセクレターゼによる切断を変化させ、特に凝集性の高いAβ42産生比率を上昇させる。またFlemish変異(A692G(Aβ配列としてA21G))はAβ産生量を増大させる。これはA21を含む領域がAPPに存在するγセクレターゼ活性を抑制するドメインであり、Flemish変異はその抑制効果を低下させるため、Aβ産生量を増加させると考えられている<ref><pubmed> 20062056 </pubmed></ref>。 | |||
一方で、ほとんどのFADはPresenilin 1もしくは2遺伝子上の点突然変異に連鎖する。Presenlinはγセクレターゼの活性中心サブユニットであり、ニカストリン、Aph-1、Pen-2と膜タンパク複合体として機能する<ref><pubmed> 12660785 </pubmed></ref>。その遺伝子変異はほぼおしなべてAβ42産生比率を上昇させる。γセクレターゼは特殊な切断様式をとる膜内配列切断プロテアーゼ<ref><pubmed> 23585568 </pubmed></ref>でありその変異がどのような影響を及ぼしているかは未だ定かではないが、何れにせよいずれの変異もγセクレターゼによる切断様式を変化させ、Aβ42の産生量を特異的に増加させることでAD発症過程を促進していると考えられている。 | |||
===Aβの凝集性を変化させる遺伝子変異=== | |||
Aβ配列内にも多くのFAD変異が存在し、多くの場合はAβの凝集性に大きな影響を与える。Aβ配列のN末端側にある変異は、British変異(H677R(Aβ配列としてH6R))、Tottori変異(D678N(Aβ配列としてD7N))そしてItalian変異(A673V(Aβ配列としてA2V))である。British変異およびTottori変異は、いずれもAβアミロイド線維形成を亢進させる<ref><pubmed> 17170111 </pubmed></ref>。Italian変異については、βセクレターゼによる切断を亢進させると同時に凝集性を高める<ref><pubmed> 19286555 </pubmed></ref>。 | |||
一方、Aβ配列の中央部に位置する変異としては、Arctic変異(E693G(Aβ配列としてE22G))、Osaka変異(ΔE693(Aβ配列としてΔE22))、Iowa変異(D694N(Aβ配列としてD23N))が存在する。Dutch変異(E693Q(Aβ配列としてE22Q))はオランダ型遺伝性アミロイド性脳出血に連鎖する変異として発見された。Dutch変異、Arctic変異ともに<i>in vitro</i>でアミロイド線維形成能が高いこと<ref><pubmed> 12944403 </pubmed></ref>が示されている。加えて、Arctic変異はAβ線維形成過程の中間段階で生じるプロトフィブリルの形成を亢進・安定化することが観察されている<ref><pubmed> 11528419 </pubmed></ref>。Osaka変異は、2008年に本邦より報告された比較的新しい変異である。興味深いことに、この変異をもつAβはアミロイド線維を形成せずオリゴマーの形で留まり、シナプス毒性を示す<ref><pubmed> 18300294 </pubmed></ref>。 | |||
==アミロイドの構造と線維形成過程== | |||
各アミロイドタンパク質には一定の共通したアミノ酸配列や構造は見られないが、アミロイド線維になると共通してクロスβ構造[[Image:TTfig4.PNG|thumb|'''図4 クロスβ構造'''<br>トランスサイレチン部分ペプチドからなるクロスβ構造。PDB ID: 2M5N]]と呼ばれる形態をとっている<ref><pubmed> 17468747 </pubmed></ref><ref><pubmed> 21456964 </pubmed></ref><ref><pubmed> 23513222 </pubmed></ref>。これはアミロイド線維を構成するポリペプチド鎖が線維軸と垂直方向にβストランドとなり、かつ線維軸方向にβシート構造をとっているものである。このような構造学的特徴はイメージング技術に応用されつつあり、Aβアミロイドに特異的に結合する低分子化合物を利用したアミロイドPETスキャンが可能となった<ref><pubmed> 14991808 </pubmed></ref><ref><pubmed> 21245183 </pubmed></ref>。 | |||
アミロイド線維形成過程では、多くの場合正常なフォールディングをうけているアミロイドタンパク質が何らかの理由で一旦部分変性し、会合することが必要である。また線維形成過程はその鋳型となるシード(種、核)の形成を契機として急速に進んでいくことが示されている<ref><pubmed> 22885025 </pubmed></ref>。すなわち、このシードの両端の末端にアミロイドタンパク質が結合して線維が伸長していくと考えられている。このようなシード依存性伸長反応モデルは、プリオンタンパク質が示す伝播能力とも関連していると考えられている。すなわち、一旦異常構造をとったタンパク質がシードとなり、別の個体におけるアミロイドタンパク質の構造及び性質を変化させていくというモデルである<ref><pubmed> 8513491 </pubmed></ref>。またプリオンの感染性にはごく僅かなアミノ酸の違いに起因する「種の壁」が存在するが、この現象もシードの構造の違いによって説明できる。また最近ではAβなどアミロイドを形成しうるアミロイドタンパク質がいずれもプリオン様の伝播能力を示す可能性が推測されている<ref><pubmed> 22660329 </pubmed></ref><ref><pubmed> 24005412 </pubmed></ref>。実際、酵母などにおいてはプリオン様タンパク性因子による形質転換が報告されており、タンパク質の構造に依存した形質の伝播様式として注目されている<ref><pubmed> 23379365 </pubmed></ref>。一方最近、アルツハイマー病患者脳から得られたAβ線維の構造解析[[Image:TTfig5.PNG|thumb|'''図5 アルツハイマー病患者脳由来のAβ線維構造'''<br>患者脳由来アミロイドから伸長したAβの分子構造。PDB ID: 2M4J]]がなされ、<i>in vitro</i>で凝集させた構造とは異なる凝集形態を示していたことから、<i>in vivo</i>における凝集プロセスの違いが指摘されている<ref><pubmed> 24034249 </pubmed></ref>。 | |||
== | ==アミロイドによる細胞毒性== | ||
アミロイド線維が持つ細胞毒性はアミロイドーシスにおける臓器不全の基本的病態と言える。しかしアミロイドタンパク質のどのような構造、分子状態が毒性を発揮するのかについては未だ明確ではない。特にAβと家族性アルツハイマー病遺伝子変異がもたらす分子病態の解析から、アミロイド線維そのものではなく、その中間体となるオリゴマー<ref><pubmed> 12702875 </pubmed></ref>に起因しているというオリゴマー仮説が提唱されている。 | |||
このアミロイドタンパク質の凝集物がどのように細胞傷害を惹起しているか、という点については、脂質二重膜の障害、酸化的ストレスや小胞体ストレスの惹起、ミトコンドリア障害などが想定されている<ref><pubmed> 23820032 </pubmed></ref>。興味深いことに、全く異なるアミロイドタンパク質であるAβとADanが蓄積するそれぞれのモデルマウスを、tauトランスジェニックマウスと交配するといずれもtau病理が亢進することが示され<ref><pubmed> 20385796 </pubmed></ref>、少なくとも大脳皮質に沈着するアミロイドが示す神経細胞傷害プロセスには共通性があることが示唆された。すなわち、アミロイドタンパク質の種類を問わず、どのような線維がどの細胞や臓器に沈着するかによって最終的にアミロイドーシスにおける病態が決定する可能性が考えられている。 | |||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2013年11月27日 (水) 19:17時点における版
アミロイドタンパク質 英:amyloid protein 同義語:アミロイドペプチド、amyloid peptide
アミロイドamyloidはコンゴーレッド染色でオレンジ色に染まり、偏光顕微鏡で緑色偏光を呈し、電子顕微鏡観察下では7~15nmの繊維構造を呈する物質として定義される。多くの場合、前駆タンパクであるアミロイドタンパク質が折りたたみ障害を引き起こして重合し、βシート構造に富む不溶性線維として蓄積・凝集している。
アミロイドーシス
アミロイドが、組織間隙に沈着する疾患をアミロイドーシス amyloidosisと呼ぶ[1]。沈着部位や沈着量により臓器の機能不全が生じる。沈着するアミロイドタンパク質の種類や臓器によって特徴が見られ、特に大きく全身性アミロイドーシスと限局性アミロイドーシスに分類されている。
全身性アミロイドーシス
アミロイドタンパク質が血中に存在する場合は全身性アミロイドーシスとなる[2]。アミロイドタンパク質としては、モノクローナル免疫グロブリンのL鎖由来のアミロイドALやH鎖由来のアミロイドAH、血清アミロイドAの代謝産物であるアミロイドA、β2ミクログロブリン、トランスサイレチン、ゲルソリン、アポAIが知られている。いずれもアミロイドタンパク質の産生亢進、濃度上昇がアミロイドーシスを惹起していることが知られており、例えばアミロイドALでは免疫グロブリン産生細胞である形質細胞の過剰な増殖や腫瘍化がその原因である。また膠原病やリウマチなどが原因となり全身性慢性炎症を基礎疾患として血清アミロイドAの濃度上昇が継続し、全身性アミロイドーシスを惹起する。さらに腎障害及び血液透析によってβ2ミクログロブリンの排泄、除去が不全となり、10年以上の長期透析の結果アミロイド沈着を招くことが知られている。
遺伝子変異によって生じる全身性アミロイドーシスとして、家族性アミロイドニューロパチーFamilial amyloid polyneuropathy(FAP)が知られている[3]。FAPはトランスサイレチン、ゲルソリン、アポAI、血清アミロイドA遺伝子変異に連鎖し、これらのアミロイドタンパク質が神経節を含む神経系および他の臓器に沈着する。我が国を含めて、特にトランスサイレチン遺伝子変異によるFAPが最も多い[4]。通常トランスサイレチンは四量体を形成しているが、遺伝子変異によって生じるアミノ酸置換によって不安定な単量体へ解離しやすくなり、なんらかの機序で重合して線維化すると考えられている。体内のトランスサイレチンは主として肝臓で産生されるが、肝実質にアミロイドは沈着しない。このためFAP患者の肝臓を移植により正常肝に換えることでアミロイドタンパク質である変異トランスサイレチンの消失が期待され、移植後多くの症例でFAPの臨床進行が停止するか,遅延することが確認されている。また2013年には、トランスサイレチンの四量体の解離及び変性を抑制することでアミロイド形成を阻害し、末梢神経障害の進行を抑制するVyndaqel(一般名:Tafamidis)が承認された。
限局性アミロイドーシス
特定の臓器に限局して沈着を認める場合は限局性アミロイドーシスとなる。臓器に応じて分類され、脳アミロイドーシス[5]としてはアルツハイマー病や脳血管アミロイドアンギオパチーで蓄積が見られるアミロイドβタンパク質(Aβ)の他、シスタチンCの遺伝子変異[6]がアイスランド型遺伝性アミロイド性脳出血で見出されている。またプリオンタンパク質の蓄積、沈着はクロイツフェルト・ヤコブ病やゲルストマン・ストロイスラー・シャインカー症候群などのプリオン病患者脳で報告されている。さらにBRI2遺伝子の変異によって生じるアミロイドペプチドABri、ADanはそれぞれBritish型、Danish型家族性認知症患者脳において蓄積している[7]。BRI2はその最C末端部がFurinによって切断され分泌されているが、終止コドン近傍の遺伝子変異により野生型よりも僅かに長いペプチドが分泌され、これらがアミロイドとして脳実質に蓄積する。
その他の限局性アミロイドーシスとしては、内分泌アミロイドーシスのアミロイドタンパク質としてはカルシトニン、アミリン、インスリン、心房ナトリウム利尿ペプチドが同定されており、主にこれらのホルモンを分泌する細胞由来の腫瘍内で蓄積・沈着が観察される。また皮膚アミロイドーシスとしてはケラチンが、限局性結節性アミロイドーシスはアミロイドALがアミロイドタンパク質として蓄積することが報告されている。
アミロイドβタンパク質(Aβ)
アルツハイマー病患者脳において蓄積している脳血管アミロイドアンギオパチーや老人斑の生化学的解析から、その主要構成成分がAβであることが明らかとなった[8]。その後、cDNAクローニングによりAβは前駆タンパク質であるAmyloid-β precursor protein(APP)の部分断片であること、βセクレターゼおよびγセクレターゼによる連続した二段階切断によって切りだされ
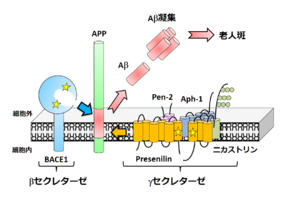
APPはβ及びγセクレターゼによる切断を受ける。
、細胞外へと分泌されることが示された[9]。一方APPにはαセクレターゼおよびγセクレターゼによって切断される代謝経路も存在し、この場合はAβが産生されないため、アルツハイマー病発症に対して予防的な経路と考えられる。 Aβの特徴はその凝集性の高さであり、緩衝液中に高濃度で存在するだけで凝集してアミロイド線維を形成する。人工合成ペプチドを用いた解析から、その線維形成過程は主にAβの一次配列とアミノ酸長に依存することが示されている。特に産生時のγセクレターゼによる切断部位の多様性によって生じる最C末端長の違い[10]が、生理的条件下で生じうるAβの凝集性を変化させる要因である[11]。また産生後に生じる最N末端の部分分解とピログルタミル化[12]も非常に疎水性が上がるため重要であると考えられている。そのためアルツハイマー病患者脳に老人斑として蓄積している最も主要なAβは、3番目のグルタミン酸がピログルタミル化し、最C末端が42番目のアラニンで終わっている[13]分子種であると想定されている。さらに興味深いことに家族性アルツハイマー病(FAD)に連鎖する遺伝子変異(Alzheimer Disease & Frontotemporal Dementia Mutation Database)の多くはこのAβの産生量
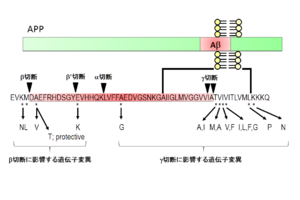
β及びγセクレターゼによる切断に影響を与える遺伝子変異。
もしくは凝集性を高める
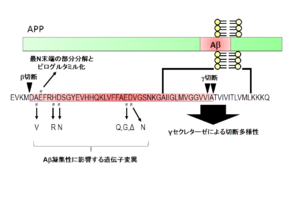
Aβ配列内部の変異は凝集性に影響を与える。
性質を示しており、アルツハイマー病におけるアミロイドカスケード仮説の強い根拠となっている。
そのためAβを標的とした抗アルツハイマー病戦略は根治療法として期待され、特にセクレターゼ活性制御によるAβ産生メカニズムの抑制、Aβ凝集阻害によるアミロイド形成抑制、そしてAβ除去を促進するアミロイド沈着の抑制を主たる薬効とする治療薬開発が推進されてきた。この中でセクレターゼ活性制御のうちγセクレターゼ阻害薬Semagacestatの治験は副作用を生じて開発が中止されたが、現在ではβセクレターゼ阻害薬の治験が精力的に進められている。Aβ凝集阻害についてはscyllo-Inositolを用いた治験が行われたが、やはり副作用のため開発中止となった。Aβ除去を目的としたストラテジーについては、特に能動免疫を利用した抗体による治療薬開発が進められている。
総Aβ産生量を変化させる遺伝子変異
βセクレターゼ活性はBACE1と呼ばれる膜結合型アスパラギン酸プロテアーゼによって担われており、その切断が総Aβ産生量を規定している。βセクレターゼ切断部位近傍に存在するSwedish変異(KM670/671NL)、Italian変異(A673V(Aβ配列としてA2V))は、APPのBACE1に対する親和性を高め、総Aβ産生量を上昇させる。またβセクレターゼの切断部位にはAβ配列内にもう一つ存在し、β’切断部位と呼称されている。この切断はN末端が短いAβ産生につながるが、β’切断部位の変異であるLeuven変異(E682K(Aβ配列としてE11K))がβ’切断を抑制し、結果的に総Aβ産生量を増加させる効果を持つ。一方ごく最近、アイスランド国民の全ゲノムシーケンシング解析からアルツハイマー病および老化に伴う認知機能低下に対して予防的に作用するrare variantとしてAβ産生を40%低下させるIcelandic変異(A673T(Aβ配列としてA2T))が同定された[14]。この変異はβセクレターゼによる切断効率を低下させることが示されている。
これまでにBACE1遺伝子変異は報告されていないが、アルツハイマー病患者脳や脳脊髄液中でBACE1タンパク質[15]や活性[16][17]の上昇が報告されている。すなわち、老化に伴うBACE1活性の変動が孤発性アルツハイマー病発症機序に影響を与えている可能性が示唆されている。また最近になり、神経細胞における主たるαセクレターゼであるADAM10の機能欠失型変異が見出され、非Aβ産生経路の抑制がアルツハイマー病を惹起することも示された[18]。
凝集性の高いAβ42の産生比率を変化させる遺伝子変異
APP配列内のAβ配列近傍に存在するFAD変異は、Aβそのものに影響を与えないが、その産生量を変化させる。AβのC末側に存在するIranian変異(T714A)、Austrian変異(T714I)、German変異(V715A)、French変異(V715M)、Florida変異(I716V)、Iberian変異(I716F)、London変異(V717Iの他、L、F、G)、Australian変異(L723P)、Belgian変異(K724N)などは、γセクレターゼによる切断を変化させ、特に凝集性の高いAβ42産生比率を上昇させる。またFlemish変異(A692G(Aβ配列としてA21G))はAβ産生量を増大させる。これはA21を含む領域がAPPに存在するγセクレターゼ活性を抑制するドメインであり、Flemish変異はその抑制効果を低下させるため、Aβ産生量を増加させると考えられている[19]。
一方で、ほとんどのFADはPresenilin 1もしくは2遺伝子上の点突然変異に連鎖する。Presenlinはγセクレターゼの活性中心サブユニットであり、ニカストリン、Aph-1、Pen-2と膜タンパク複合体として機能する[20]。その遺伝子変異はほぼおしなべてAβ42産生比率を上昇させる。γセクレターゼは特殊な切断様式をとる膜内配列切断プロテアーゼ[21]でありその変異がどのような影響を及ぼしているかは未だ定かではないが、何れにせよいずれの変異もγセクレターゼによる切断様式を変化させ、Aβ42の産生量を特異的に増加させることでAD発症過程を促進していると考えられている。
Aβの凝集性を変化させる遺伝子変異
Aβ配列内にも多くのFAD変異が存在し、多くの場合はAβの凝集性に大きな影響を与える。Aβ配列のN末端側にある変異は、British変異(H677R(Aβ配列としてH6R))、Tottori変異(D678N(Aβ配列としてD7N))そしてItalian変異(A673V(Aβ配列としてA2V))である。British変異およびTottori変異は、いずれもAβアミロイド線維形成を亢進させる[22]。Italian変異については、βセクレターゼによる切断を亢進させると同時に凝集性を高める[23]。
一方、Aβ配列の中央部に位置する変異としては、Arctic変異(E693G(Aβ配列としてE22G))、Osaka変異(ΔE693(Aβ配列としてΔE22))、Iowa変異(D694N(Aβ配列としてD23N))が存在する。Dutch変異(E693Q(Aβ配列としてE22Q))はオランダ型遺伝性アミロイド性脳出血に連鎖する変異として発見された。Dutch変異、Arctic変異ともにin vitroでアミロイド線維形成能が高いこと[24]が示されている。加えて、Arctic変異はAβ線維形成過程の中間段階で生じるプロトフィブリルの形成を亢進・安定化することが観察されている[25]。Osaka変異は、2008年に本邦より報告された比較的新しい変異である。興味深いことに、この変異をもつAβはアミロイド線維を形成せずオリゴマーの形で留まり、シナプス毒性を示す[26]。
アミロイドの構造と線維形成過程
各アミロイドタンパク質には一定の共通したアミノ酸配列や構造は見られないが、アミロイド線維になると共通してクロスβ構造
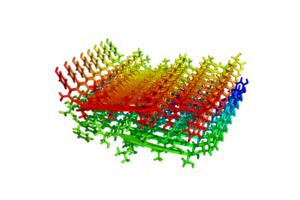
トランスサイレチン部分ペプチドからなるクロスβ構造。PDB ID: 2M5N
と呼ばれる形態をとっている[27][28][29]。これはアミロイド線維を構成するポリペプチド鎖が線維軸と垂直方向にβストランドとなり、かつ線維軸方向にβシート構造をとっているものである。このような構造学的特徴はイメージング技術に応用されつつあり、Aβアミロイドに特異的に結合する低分子化合物を利用したアミロイドPETスキャンが可能となった[30][31]。 アミロイド線維形成過程では、多くの場合正常なフォールディングをうけているアミロイドタンパク質が何らかの理由で一旦部分変性し、会合することが必要である。また線維形成過程はその鋳型となるシード(種、核)の形成を契機として急速に進んでいくことが示されている[32]。すなわち、このシードの両端の末端にアミロイドタンパク質が結合して線維が伸長していくと考えられている。このようなシード依存性伸長反応モデルは、プリオンタンパク質が示す伝播能力とも関連していると考えられている。すなわち、一旦異常構造をとったタンパク質がシードとなり、別の個体におけるアミロイドタンパク質の構造及び性質を変化させていくというモデルである[33]。またプリオンの感染性にはごく僅かなアミノ酸の違いに起因する「種の壁」が存在するが、この現象もシードの構造の違いによって説明できる。また最近ではAβなどアミロイドを形成しうるアミロイドタンパク質がいずれもプリオン様の伝播能力を示す可能性が推測されている[34][35]。実際、酵母などにおいてはプリオン様タンパク性因子による形質転換が報告されており、タンパク質の構造に依存した形質の伝播様式として注目されている[36]。一方最近、アルツハイマー病患者脳から得られたAβ線維の構造解析
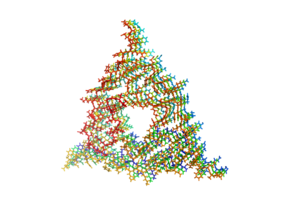
患者脳由来アミロイドから伸長したAβの分子構造。PDB ID: 2M4J
がなされ、in vitroで凝集させた構造とは異なる凝集形態を示していたことから、in vivoにおける凝集プロセスの違いが指摘されている[37]。
アミロイドによる細胞毒性
アミロイド線維が持つ細胞毒性はアミロイドーシスにおける臓器不全の基本的病態と言える。しかしアミロイドタンパク質のどのような構造、分子状態が毒性を発揮するのかについては未だ明確ではない。特にAβと家族性アルツハイマー病遺伝子変異がもたらす分子病態の解析から、アミロイド線維そのものではなく、その中間体となるオリゴマー[38]に起因しているというオリゴマー仮説が提唱されている。
このアミロイドタンパク質の凝集物がどのように細胞傷害を惹起しているか、という点については、脂質二重膜の障害、酸化的ストレスや小胞体ストレスの惹起、ミトコンドリア障害などが想定されている[39]。興味深いことに、全く異なるアミロイドタンパク質であるAβとADanが蓄積するそれぞれのモデルマウスを、tauトランスジェニックマウスと交配するといずれもtau病理が亢進することが示され[40]、少なくとも大脳皮質に沈着するアミロイドが示す神経細胞傷害プロセスには共通性があることが示唆された。すなわち、アミロイドタンパク質の種類を問わず、どのような線維がどの細胞や臓器に沈着するかによって最終的にアミロイドーシスにおける病態が決定する可能性が考えられている。
参考文献
- ↑
Radford, S.E., & Weissman, J.S. (2012).
Special issue: the molecular and cellular mechanisms of amyloidosis. Journal of molecular biology, 421(2-3), 139-41. [PubMed:22664198] [WorldCat] [DOI] - ↑
Blancas-Mejía, L.M., & Ramirez-Alvarado, M. (2013).
Systemic amyloidoses. Annual review of biochemistry, 82, 745-74. [PubMed:23451869] [PMC] [WorldCat] [DOI] - ↑
Planté-Bordeneuve, V., & Said, G. (2011).
Familial amyloid polyneuropathy. The Lancet. Neurology, 10(12), 1086-97. [PubMed:22094129] [WorldCat] [DOI] - ↑
Ikeda, S., Nakazato, M., Ando, Y., & Sobue, G. (2002).
Familial transthyretin-type amyloid polyneuropathy in Japan: clinical and genetic heterogeneity. Neurology, 58(7), 1001-7. [PubMed:11940682] [WorldCat] [DOI] - ↑
Yamada, M., & Naiki, H. (2012).
Cerebral amyloid angiopathy. Progress in molecular biology and translational science, 107, 41-78. [PubMed:22482447] [WorldCat] [DOI] - ↑
Palsdottir, A., Abrahamson, M., Thorsteinsson, L., Arnason, A., Olafsson, I., Grubb, A., & Jensson, O. (1988).
Mutation in cystatin C gene causes hereditary brain haemorrhage. Lancet (London, England), 2(8611), 603-4. [PubMed:2900981] [WorldCat] [DOI] - ↑
Tsachaki, M., Ghiso, J., & Efthimiopoulos, S. (2008).
BRI2 as a central protein involved in neurodegeneration. Biotechnology journal, 3(12), 1548-54. [PubMed:19072909] [WorldCat] [DOI] - ↑
Glenner, G.G., & Wong, C.W. (1984).
Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein. Biochemical and biophysical research communications, 120(3), 885-90. [PubMed:6375662] [WorldCat] [DOI] - ↑
De Strooper, B., Vassar, R., & Golde, T. (2010).
The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology, 6(2), 99-107. [PubMed:20139999] [PMC] [WorldCat] [DOI] - ↑
Suzuki, N., Cheung, T.T., Cai, X.D., Odaka, A., Otvos, L., Eckman, C., ..., & Younkin, S.G. (1994).
An increased percentage of long amyloid beta protein secreted by familial amyloid beta protein precursor (beta APP717) mutants. Science (New York, N.Y.), 264(5163), 1336-40. [PubMed:8191290] [WorldCat] [DOI] - ↑
Jarrett, J.T., Berger, E.P., & Lansbury, P.T. (1993).
The carboxy terminus of the beta amyloid protein is critical for the seeding of amyloid formation: implications for the pathogenesis of Alzheimer's disease. Biochemistry, 32(18), 4693-7. [PubMed:8490014] [WorldCat] [DOI] - ↑
Saido, T.C., Iwatsubo, T., Mann, D.M., Shimada, H., Ihara, Y., & Kawashima, S. (1995).
Dominant and differential deposition of distinct beta-amyloid peptide species, A beta N3(pE), in senile plaques. Neuron, 14(2), 457-66. [PubMed:7857653] [WorldCat] [DOI] - ↑
Iwatsubo, T., Odaka, A., Suzuki, N., Mizusawa, H., Nukina, N., & Ihara, Y. (1994).
Visualization of A beta 42(43) and A beta 40 in senile plaques with end-specific A beta monoclonals: evidence that an initially deposited species is A beta 42(43). Neuron, 13(1), 45-53. [PubMed:8043280] [WorldCat] [DOI] - ↑
Jonsson, T., Atwal, J.K., Steinberg, S., Snaedal, J., Jonsson, P.V., Bjornsson, S., ..., & Stefansson, K. (2012).
A mutation in APP protects against Alzheimer's disease and age-related cognitive decline. Nature, 488(7409), 96-9. [PubMed:22801501] [WorldCat] [DOI] - ↑
Yang, L.B., Lindholm, K., Yan, R., Citron, M., Xia, W., Yang, X.L., ..., & Shen, Y. (2003).
Elevated beta-secretase expression and enzymatic activity detected in sporadic Alzheimer disease. Nature medicine, 9(1), 3-4. [PubMed:12514700] [WorldCat] [DOI] - ↑
Fukumoto, H., Cheung, B.S., Hyman, B.T., & Irizarry, M.C. (2002).
Beta-secretase protein and activity are increased in the neocortex in Alzheimer disease. Archives of neurology, 59(9), 1381-9. [PubMed:12223024] [WorldCat] [DOI] - ↑
Li, R., Lindholm, K., Yang, L.B., Yue, X., Citron, M., Yan, R., ..., & Shen, Y. (2004).
Amyloid beta peptide load is correlated with increased beta-secretase activity in sporadic Alzheimer's disease patients. Proceedings of the National Academy of Sciences of the United States of America, 101(10), 3632-7. [PubMed:14978286] [PMC] [WorldCat] [DOI] - ↑
Suh, J., Choi, S.H., Romano, D.M., Gannon, M.A., Lesinski, A.N., Kim, D.Y., & Tanzi, R.E. (2013).
ADAM10 missense mutations potentiate β-amyloid accumulation by impairing prodomain chaperone function. Neuron, 80(2), 385-401. [PubMed:24055016] [PMC] [WorldCat] [DOI] - ↑
Tian, Y., Bassit, B., Chau, D., & Li, Y.M. (2010).
An APP inhibitory domain containing the Flemish mutation residue modulates gamma-secretase activity for Abeta production. Nature structural & molecular biology, 17(2), 151-8. [PubMed:20062056] [WorldCat] [DOI] - ↑
Takasugi, N., Tomita, T., Hayashi, I., Tsuruoka, M., Niimura, M., Takahashi, Y., ..., & Iwatsubo, T. (2003).
The role of presenilin cofactors in the gamma-secretase complex. Nature, 422(6930), 438-41. [PubMed:12660785] [WorldCat] [DOI] - ↑
Tomita, T., & Iwatsubo, T. (2013).
Structural biology of presenilins and signal peptide peptidases. The Journal of biological chemistry, 288(21), 14673-80. [PubMed:23585568] [PMC] [WorldCat] [DOI] - ↑
Hori, Y., Hashimoto, T., Wakutani, Y., Urakami, K., Nakashima, K., Condron, M.M., ..., & Iwatsubo, T. (2007).
The Tottori (D7N) and English (H6R) familial Alzheimer disease mutations accelerate Abeta fibril formation without increasing protofibril formation. The Journal of biological chemistry, 282(7), 4916-23. [PubMed:17170111] [WorldCat] [DOI] - ↑
Di Fede, G., Catania, M., Morbin, M., Rossi, G., Suardi, S., Mazzoleni, G., ..., & Tagliavini, F. (2009).
A recessive mutation in the APP gene with dominant-negative effect on amyloidogenesis. Science (New York, N.Y.), 323(5920), 1473-7. [PubMed:19286555] [PMC] [WorldCat] [DOI] - ↑
Murakami, K., Irie, K., Morimoto, A., Ohigashi, H., Shindo, M., Nagao, M., ..., & Shirasawa, T. (2003).
Neurotoxicity and physicochemical properties of Abeta mutant peptides from cerebral amyloid angiopathy: implication for the pathogenesis of cerebral amyloid angiopathy and Alzheimer's disease. The Journal of biological chemistry, 278(46), 46179-87. [PubMed:12944403] [WorldCat] [DOI] - ↑
Nilsberth, C., Westlind-Danielsson, A., Eckman, C.B., Condron, M.M., Axelman, K., Forsell, C., ..., & Lannfelt, L. (2001).
The 'Arctic' APP mutation (E693G) causes Alzheimer's disease by enhanced Abeta protofibril formation. Nature neuroscience, 4(9), 887-93. [PubMed:11528419] [WorldCat] [DOI] - ↑
Tomiyama, T., Nagata, T., Shimada, H., Teraoka, R., Fukushima, A., Kanemitsu, H., ..., & Mori, H. (2008).
A new amyloid beta variant favoring oligomerization in Alzheimer's-type dementia. Annals of neurology, 63(3), 377-87. [PubMed:18300294] [WorldCat] [DOI] - ↑
Sawaya, M.R., Sambashivan, S., Nelson, R., Ivanova, M.I., Sievers, S.A., Apostol, M.I., ..., & Eisenberg, D. (2007).
Atomic structures of amyloid cross-beta spines reveal varied steric zippers. Nature, 447(7143), 453-7. [PubMed:17468747] [WorldCat] [DOI] - ↑
Toyama, B.H., & Weissman, J.S. (2011).
Amyloid structure: conformational diversity and consequences. Annual review of biochemistry, 80, 557-85. [PubMed:21456964] [PMC] [WorldCat] [DOI] - ↑
Fitzpatrick, A.W., Debelouchina, G.T., Bayro, M.J., Clare, D.K., Caporini, M.A., Bajaj, V.S., ..., & Dobson, C.M. (2013).
Atomic structure and hierarchical assembly of a cross-β amyloid fibril. Proceedings of the National Academy of Sciences of the United States of America, 110(14), 5468-73. [PubMed:23513222] [PMC] [WorldCat] [DOI] - ↑
Klunk, W.E., Engler, H., Nordberg, A., Wang, Y., Blomqvist, G., Holt, D.P., ..., & Långström, B. (2004).
Imaging brain amyloid in Alzheimer's disease with Pittsburgh Compound-B. Annals of neurology, 55(3), 306-19. [PubMed:14991808] [WorldCat] [DOI] - ↑
Clark, C.M., Schneider, J.A., Bedell, B.J., Beach, T.G., Bilker, W.B., Mintun, M.A., ..., & AV45-A07 Study Group (2011).
Use of florbetapir-PET for imaging beta-amyloid pathology. JAMA, 305(3), 275-83. [PubMed:21245183] [WorldCat] [DOI] - ↑
Lee, Y.H., & Goto, Y. (2012).
Kinetic intermediates of amyloid fibrillation studied by hydrogen exchange methods with nuclear magnetic resonance. Biochimica et biophysica acta, 1824(12), 1307-23. [PubMed:22885025] [WorldCat] [DOI] - ↑
Jarrett, J.T., & Lansbury, P.T. (1993).
Seeding "one-dimensional crystallization" of amyloid: a pathogenic mechanism in Alzheimer's disease and scrapie? Cell, 73(6), 1055-8. [PubMed:8513491] [WorldCat] [DOI] - ↑
Nussbaum, J.M., Schilling, S., Cynis, H., Silva, A., Swanson, E., Wangsanut, T., ..., & Bloom, G.S. (2012).
Prion-like behaviour and tau-dependent cytotoxicity of pyroglutamylated amyloid-β. Nature, 485(7400), 651-5. [PubMed:22660329] [PMC] [WorldCat] [DOI] - ↑
Jucker, M., & Walker, L.C. (2013).
Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature, 501(7465), 45-51. [PubMed:24005412] [PMC] [WorldCat] [DOI] - ↑
Wickner, R.B., Edskes, H.K., Bateman, D.A., Kelly, A.C., Gorkovskiy, A., Dayani, Y., & Zhou, A. (2013).
Amyloids and yeast prion biology. Biochemistry, 52(9), 1514-27. [PubMed:23379365] [WorldCat] [DOI] - ↑
Lu, J.X., Qiang, W., Yau, W.M., Schwieters, C.D., Meredith, S.C., & Tycko, R. (2013).
Molecular structure of β-amyloid fibrils in Alzheimer's disease brain tissue. Cell, 154(6), 1257-68. [PubMed:24034249] [PMC] [WorldCat] [DOI] - ↑
Kayed, R., Head, E., Thompson, J.L., McIntire, T.M., Milton, S.C., Cotman, C.W., & Glabe, C.G. (2003).
Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis. Science (New York, N.Y.), 300(5618), 486-9. [PubMed:12702875] [WorldCat] [DOI] - ↑
Cheng, B., Gong, H., Xiao, H., Petersen, R.B., Zheng, L., & Huang, K. (2013).
Inhibiting toxic aggregation of amyloidogenic proteins: a therapeutic strategy for protein misfolding diseases. Biochimica et biophysica acta, 1830(10), 4860-71. [PubMed:23820032] [WorldCat] [DOI] - ↑
Coomaraswamy, J., Kilger, E., Wölfing, H., Schäfer, C., Kaeser, S.A., Wegenast-Braun, B.M., ..., & Jucker, M. (2010).
Modeling familial Danish dementia in mice supports the concept of the amyloid hypothesis of Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America, 107(17), 7969-74. [PubMed:20385796] [PMC] [WorldCat] [DOI]