「グリア細胞」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の67版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[http://researchmap.jp/kudoy/ | <font size="+1">[http://researchmap.jp/kudoy/ 工藤佳久]</font><br> | ||
''東京薬科大学 生命科学部 名誉教授''<br> | ''東京薬科大学 生命科学部 名誉教授''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2013年11月2日 原稿完成日:2013年XX月XX日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br></div> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br></div> | ||
英語名:glial cell 独:Gliazelle 仏:cellule gliale | 英語名:glial cell 独:Gliazelle 仏:cellule gliale | ||
同義語:膠細胞、神経膠細胞 | |||
{{box|text= | {{box|text= 脳に分布する主なグリア細胞はアストロサイト、オリゴデンドロサイトおよびミクログリアの三種に分類される。ヒトの脳におけるこれらグリア細胞全体の数はニューロンの数を遙かに上回る。しかし、電気的には不活性なこれらの細胞の中枢神経系における機能は発見以来、長い間、過小評価されてきた。しかし、20世紀後半からグリア細胞の新しい側面が浮き彫りにされてきたのである。ニューロンやシナプスの維持や管理機能に加えて、ニューロンとのダイナミックな情報交換によってニューロン活動やシナプス構築に直接関わっていることが明らかになってきたのだ。この事実はこれまでのニューロンのみを中心とした脳研究では脳機能の全貌を解き明かすことは困難であることを意味している。この項では三種のグリア細胞の形態と機能から細胞の脳機能発現における役割と重要性を述べる。}} | ||
==発見== | ==発見== | ||
グリア細胞のgliaは[[ニューロン]]とニューロンの間の空間を埋める糊やセメントのような物質という意味のNerven Kitteが語源となっている。病理学者の[[wj:ルドルフ・ルートヴィヒ・カール・ウィルヒョー|ルドルフ・ウイルヒョー]](Rudolph Virchow)が1846年に発表した論文に記載されている当時の組織染色技術では細胞の形を捉えることができなかったので、とりあえず、「神経の間を埋める何らかの物質」というような意味としての定義したのだろう。ウイルヒョーはやがてこれが細胞であることをつきとめて、細胞病理学の教科書には結合組織細胞と記載している(1858年)。その後、[[w:Otto Deiters|オットー・ダイテルス]](Otto Deiters) 、ミカエル・レンホサック(Michael von Lenhossek)、ウイルヘルム・ヒス(Wilhelm His)など19世紀末に活躍した多くの著名な神経組織学者がこの細胞の存在に興味を持ち、多様な形態や脳内分布の特徴を報告している。英語ではNeuroglia訳され、日本語では「膠(こう)細胞」(膠はにかわと呼ばれるコラーゲンを原料とする古い接着剤)と訳される。やがて、細胞染色法の発達によって、その実体が少しずつ明らかにされてきたが、カミロ・ゴルジ(Camillo Golgi)が確立したゴルジ染色法により、ニューロンと共にこの細胞の形態も浮き彫りになってきた。現在、グリア細胞の一つとして、よく知られている[[アストロサイト]](astrocyte:アストログリア,astroglia)という名称を与えたのはレンホサックであるが、その実体を最も正確に記載したのがラモン・イ・カハール(Santiago Ramon y Cajal)である。ゴルジ染色を改良した染色法によって様々な形態のアストロサイトを観察している。その後、ピオ・デル・リオ-オルテガ(Pio del Rio-Hortega)がニューロン、アストロサイトに次ぐ第三の細胞群として、[[オリゴデンドロサイト]](oligodendrocyte:[[オリゴデンドログリア]]:oligodendroglia)と[[ミクログリア]](microglia)の存在を報告している(1921)(グリア細胞発見の歴史については文献<ref>'''H Kettenmann, B R Ranson'''<br>Neuroglia 2nd Ed<br>''Oxford University Press(New York)''2005</ref>および<ref>'''工藤佳久'''<br>脳とグリア細胞<br>''技術評論社(東京)''2011</ref>を参照)。すなわち、これらの脳を構成する主要な細胞としてのグリア細胞群の存在は、ニューロンとほぼ同時代に発見されていたのである。現在、グリア細胞は、大グリア細胞(macroglia:アストロサイトとオリゴデンドロサイト)と、小グリア細胞(microglia:ミクログリア)に分類されている。 | |||
存在部位や機能によってその形態には多様性があり、それぞれが持つ特異的抗原分子によって分類される。現在は脳の第二の主役と呼ばれるほどに機能の重要さが注目されるようになってきている。多くのグリア細胞に関する叢書の序論にはヒトの脳におけるグリア細胞脳存在量はニューロンの10倍近くと述べられているが、その根拠は曖昧である。しかし、哺乳動物の脳におけるグリア細胞の分布比は脳が発達に伴って高くなっており<ref><pubmed>4945394</pubmed></ref>、また、他の霊長類(チンパンジーやゴリラなど)と比較しても高いことが明らかにされているので、脳の進化とグリア細胞の数には何らかの相関がある可能性は高い<ref><pubmed>16938869</pubmed></ref>。 | |||
==発生== | ==発生== | ||
[[ファイル:Kudo Fig1.png|thumb|right| | [[ファイル:Kudo Fig1.png|thumb|right|450px|'''図1 ニューロンとグリア細胞の発生'''<br>まず、マトリックス細胞から神経幹細胞が作られる。十分な神経細胞ができると、マトリックス細胞は海綿芽細胞にスイッチし、グリオブラストをつくる、これがアストロサイトとオリゴデンドロサイトに分化する。<ref name=ref14304273 />の図を参考にして作成]] | ||
20世紀の半ばまで、グリア細胞の発生については1889年にウイルヘルム・ヒス(Wilhenlm His)が提唱した二元説を基にして構築されていた。すなわち、神経細胞は胚芽細胞(germinal cell)を起源とする[[神経幹細胞]](neuroblast)から発生し、グリア細胞は海綿芽細胞(sponginoblast)を起源とするグリア幹細胞(glioblast)から発生する。これらの幹細胞はほぼ同時期に作られ、それらがニューロンとグリア細胞を同時並行的に作り出すという学説が確立されてきた。しかし、それに対して、日本の解剖学者、藤田晢也(Setsuya Fujita)がト[[リチウム]]・チミジン・オートラジオグラフィー法を用いて、初期[[神経管]]における分裂細胞の動態を解析することによって、それまで海綿細胞(sponginoblast)または[[放射状グリア]](radial glia)と呼ばれていた細胞が、すべて胚芽細胞であり、その核の周囲部が分裂サイクルに同期してエレベータ運動を生ずることを発見した<ref><pubmed>13825588</pubmed></ref>。すなわち、この時期の神経管には均質な細胞しか存在せず、この細胞は神経およびグリア細胞の発生の基盤になるものであり、マトリックス細胞(matrix cell)と呼ばれるべきものである。藤田はこのマトリックス細胞が不均一分裂し、マトリックスス細胞と神経幹細胞(neuroblast)が生ずることを明らかにしたのだ<ref><pubmed>14184856</pubmed></ref>。発生の初期の段階で、マトリックス細胞はこの分裂周期を繰り返すことによって、次々に神経幹細胞を造り出し、それらがニューロンに[[分化]]する。十分な量のニューロンができると、やがて、マトリクス細胞は[[脳室]]上衣グリア幹細胞(ependymoglioblast)にスイッチし、そこからグリア幹細胞が造られるようになることを証明した<ref name=ref14304273><pubmed>14304273</pubmed></ref>(図1)。アストロサイトもオリゴデンドロサイトもこのようにして造り出されることが明らかにされている。当然のことながら、藤田学説は猛烈な反対を受ける。そして、1970年のアメリカの神経発生学者達によって「神経系の細胞発生における命名法の改変に関する委員会」(ボールダー委員会)によって、藤田説は否定された。しかし、現在は遺伝子発現の解析などで藤田説が正しいことが認められている。それにもかかわらず、ボールダー委員会の決議が撤回されたとは聞いていない。 | |||
ミクログリアの発生についてはまだ議論が定着したとはいいきれない。アストロサイトやオリゴデンドロサイトと同様にグリア幹細胞から分化してくる細胞と考えるグループもある。しかし、最近になって、ミクログリアの起源は胎児期に卵黄嚢で造血細胞から分化して、神経管に浸入してくる中胚葉起源の細胞であることを示す証拠が報告されている<ref><pubmed>21125659</pubmed></ref>。しかし、ここでは最終的結論には至っていないとしておこう。 | |||
==アストロサイト== | ==アストロサイト== | ||
[[ファイル:Kudo Fig2.png|thumb|right|350px|''' | [[ファイル:Kudo Fig2.png|thumb|right|350px|'''図2 アストロサイトの形態'''<br>'''A.''' GFAP抗体で標識したアストロサイト(脳スライス培養標本)(著者原図)<br>'''B.''' ゴルジ染色されたアストロサイト(超高圧電子顕微鏡による立体画像)(濱 清先生提供)]] | ||
=== 名称と形態の特徴 === | === 名称と形態の特徴 === | ||
日本語では星状膠細胞と訳されている。その名はミカエル・レンホサックにより「星のような」細胞という意味で命名されて、現在に至っている。発見当初の細胞染色法ではこの細胞の骨格部分のみを染色していたために星のように見えたのだ。前述のようにアストロサイトが組織学的にニューロンとは異なった第二の脳細胞であることを正確に記載したのはカハール(1913)である。 | |||
超高圧電子顕微鏡による三次元形態解析によりアストロサイトは多数の突起がさらに細かく分岐し、その先端をシート状に広げていることが明らかにされている<ref><pubmed>15475683</pubmed></ref>。したがって、全体としては星状というよりスポンジ状であり、大きな表面積を持つ細胞である(図2)。しかし、脳内でアストロサイトが占める空間の大きさは絶対数のみではなく一つのアストロサイトのサイズとその突起の広がりにも依存する。ラットのアストロサイトの直径は30から60&mu mであり、3~4本の突起を伸ばしている。その結果、一個のアストロサイトが占める空間は66000&mu m<sup>3</Sup>に及ぶ。それに対して、ヒトのアストロサイトの直径は100~200&mu mであり、その上、突起の数は40本を超えるので、その総体積はラットのアストロサイトの27倍にも及ぶ。ラットでは一個のアストロサイトに約9万個のシナプスが被われていると推定されている。これをヒトのアストロサイトに当てはめると、一個あたり、200万個以上のシナプスを被っていることになる<ref><pubmed>12815249</pubmed></ref>。 | |||
====同種の細胞==== | ====同種の細胞==== | ||
アストロサイトの同種と考えられる細胞は脳室[[上衣細胞]](ependemoglia)、小脳のバーグマン細胞(Bergmann glia)、網膜に分布するミューラー細胞(Muller cell)など多様である。しかし、これらの形は決して星の様な形はとっていない。 | |||
====マーカー分子==== | ====マーカー分子==== | ||
アストロサイトまたはその同類の細胞を同定するためのマーカータンパク質として、glial fibrillary acidic protein(GFAP)、vimentin、S-100βなど多様な分子が確認されている。これらは多くの同種細胞に発現する。しかし、どの分子もすべての種類のアストロサイトに対応するものではない。また、分布する部位や、発達時期、障害の有無によって発現の程度が異なり、まったく発現しない場合もあるので、同定には注意を要する。 | |||
====ヒト脳における分布量==== | ====ヒト脳における分布量==== | ||
ヒトの大脳皮質においてはニューロンの1. | ヒトの大脳皮質においてはニューロンの1.4倍ほど分布していると推定されている。これはラットやマウスの5倍に及ぶとされている<ref><pubmed>14522144</pubmed></ref>。しかし、高次機能におけるアストロサイトの重要性を主張するにはあまりインパクトのない分布量の差である。しかし、この数よりも上述のようなヒトのアストロサイトがラットのそれより27倍も大きな空間を占めるという点に注目すべきであろう。ヒトでは一個のアストロサイトが200万個以上のシナプスを被い、それがラットの5倍も存在するのだから、脳機能の進化との関連性を強く示唆すると考えることに異論はないだろう。アインシュタイン(Albert Einstein)の脳ではニューロンに対するアストロサイトの量が多かったという報告もある<ref><pubmed>3979509</pubmed></ref>。もちろん、同年齢の健康なヒトの脳のデータとの比較であるが、有意差を求めることは難しい。しかし、アストロサイトが単なる支持細胞としてだけではなく、脳の機能の高度化にも関わっている可能性を支持する証拠の一つとして挙げたくなる気持ちはわかる。 | ||
===機能=== | ===機能=== | ||
[[ファイル:Kudo Fig3.png|thumb|right|350px|''' | [[ファイル:Kudo Fig3.png|thumb|right|350px|'''図3 血管とアストロサイトが作る空間に配置されるニューロン'''<br>アストロサイトの樹状突起は細かく枝分かれして広い範囲に広がる。その突起の一本は細動脈と接触している。アストロサイト同士のオーバーラップは小さい。ニューロンはアストロサイトが作る空間に位置し、その中で神経回路を作る。 | ||
]] | ]] | ||
====脳の機能的構造維持==== | ====脳の機能的構造維持==== | ||
前述のようにアストロサイトは沢山の突起を伸ばし、その先端をシート状にひろげ、まるでスポンジのような形をしている。脳の灰白質の中では一つのアストロサイトは突起の先端部分で他のアストロサイトとわずかに重なり合う程度である。一方、アストロサイトの一端は血管に接触している。したがって、アストロサイトと血管の間に一定の三次元空間が造り出される(図3)<ref><pubmed>14522144</pubmed></ref>。したがって、ニューロンのネットワークはアストロサイトが造り出す網目状の空間に配置されていることになる。実際にニューロンが造るシナプスをアストロサイトの先端突起部(ラメラ:lamella)が覆っており、互いに緊密な機能的相関があることを示している。 | |||
====細胞外イオン環境の調節==== | ====細胞外イオン環境の調節==== | ||
シナプス周辺に高密度に広がるアストロサイトの先端突起はニューロン活動に伴う細胞外イオン環境の変化の恒常性に重要な役割を持つ。ニューロンの活動、すなわち脱分極はニューロン内にNa+とCa2+を流入させ、細胞外にK+を流出させる。細胞外のK+が上昇はニューロン内外のイオン勾配を小さくしてしまうので、活動電位の発生に支障を来す。アストロサイトには多様なイオンポンプやイオンチャンネル(K+チャンネル、Na+/H+アンチポーター、Na+/K+/Cl-トランスポーター、Cl-チャンネル、水チャンネルなど)が分布しており、ニューロン活動に伴って生ずる細胞外液のイオン濃度の変化を調節し、恒常性を保っている。 | |||
====血液-脳関門==== | |||
脳の細動脈はアストロサイトの先端で覆われており、血管上皮細胞は互いに緊密に繋ぎ合わされている。ニューロンは血管とは直接接触していないので、血液と脳実質間の物質の受け渡しは血管壁とアストロサイト膜を介して行わなければならない。実際にこのままでは小さなイオンさえも通すことはできない。必要な分子は血管上皮とアストロサイトに発現した次のような特殊なトランスポーを介して行われる。この仕組みが、脳内への有害物質の浸入を防ぎ、必要な分子を選択的に通過させる血液―脳関門である。 | |||
#グルコーストランスポーター(GLUT1) | |||
#多様なアミノ酸トランスポーター | |||
#エネルギー依存性アデニンヌクレオチド結合(adenine-nucleotide binding casset(ABC)トランスポーター | |||
#各種のイオン交換システム(Na+/H+,Na+/K+,Cl-/HCO3-) | |||
[[ファイル:Kudo Fig4.png|thumb|right|350px|'''図4 アストロサイトに発現する多様な神経伝達物質トランスポーター'''<br>Uptake2(モノアミントランスポーター)以外はすべてNa+を共輸送する。グリシントランスポーターとUptake1はCl-を共輸送する。特にグルタミン酸トランスポーターでは陽イオンの共輸送が大きくとりこみにより電位が発生する(起電性)。 | |||
]] | |||
====神経伝達物質の取り込み==== | ====神経伝達物質の取り込み==== | ||
神経信号の伝達の際にシナプス周辺には神経伝達物質が大量に放出される。信号伝達後、過剰な伝達物質は早急にシナプス部位から排除されることが必要である。アセチルコリンやATPは特殊な分解酵素によって速やかに排除される。しかし、中枢神経系の約70%シナプスにおいて興奮性神経伝達物質して機能しているグルタミン酸をはじめとして、多くの伝達物質は特殊なトランスポーターによってシナプス周辺から除去される(図4)。グルタミン酸の取り込みには興奮性アミノ酸トランスポーター(Excitatory amino acid transporter: EAAT)が使われる。ニューロンにも存在するが、アストロサイトに発現するEAAT1(GLAST: Glutamate aspartate transporter)とEAAT2(GLT-1: Glutamate transporter-1)が主なグルタミン酸取り込み経路となっている。これらのトランスポーターは細胞内外のイオン濃度勾配を利用してグルタミン酸を輸送する。図4に示すように、グルタミン酸一分子の取り込みには2 - 3個のNaイオンと1個のHイオンが共輸送され、1個のKイオンが排出される。結果として、この取り込みの際にはアストロサイトは脱分極する(起電性トランスポーター:electrogenic transporter)<ref><pubmed>21752877</pubmed></ref>。 | |||
アストロサイトには抑制性伝達物質GABAおよびグリシンに対するトランスポーターも発現する。前者はGAT-3と呼ばれ、一分子のGABAの取り込みに2個のNaイオンの共輸送を必要とする。後者はGLYT-1と呼ばれ、一分子のグリシンの取り込みに2個のNaイオンと1個のClイオン の共輸送が必要とされる<ref><pubmed>24273530</pubmed></ref>。その他、アストロサイトにはタウリントランスポーターも発現している。 | |||
さらに中枢におけるuptake1と呼ばれるNaイオン依存性およびコカイン感受性の神経型モノアミントランスポーターに加えて、uptake2と呼ばれるNaイオンに依存しないステロイド感受性のモノアミントランスポーターが存在することが明らかにされている。アストロサイトにはuptake1もuptake2も存在し、モノアミン除去に重要な役割を果たしている。モノアミントランスポーターとして、ドーパミントランスポーター(DAT)、ノルエピネフリントランスポーター(NET)およびセロトニントランスポーター(SET)のcDNAがクローニングされている。その他、アストロサイトにはヒスタミントランスポーターの存在も同定されている<ref><pubmed>13677912</pubmed></ref>、<ref>'''A Verkhratsky, A Butt'''<br>Glial Neurobiology A Textbook<br>''Wiley(England)''2007</ref>。 | |||
====グリア細胞が合成し遊離する分子==== | ====グリア細胞が合成し遊離する分子==== | ||
グリア細胞はニューロトロフィン類(Nerve growth factor:NGF, Brain-derived neurotropic factor:BDNF, Neurotrophin 3, 4: NT3, NT4)やNeuropeptide Y(NPY)、Opioidペプチドなど多様なポリペプチドを合成し、遊離する。それらはニューロンに働きかけて、樹状突起の成長や軸索の伸張、神経回路の修復などに広範囲に脳機能の維持に寄与している。 | |||
[[ファイル:Kudo Fig5.png|thumb|right|350px|'''図5 血管からニューロンへのエネルギー源の移動'''<br>血中グルコースの大半は血管壁とアストロサイトの膜に発現するGLUT1を介してアストロサイトに取り込まれ、その中で乳酸まで代謝される。乳酸はMCTを介してニューロンに運び込まれて、TCAサイクルにより代謝されてATPが作られる。一部のグルコースは血管壁から細胞外液に拡散し、GLUT3を介して直接ニューロンに取り込まれる。Glu : グルコース、GLUT1, 3: 1型, 3型グルコーストランスポーター、MCT: モノカルボン酸トランスポーター]] | |||
[[ファイル:Kudo Fig5.png|thumb|right|350px|''' | |||
====エネルギー供給機構==== | ====エネルギー供給機構==== | ||
ニューロンにとって唯一のエネルギー源はグルコース(glucose)である。そのグルコースは上述のグルコーストランスポーター(glucose transporter )を使って、ニューロンにエネルギー源としてのグルコースを供給されている。実は、アストロサイトは取り込んだグルコースを乳酸(lactate)まで代謝してから、モノカルボン酸トランスポーター(mono-carboxylic acid transporter :MCT) を介してニューロンに供給しているのだ<ref><pubmed>15953344</pubmed></ref>(図5)。 | |||
さらに重要なことは、細動脈周辺のアストロサイトの細胞内カルシウム濃度が高まると、細動脈の直径が広がり、血流量が高まるという事実である<ref><pubmed>3638986</pubmed></ref>。これはニューロン活動により遊離されたグルタミン酸が周辺のアストロサイトの活性化を介して血流量を増やし、エネルギーを必要とする部位へより多くのグルコースを供給できることを意味する。この事実から考えると、現在、脳活動の画像化に利用されている機能性核磁気共鳴イメージング(functional magnetic resonance imaging: fMRI)はアストロサイトの機能を間接的に見ているものではないかと思われる。 | |||
====神経伝達物質受容体の発現==== | ====神経伝達物質受容体の発現==== | ||
20世紀末まではもっぱら、ニューロンの支持細胞としての機能のみが注目されていたアストロサイトであるが、実は1980年代後半にはこの細胞にグルタミン酸受容体、GABA受容体、セロトニン受容体、ノルアドレナリン受容体など様々な神経伝達物質受容体が発現していることがすでに報告されている。この頃から、分子生物学的に神経伝達物質受容体の存在を実証する方法が確立され、アストロサイトにはGタンパク質共役型受容体が分布していることが明らかにされてきていたのだ。現在ではプリン受容体、アセチルコリン受容体、ヒスタミン受容体、ドーパミン受容体の発現も確認されている。もちろん、すべてのアストロサイトに発現しているのではない。しかし、主要な神経伝達物質のほとんどがアストロサイトに発現する可能性があるのだ<ref><pubmed>3117429</pubmed></ref>。 | |||
[[ファイル:Kudo Fig6.png|thumb|right|350px|'''図6 G-タンパク質共役型グルタミン酸受容体を介したアストロサイトのカルシウムオシレーション | |||
[[ファイル:Kudo Fig6.png|thumb|right|350px|''' | '''<br>初代培養海馬細胞に蛍光カルシウム指示薬fura-2を負荷して、NMDAとt-ACPDの作用を検討した後MAP2抗体とGFAP抗体で、それぞれニューロンとアストロサイトを同定した。黒枠:NMDAまたはt-ACPDにカルシウム応答をする細胞。赤枠:t-ACPDによってアストロサイトに引き起こされたカルシウムオシレーション(動画参照)。]] | ||
====細胞内カルシウム濃度の変化==== | ====細胞内カルシウム濃度の変化==== | ||
受容体の発現があったとしても、それが機能的に意味を持っているかどうかはわからず、多くの神経研究者は注目することなく時が過ぎた。というのも、アストロサイトは電気的にはまったく不活性であると報告されており、確かに、深い静止膜電位は持つものの、通電してもまったく応答することはない<ref><pubmed>5966434</pubmed></ref>。電気生理学が脳研究の中心的な解析手法であった当時、こんな不活性な細胞が伝達物質受容体を発現していたとしても意味がないと考えられたのも不思議はない。 | |||
ところがアストロサイトの活動を検出できる研究手法が開発されたことで、事情は一変する。カルシウムイメージング(calcium imaging)法、すなわち、細胞内カルシウム濃度の画像による解析方法である。細胞内に容易に導入することができる蛍光カルシウム指示薬を用い、カルシウム濃度の変動の結果生ずる蛍光強度の変動をビデオ画像として捉えるものである<ref><pubmed>2879588</pubmed></ref>。。この方法を使って、アストログリアのクローン細胞にセロトニンに対するカルシウム応答反応がることが報告された<ref><pubmed>3761750</pubmed></ref>。その後、中枢由来の培養細胞を用いて、グルタミン酸が細胞内カルシウム濃度上昇させることが報告された<ref><pubmed>1967852</pubmed></ref>、<ref><pubmed>12106244</pubmed></ref>。それに前後して、アセチルコリン、ヒスタミン、ATP、ノルアドレナリン、ドーパミン、セロトニンに対してもアストロサイトが同様なカルシウム応答反応を生ずることが報告されている。この反応は細胞の一点で見ると反復性律動的反応(カルシウムカルシウムオシレーション:calcium oscillation)として観察できる(図6)二次元的に観察すると、細胞内で反応が波状に広がるばかりか、周辺のアストロサイトにも波状に伝搬していることがわかる(カルシウムウエーブ: calcium wave)<ref><pubmed>1647876</pubmed></ref>(動画1)。その伝搬速度は神経活動に比べると数オーダー遅い。しかし、この発見はそれまで不活性であり、脳のダイナミックな機能には寄与しないだろうと考えられていたアストロサイトが脳機能発現に積極的関与する可能性を示唆する重要な発見である。 | |||
====グリア伝達物質の遊離==== | ====グリア伝達物質の遊離==== | ||
アストロサイトがモノアミン刺激によってGABAやグルタミン酸を遊離できることは、カルシウム濃度上昇の発見以前に報告されていた<ref><pubmed>3005511</pubmed></ref>、<ref><pubmed>2575232</pubmed></ref>。このような神経伝達物質遊離がカルシウムの上昇によって引き起されるのか。また、それによって周辺のニューロンに影響を与えることができるのか。これらの証拠があれば、ニューロンからアストロサイトへの情報伝達ばかりではなく、アストロサイトからニューロンへの逆行性情報伝達が証明できる。この点も比較的簡単にクリアされたのだ。アストロサイトにおけるカルシウム濃度上昇がグルタミン酸 、ATP、D-セリンなどの分子を遊離できること、これらの直接的にも間接的にもニューロンの活性に影響を与えることが証明されている(図7)<ref><pubmed>12927771</pubmed></ref>。 | |||
グルタミン酸(glutamate)は脳内のシナプスの70%で興奮性伝達物質として使われている分子である。従って、これを遊離できることはアストロサイトから周辺のシナプスに情報を伝達できることを意味する。 | |||
もう一つ重要な分子がATP (adenosine triphosphate)である。アストロサイトがATPを遊離できることはアストロサイト特異的培養系で、ATP測定をすることによって容易に証明できる。ATPはそのものが神経伝達物質の一つして認められており、ニューロンには7種のイオンチャンネル型のP2X受容体と8種のG-タンパク質共役型のP2Y型が分布していることが認められている。一方、アストロサイトにはイオンチャンネル型P2X受容体とG-タンパク質共役型のP2Y1、P2Y2、P2Y4を発現しているので、ATPに対する感受性が高く、カルシウムイメージング法でその効果を容易に確かめることができる<ref><pubmed>12420311</pubmed></ref>。 | |||
さらに、もう一つ重要な物質の遊離がある。D-セリン(D-serine)である。D-セリンはL-セリンからセリン異性化酵素(serine racemase)によって合成される。このアミノ酸はグルタミン酸受容体のサブタイプの一つであるNMDA受容体(N-methyl-D-aspartic acid receptor)の活性化因子の一つである。このNMDA受容体はカルシウム流入を引き起こすことができるチャンネルに連動しており、シナプス可塑性過程での重要性が高い。アストロサイトはセリン異性化酵素をもっており、D-セリンを遊離することができる<ref><pubmed>9892700</pubmed></ref>。最近はニューロンもD-セリンを産生することができると報告されており、この機能がアストロサイトの特異的機能であることには疑問があるが<ref><pubmed>17663143</pubmed></ref>、グリア細胞から遊離されてニューロンのグルタミン酸受容体に促進的作用を受けもっていることは確からしい。このような分子はグリオトランスミッター(gliotransmitters)と呼ばれている<ref><pubmed>17006901</pubmed></ref>。 | |||
さらに、もう一つ重要な物質の遊離がある。D- | |||
====トライパータイトシナプス==== | ====トライパータイトシナプス==== | ||
グリアとニューロンとがそれぞれ伝達物質受容体を発現し、ともに伝達物質を遊離できることから、脳機能が単にニューロンが作る回路のみではなく、グリア細胞とニューロンが作るもっと広範囲な回路の中から生み出されるのではないかという考え方が提唱されている。シナプス前ニューロンとシナプス後ニューロンとで作られるシナプスに、周辺のアストロサイトとの間でのシナプスの存在を加えたトライパータイトシナプス(tripartite synapse:三者間シナプス)という概念である<ref><pubmed>10322493</pubmed></ref>。これまでに述べたアストロサイトの性質を考えれば当然あって然るべき仕組みである。このようなシナプスの存在を考慮に入れて脳における情報処理を考えると、これまでにニューロンのみで作られる回路の上で考えていた脳機能はもっと複雑で奥深いものになる(図7)。 | |||
====シナプス可塑性に及ぼす役割==== | ====シナプス可塑性に及ぼす役割==== | ||
すでに述べたようにアストロサイトには細かく枝分かれし、シート状の突起(ラメラ:lamella)を持つ樹状突起と、血管に巻き付く突起があり、そのラメラはニューロンの樹状突起上のシナプス構造を包み込んでいる。この構造はアストロサイトがシナプスをサポートしていることを示唆している。 また、海馬スライス培養標本において、アストロサイトを緑色蛍光タンパク質(GFP)で、ニューロンをrhodamine-dextranで標識して、二光子顕微鏡でリアルタイム観察した結果、アストロサイトと接触したシナプスの寿命は接触しなかったシナプスに比較して有意に長く、成熟型のシナプスに移行していくことが証明されている<ref><pubmed>17215394</pubmed></ref>この事実はおそらくシナプス可塑性にはアストロサイトの存在が重要であることを示唆しており、ますますアストロサイトの重要性が高まっている。 | |||
==オリゴデンドロサイト== | ==オリゴデンドロサイト== | ||
===名称と形態の特徴=== | ===名称と形態の特徴=== | ||
オリゴデンドロサイト(oligodendrocyte; oligodendroglia):この名前はアストログリアに比べて突起が少ないことに基づいている(図8)。日本語では「希突起神経膠細胞」と訳されている。この細胞は前述のようにカハールの弟子である、リオ・オルテガによって発見された(1928)、オルテガはこれらの細胞を第三の脳細胞として発表する。実は彼が第三の脳細胞と分類した中には後述のミクログリア(microglia)も含まれていたのだ。この発表は師であるカハールには受け入れられず、リオ・オルテガは破門の憂き目にあう。 | |||
中枢神経系におけるオリゴデンドロサイトの特徴的な形態は、突起が神経軸索に巻き付いてミエリン髄鞘を作っている様子である。成熟脳に分布するすべてのオリゴデンドロサイトが髄鞘を作っているわけではない。図8Bに示すように、見かけは単に突起を伸ばした細胞の形をとっているものも多い。 | |||
====同種の細胞==== | |||
リオ・オルテガはオリゴデントロサイトの突起の数や、細胞体の形態、分布する部位などからI型からⅣ型の四種に分類している。しかし、四種に分類されたオリゴデンドロサイトの基本的な機能には大きな差はないようである。 | |||
末梢神経の軸索に巻き付き、ミエリン髄鞘を作るシュワン細胞(Schwann cell)(亡突起膠細胞)もオリゴデンドロサイトと同種の細胞である。 | |||
成熟中枢神経系にはオリゴデンドロサイトの性質を備えながらミエリン髄鞘を作らない細胞も多く見出される。それらの中にはオリゴデントロサイト前駆細胞(olygodendrocyte progenitor cells :OPC)に分類される細胞があるが、さらに、コンドロイチン硫酸プロテオグリカン(NG2 condroitin sulfate proteoglycan) を発現する細胞が見出される。この細胞は成熟細胞でもオリゴデントロサイトと区別ができない。NG2またはポリデンドロサイト(polydendrocyte)と呼ばれるこの細胞もミエリン鞘形成に至るものとミエリン鞘を形成しない種類がある。この細胞は白質にも灰白質にも分布しており、時にはアストロサイトのような形態をとっていることもある。しかし、アストロサイトのマーカー蛋白であるGFAP(glial fibrillary acidic protein)は発現しない。実にややこしい細胞である<ref><pubmed>19096367</pubmed></ref>。 | |||
====同種の細胞==== | 重要な事実はこの細胞が中枢損傷部位に集まり、グリア瘢痕(glial sxcar)、グリオーシス(gliosis)を作ることである。このような性質からこの細胞はsynantocyte(synant :ギリシャ語で:接触することを意味する言葉)と命名されたこともあるが、その後、この名前はあまり流布していない<ref><pubmed>14501223</pubmed></ref>。ニューロンにも似た性質を持っており、この細胞の存在は脳内に分布する多様な機能精細胞の系譜が同じであることを如実に語っている。 | ||
====マーカー分子==== | ====マーカー分子==== | ||
オリゴデンドロサイトのマーカー分子は多様である。ミエリン髄鞘に特異的なタンパク質、プロテオリピッドプロテインproteolipid protein:PLP)やミエリンベーシックプロテイン(myelin basic protein:MBP)は髄鞘のマーカーとして使われる。その他、特殊な糖脂質、例えばガラクトセレブロシ(Galactocerebroside)やスルファチド(sulfatide)(3-O-硫酸化ガラクトシルセラミド)が分布しているので、これがよいマーカー分子になる。前者についてモノクローン抗体O1が、後者についてはモノクローン抗体O4が検出のために利用できる(図8A,B)。同じくミエリン髄鞘に豊富に存在する酵素類、cyclicnucleotide phosphatase (CNPase)などもよいマーカーとなる。 | |||
====ヒト脳における分布量==== | ====ヒト脳における分布量==== | ||
オリゴデンドロサイトはミエリン鞘をつくるという役割のために白質に多く存在している。しかし、その分布量に関する報告は見ない。ヒト脳においてはアストロサイトがニューロンの二倍程度、後述のミクログリアがニューロンとほぼ同程度とされている。グリア細胞全体がニューロンの10倍以上と考えると、その分布量はアストロサイトの三倍以上ということになる。この細胞が中枢神経系内のほとんどの神経軸索の全長にわたって有髄化していることから考えると、その数はアストロサイト数倍は分布すると考えても無理はない。 | |||
===機能=== | ===機能=== | ||
====ミエリン髄鞘の形成 神経伝導速度の促進==== | ====ミエリン髄鞘の形成 神経伝導速度の促進==== | ||
オリゴデンドロサイトの重要な役割は神経軸索に絶縁テープのように巻き付き、神経信号の伝導効率を上げることである。この巻き付いた部分はミエリン髄鞘(myelin sheath)とよばれ、250~1000ミクロンほどの幅を持っている。髄鞘を持つ神経線維は有髄神経線維(myelinated nerve fiber)と呼ばれ、髄鞘を持たない神経線維は無髄神経線維(nonmyelinated nerve fiber)と呼ばれる。中枢神経系では一つのオリゴデンドログリアが、少ない場合は1から2本、多い場合は30本ほどの神経軸索に突起を伸ばしてミエリン髄鞘を作っている。神経信号は髄鞘と髄鞘の間、ランビエー絞輪( node of Ranvier)と呼ばれる部分を跳躍するように伝わっていく(跳躍伝導:saltatory conduction)(図8)。中枢神経系の神経線維はほとんど有髄神経である。この種の髄鞘のおかげで、神経軸索上を伝導する信号の速度は新幹線に優るとも劣らないものになる(秒速100メーター、時速360キロ)。因みにこの髄鞘を持たない神経軸索(自律神経の節後線維)での伝導速度は秒速1メーター程度、時速3.6キロだから、ゆっくりと歩く程度である(図9)。無髄神経で速度を高めるには神経線維の直径を大きくして、局所電位の大きさを高める必要がある。軟体動物のヤリイカでは速やかに動かす必要のある筋肉への神経線維は無髄であるので、その直径は1mmほどもある。我々の脳内の配線はこのように太い神経線維では不可能である。 | |||
図10Aは有髄神経線維をちょうどオリゴデンドロサイトの突起が神経軸索に届いた位置で、横断した電子顕微鏡像である。薄く紙のように広がった先端が四重に巻き付いており、一重分を注意深く見ると、二枚の膜からなっているのが分かる。一方、図10Bは有髄神経を二つの髄鞘の間(無髄状態になっており、ランビエー絞輪と呼ばれる)で縦方向に切ったものである。幾重にも巻いたオリゴデンドロサイトの突起部位が、ランビエー絞輪(Ranvier node)を挟んで、存在している(パラノード:paranode)。実際に、免疫組織化学的に、活動電位の発現に必要な、電位依存性Na+チャンネルはランビエー絞輪に局在している。一方、電位依存性K+チャンネル(Kv1.1 、Kv1.2)はパラノードの先、ジャクスタパラノード(Juxta paranode)に局在していることが示されている(図11)。 | |||
因みに無髄神経で速度を高めるとすると、神経線維の直径を大きくして、局所電位の大きさを高める必要がある。軟体動物のヤリイカでは速やかに動かす必要のある筋肉への神経線維は無髄であるので、その直径は1mmほどもある。我々の脳内の配線は極めて高度に発達しており、このように太い神経線維で配線することは不可能である。 | |||
==== | ====太くなる神経線維が脳の可塑性に関与する==== | ||
音楽家やスポーツ選手など通常の人より訓練を積んだヒトとの脳を核磁気共鳴画像で解析する試みが盛んに行われている。訓練や学習による脳の発達の手がかりを得ようとするものである<ref><pubmed>21403182</pubmed></ref>。これらの研究対象は当初、神経細胞やそのシナプス層、すなわち灰白質に置かれていた。しかし、その途上で、驚くべきことに白質、すなわち神経線維の集まりの部分に明らかな発達があることが見出されたのだ。場合によっては灰白質よりも明瞭な差があることが発見されたのだ<ref><pubmed>16282593</pubmed></ref>。最初の発見は音楽家の脳の脳梁の拡大であった。脳梁は有髄線維の束である。学習や訓練がその厚みが増すという事実は何を意味しているのだろうか。神経線維の数が増えている可能性もあるが、それより、一本一本の神経線維の太さが増している可能性が高いと考えられている。とは言え、神経軸索そのもののサイズが太くなるとは考えらにくい。とすると、軸索を覆う髄鞘部分が増大する。すなわち、神経軸索を包む髄鞘の巻数が増えたと考えるのが妥当だ。巻数が増えて、絶縁の程度が高くなると、伝導速度が増す可能性は高い。実際に最近ではMRIで水分子の拡散運動を画像化し、その拡散の方向依存性が解析されている。ミエリン化が進むと神経線維に沿った水の拡散の方向性(部分異方性:fractional anisotropy:FA)が高まることが明らかにされ、これを指標として、髄鞘形成のダイナミズムが詳しく調べられている。その結果、ジャグリングの練習、試験勉強、楽器の訓練などによってその能力が高められと、脳梁ばかりではなく大脳皮質や海馬の白質のミエリン化が促進されていることが明らかにされた<ref><pubmed>19820707</pubmed></ref>。これは可塑性が決してシナプスだけの現象ではないことを意味し、これまでに積み上げられてきた可塑性のメカニズムに関する理解を根本から変える必要を迫る事実である。 | |||
====髄鞘のダイナミズム==== | |||
上述のようにオリゴデンドロサイトは単に神経線維の上に巻き付いているだけはなく、神経の活動に応じて積極的にそのミエリン髄鞘を発達させるらしい。そのメカニズムが末梢有髄神経で示されている。末梢神経軸索に発生する活動電位が髄鞘を作るシュワン細胞(Schwann cells)の増殖や分化に影響を及ぼすというのだ。すなわち、神経軸索の活動がATPを介してシュワン細胞のP2受容体を活性化して細胞内カルシウム濃度を上昇させ、その結果、シュワン細胞のCa2+レベルが上昇する。細胞内で上昇したCa2+が軸索における未熟なシュワン細胞を髄鞘形成に導くというものである。この反応はさらに隣接するシュワン細胞に伝達されて、軸索全体にその効果が及ぶという。<ref><pubmed>10731149</pubmed></ref>。 | |||
さらに、神経軸索がグルタミン酸を遊離し、それが髄鞘に分布するグルタミン酸受容体(NMDA受容体やG-タンパク質共役型受容体)の活性を介して、髄鞘内Ca2+濃度の上昇を引き起こすことが明らかにされている。このCa2+上昇は髄鞘と神経軸索の結合部に発現するFynキナーゼを活性化し、ミエリンベーシックプロテイン(MBP)の産生を高めるのだ<ref><pubmed>21817014</pubmed></ref>。これは髄鞘の強化が活動依存性に促進されることを強く支持する発見である。同時に、オリゴデンドロサイトが発現しているATPやアデノシンに対する受容体を介した細胞内Ca2+の上昇も同じ機構で髄鞘の強化に寄与している可能性を支持する。 | |||
このような神経活動依存性のミエリン髄鞘形成は脳内の神経回路の成熟過程においても活発に引き起こされている可能性が高い。 | |||
====神経活動の同期に関わる可能性==== | ====神経活動の同期に関わる可能性==== | ||
ATPやその代謝産物であるアデノシンによる髄鞘の興奮についてはさらに重要な発見がある。興奮した髄鞘で包まれている軸索における伝導速度を上昇させるのである<ref><pubmed>18634564</pubmed></ref>。オリゴデンドロサイトはその名の通り、あまり沢山の突起は持たないが、それでも多い場合は30本ほどの突起を繰り出して、神経軸索に髄鞘を作る。もし、この細胞が興奮したら、その細胞が関わる30本の軸索の伝導速度は一気に高まることになる(図12)。また、上述のように一つのオリゴデンドロサイトの興奮が隣接するオリゴデンドロサイトに伝搬すれば、ある集団の神経軸索の伝導速度は高められ、それらが送られるシナプス側において、非常に高い同期性を持つことになる。これは特定の情報の伝達効率を集団的に高めるのに有効な方法であり、これまでに考えられてきたシナプスにおける伝達効率促進とはまったく質の異なったメカニズムである。 | |||
髄鞘の厚みが増すことによる伝導速度促進および同じオリゴデンドロサイトに支配されている神経軸索間の同期は間違いなく脳機能の向上に関わるはずである。脳の可塑性を支える要素の一つとして注目されるべき機能である。 | |||
しかし、一つ、どうしても理解できない点がある。一個のオリゴデンドロサイトから繰り出された複数のシート状突起が、それぞれの軸索に接触した後に、バームクーヘンのような形に幾重にも巻き付くことができるのだろうか?軸索の表面がくるくると回って糸巻きのように巻き取っている仕組みがなければならないが、これはまだ証明されていない。 | |||
==ミクログリア== | ==ミクログリア== | ||
===名称と形態の特徴=== | ===名称と形態の特徴=== | ||
ミクログリア(microglia)の名称は、この細胞より先に同定されたアストロサイトや、ほぼ同時に発見されたオリゴデンドロサイトに類似の細胞でありながらサイズが小さいことから単純に命名されたものと思われる。見かけの形態の特徴は小さいことと、突起が少ないことであるが、リオ-オルテガは発見の早い段階にこの細胞にはさらに重要な形態変化があることを発見している。正常な脳の中でのミクログリアは突起を伸ばした形だが、周辺に何らかの障害が生ずると、突起を縮め、細胞体部分が大きくなる「活性化型」にかわり、やがて、アメーバ状に形を変えて、障害部周辺を活発に動き回るようになるのだ(図13)。 | |||
====同種の細胞==== | ====同種の細胞==== | ||
発生の項目でも述べたように、ミクログリアの起源は胎児期に卵黄嚢で造血細胞から分化して、神経管に浸入してくる中胚葉起源の細胞であることを示す証拠が報告されている。実際に、中枢の損傷部位の周辺をアメーバ運動しているミクログリアの姿は末梢の免疫細胞マクロファージと区別がつかない。形態のみではない、この細胞の細胞表面に発現する分子もマーカーの項で述べるように非常に似通っている。さらに、障害部に到着すると、死んだ細胞をどんどんと食べ始めるの様子もマクロファージと同じである。この両者は同じ起源であると考えてもよいだろう。 | |||
====マーカー分子==== | ====マーカー分子==== | ||
ミクログリアはいろいろなマーカーによって検出できる。例えば、チアミン・ピロフォスファターゼ(Thiamine pyrophosphatase: TPPase)や非特異的エステラーゼ(nonspecific esterase NSE)など中枢神経系の細胞の中ではミクログリアに比較的特異的に発現する酵素類を検出する方法である。また、マクロファージの特異的抗体や、免疫関連の補体受容体に対する抗体を用いても脳内のミクログリアを免疫染色できる。一方、ミクログリアの細胞表面には主要組織適合遺伝子複合体(Major histocompatibility complex:MHC)分子が存在し、その抗体はミクログリアのよいマーカーとなる。 現在、ミクログリアの最も有効なマーカーとして利用されるのがIba1と呼ばれるタンパク質である。Iba1抗体もミクログリアばかりではなく、マクロファージにも反応する<ref><pubmed>14756805</pubmed></ref>。 | |||
====ヒト脳における分布量==== | ====ヒト脳における分布量==== | ||
ヒトの脳においてミクログリアは脳の灰白質にほぼ均一に分布し、全体のグリア細胞のほぼ10%程度と見積もられている。グリア細胞全体でニューロンのほぼ10倍と見積もれば、ミクログリアはニューロンとほぼ同数がニューロンと同じ場所に分布していることになる。 | |||
===機能=== | ===機能=== | ||
====損傷を受けた細胞の除去==== | ====損傷を受けた細胞の除去==== | ||
ミクログリアがリオ・オルテガによって第三の脳細胞としてオリゴデンドロサイトと共に発見されたのは1932年であるが、その後その性質はごく最近になるまでほとんど解明されないままになっていた(図14)。実は、20世紀初頭、アルツハイマー(Alois Arzheimer)や彼の同時代の病理学者達は神経変性が生じている部位に突起のないアメーバ状の細胞が多数浸潤していることに気づいていた。これらは顆粒細胞(granule cells)とか格子細胞(lattice cells)と呼ばれ、当時は認識されていたアストロサイトとは別ものであり、神経疾患部位に出現する細胞と認識していた。この姿は損傷部位に浸潤している細胞であり、この姿が誤解されて、障害の犯人扱いされることがあった。しかし、脳という閉鎖空間では死んだ細胞を素早く片付けることが必須であり、その意味で、極めて重要な機能である。 | |||
====ミクログリアの出動==== | ====ミクログリアの出動==== | ||
二光子励起顕微鏡によって脳に傷つけることなく深部に存在する細胞の動きを捉えることができるようになり、多くの新しい発見がなされている。その中でもミクログリアのダイナミックな活動の可視化はこの細胞の機能の解明に役立っている。特に興味深いのはミクログリアの突起の正常時の柔らかではあるがダイナミックな動き、そして、損傷部位に対するミクログリアの突起の早い反応とその後の損傷部位への移動の過程である。固定された組織標本では認識できない。ダイナミックな活動が示されている<ref><pubmed>15831717</pubmed></ref>。 | |||
先にも述べたようにミクログリアの細胞表面にはMHC分子が発現しており、その姿は末梢におけるマクロファージのそれと一致する。静止状態のミクログリアからは想像もできないが、損傷部位に浸潤した活動期のミクログリアの形態はアメーバ状になり、活発に細胞貪食活動を示す(図14)。その姿はマクロファージと区別がつかない。しかし、損傷部位の血管は透過性が高まり、末梢のマクロファージの浸潤を許している可能性が高いので、損傷部位に集まっているアメーバ状の細胞がすべて活性型のミクログリアとは言い切れない。とはいえ、静止型のミクログリアが活性化状態になり細胞貪食性を持つアメーバ状に変化する様は組織学的に正確に捉えられている<ref><pubmed>15895084</pubmed></ref>。 | 先にも述べたようにミクログリアの細胞表面にはMHC分子が発現しており、その姿は末梢におけるマクロファージのそれと一致する。静止状態のミクログリアからは想像もできないが、損傷部位に浸潤した活動期のミクログリアの形態はアメーバ状になり、活発に細胞貪食活動を示す(図14)。その姿はマクロファージと区別がつかない。しかし、損傷部位の血管は透過性が高まり、末梢のマクロファージの浸潤を許している可能性が高いので、損傷部位に集まっているアメーバ状の細胞がすべて活性型のミクログリアとは言い切れない。とはいえ、静止型のミクログリアが活性化状態になり細胞貪食性を持つアメーバ状に変化する様は組織学的に正確に捉えられている<ref><pubmed>15895084</pubmed></ref>。 | ||
====脳内清掃システム==== | ====脳内清掃システム==== | ||
脳に整然と配置されているミクログリアが脳細胞を無差別に攻撃するなどありえない。では、どのような条件でミクログリアの活性が高まり、そのようにして特定の損傷を受けた細胞のみを貪食するのか。 | 脳に整然と配置されているミクログリアが脳細胞を無差別に攻撃するなどありえない。では、どのような条件でミクログリアの活性が高まり、そのようにして特定の損傷を受けた細胞のみを貪食するのか。 | ||
損傷を受けた脳細胞からはATPが放出される。細胞外液のATP濃度は正常状態では低く保たれているので、ATP濃度の高い部位はそこに損傷細胞が存在することを示す信号になる。ミクログリアは多様なプリン受容体を発現しているが、そのうち、P2X4受容体が刺激されると、ミクログリアの突起はATP濃度の高い方向に向かって伸びて行く<ref><pubmed>17299767</pubmed></ref>。さらに、その部位に近づくと、P2Y12受容体が刺激され、BDNFなどのニューロトロフィンを遊離するのだ<ref><pubmed>20653959</pubmed></ref>。この段階では損傷部位の修復のために機能しているようである。ここまでの過程を見ると、損傷を受けた脳細胞はATPを救助信号として、「私を見つけて、助けて、Find me and help me」と叫んでいるようである。 | |||
ところが、その救助がすでに間に合わない状態である場合にミクログリアはアメーバ状に形を変えて、その場に移動する。そして、損傷を受けた細胞を貪食する。この時、貪食する必要のある死んだ細胞を見つけ出しているのだ。これが成り立つためには、死にかかった細胞から出される信号を認知する必要がある。実はミクログリアにはもう一つプリン受容体、P2Y6が存在している。この受容体は不思議なことに、ATPやADPには反応しないのだ。発見以後しばらくはその役目が不明であったが、やがて、P2Y6を活性化するのはウリジン二リン酸(UDP)であることが明らかにされた<ref><pubmed>19262132</pubmed></ref>。。UDPはやたらに細胞外に遊離される分子ではない。死にかかった細胞からごく少量遊離されるだけである。P2Y6受容体がUDPで刺激されると、ミクログリアのアメーバ運動が活性化され貪食機能が活性化される。こうして、貪食能が高まったミクログリアが周辺に分布する細胞のすべてを貪食するのはない。もう一つ条件がある。死んで細胞膜が壊れた時に、提示される膜成分のリン脂質の成分であるホスファチジルセリン(phosphatidylserine)である。これを提示していることを認識して、その細胞のみを貪食するのだ。このホスファチジルセリンは「私を食べて信号、Eat me signal」なのである<ref><pubmed>3464483</pubmed></ref>(図15)。ミクログリアは単なる破壊者でも、無差別な掃除係でもない。非常に高度な認識機能を備えた、環境整備係として機能していることがわかる。 | |||
====シナプスの保守点検==== | ====シナプスの保守点検==== | ||
ミクログリアが高度な仕組みを持つ環境整備係であることはそれだけでもこの細胞が脳内で重要な要素であることを物語っている。しかし、最近は神経回路の保守点検にも関わっている可能性が示唆されている。これも蛍光タンパク質発現させたミクログリアの形態の二光子励起顕微鏡を用いた長時間ライブイメージングによって明らかにされている。 先に述べたように静止状態のミクログリア(ラミファイド型)は静止状態とはいいながら、沢山の突起をゆらゆらと動かせている。この突起の動きには生理学的目的があるようで、正常なシナプスには1時間に1回、一回あたり5分間ほど接触することが観察されている。一方、使われないシナプスにはこのような繊細な管理を行われていないのだ<ref><pubmed>19339593</pubmed></ref>。接触時にミクログリアとシナプスの間でどのような情報交換が行われているかは不明だが、ミクログリアの神経回路形成への重要性を示唆する重要な事実である。 | |||
ミクログリアがシナプス回路の維持再編に積極的に働いていることの証拠はまだある。視覚回路の中継核である外側膝状体で活発に行われている左右の視覚路の選択の過程である。未熟な視覚回路では左右両側の視神経節細胞からの入力を受けているが、それが発達に応じて主に同側からの入力が除去されて行く。この過程でミクログリアの得意技とも言うべき、不要物処理機能が発揮されるのだ<ref><pubmed>22632727</pubmed></ref>。 | |||
ではこのような選択的な除去はどのように行われるのだろうか。最終的にはミクログリアの貪食機能が発揮されるものと考えられるが、どのようにして不要シナプスを認識しているのだろうか。これには前述の脳内免疫細胞としての性質が使われているらしい。例えば、ミクログリアに発現している補体分子、C3の合成が、その合成の活性化因子Clqの存在により高まり、C3受容体を多く発現しているシナプス部位を認識して除去するという仕組みである<ref><pubmed>18083105</pubmed></ref>。また、MHCのClass1が神経傷害時のシナプス除去に関与している可能性を示唆する証拠もある<ref><pubmed>15591351</pubmed></ref>。ミクログリアが脳内の免疫細胞だと考えられているもののまだその実体は十分に解明されていない。その能力がシナプスの消長に積極的に関わるとすれば、神経回路の構築や維持における最重要因子としてその機能を再認識する必要がある。 | |||
====神経因性疼痛==== | |||
ミクログリアが悪玉ではないことは十分に理解できたが、最後に、ミクログリアの関与するやっかいな疾患について述べなければならない。「神経因性疼痛」(neuropathic pain allodynia)である。帯状疱疹の後遺症や手術や怪我の後遺症として、損傷部周辺の触覚が激しい疼痛として感じられる疾患である。その成立メカニズムについては長い間、謎となっていた。しかし、この疼痛のメカニズムにミクログリアが関与していることが明らかになったのだ。 | |||
図16aに示すように、痛覚や触覚に関わる知覚神経信号は脊髄後根から脊髄後角に入力し、そこで、二次知覚ニューロンに乗り換える。このシナプス部位には知覚神経からの側抑制(lateral inhibition)回路が組み込まれており、過剰な入力を和らげている。皮膚に障害が受けた時に痛みは比較的短い時間で和らぐのはこの仕組みによる。この回路にはGABAを伝達物質とする抑制性介在ニューロンが関与している(図16A)。 | |||
この部位で生ずる神経因性疼痛の発症メカニズムは次のような仕組みによることが明らかにされている(図15B)。知覚神経の末梢部に激しい損傷があると、知覚ニューロンの入力部位である脊髄後角周辺に多数のミクログリアが集まる。このミクログリアは上述のようにBDNF(brain derived neurotrophic factor)を遊離する。おそらく、損傷を受けた知覚回路の修復のためと考えられる。しかし、このBDNFが二次知覚神経細胞において細胞内のClイオンとKイオンの量をコントロールするためのClイオン/Kイオン交換ポンプを止めてしまうのだ。結果として、二次知覚ニューロン内のClイオン量が異常に増え、Kイオンが減少した状態が作られる。この状態では痛覚や触覚などの入力を側抑制するために遊離されたGABAによって、Clイオンチャンネルが開口すると、細胞外へのClイオンの流出、すなわち脱分極を生じさせることになる。痛みや高まった触感覚を和らげる仕組みが逆に促進してしまうことになるのだ<ref><pubmed>12917686</pubmed></ref>。。この状態はミクログリアの活動が続く間は回復することはない。従って、ちょっとした痛みや触覚が異常に強く入力されてしまうのである。触覚も過剰になると痛みと感ずるというやっかいな疾患である。原因が解明されたことによって神経因性疼痛の有効な治療法も開発されてきている。 | |||
==関連項目== | ==関連項目== | ||
*[[星状膠細胞]] | *[[星状膠細胞]] | ||
*[[稀突起膠細胞]] | *[[稀突起膠細胞]] | ||
*[[ミクログリア]] | *[[ミクログリア]] | ||
*[[神経因性疼痛]] | *[[神経因性疼痛]] | ||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2013年12月30日 (月) 19:17時点における版
工藤佳久
東京薬科大学 生命科学部 名誉教授
DOI XXXX/XXXX 原稿受付日:2013年11月2日 原稿完成日:2013年XX月XX日
英語名:glial cell 独:Gliazelle 仏:cellule gliale
同義語:膠細胞、神経膠細胞
脳に分布する主なグリア細胞はアストロサイト、オリゴデンドロサイトおよびミクログリアの三種に分類される。ヒトの脳におけるこれらグリア細胞全体の数はニューロンの数を遙かに上回る。しかし、電気的には不活性なこれらの細胞の中枢神経系における機能は発見以来、長い間、過小評価されてきた。しかし、20世紀後半からグリア細胞の新しい側面が浮き彫りにされてきたのである。ニューロンやシナプスの維持や管理機能に加えて、ニューロンとのダイナミックな情報交換によってニューロン活動やシナプス構築に直接関わっていることが明らかになってきたのだ。この事実はこれまでのニューロンのみを中心とした脳研究では脳機能の全貌を解き明かすことは困難であることを意味している。この項では三種のグリア細胞の形態と機能から細胞の脳機能発現における役割と重要性を述べる。
発見
グリア細胞のgliaはニューロンとニューロンの間の空間を埋める糊やセメントのような物質という意味のNerven Kitteが語源となっている。病理学者のルドルフ・ウイルヒョー(Rudolph Virchow)が1846年に発表した論文に記載されている当時の組織染色技術では細胞の形を捉えることができなかったので、とりあえず、「神経の間を埋める何らかの物質」というような意味としての定義したのだろう。ウイルヒョーはやがてこれが細胞であることをつきとめて、細胞病理学の教科書には結合組織細胞と記載している(1858年)。その後、オットー・ダイテルス(Otto Deiters) 、ミカエル・レンホサック(Michael von Lenhossek)、ウイルヘルム・ヒス(Wilhelm His)など19世紀末に活躍した多くの著名な神経組織学者がこの細胞の存在に興味を持ち、多様な形態や脳内分布の特徴を報告している。英語ではNeuroglia訳され、日本語では「膠(こう)細胞」(膠はにかわと呼ばれるコラーゲンを原料とする古い接着剤)と訳される。やがて、細胞染色法の発達によって、その実体が少しずつ明らかにされてきたが、カミロ・ゴルジ(Camillo Golgi)が確立したゴルジ染色法により、ニューロンと共にこの細胞の形態も浮き彫りになってきた。現在、グリア細胞の一つとして、よく知られているアストロサイト(astrocyte:アストログリア,astroglia)という名称を与えたのはレンホサックであるが、その実体を最も正確に記載したのがラモン・イ・カハール(Santiago Ramon y Cajal)である。ゴルジ染色を改良した染色法によって様々な形態のアストロサイトを観察している。その後、ピオ・デル・リオ-オルテガ(Pio del Rio-Hortega)がニューロン、アストロサイトに次ぐ第三の細胞群として、オリゴデンドロサイト(oligodendrocyte:オリゴデンドログリア:oligodendroglia)とミクログリア(microglia)の存在を報告している(1921)(グリア細胞発見の歴史については文献[1]および[2]を参照)。すなわち、これらの脳を構成する主要な細胞としてのグリア細胞群の存在は、ニューロンとほぼ同時代に発見されていたのである。現在、グリア細胞は、大グリア細胞(macroglia:アストロサイトとオリゴデンドロサイト)と、小グリア細胞(microglia:ミクログリア)に分類されている。
存在部位や機能によってその形態には多様性があり、それぞれが持つ特異的抗原分子によって分類される。現在は脳の第二の主役と呼ばれるほどに機能の重要さが注目されるようになってきている。多くのグリア細胞に関する叢書の序論にはヒトの脳におけるグリア細胞脳存在量はニューロンの10倍近くと述べられているが、その根拠は曖昧である。しかし、哺乳動物の脳におけるグリア細胞の分布比は脳が発達に伴って高くなっており[3]、また、他の霊長類(チンパンジーやゴリラなど)と比較しても高いことが明らかにされているので、脳の進化とグリア細胞の数には何らかの相関がある可能性は高い[4]。
発生
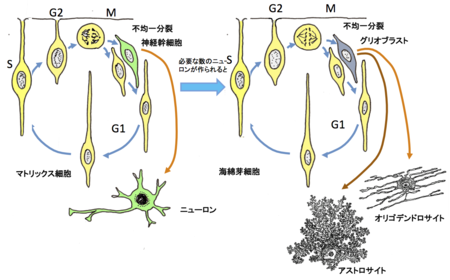
まず、マトリックス細胞から神経幹細胞が作られる。十分な神経細胞ができると、マトリックス細胞は海綿芽細胞にスイッチし、グリオブラストをつくる、これがアストロサイトとオリゴデンドロサイトに分化する。[5]の図を参考にして作成
20世紀の半ばまで、グリア細胞の発生については1889年にウイルヘルム・ヒス(Wilhenlm His)が提唱した二元説を基にして構築されていた。すなわち、神経細胞は胚芽細胞(germinal cell)を起源とする神経幹細胞(neuroblast)から発生し、グリア細胞は海綿芽細胞(sponginoblast)を起源とするグリア幹細胞(glioblast)から発生する。これらの幹細胞はほぼ同時期に作られ、それらがニューロンとグリア細胞を同時並行的に作り出すという学説が確立されてきた。しかし、それに対して、日本の解剖学者、藤田晢也(Setsuya Fujita)がトリチウム・チミジン・オートラジオグラフィー法を用いて、初期神経管における分裂細胞の動態を解析することによって、それまで海綿細胞(sponginoblast)または放射状グリア(radial glia)と呼ばれていた細胞が、すべて胚芽細胞であり、その核の周囲部が分裂サイクルに同期してエレベータ運動を生ずることを発見した[6]。すなわち、この時期の神経管には均質な細胞しか存在せず、この細胞は神経およびグリア細胞の発生の基盤になるものであり、マトリックス細胞(matrix cell)と呼ばれるべきものである。藤田はこのマトリックス細胞が不均一分裂し、マトリックスス細胞と神経幹細胞(neuroblast)が生ずることを明らかにしたのだ[7]。発生の初期の段階で、マトリックス細胞はこの分裂周期を繰り返すことによって、次々に神経幹細胞を造り出し、それらがニューロンに分化する。十分な量のニューロンができると、やがて、マトリクス細胞は脳室上衣グリア幹細胞(ependymoglioblast)にスイッチし、そこからグリア幹細胞が造られるようになることを証明した[5](図1)。アストロサイトもオリゴデンドロサイトもこのようにして造り出されることが明らかにされている。当然のことながら、藤田学説は猛烈な反対を受ける。そして、1970年のアメリカの神経発生学者達によって「神経系の細胞発生における命名法の改変に関する委員会」(ボールダー委員会)によって、藤田説は否定された。しかし、現在は遺伝子発現の解析などで藤田説が正しいことが認められている。それにもかかわらず、ボールダー委員会の決議が撤回されたとは聞いていない。
ミクログリアの発生についてはまだ議論が定着したとはいいきれない。アストロサイトやオリゴデンドロサイトと同様にグリア幹細胞から分化してくる細胞と考えるグループもある。しかし、最近になって、ミクログリアの起源は胎児期に卵黄嚢で造血細胞から分化して、神経管に浸入してくる中胚葉起源の細胞であることを示す証拠が報告されている[8]。しかし、ここでは最終的結論には至っていないとしておこう。
アストロサイト

A. GFAP抗体で標識したアストロサイト(脳スライス培養標本)(著者原図)
B. ゴルジ染色されたアストロサイト(超高圧電子顕微鏡による立体画像)(濱 清先生提供)
名称と形態の特徴
日本語では星状膠細胞と訳されている。その名はミカエル・レンホサックにより「星のような」細胞という意味で命名されて、現在に至っている。発見当初の細胞染色法ではこの細胞の骨格部分のみを染色していたために星のように見えたのだ。前述のようにアストロサイトが組織学的にニューロンとは異なった第二の脳細胞であることを正確に記載したのはカハール(1913)である。 超高圧電子顕微鏡による三次元形態解析によりアストロサイトは多数の突起がさらに細かく分岐し、その先端をシート状に広げていることが明らかにされている[9]。したがって、全体としては星状というよりスポンジ状であり、大きな表面積を持つ細胞である(図2)。しかし、脳内でアストロサイトが占める空間の大きさは絶対数のみではなく一つのアストロサイトのサイズとその突起の広がりにも依存する。ラットのアストロサイトの直径は30から60&mu mであり、3~4本の突起を伸ばしている。その結果、一個のアストロサイトが占める空間は66000&mu m3に及ぶ。それに対して、ヒトのアストロサイトの直径は100~200&mu mであり、その上、突起の数は40本を超えるので、その総体積はラットのアストロサイトの27倍にも及ぶ。ラットでは一個のアストロサイトに約9万個のシナプスが被われていると推定されている。これをヒトのアストロサイトに当てはめると、一個あたり、200万個以上のシナプスを被っていることになる[10]。
同種の細胞
アストロサイトの同種と考えられる細胞は脳室上衣細胞(ependemoglia)、小脳のバーグマン細胞(Bergmann glia)、網膜に分布するミューラー細胞(Muller cell)など多様である。しかし、これらの形は決して星の様な形はとっていない。
マーカー分子
アストロサイトまたはその同類の細胞を同定するためのマーカータンパク質として、glial fibrillary acidic protein(GFAP)、vimentin、S-100βなど多様な分子が確認されている。これらは多くの同種細胞に発現する。しかし、どの分子もすべての種類のアストロサイトに対応するものではない。また、分布する部位や、発達時期、障害の有無によって発現の程度が異なり、まったく発現しない場合もあるので、同定には注意を要する。
ヒト脳における分布量
ヒトの大脳皮質においてはニューロンの1.4倍ほど分布していると推定されている。これはラットやマウスの5倍に及ぶとされている[11]。しかし、高次機能におけるアストロサイトの重要性を主張するにはあまりインパクトのない分布量の差である。しかし、この数よりも上述のようなヒトのアストロサイトがラットのそれより27倍も大きな空間を占めるという点に注目すべきであろう。ヒトでは一個のアストロサイトが200万個以上のシナプスを被い、それがラットの5倍も存在するのだから、脳機能の進化との関連性を強く示唆すると考えることに異論はないだろう。アインシュタイン(Albert Einstein)の脳ではニューロンに対するアストロサイトの量が多かったという報告もある[12]。もちろん、同年齢の健康なヒトの脳のデータとの比較であるが、有意差を求めることは難しい。しかし、アストロサイトが単なる支持細胞としてだけではなく、脳の機能の高度化にも関わっている可能性を支持する証拠の一つとして挙げたくなる気持ちはわかる。
機能

アストロサイトの樹状突起は細かく枝分かれして広い範囲に広がる。その突起の一本は細動脈と接触している。アストロサイト同士のオーバーラップは小さい。ニューロンはアストロサイトが作る空間に位置し、その中で神経回路を作る。
脳の機能的構造維持
前述のようにアストロサイトは沢山の突起を伸ばし、その先端をシート状にひろげ、まるでスポンジのような形をしている。脳の灰白質の中では一つのアストロサイトは突起の先端部分で他のアストロサイトとわずかに重なり合う程度である。一方、アストロサイトの一端は血管に接触している。したがって、アストロサイトと血管の間に一定の三次元空間が造り出される(図3)[13]。したがって、ニューロンのネットワークはアストロサイトが造り出す網目状の空間に配置されていることになる。実際にニューロンが造るシナプスをアストロサイトの先端突起部(ラメラ:lamella)が覆っており、互いに緊密な機能的相関があることを示している。
細胞外イオン環境の調節
シナプス周辺に高密度に広がるアストロサイトの先端突起はニューロン活動に伴う細胞外イオン環境の変化の恒常性に重要な役割を持つ。ニューロンの活動、すなわち脱分極はニューロン内にNa+とCa2+を流入させ、細胞外にK+を流出させる。細胞外のK+が上昇はニューロン内外のイオン勾配を小さくしてしまうので、活動電位の発生に支障を来す。アストロサイトには多様なイオンポンプやイオンチャンネル(K+チャンネル、Na+/H+アンチポーター、Na+/K+/Cl-トランスポーター、Cl-チャンネル、水チャンネルなど)が分布しており、ニューロン活動に伴って生ずる細胞外液のイオン濃度の変化を調節し、恒常性を保っている。
血液-脳関門
脳の細動脈はアストロサイトの先端で覆われており、血管上皮細胞は互いに緊密に繋ぎ合わされている。ニューロンは血管とは直接接触していないので、血液と脳実質間の物質の受け渡しは血管壁とアストロサイト膜を介して行わなければならない。実際にこのままでは小さなイオンさえも通すことはできない。必要な分子は血管上皮とアストロサイトに発現した次のような特殊なトランスポーを介して行われる。この仕組みが、脳内への有害物質の浸入を防ぎ、必要な分子を選択的に通過させる血液―脳関門である。
- グルコーストランスポーター(GLUT1)
- 多様なアミノ酸トランスポーター
- エネルギー依存性アデニンヌクレオチド結合(adenine-nucleotide binding casset(ABC)トランスポーター
- 各種のイオン交換システム(Na+/H+,Na+/K+,Cl-/HCO3-)

Uptake2(モノアミントランスポーター)以外はすべてNa+を共輸送する。グリシントランスポーターとUptake1はCl-を共輸送する。特にグルタミン酸トランスポーターでは陽イオンの共輸送が大きくとりこみにより電位が発生する(起電性)。
神経伝達物質の取り込み
神経信号の伝達の際にシナプス周辺には神経伝達物質が大量に放出される。信号伝達後、過剰な伝達物質は早急にシナプス部位から排除されることが必要である。アセチルコリンやATPは特殊な分解酵素によって速やかに排除される。しかし、中枢神経系の約70%シナプスにおいて興奮性神経伝達物質して機能しているグルタミン酸をはじめとして、多くの伝達物質は特殊なトランスポーターによってシナプス周辺から除去される(図4)。グルタミン酸の取り込みには興奮性アミノ酸トランスポーター(Excitatory amino acid transporter: EAAT)が使われる。ニューロンにも存在するが、アストロサイトに発現するEAAT1(GLAST: Glutamate aspartate transporter)とEAAT2(GLT-1: Glutamate transporter-1)が主なグルタミン酸取り込み経路となっている。これらのトランスポーターは細胞内外のイオン濃度勾配を利用してグルタミン酸を輸送する。図4に示すように、グルタミン酸一分子の取り込みには2 - 3個のNaイオンと1個のHイオンが共輸送され、1個のKイオンが排出される。結果として、この取り込みの際にはアストロサイトは脱分極する(起電性トランスポーター:electrogenic transporter)[14]。 アストロサイトには抑制性伝達物質GABAおよびグリシンに対するトランスポーターも発現する。前者はGAT-3と呼ばれ、一分子のGABAの取り込みに2個のNaイオンの共輸送を必要とする。後者はGLYT-1と呼ばれ、一分子のグリシンの取り込みに2個のNaイオンと1個のClイオン の共輸送が必要とされる[15]。その他、アストロサイトにはタウリントランスポーターも発現している。 さらに中枢におけるuptake1と呼ばれるNaイオン依存性およびコカイン感受性の神経型モノアミントランスポーターに加えて、uptake2と呼ばれるNaイオンに依存しないステロイド感受性のモノアミントランスポーターが存在することが明らかにされている。アストロサイトにはuptake1もuptake2も存在し、モノアミン除去に重要な役割を果たしている。モノアミントランスポーターとして、ドーパミントランスポーター(DAT)、ノルエピネフリントランスポーター(NET)およびセロトニントランスポーター(SET)のcDNAがクローニングされている。その他、アストロサイトにはヒスタミントランスポーターの存在も同定されている[16]、[17]。
グリア細胞が合成し遊離する分子
グリア細胞はニューロトロフィン類(Nerve growth factor:NGF, Brain-derived neurotropic factor:BDNF, Neurotrophin 3, 4: NT3, NT4)やNeuropeptide Y(NPY)、Opioidペプチドなど多様なポリペプチドを合成し、遊離する。それらはニューロンに働きかけて、樹状突起の成長や軸索の伸張、神経回路の修復などに広範囲に脳機能の維持に寄与している。
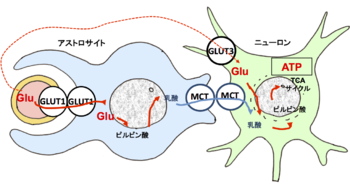
血中グルコースの大半は血管壁とアストロサイトの膜に発現するGLUT1を介してアストロサイトに取り込まれ、その中で乳酸まで代謝される。乳酸はMCTを介してニューロンに運び込まれて、TCAサイクルにより代謝されてATPが作られる。一部のグルコースは血管壁から細胞外液に拡散し、GLUT3を介して直接ニューロンに取り込まれる。Glu : グルコース、GLUT1, 3: 1型, 3型グルコーストランスポーター、MCT: モノカルボン酸トランスポーター
エネルギー供給機構
ニューロンにとって唯一のエネルギー源はグルコース(glucose)である。そのグルコースは上述のグルコーストランスポーター(glucose transporter )を使って、ニューロンにエネルギー源としてのグルコースを供給されている。実は、アストロサイトは取り込んだグルコースを乳酸(lactate)まで代謝してから、モノカルボン酸トランスポーター(mono-carboxylic acid transporter :MCT) を介してニューロンに供給しているのだ[18](図5)。 さらに重要なことは、細動脈周辺のアストロサイトの細胞内カルシウム濃度が高まると、細動脈の直径が広がり、血流量が高まるという事実である[19]。これはニューロン活動により遊離されたグルタミン酸が周辺のアストロサイトの活性化を介して血流量を増やし、エネルギーを必要とする部位へより多くのグルコースを供給できることを意味する。この事実から考えると、現在、脳活動の画像化に利用されている機能性核磁気共鳴イメージング(functional magnetic resonance imaging: fMRI)はアストロサイトの機能を間接的に見ているものではないかと思われる。
神経伝達物質受容体の発現
20世紀末まではもっぱら、ニューロンの支持細胞としての機能のみが注目されていたアストロサイトであるが、実は1980年代後半にはこの細胞にグルタミン酸受容体、GABA受容体、セロトニン受容体、ノルアドレナリン受容体など様々な神経伝達物質受容体が発現していることがすでに報告されている。この頃から、分子生物学的に神経伝達物質受容体の存在を実証する方法が確立され、アストロサイトにはGタンパク質共役型受容体が分布していることが明らかにされてきていたのだ。現在ではプリン受容体、アセチルコリン受容体、ヒスタミン受容体、ドーパミン受容体の発現も確認されている。もちろん、すべてのアストロサイトに発現しているのではない。しかし、主要な神経伝達物質のほとんどがアストロサイトに発現する可能性があるのだ[20]。
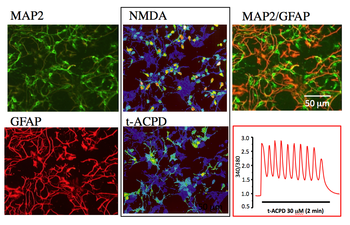
初代培養海馬細胞に蛍光カルシウム指示薬fura-2を負荷して、NMDAとt-ACPDの作用を検討した後MAP2抗体とGFAP抗体で、それぞれニューロンとアストロサイトを同定した。黒枠:NMDAまたはt-ACPDにカルシウム応答をする細胞。赤枠:t-ACPDによってアストロサイトに引き起こされたカルシウムオシレーション(動画参照)。
細胞内カルシウム濃度の変化
受容体の発現があったとしても、それが機能的に意味を持っているかどうかはわからず、多くの神経研究者は注目することなく時が過ぎた。というのも、アストロサイトは電気的にはまったく不活性であると報告されており、確かに、深い静止膜電位は持つものの、通電してもまったく応答することはない[21]。電気生理学が脳研究の中心的な解析手法であった当時、こんな不活性な細胞が伝達物質受容体を発現していたとしても意味がないと考えられたのも不思議はない。
ところがアストロサイトの活動を検出できる研究手法が開発されたことで、事情は一変する。カルシウムイメージング(calcium imaging)法、すなわち、細胞内カルシウム濃度の画像による解析方法である。細胞内に容易に導入することができる蛍光カルシウム指示薬を用い、カルシウム濃度の変動の結果生ずる蛍光強度の変動をビデオ画像として捉えるものである[22]。。この方法を使って、アストログリアのクローン細胞にセロトニンに対するカルシウム応答反応がることが報告された[23]。その後、中枢由来の培養細胞を用いて、グルタミン酸が細胞内カルシウム濃度上昇させることが報告された[24]、[25]。それに前後して、アセチルコリン、ヒスタミン、ATP、ノルアドレナリン、ドーパミン、セロトニンに対してもアストロサイトが同様なカルシウム応答反応を生ずることが報告されている。この反応は細胞の一点で見ると反復性律動的反応(カルシウムカルシウムオシレーション:calcium oscillation)として観察できる(図6)二次元的に観察すると、細胞内で反応が波状に広がるばかりか、周辺のアストロサイトにも波状に伝搬していることがわかる(カルシウムウエーブ: calcium wave)[26](動画1)。その伝搬速度は神経活動に比べると数オーダー遅い。しかし、この発見はそれまで不活性であり、脳のダイナミックな機能には寄与しないだろうと考えられていたアストロサイトが脳機能発現に積極的関与する可能性を示唆する重要な発見である。
グリア伝達物質の遊離
アストロサイトがモノアミン刺激によってGABAやグルタミン酸を遊離できることは、カルシウム濃度上昇の発見以前に報告されていた[27]、[28]。このような神経伝達物質遊離がカルシウムの上昇によって引き起されるのか。また、それによって周辺のニューロンに影響を与えることができるのか。これらの証拠があれば、ニューロンからアストロサイトへの情報伝達ばかりではなく、アストロサイトからニューロンへの逆行性情報伝達が証明できる。この点も比較的簡単にクリアされたのだ。アストロサイトにおけるカルシウム濃度上昇がグルタミン酸 、ATP、D-セリンなどの分子を遊離できること、これらの直接的にも間接的にもニューロンの活性に影響を与えることが証明されている(図7)[29]。 グルタミン酸(glutamate)は脳内のシナプスの70%で興奮性伝達物質として使われている分子である。従って、これを遊離できることはアストロサイトから周辺のシナプスに情報を伝達できることを意味する。 もう一つ重要な分子がATP (adenosine triphosphate)である。アストロサイトがATPを遊離できることはアストロサイト特異的培養系で、ATP測定をすることによって容易に証明できる。ATPはそのものが神経伝達物質の一つして認められており、ニューロンには7種のイオンチャンネル型のP2X受容体と8種のG-タンパク質共役型のP2Y型が分布していることが認められている。一方、アストロサイトにはイオンチャンネル型P2X受容体とG-タンパク質共役型のP2Y1、P2Y2、P2Y4を発現しているので、ATPに対する感受性が高く、カルシウムイメージング法でその効果を容易に確かめることができる[30]。 さらに、もう一つ重要な物質の遊離がある。D-セリン(D-serine)である。D-セリンはL-セリンからセリン異性化酵素(serine racemase)によって合成される。このアミノ酸はグルタミン酸受容体のサブタイプの一つであるNMDA受容体(N-methyl-D-aspartic acid receptor)の活性化因子の一つである。このNMDA受容体はカルシウム流入を引き起こすことができるチャンネルに連動しており、シナプス可塑性過程での重要性が高い。アストロサイトはセリン異性化酵素をもっており、D-セリンを遊離することができる[31]。最近はニューロンもD-セリンを産生することができると報告されており、この機能がアストロサイトの特異的機能であることには疑問があるが[32]、グリア細胞から遊離されてニューロンのグルタミン酸受容体に促進的作用を受けもっていることは確からしい。このような分子はグリオトランスミッター(gliotransmitters)と呼ばれている[33]。
トライパータイトシナプス
グリアとニューロンとがそれぞれ伝達物質受容体を発現し、ともに伝達物質を遊離できることから、脳機能が単にニューロンが作る回路のみではなく、グリア細胞とニューロンが作るもっと広範囲な回路の中から生み出されるのではないかという考え方が提唱されている。シナプス前ニューロンとシナプス後ニューロンとで作られるシナプスに、周辺のアストロサイトとの間でのシナプスの存在を加えたトライパータイトシナプス(tripartite synapse:三者間シナプス)という概念である[34]。これまでに述べたアストロサイトの性質を考えれば当然あって然るべき仕組みである。このようなシナプスの存在を考慮に入れて脳における情報処理を考えると、これまでにニューロンのみで作られる回路の上で考えていた脳機能はもっと複雑で奥深いものになる(図7)。
シナプス可塑性に及ぼす役割
すでに述べたようにアストロサイトには細かく枝分かれし、シート状の突起(ラメラ:lamella)を持つ樹状突起と、血管に巻き付く突起があり、そのラメラはニューロンの樹状突起上のシナプス構造を包み込んでいる。この構造はアストロサイトがシナプスをサポートしていることを示唆している。 また、海馬スライス培養標本において、アストロサイトを緑色蛍光タンパク質(GFP)で、ニューロンをrhodamine-dextranで標識して、二光子顕微鏡でリアルタイム観察した結果、アストロサイトと接触したシナプスの寿命は接触しなかったシナプスに比較して有意に長く、成熟型のシナプスに移行していくことが証明されている[35]この事実はおそらくシナプス可塑性にはアストロサイトの存在が重要であることを示唆しており、ますますアストロサイトの重要性が高まっている。
オリゴデンドロサイト
名称と形態の特徴
オリゴデンドロサイト(oligodendrocyte; oligodendroglia):この名前はアストログリアに比べて突起が少ないことに基づいている(図8)。日本語では「希突起神経膠細胞」と訳されている。この細胞は前述のようにカハールの弟子である、リオ・オルテガによって発見された(1928)、オルテガはこれらの細胞を第三の脳細胞として発表する。実は彼が第三の脳細胞と分類した中には後述のミクログリア(microglia)も含まれていたのだ。この発表は師であるカハールには受け入れられず、リオ・オルテガは破門の憂き目にあう。 中枢神経系におけるオリゴデンドロサイトの特徴的な形態は、突起が神経軸索に巻き付いてミエリン髄鞘を作っている様子である。成熟脳に分布するすべてのオリゴデンドロサイトが髄鞘を作っているわけではない。図8Bに示すように、見かけは単に突起を伸ばした細胞の形をとっているものも多い。
====同種の細胞==== リオ・オルテガはオリゴデントロサイトの突起の数や、細胞体の形態、分布する部位などからI型からⅣ型の四種に分類している。しかし、四種に分類されたオリゴデンドロサイトの基本的な機能には大きな差はないようである。 末梢神経の軸索に巻き付き、ミエリン髄鞘を作るシュワン細胞(Schwann cell)(亡突起膠細胞)もオリゴデンドロサイトと同種の細胞である。 成熟中枢神経系にはオリゴデンドロサイトの性質を備えながらミエリン髄鞘を作らない細胞も多く見出される。それらの中にはオリゴデントロサイト前駆細胞(olygodendrocyte progenitor cells :OPC)に分類される細胞があるが、さらに、コンドロイチン硫酸プロテオグリカン(NG2 condroitin sulfate proteoglycan) を発現する細胞が見出される。この細胞は成熟細胞でもオリゴデントロサイトと区別ができない。NG2またはポリデンドロサイト(polydendrocyte)と呼ばれるこの細胞もミエリン鞘形成に至るものとミエリン鞘を形成しない種類がある。この細胞は白質にも灰白質にも分布しており、時にはアストロサイトのような形態をとっていることもある。しかし、アストロサイトのマーカー蛋白であるGFAP(glial fibrillary acidic protein)は発現しない。実にややこしい細胞である[36]。 重要な事実はこの細胞が中枢損傷部位に集まり、グリア瘢痕(glial sxcar)、グリオーシス(gliosis)を作ることである。このような性質からこの細胞はsynantocyte(synant :ギリシャ語で:接触することを意味する言葉)と命名されたこともあるが、その後、この名前はあまり流布していない[37]。ニューロンにも似た性質を持っており、この細胞の存在は脳内に分布する多様な機能精細胞の系譜が同じであることを如実に語っている。
マーカー分子
オリゴデンドロサイトのマーカー分子は多様である。ミエリン髄鞘に特異的なタンパク質、プロテオリピッドプロテインproteolipid protein:PLP)やミエリンベーシックプロテイン(myelin basic protein:MBP)は髄鞘のマーカーとして使われる。その他、特殊な糖脂質、例えばガラクトセレブロシ(Galactocerebroside)やスルファチド(sulfatide)(3-O-硫酸化ガラクトシルセラミド)が分布しているので、これがよいマーカー分子になる。前者についてモノクローン抗体O1が、後者についてはモノクローン抗体O4が検出のために利用できる(図8A,B)。同じくミエリン髄鞘に豊富に存在する酵素類、cyclicnucleotide phosphatase (CNPase)などもよいマーカーとなる。
ヒト脳における分布量
オリゴデンドロサイトはミエリン鞘をつくるという役割のために白質に多く存在している。しかし、その分布量に関する報告は見ない。ヒト脳においてはアストロサイトがニューロンの二倍程度、後述のミクログリアがニューロンとほぼ同程度とされている。グリア細胞全体がニューロンの10倍以上と考えると、その分布量はアストロサイトの三倍以上ということになる。この細胞が中枢神経系内のほとんどの神経軸索の全長にわたって有髄化していることから考えると、その数はアストロサイト数倍は分布すると考えても無理はない。
機能
ミエリン髄鞘の形成 神経伝導速度の促進
オリゴデンドロサイトの重要な役割は神経軸索に絶縁テープのように巻き付き、神経信号の伝導効率を上げることである。この巻き付いた部分はミエリン髄鞘(myelin sheath)とよばれ、250~1000ミクロンほどの幅を持っている。髄鞘を持つ神経線維は有髄神経線維(myelinated nerve fiber)と呼ばれ、髄鞘を持たない神経線維は無髄神経線維(nonmyelinated nerve fiber)と呼ばれる。中枢神経系では一つのオリゴデンドログリアが、少ない場合は1から2本、多い場合は30本ほどの神経軸索に突起を伸ばしてミエリン髄鞘を作っている。神経信号は髄鞘と髄鞘の間、ランビエー絞輪( node of Ranvier)と呼ばれる部分を跳躍するように伝わっていく(跳躍伝導:saltatory conduction)(図8)。中枢神経系の神経線維はほとんど有髄神経である。この種の髄鞘のおかげで、神経軸索上を伝導する信号の速度は新幹線に優るとも劣らないものになる(秒速100メーター、時速360キロ)。因みにこの髄鞘を持たない神経軸索(自律神経の節後線維)での伝導速度は秒速1メーター程度、時速3.6キロだから、ゆっくりと歩く程度である(図9)。無髄神経で速度を高めるには神経線維の直径を大きくして、局所電位の大きさを高める必要がある。軟体動物のヤリイカでは速やかに動かす必要のある筋肉への神経線維は無髄であるので、その直径は1mmほどもある。我々の脳内の配線はこのように太い神経線維では不可能である。 図10Aは有髄神経線維をちょうどオリゴデンドロサイトの突起が神経軸索に届いた位置で、横断した電子顕微鏡像である。薄く紙のように広がった先端が四重に巻き付いており、一重分を注意深く見ると、二枚の膜からなっているのが分かる。一方、図10Bは有髄神経を二つの髄鞘の間(無髄状態になっており、ランビエー絞輪と呼ばれる)で縦方向に切ったものである。幾重にも巻いたオリゴデンドロサイトの突起部位が、ランビエー絞輪(Ranvier node)を挟んで、存在している(パラノード:paranode)。実際に、免疫組織化学的に、活動電位の発現に必要な、電位依存性Na+チャンネルはランビエー絞輪に局在している。一方、電位依存性K+チャンネル(Kv1.1 、Kv1.2)はパラノードの先、ジャクスタパラノード(Juxta paranode)に局在していることが示されている(図11)。 因みに無髄神経で速度を高めるとすると、神経線維の直径を大きくして、局所電位の大きさを高める必要がある。軟体動物のヤリイカでは速やかに動かす必要のある筋肉への神経線維は無髄であるので、その直径は1mmほどもある。我々の脳内の配線は極めて高度に発達しており、このように太い神経線維で配線することは不可能である。
太くなる神経線維が脳の可塑性に関与する
音楽家やスポーツ選手など通常の人より訓練を積んだヒトとの脳を核磁気共鳴画像で解析する試みが盛んに行われている。訓練や学習による脳の発達の手がかりを得ようとするものである[38]。これらの研究対象は当初、神経細胞やそのシナプス層、すなわち灰白質に置かれていた。しかし、その途上で、驚くべきことに白質、すなわち神経線維の集まりの部分に明らかな発達があることが見出されたのだ。場合によっては灰白質よりも明瞭な差があることが発見されたのだ[39]。最初の発見は音楽家の脳の脳梁の拡大であった。脳梁は有髄線維の束である。学習や訓練がその厚みが増すという事実は何を意味しているのだろうか。神経線維の数が増えている可能性もあるが、それより、一本一本の神経線維の太さが増している可能性が高いと考えられている。とは言え、神経軸索そのもののサイズが太くなるとは考えらにくい。とすると、軸索を覆う髄鞘部分が増大する。すなわち、神経軸索を包む髄鞘の巻数が増えたと考えるのが妥当だ。巻数が増えて、絶縁の程度が高くなると、伝導速度が増す可能性は高い。実際に最近ではMRIで水分子の拡散運動を画像化し、その拡散の方向依存性が解析されている。ミエリン化が進むと神経線維に沿った水の拡散の方向性(部分異方性:fractional anisotropy:FA)が高まることが明らかにされ、これを指標として、髄鞘形成のダイナミズムが詳しく調べられている。その結果、ジャグリングの練習、試験勉強、楽器の訓練などによってその能力が高められと、脳梁ばかりではなく大脳皮質や海馬の白質のミエリン化が促進されていることが明らかにされた[40]。これは可塑性が決してシナプスだけの現象ではないことを意味し、これまでに積み上げられてきた可塑性のメカニズムに関する理解を根本から変える必要を迫る事実である。
髄鞘のダイナミズム
上述のようにオリゴデンドロサイトは単に神経線維の上に巻き付いているだけはなく、神経の活動に応じて積極的にそのミエリン髄鞘を発達させるらしい。そのメカニズムが末梢有髄神経で示されている。末梢神経軸索に発生する活動電位が髄鞘を作るシュワン細胞(Schwann cells)の増殖や分化に影響を及ぼすというのだ。すなわち、神経軸索の活動がATPを介してシュワン細胞のP2受容体を活性化して細胞内カルシウム濃度を上昇させ、その結果、シュワン細胞のCa2+レベルが上昇する。細胞内で上昇したCa2+が軸索における未熟なシュワン細胞を髄鞘形成に導くというものである。この反応はさらに隣接するシュワン細胞に伝達されて、軸索全体にその効果が及ぶという。[41]。 さらに、神経軸索がグルタミン酸を遊離し、それが髄鞘に分布するグルタミン酸受容体(NMDA受容体やG-タンパク質共役型受容体)の活性を介して、髄鞘内Ca2+濃度の上昇を引き起こすことが明らかにされている。このCa2+上昇は髄鞘と神経軸索の結合部に発現するFynキナーゼを活性化し、ミエリンベーシックプロテイン(MBP)の産生を高めるのだ[42]。これは髄鞘の強化が活動依存性に促進されることを強く支持する発見である。同時に、オリゴデンドロサイトが発現しているATPやアデノシンに対する受容体を介した細胞内Ca2+の上昇も同じ機構で髄鞘の強化に寄与している可能性を支持する。 このような神経活動依存性のミエリン髄鞘形成は脳内の神経回路の成熟過程においても活発に引き起こされている可能性が高い。
神経活動の同期に関わる可能性
ATPやその代謝産物であるアデノシンによる髄鞘の興奮についてはさらに重要な発見がある。興奮した髄鞘で包まれている軸索における伝導速度を上昇させるのである[43]。オリゴデンドロサイトはその名の通り、あまり沢山の突起は持たないが、それでも多い場合は30本ほどの突起を繰り出して、神経軸索に髄鞘を作る。もし、この細胞が興奮したら、その細胞が関わる30本の軸索の伝導速度は一気に高まることになる(図12)。また、上述のように一つのオリゴデンドロサイトの興奮が隣接するオリゴデンドロサイトに伝搬すれば、ある集団の神経軸索の伝導速度は高められ、それらが送られるシナプス側において、非常に高い同期性を持つことになる。これは特定の情報の伝達効率を集団的に高めるのに有効な方法であり、これまでに考えられてきたシナプスにおける伝達効率促進とはまったく質の異なったメカニズムである。 髄鞘の厚みが増すことによる伝導速度促進および同じオリゴデンドロサイトに支配されている神経軸索間の同期は間違いなく脳機能の向上に関わるはずである。脳の可塑性を支える要素の一つとして注目されるべき機能である。 しかし、一つ、どうしても理解できない点がある。一個のオリゴデンドロサイトから繰り出された複数のシート状突起が、それぞれの軸索に接触した後に、バームクーヘンのような形に幾重にも巻き付くことができるのだろうか?軸索の表面がくるくると回って糸巻きのように巻き取っている仕組みがなければならないが、これはまだ証明されていない。
ミクログリア
名称と形態の特徴
ミクログリア(microglia)の名称は、この細胞より先に同定されたアストロサイトや、ほぼ同時に発見されたオリゴデンドロサイトに類似の細胞でありながらサイズが小さいことから単純に命名されたものと思われる。見かけの形態の特徴は小さいことと、突起が少ないことであるが、リオ-オルテガは発見の早い段階にこの細胞にはさらに重要な形態変化があることを発見している。正常な脳の中でのミクログリアは突起を伸ばした形だが、周辺に何らかの障害が生ずると、突起を縮め、細胞体部分が大きくなる「活性化型」にかわり、やがて、アメーバ状に形を変えて、障害部周辺を活発に動き回るようになるのだ(図13)。
同種の細胞
発生の項目でも述べたように、ミクログリアの起源は胎児期に卵黄嚢で造血細胞から分化して、神経管に浸入してくる中胚葉起源の細胞であることを示す証拠が報告されている。実際に、中枢の損傷部位の周辺をアメーバ運動しているミクログリアの姿は末梢の免疫細胞マクロファージと区別がつかない。形態のみではない、この細胞の細胞表面に発現する分子もマーカーの項で述べるように非常に似通っている。さらに、障害部に到着すると、死んだ細胞をどんどんと食べ始めるの様子もマクロファージと同じである。この両者は同じ起源であると考えてもよいだろう。
マーカー分子
ミクログリアはいろいろなマーカーによって検出できる。例えば、チアミン・ピロフォスファターゼ(Thiamine pyrophosphatase: TPPase)や非特異的エステラーゼ(nonspecific esterase NSE)など中枢神経系の細胞の中ではミクログリアに比較的特異的に発現する酵素類を検出する方法である。また、マクロファージの特異的抗体や、免疫関連の補体受容体に対する抗体を用いても脳内のミクログリアを免疫染色できる。一方、ミクログリアの細胞表面には主要組織適合遺伝子複合体(Major histocompatibility complex:MHC)分子が存在し、その抗体はミクログリアのよいマーカーとなる。 現在、ミクログリアの最も有効なマーカーとして利用されるのがIba1と呼ばれるタンパク質である。Iba1抗体もミクログリアばかりではなく、マクロファージにも反応する[44]。
ヒト脳における分布量
ヒトの脳においてミクログリアは脳の灰白質にほぼ均一に分布し、全体のグリア細胞のほぼ10%程度と見積もられている。グリア細胞全体でニューロンのほぼ10倍と見積もれば、ミクログリアはニューロンとほぼ同数がニューロンと同じ場所に分布していることになる。
機能
損傷を受けた細胞の除去
ミクログリアがリオ・オルテガによって第三の脳細胞としてオリゴデンドロサイトと共に発見されたのは1932年であるが、その後その性質はごく最近になるまでほとんど解明されないままになっていた(図14)。実は、20世紀初頭、アルツハイマー(Alois Arzheimer)や彼の同時代の病理学者達は神経変性が生じている部位に突起のないアメーバ状の細胞が多数浸潤していることに気づいていた。これらは顆粒細胞(granule cells)とか格子細胞(lattice cells)と呼ばれ、当時は認識されていたアストロサイトとは別ものであり、神経疾患部位に出現する細胞と認識していた。この姿は損傷部位に浸潤している細胞であり、この姿が誤解されて、障害の犯人扱いされることがあった。しかし、脳という閉鎖空間では死んだ細胞を素早く片付けることが必須であり、その意味で、極めて重要な機能である。
ミクログリアの出動
二光子励起顕微鏡によって脳に傷つけることなく深部に存在する細胞の動きを捉えることができるようになり、多くの新しい発見がなされている。その中でもミクログリアのダイナミックな活動の可視化はこの細胞の機能の解明に役立っている。特に興味深いのはミクログリアの突起の正常時の柔らかではあるがダイナミックな動き、そして、損傷部位に対するミクログリアの突起の早い反応とその後の損傷部位への移動の過程である。固定された組織標本では認識できない。ダイナミックな活動が示されている[45]。 先にも述べたようにミクログリアの細胞表面にはMHC分子が発現しており、その姿は末梢におけるマクロファージのそれと一致する。静止状態のミクログリアからは想像もできないが、損傷部位に浸潤した活動期のミクログリアの形態はアメーバ状になり、活発に細胞貪食活動を示す(図14)。その姿はマクロファージと区別がつかない。しかし、損傷部位の血管は透過性が高まり、末梢のマクロファージの浸潤を許している可能性が高いので、損傷部位に集まっているアメーバ状の細胞がすべて活性型のミクログリアとは言い切れない。とはいえ、静止型のミクログリアが活性化状態になり細胞貪食性を持つアメーバ状に変化する様は組織学的に正確に捉えられている[46]。
脳内清掃システム
脳に整然と配置されているミクログリアが脳細胞を無差別に攻撃するなどありえない。では、どのような条件でミクログリアの活性が高まり、そのようにして特定の損傷を受けた細胞のみを貪食するのか。 損傷を受けた脳細胞からはATPが放出される。細胞外液のATP濃度は正常状態では低く保たれているので、ATP濃度の高い部位はそこに損傷細胞が存在することを示す信号になる。ミクログリアは多様なプリン受容体を発現しているが、そのうち、P2X4受容体が刺激されると、ミクログリアの突起はATP濃度の高い方向に向かって伸びて行く[47]。さらに、その部位に近づくと、P2Y12受容体が刺激され、BDNFなどのニューロトロフィンを遊離するのだ[48]。この段階では損傷部位の修復のために機能しているようである。ここまでの過程を見ると、損傷を受けた脳細胞はATPを救助信号として、「私を見つけて、助けて、Find me and help me」と叫んでいるようである。 ところが、その救助がすでに間に合わない状態である場合にミクログリアはアメーバ状に形を変えて、その場に移動する。そして、損傷を受けた細胞を貪食する。この時、貪食する必要のある死んだ細胞を見つけ出しているのだ。これが成り立つためには、死にかかった細胞から出される信号を認知する必要がある。実はミクログリアにはもう一つプリン受容体、P2Y6が存在している。この受容体は不思議なことに、ATPやADPには反応しないのだ。発見以後しばらくはその役目が不明であったが、やがて、P2Y6を活性化するのはウリジン二リン酸(UDP)であることが明らかにされた[49]。。UDPはやたらに細胞外に遊離される分子ではない。死にかかった細胞からごく少量遊離されるだけである。P2Y6受容体がUDPで刺激されると、ミクログリアのアメーバ運動が活性化され貪食機能が活性化される。こうして、貪食能が高まったミクログリアが周辺に分布する細胞のすべてを貪食するのはない。もう一つ条件がある。死んで細胞膜が壊れた時に、提示される膜成分のリン脂質の成分であるホスファチジルセリン(phosphatidylserine)である。これを提示していることを認識して、その細胞のみを貪食するのだ。このホスファチジルセリンは「私を食べて信号、Eat me signal」なのである[50](図15)。ミクログリアは単なる破壊者でも、無差別な掃除係でもない。非常に高度な認識機能を備えた、環境整備係として機能していることがわかる。
シナプスの保守点検
ミクログリアが高度な仕組みを持つ環境整備係であることはそれだけでもこの細胞が脳内で重要な要素であることを物語っている。しかし、最近は神経回路の保守点検にも関わっている可能性が示唆されている。これも蛍光タンパク質発現させたミクログリアの形態の二光子励起顕微鏡を用いた長時間ライブイメージングによって明らかにされている。 先に述べたように静止状態のミクログリア(ラミファイド型)は静止状態とはいいながら、沢山の突起をゆらゆらと動かせている。この突起の動きには生理学的目的があるようで、正常なシナプスには1時間に1回、一回あたり5分間ほど接触することが観察されている。一方、使われないシナプスにはこのような繊細な管理を行われていないのだ[51]。接触時にミクログリアとシナプスの間でどのような情報交換が行われているかは不明だが、ミクログリアの神経回路形成への重要性を示唆する重要な事実である。 ミクログリアがシナプス回路の維持再編に積極的に働いていることの証拠はまだある。視覚回路の中継核である外側膝状体で活発に行われている左右の視覚路の選択の過程である。未熟な視覚回路では左右両側の視神経節細胞からの入力を受けているが、それが発達に応じて主に同側からの入力が除去されて行く。この過程でミクログリアの得意技とも言うべき、不要物処理機能が発揮されるのだ[52]。 ではこのような選択的な除去はどのように行われるのだろうか。最終的にはミクログリアの貪食機能が発揮されるものと考えられるが、どのようにして不要シナプスを認識しているのだろうか。これには前述の脳内免疫細胞としての性質が使われているらしい。例えば、ミクログリアに発現している補体分子、C3の合成が、その合成の活性化因子Clqの存在により高まり、C3受容体を多く発現しているシナプス部位を認識して除去するという仕組みである[53]。また、MHCのClass1が神経傷害時のシナプス除去に関与している可能性を示唆する証拠もある[54]。ミクログリアが脳内の免疫細胞だと考えられているもののまだその実体は十分に解明されていない。その能力がシナプスの消長に積極的に関わるとすれば、神経回路の構築や維持における最重要因子としてその機能を再認識する必要がある。
神経因性疼痛
ミクログリアが悪玉ではないことは十分に理解できたが、最後に、ミクログリアの関与するやっかいな疾患について述べなければならない。「神経因性疼痛」(neuropathic pain allodynia)である。帯状疱疹の後遺症や手術や怪我の後遺症として、損傷部周辺の触覚が激しい疼痛として感じられる疾患である。その成立メカニズムについては長い間、謎となっていた。しかし、この疼痛のメカニズムにミクログリアが関与していることが明らかになったのだ。 図16aに示すように、痛覚や触覚に関わる知覚神経信号は脊髄後根から脊髄後角に入力し、そこで、二次知覚ニューロンに乗り換える。このシナプス部位には知覚神経からの側抑制(lateral inhibition)回路が組み込まれており、過剰な入力を和らげている。皮膚に障害が受けた時に痛みは比較的短い時間で和らぐのはこの仕組みによる。この回路にはGABAを伝達物質とする抑制性介在ニューロンが関与している(図16A)。 この部位で生ずる神経因性疼痛の発症メカニズムは次のような仕組みによることが明らかにされている(図15B)。知覚神経の末梢部に激しい損傷があると、知覚ニューロンの入力部位である脊髄後角周辺に多数のミクログリアが集まる。このミクログリアは上述のようにBDNF(brain derived neurotrophic factor)を遊離する。おそらく、損傷を受けた知覚回路の修復のためと考えられる。しかし、このBDNFが二次知覚神経細胞において細胞内のClイオンとKイオンの量をコントロールするためのClイオン/Kイオン交換ポンプを止めてしまうのだ。結果として、二次知覚ニューロン内のClイオン量が異常に増え、Kイオンが減少した状態が作られる。この状態では痛覚や触覚などの入力を側抑制するために遊離されたGABAによって、Clイオンチャンネルが開口すると、細胞外へのClイオンの流出、すなわち脱分極を生じさせることになる。痛みや高まった触感覚を和らげる仕組みが逆に促進してしまうことになるのだ[55]。。この状態はミクログリアの活動が続く間は回復することはない。従って、ちょっとした痛みや触覚が異常に強く入力されてしまうのである。触覚も過剰になると痛みと感ずるというやっかいな疾患である。原因が解明されたことによって神経因性疼痛の有効な治療法も開発されてきている。
関連項目
参考文献
- ↑ H Kettenmann, B R Ranson
Neuroglia 2nd Ed
Oxford University Press(New York)2005 - ↑ 工藤佳久
脳とグリア細胞
技術評論社(東京)2011 - ↑
Bass, N.H., Hess, H.H., Pope, A., & Thalheimer, C. (1971).
Quantitative cytoarchitectonic distribution of neurons, glia, and DNa in rat cerebral cortex. The Journal of comparative neurology, 143(4), 481-90. [PubMed:4945394] [WorldCat] [DOI] - ↑
Sherwood, C.C., Stimpson, C.D., Raghanti, M.A., Wildman, D.E., Uddin, M., Grossman, L.I., ..., & Hof, P.R. (2006).
Evolution of increased glia-neuron ratios in the human frontal cortex. Proceedings of the National Academy of Sciences of the United States of America, 103(37), 13606-11. [PubMed:16938869] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
FUJITA, S. (1965).
AN AUTORADIOGRAPHIC STUDY ON THE ORIGIN AND FATE OF THE SUB-PIAL GLIOBLAST IN THE EMBRYONIC CHICK SPINAL CORD. The Journal of comparative neurology, 124, 51-9. [PubMed:14304273] [WorldCat] [DOI] - ↑
FUJITA, S. (1960).
Mitotic pattern and histogenesis of the central nervous system. Nature, 185, 702-3. [PubMed:13825588] [WorldCat] [DOI] - ↑
FUJITA, S. (1964).
ANALYSIS OF NEURON DIFFERENTIATION IN THE CENTRAL NERVOUS SYSTEM BY TRITIATED THYMIDINE AUTORADIOGRAPHY. The Journal of comparative neurology, 122, 311-27. [PubMed:14184856] [WorldCat] [DOI] - ↑
Prinz, M., & Mildner, A. (2011).
Microglia in the CNS: immigrants from another world. Glia, 59(2), 177-87. [PubMed:21125659] [WorldCat] [DOI] - ↑
Hama, K., Arii, T., Katayama, E., Marton, M., & Ellisman, M.H. (2004).
Tri-dimensional morphometric analysis of astrocytic processes with high voltage electron microscopy of thick Golgi preparations. Journal of neurocytology, 33(3), 277-85. [PubMed:15475683] [WorldCat] [DOI] - ↑
DeFelipe, J., Alonso-Nanclares, L., & Arellano, J.I. (2003).
Microstructure of the neocortex: comparative aspects. Journal of neurocytology, 31(3-5), 299-316. [PubMed:12815249] [WorldCat] [DOI] - ↑
Nedergaard, M., Ransom, B., & Goldman, S.A. (2003).
New roles for astrocytes: redefining the functional architecture of the brain. Trends in neurosciences, 26(10), 523-30. [PubMed:14522144] [WorldCat] [DOI] - ↑
Diamond, M.C., Scheibel, A.B., Murphy, G.M., & Harvey, T. (1985).
On the brain of a scientist: Albert Einstein. Experimental neurology, 88(1), 198-204. [PubMed:3979509] [WorldCat] [DOI] - ↑
Nedergaard, M., Ransom, B., & Goldman, S.A. (2003).
New roles for astrocytes: redefining the functional architecture of the brain. Trends in neurosciences, 26(10), 523-30. [PubMed:14522144] [WorldCat] [DOI] - ↑
Kristensen, A.S., Andersen, J., Jørgensen, T.N., Sørensen, L., Eriksen, J., Loland, C.J., ..., & Gether, U. (2011).
SLC6 neurotransmitter transporters: structure, function, and regulation. Pharmacological reviews, 63(3), 585-640. [PubMed:21752877] [WorldCat] [DOI] - ↑
Zhou, Y., & Danbolt, N.C. (2013).
GABA and Glutamate Transporters in Brain. Frontiers in endocrinology, 4, 165. [PubMed:24273530] [PMC] [WorldCat] [DOI] - ↑
Inazu, M., Takeda, H., & Matsumiya, T. (2003).
[The role of glial monoamine transporters in the central nervous system]. Nihon shinkei seishin yakurigaku zasshi = Japanese journal of psychopharmacology, 23(4), 171-8. [PubMed:13677912] [WorldCat] - ↑ A Verkhratsky, A Butt
Glial Neurobiology A Textbook
Wiley(England)2007 - ↑
Pierre, K., & Pellerin, L. (2005).
Monocarboxylate transporters in the central nervous system: distribution, regulation and function. Journal of neurochemistry, 94(1), 1-14. [PubMed:15953344] [WorldCat] [DOI] - ↑
Jackson, P.L. (1986).
Child care: a working solution. California nurse, 82(8), 5. [PubMed:3638986] [WorldCat] - ↑
Benvenga, S., Li Calzi, L., & Robbins, J. (1987).
Effect of free fatty acids and nonlipid inhibitors of thyroid hormone binding in the immunoradiometric assay of thyroxin-binding globulin. Clinical chemistry, 33(10), 1752-5. [PubMed:3117429] [WorldCat] - ↑
Kuffler, S.W., Nicholls, J.G., & Orkand, R.K. (1966).
Physiological properties of glial cells in the central nervous system of amphibia. Journal of neurophysiology, 29(4), 768-87. [PubMed:5966434] [WorldCat] [DOI] - ↑
Kudo, Y., & Ogura, A. (1986).
Glutamate-induced increase in intracellular Ca2+ concentration in isolated hippocampal neurones. British journal of pharmacology, 89(1), 191-8. [PubMed:2879588] [PMC] [WorldCat] [DOI] - ↑
Kudo, Y., Ozaki, K., Miyakawa, A., Amano, T., & Ogura, A. (1986).
Monitoring of intracellular Ca2+ elevation in a single neural cell using a fluorescence microscope/video-camera system. Japanese journal of pharmacology, 41(3), 345-51. [PubMed:3761750] [WorldCat] [DOI] - ↑
Cornell-Bell, A.H., Finkbeiner, S.M., Cooper, M.S., & Smith, S.J. (1990).
Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science (New York, N.Y.), 247(4941), 470-3. [PubMed:1967852] [WorldCat] [DOI] - ↑
De Barry, J., Ogura, A., & Kudo, Y. (1991).
Ca2+ Mobilization in Cultured Rat Cerebellar Cells: Astrocytes are Activated by t-ACPD. The European journal of neuroscience, 3(11), 1146-1154. [PubMed:12106244] [WorldCat] [DOI] - ↑
Cornell-Bell, A.H., & Finkbeiner, S.M. (1991).
Ca2+ waves in astrocytes. Cell calcium, 12(2-3), 185-204. [PubMed:1647876] [WorldCat] [DOI] - ↑
Shain, W., Madelian, V., Martin, D.L., Kimelberg, H.K., Perrone, M., & Lepore, R. (1986).
Activation of beta-adrenergic receptors stimulates release of an inhibitory transmitter from astrocytes. Journal of neurochemistry, 46(4), 1298-303. [PubMed:3005511] [WorldCat] [DOI] - ↑
Hertz, L., Peng, L., Hertz, E., Juurlink, B.H., & Yu, P.H. (1989).
Development of monoamine oxidase activity and monoamine effects on glutamate release in cerebellar neurons and astrocytes. Neurochemical research, 14(10), 1039-46. [PubMed:2575232] [WorldCat] [DOI] - ↑
Morita, M., Yoshiki, F., & Kudo, Y. (2003).
Simultaneous imaging of phosphatidyl inositol metabolism and Ca2+ levels in PC12h cells. Biochemical and biophysical research communications, 308(4), 673-8. [PubMed:12927771] [WorldCat] [DOI] - ↑
Bal-Price, A., Moneer, Z., & Brown, G.C. (2002).
Nitric oxide induces rapid, calcium-dependent release of vesicular glutamate and ATP from cultured rat astrocytes. Glia, 40(3), 312-23. [PubMed:12420311] [WorldCat] [DOI] - ↑
Wolosker, H., Sheth, K.N., Takahashi, M., Mothet, J.P., Brady, R.O., Ferris, C.D., & Snyder, S.H. (1999).
Purification of serine racemase: biosynthesis of the neuromodulator D-serine. Proceedings of the National Academy of Sciences of the United States of America, 96(2), 721-5. [PubMed:9892700] [PMC] [WorldCat] [DOI] - ↑
Ying-Luan, Z., Zhao, Y.L., & Mori, H. (2007).
[Role of D-serine in the mammalian brain]. Brain and nerve = Shinkei kenkyu no shinpo, 59(7), 725-30. [PubMed:17663143] [WorldCat] - ↑
Oliet, S.H., & Mothet, J.P. (2006).
Molecular determinants of D-serine-mediated gliotransmission: from release to function. Glia, 54(7), 726-37. [PubMed:17006901] [WorldCat] [DOI] - ↑
Araque, A., Parpura, V., Sanzgiri, R.P., & Haydon, P.G. (1999).
Tripartite synapses: glia, the unacknowledged partner. Trends in neurosciences, 22(5), 208-15. [PubMed:10322493] [WorldCat] [DOI] - ↑
Nishida, H., & Okabe, S. (2007).
Direct astrocytic contacts regulate local maturation of dendritic spines. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(2), 331-40. [PubMed:17215394] [PMC] [WorldCat] [DOI] - ↑
Nishiyama, A., Komitova, M., Suzuki, R., & Zhu, X. (2009).
Polydendrocytes (NG2 cells): multifunctional cells with lineage plasticity. Nature reviews. Neuroscience, 10(1), 9-22. [PubMed:19096367] [WorldCat] [DOI] - ↑
Butt, A.M., Kiff, J., Hubbard, P., & Berry, M. (2003).
Synantocytes: new functions for novel NG2 expressing glia. Journal of neurocytology, 31(6-7), 551-65. [PubMed:14501223] [WorldCat] [DOI] - ↑
Fields, R.D. (2011).
Imaging learning: the search for a memory trace. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 17(2), 185-96. [PubMed:21403182] [PMC] [WorldCat] [DOI] - ↑
Fields, R.D. (2005).
Myelination: an overlooked mechanism of synaptic plasticity? The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 11(6), 528-31. [PubMed:16282593] [PMC] [WorldCat] [DOI] - ↑
Scholz, J., Klein, M.C., Behrens, T.E., & Johansen-Berg, H. (2009).
Training induces changes in white-matter architecture. Nature neuroscience, 12(11), 1370-1. [PubMed:19820707] [PMC] [WorldCat] [DOI] - ↑
Stevens, B., & Fields, R.D. (2000).
Response of Schwann cells to action potentials in development. Science (New York, N.Y.), 287(5461), 2267-71. [PubMed:10731149] [WorldCat] [DOI] - ↑
Wake, H., Lee, P.R., & Fields, R.D. (2011).
Control of local protein synthesis and initial events in myelination by action potentials. Science (New York, N.Y.), 333(6049), 1647-51. [PubMed:21817014] [PMC] [WorldCat] [DOI] - ↑
Yamazaki, Y., Hozumi, Y., Kaneko, K., Sugihara, T., Fujii, S., Goto, K., & Kato, H. (2007).
Modulatory effects of oligodendrocytes on the conduction velocity of action potentials along axons in the alveus of the rat hippocampal CA1 region. Neuron glia biology, 3(4), 325-34. [PubMed:18634564] [WorldCat] [DOI] - ↑
Ohsawa, K., Imai, Y., Sasaki, Y., & Kohsaka, S. (2004).
Microglia/macrophage-specific protein Iba1 binds to fimbrin and enhances its actin-bundling activity. Journal of neurochemistry, 88(4), 844-56. [PubMed:14756805] [WorldCat] [DOI] - ↑
Nimmerjahn, A., Kirchhoff, F., & Helmchen, F. (2005).
Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science (New York, N.Y.), 308(5726), 1314-8. [PubMed:15831717] [WorldCat] [DOI] - ↑
Davalos, D., Grutzendler, J., Yang, G., Kim, J.V., Zuo, Y., Jung, S., ..., & Gan, W.B. (2005).
ATP mediates rapid microglial response to local brain injury in vivo. Nature neuroscience, 8(6), 752-8. [PubMed:15895084] [WorldCat] [DOI] - ↑
Ohsawa, K., Irino, Y., Nakamura, Y., Akazawa, C., Inoue, K., & Kohsaka, S. (2007).
Involvement of P2X4 and P2Y12 receptors in ATP-induced microglial chemotaxis. Glia, 55(6), 604-16. [PubMed:17299767] [WorldCat] [DOI] - ↑
Biggs, J.E., Lu, V.B., Stebbing, M.J., Balasubramanyan, S., & Smith, P.A. (2010).
Is BDNF sufficient for information transfer between microglia and dorsal horn neurons during the onset of central sensitization? Molecular pain, 6, 44. [PubMed:20653959] [PMC] [WorldCat] [DOI] - ↑
Inoue, K. (2007).
UDP facilitates microglial phagocytosis through P2Y6 receptors. Cell adhesion & migration, 1(3), 131-2. [PubMed:19262132] [PMC] [WorldCat] [DOI] - ↑
Palattella, G., Gentili, S., Mangani, F., Bellardini, M., & Palattella, P. (1986).
[Anxiety experienced by patients undergoing dental care. II]. Studion dell'ansia effettuato su pazienti da sottoporre ad interventi odontostomatologici. Nota II. Dental Cadmos, 54(8), 103-5. [PubMed:3464483] [WorldCat] - ↑
Wake, H., Moorhouse, A.J., Jinno, S., Kohsaka, S., & Nabekura, J. (2009).
Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(13), 3974-80. [PubMed:19339593] [PMC] [WorldCat] [DOI] - ↑
Schafer, D.P., Lehrman, E.K., Kautzman, A.G., Koyama, R., Mardinly, A.R., Yamasaki, R., ..., & Stevens, B. (2012).
Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron, 74(4), 691-705. [PubMed:22632727] [PMC] [WorldCat] [DOI] - ↑
Stevens, B., Allen, N.J., Vazquez, L.E., Howell, G.R., Christopherson, K.S., Nouri, N., ..., & Barres, B.A. (2007).
The classical complement cascade mediates CNS synapse elimination. Cell, 131(6), 1164-78. [PubMed:18083105] [WorldCat] [DOI] - ↑
Oliveira, A.L., Thams, S., Lidman, O., Piehl, F., Hökfelt, T., Kärre, K., ..., & Cullheim, S. (2004).
A role for MHC class I molecules in synaptic plasticity and regeneration of neurons after axotomy. Proceedings of the National Academy of Sciences of the United States of America, 101(51), 17843-8. [PubMed:15591351] [PMC] [WorldCat] [DOI] - ↑
Tsuda, M., Shigemoto-Mogami, Y., Koizumi, S., Mizokoshi, A., Kohsaka, S., Salter, M.W., & Inoue, K. (2003).
P2X4 receptors induced in spinal microglia gate tactile allodynia after nerve injury. Nature, 424(6950), 778-83. [PubMed:12917686] [WorldCat] [DOI]