「Held萼状シナプス」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の13版が非表示) | |||
| 4行目: | 4行目: | ||
<font size="+1">[http://researchmap.jp/ttakahas 高橋 智幸]</font><br> | <font size="+1">[http://researchmap.jp/ttakahas 高橋 智幸]</font><br> | ||
''沖縄科学技術大学院大学細胞分子シナプス機能ユニット''<br> | ''沖縄科学技術大学院大学細胞分子シナプス機能ユニット''<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 12行目: | 11行目: | ||
同義語:Held杯状シナプス、Heldのカリックスシナプス | 同義語:Held杯状シナプス、Heldのカリックスシナプス | ||
{{box|text= | {{box|text= 蝸牛神経核から伸長した軸索終末端が、対側台形体核の主細胞に形成するカリックス(calyx、萼)状のシナプス。音入力を聴覚中枢へ高速かつ正確に伝達するため、前終末端が台形体核主細胞体を萼状に包み込み、興奮性神経伝達物質グルタミン酸を放出する。巨大なシナプス前終末をもつことから、シナプス前終末とシナプス後細胞からの同時パッチクランプ記録が可能であり、温血動物中枢シナプス伝達機構の研究上、格好のモデルとなっている。}} | ||
==Held萼状シナプスとは== | ==Held萼状シナプスとは== | ||
[[Image:CalyxFig1.png|thumb|350px|''' | [[Image:CalyxFig1.png|thumb|350px|'''図1.カリックスシナプス前終末からのパッチクランプ記録'''<br>(左)ラット脳幹スライス標本におけるシナプス前終末とシナプス後細胞からの同時パッチクランプ記録の例。画面中央円形の構造が台形体核主細胞の細胞体、その細胞体上部辺縁に位置する三日月形の構造がカリックスシナプス前終末である。(右)パッチ電極より蛍光色素を注入し、カリックスシナプス前終末の形態を可視化した顕微鏡写真。透過光像と重ね合わせてある。]] | ||
[[脳幹]]の[[蝸牛神経核]]から伸長した[[軸索]]終末端が、対側[[台形体核]]の主細胞に形成するカリックス(calyx、萼)状の[[シナプス]]。ドイツの解剖学者[[wikipedia:de:Hans Held | [[脳幹]]の[[蝸牛神経核]]から伸長した[[軸索]]終末端が、対側[[台形体核]]の主細胞に形成するカリックス(calyx、萼)状の[[シナプス]]。ドイツの解剖学者[[wikipedia:de: Hans von Held |Hans von Held]](1866-1942)が[[ゴルジ染色]]によって同定した<ref name=ref1>'''Hans von Held'''<br>Die zentrale Gehörleitung.<br>''Arch. Anat. Physiol. Anat. Abt. '' :1893, 17;201-248.</ref>。[[聴覚]]神経回路を構成し、[[音源定位]]に重要な情報処理機能を果たしている。音入力を聴覚中枢へ高速かつ正確に伝達するため、前終末端が台形体核主細胞体を萼状に包み込み、入力信号に応じて多量の興奮性[[神経伝達物質]][[グルタミン酸]]を放出する。1994年、Forsytheはこの巨大[[シナプス前終末]]から[[パッチクランプ記録]]を行うことに成功した<ref name=ref2><pubmed> 7837096 </pubmed></ref>。ついでシナプス前終末とシナプス後細胞からの同時パッチクランプ記録(図1)が可能になり、温血動物中枢シナプス伝達機構の研究上、格好のモデルとなっている<ref name=ref3><pubmed> 16896951 </pubmed></ref><ref name=ref4>'''高橋 智幸, 堀 哲也, 中村 行宏, 山下 貴之'''<br>プレシナプス機構のスライスパッチクランプ研究法<br>岡田泰伸編 最新パッチクランプ実験技術法, pp.96-102. ''吉岡書店(東京)'':2011</ref><ref name=ref5><pubmed> 22035348 </pubmed></ref>。 | ||
==構造== | ==構造== | ||
=== 聴覚神経回路上での位置づけ=== | === 聴覚神経回路上での位置づけ=== | ||
[[Image:CalyxFig3.png|thumb|350px|'''図2.齧歯類脳幹の聴覚神経回路図'''<br> | [[Image:CalyxFig3.png|thumb|350px|'''図2.齧歯類脳幹の聴覚神経回路図'''<br>音の振動は内耳の有毛細胞で電気信号に変換され、蝸牛神経を経て蝸牛神経核の細胞へ入力する。内側蝸牛神経核の球形房状細胞は脳幹反対側の台形体核へ興奮性の投射を送る。この軸索終末がカリックスシナプスである。台形体核神経細胞は抑制性の投射を上オリーブ核へ送る。上オリーブ核の細胞は台形体核から抑制性の入力、同側(図右側)の蝸牛神経核から興奮性の入力を受け、左右の耳からの入力が合一する。興奮性投射は赤、抑制性投射は青で示してある。矢印は信号の流れを示す。]] | ||
カリックスシナプスの高速高信頼性伝達機能は、[[音源定位]]の目的に特化したものと考えられる。 | |||
音の振動は内耳の[[有毛細胞]]で電気信号に変換され、蝸牛神経を経て[[蝸牛神経核]]へ入力する。[[ | 音の振動は内耳の[[有毛細胞]]で電気信号に変換され、蝸牛神経を経て[[蝸牛神経核]]へ入力する。[[内側蝸牛神経核]]の細胞のうち、[[大型球形房状細胞]](large spherical bushy cell)は低周波の音を検出し、両側の[[内側上オリーブ核]]に投射し、ここで両耳間時間差を検出する。一方、[[小型球形房状細胞]](small spherical bushy cell)と[[球形房状細胞]](globular bushy cell)は高周波の音を検出する。 | ||
球形房状細胞(globular bushy cell)は[[脳幹]]反対側の[[台形体核]]へ興奮性の信号を送り、[[カリックスシナプス]] | 球形房状細胞(globular bushy cell)は[[脳幹]]反対側の[[台形体核]]へ興奮性の信号を送り、[[カリックスシナプス]]を介して台形体核神経細胞に興奮性入力を与える。台形体核神経細胞は[[抑制性]]投射を外側上オリーブ核へ送る(図2)。外側上オリーブ核は、同側(図2右側)の小型球形房状細胞から興奮性の入力を同時に受けることによって、両耳間の[[音圧]]差を検出し、高周波の[[音源定位]]に貢献する。同一の音源に由来する興奮性入力と抑制性入力を同時に感知するためには、同側の蝸牛神経核小型球形房状細胞からの興奮性入力と反対側の球形房状細胞-台形体核神経細胞からの抑制性入力が時間差なしで[[外側上オリーブ核]]に到達する必要がある。 | ||
=== 発生 === | === 発生 === | ||
内側蝸牛神経核球形房状細胞の軸索は、[[ | 内側蝸牛神経核球形房状細胞の軸索は、[[Robo3]]によって[[脳幹]]対側への伸長が誘導され、[[EphB]]によって台形体核神経細胞にターゲッティングされる<ref name=ref6><pubmed> 21093567 </pubmed></ref>。 | ||
齧歯類では、軸索末端が台形体核に到達してコンタクトを形成するのは胎生17日齢頃であり、この時点ですでにシナプスは台形体核神経細胞に[[活動電位]]を誘発する強度を有している<ref name=ref7><pubmed> 20855433 </pubmed></ref> | 齧歯類では、軸索末端が台形体核に到達してコンタクトを形成するのは胎生17日齢頃であり、この時点ですでにシナプスは台形体核神経細胞に[[活動電位]]を誘発する強度を有している<ref name=ref7><pubmed> 20855433 </pubmed></ref>。生後1日齢までは樹状に分岐したシナプス前終末がシナプス後細胞の細胞体や[[樹状突起]]に接触しており、1つの後細胞には複数の軸索が投射している。特徴的なカリックス状シナプス前終末は、生後2~4日齢にかけて形成される。この期間に1つの主要な投射入力を残して他の入力線維は排除され、生後5日齢までにはシナプス前終末とシナプス後細胞の間に1:1対応が確立する<ref name=ref8><pubmed> 16707803 </pubmed></ref>。しかし、一部の蝸牛神経細胞の軸索は枝分かれして別の台形体核主細胞(<u>編集部コメント:台形体核神経細胞に表記を統一してよいでしょうか。</u>)にも投射するため、蝸牛神経細胞と台形体核主細胞の関係は必ずしも1対1ではない。 | ||
=== 形態学的特徴 === | === 形態学的特徴 === | ||
カリックスシナプス前終末は、後細胞の[[細胞体]]に直接、シナプスを形成している。[[樹状突起]]を介さないこの軸索細胞体間結合は、樹状突起フィルタリングによる電気信号の減衰や遅延を排除することによって、高速高信頼性のシナプス伝達に寄与している。前終末は生後1週齢では匙状に広がりシナプス後細胞表面の約60%を覆っているが<ref name=ref9><pubmed> 12495627 </pubmed></ref>、生後2~3週齢以降では、末端が分岐(fenestration)して、幹(stalk)の先端に多数の隆起部(swelling)が生じてシナプス後細胞を取り囲むようになる<ref name=ref10><pubmed> 8423239 </pubmed></ref>。 | |||
生後9~14日齢[[ラット]] | 生後9~14日齢[[ラット]]のカリックスシナプス前終末には450~1100個の[[アクティブゾーン]]が平均約600 nm間隔で存在している<ref name=ref9 /><ref name=ref11><pubmed> 12486149 </pubmed></ref>。アクティブゾーンは幹と隆起部どちらにも分布し、隆起部当たり平均6.8個存在する<ref name=ref12><pubmed> 16399677 </pubmed></ref>。個々のアクティブゾーンは互いに独立してはたらくと考えられている。アクティブゾーンには1個当たり2~3個の[[シナプス小胞]]がドックしている様子が[[電子顕微鏡]]で観察されている<ref name=ref9 />。また隆起部ではシナプス小胞が[[ミトコンドリア]]の周囲をドーナツ状に取り囲んでいる構造が観察されている<ref name=ref12 />。シナプス小胞の直径は約45 nmで<ref name=ref9 />、シナプス前終末当たりの総数は7万個にのぼる<ref name=ref11 />。 | ||
またシナプス前終末内は[[細胞骨格]]が発達しており、シナプスの形態的安定性と[[シナプス小胞]]の動態に関わっている。シナプスの周囲は[[アストロサイト]]と[[NG2グリア細胞]] | またシナプス前終末内は[[細胞骨格]]が発達しており、シナプスの形態的安定性と[[シナプス小胞]]の動態に関わっている。シナプスの周囲は[[アストロサイト]]と[[NG2グリア細胞]]に囲まれており、一部のNG2グリア細胞はカリックスシナプス前終末から直接シナプス入力を受ける<ref name=ref13><pubmed> 19635853 </pubmed></ref>。 | ||
==機能 == | ==機能 == | ||
[[Image:CalyxFig2.png|thumb|240px|'''図3.シナプス前終末の活動電位、Ca<sup>2+</sup> | [[Image:CalyxFig2.png|thumb|240px|'''図3.シナプス前終末の活動電位、Ca<sup>2+</sup>電流、シナプス後細胞の興奮性シナプス後電流の波形'''<br>聴覚獲得前生後7日齢(橙)と聴覚獲得後生後14日(青)Wistarラットのカリックスシナプスからパッチクランプ法にて記録した。蝸牛神経核房状細胞の軸索を電気刺激することによって発生するシナプス前終末活動電位波形(上段)を、[[膜電位固定法]]における[[コマンド電圧]]として利用してシナプス前終末Ca<sup>2+</sup>電流を測定(中段)し、同時に発生する興奮性シナプス後電流(下段)を台形体核神経細胞から記録した。生後発達に伴う活動電位幅の短縮は、Ca<sup>2+</sup>電流の発生するタイミングを早めることによって、シナプス後電流の立ち上がりを早め、シナプス遅延の短縮に貢献する。]] | ||
カリックスシナプスには、高速・高信頼性のシナプス伝達を行うための最適化が見られるが、シナプス伝達の基本的な分子機構は、他のシナプスと共通であると考えられている。シナプス伝達機構についての一般的な性質は本辞典の他項目に譲り、本項ではHeldカリックスシナプスを標本として用いた研究で明らかとなった知見に絞って記述する。 | |||
=== シナプス前終末の活動電位 === | === シナプス前終末の活動電位 === | ||
内側蝸牛神経核の房状細胞で発生した活動電位は、軸索を伝導してシナプス前終末端に到達する。[[電位依存性ナトリウムチャネル]] | 内側蝸牛神経核の房状細胞で発生した活動電位は、軸索を伝導してシナプス前終末端に到達する。[[電位依存性ナトリウムチャネル]]は、カリックスシナプス前終末にはほとんど存在せず、前終末起始部に近接する[[ランヴィエ絞輪]]に局在しているため、活動電位はシナプス前終末へ受動的に伝播すると考えられている<ref name=ref14><pubmed> 15814803 </pubmed></ref>。成熟[[齧歯動物]]のシナプス前終末の活動電位の振幅は約120 mV、半値幅は約0.2 ms であり<ref name=ref15><pubmed> 11124994 </pubmed></ref>(図3)、''in vivo''では1 KHzもの高頻度で発火する。 | ||
活動電位は、[[電位依存性カリウムチャネル]]による修飾をうける。[[低電位活性型カリウムチャネル]]ファミリーの[[Kv1.1]]、[[Kv1.2]]は主として前終末起始部に発現し、活動電位の発火頻度を調節する<ref name=ref16><pubmed> 12177193 </pubmed></ref>。[[高電位活性型カリウムチャネル]][[Kv3.1]]はシナプス前終末のシナプスの反対側の膜上に高密度で発現し、膜を[[再分極]]することによって活動電位の幅を短縮している<ref name=ref17><pubmed> 14614103 </pubmed></ref>。 | 活動電位は、[[電位依存性カリウムチャネル]]による修飾をうける。[[低電位活性型カリウムチャネル]]ファミリーの[[Kv1.1]]、[[Kv1.2]]は主として前終末起始部に発現し、活動電位の発火頻度を調節する<ref name=ref16><pubmed> 12177193 </pubmed></ref>。[[高電位活性型カリウムチャネル]][[Kv3.1]]はシナプス前終末のシナプスの反対側の膜上に高密度で発現し、膜を[[再分極]]することによって活動電位の幅を短縮している<ref name=ref17><pubmed> 14614103 </pubmed></ref>。 | ||
| 56行目: | 53行目: | ||
活動電位によってシナプス前終末が[[脱分極]]すると[[電位依存性カルシウムチャネル]][[Cav2]]が開口し、Ca<sup>2+</sup>の流入が[[シナプス小胞]]の[[開口放出]]を誘導する。Cav2は[[アクティブゾーン]]内部でクラスター状に分布しており、シナプス小胞はチャネルクラスターの外縁に位置していると推定される<ref name=ref18><pubmed> 25533484 </pubmed></ref>。チャネルクラスター近傍でのCa<sup>2+</sup>の一過性濃度上昇は急峻な濃度勾配([[カルシウムドメイン]])を形成するため、カルシウムチャネルクラスター外縁とシナプス小胞の距離は、[[開口放出]]の確率やタイミングを規定する。成熟した齧歯類のシナプス前終末ではカルシウムチャネルクラスター外縁とシナプス小胞の距離は約20 nmであり、この距離でCa<sup>2+</sup>濃度は数十 μMに達すると推定される<ref name=ref18 />。 | 活動電位によってシナプス前終末が[[脱分極]]すると[[電位依存性カルシウムチャネル]][[Cav2]]が開口し、Ca<sup>2+</sup>の流入が[[シナプス小胞]]の[[開口放出]]を誘導する。Cav2は[[アクティブゾーン]]内部でクラスター状に分布しており、シナプス小胞はチャネルクラスターの外縁に位置していると推定される<ref name=ref18><pubmed> 25533484 </pubmed></ref>。チャネルクラスター近傍でのCa<sup>2+</sup>の一過性濃度上昇は急峻な濃度勾配([[カルシウムドメイン]])を形成するため、カルシウムチャネルクラスター外縁とシナプス小胞の距離は、[[開口放出]]の確率やタイミングを規定する。成熟した齧歯類のシナプス前終末ではカルシウムチャネルクラスター外縁とシナプス小胞の距離は約20 nmであり、この距離でCa<sup>2+</sup>濃度は数十 μMに達すると推定される<ref name=ref18 />。 | ||
カリックスシナプスにおける主要なCa<sup>2+</sup>センサーは[[シナプトタグミン2]]であり、シナプトタグミン2を欠損させた[[マウス]]では活動電位によって誘発される開口放出が著しく減少する<ref name=ref19><pubmed> 21338883 </pubmed></ref>。通常、1発の活動電位に対する小胞の[[放出確率]]は0.1~0.2<ref name=ref9 /><ref name=ref20><pubmed> 18339695 </pubmed></ref>である。放出された[[グルタミン酸]]は、シナプス間隙で数mMの濃度にまで達し<ref name=ref21><pubmed> 23070699 </pubmed></ref>、後シナプス細胞の[[グルタミン酸受容体]]を活性化する。放出されたグルタミン酸は[[アストロサイト]]の[[グルタミン酸トランスポーター]]によって回収される。 | |||
=== シナプス後細胞に発生するシナプス電流と活動電位 === | === シナプス後細胞に発生するシナプス電流と活動電位 === | ||
シナプス後細胞の伝達物質受容体は[[AMPA型グルタミン酸受容体|AMPA型]]および[[NMDA型グルタミン酸受容体]]である。成熟したカリックスシナプスでは、シナプス後電流は主としてAMPA型グルタミン酸受容体、なかでも速い開閉キネティクスを備えたflop型[[GluA4]]によって担われる<ref name=ref22><pubmed> 15634782 </pubmed></ref>。シナプス小胞1個あたりのグルタミン酸によって30~50 pAの[[微小シナプス電流]]が発生し<ref name=ref23><pubmed> 12736334 </pubmed></ref>、1発の活動電位によってシナプス前終末から100個以上のシナプス小胞が放出されるため<ref name=ref24><pubmed> 8837774 </pubmed></ref>、シナプス後電流の振幅は数nA~数十nAに達する。この電流量は活動電位の[[閾値]]を超えるシナプス後細胞の脱分極を惹起するのに十分であり、シナプス前終末の1発の[[活動電位]]による伝達物質の放出によってシナプス後細胞に確実に活動電位が発生する。 | |||
シナプス後細胞の細胞体に発現しているナトリウムチャネルは低密度なため[[活動電位]]は軸索起始部で発生して細胞体に逆伝播する<ref name=ref14 />。[[ナトリウムチャネル]]に加えて、軸索起始部には電位依存性[[カリウムチャネル]]Kv1.1/Kv1.2が発現しており、活動電位の閾値と振幅を制御するとともに、1回の興奮性シナプス電位によって複数の活動電位が発生するのを防いでいる<ref name=ref16 />。シナプス後細胞のKv2およびKv3.1は、活動電位の幅を調節することによって高頻度発火を可能にしている<ref name=ref25><pubmed> 9547392 </pubmed></ref>。 | |||
=== シナプス小胞の回収と伝達物質充填、再利用 === | === シナプス小胞の回収と伝達物質充填、再利用 === | ||
伝達物質を開口放出したシナプス小胞は、[[エンドサイトーシス]]によってシナプス前終末に回収される。エンドサイトーシスは、[[GTP]]の[[wikipedia:ja:加水分解|加水分解]]を伴う[[ダイナミン]]の活性によって担われる<ref name=ref26><pubmed> 15637282 </pubmed></ref>。エンドサイトーシスの速度はCa<sup>2+</sup>依存的に調節され、高頻度発火によってシナプス前終末のCa<sup>2+</sup>濃度が上昇すると亢進し、実験的に[[カルシウムキレート剤]]をシナプス前終末に注入すると抑制される<ref name=ref27><pubmed> 19640480 </pubmed></ref><ref name=ref28><pubmed> 20562869 </pubmed></ref>。エンドサイトーシスの後、シナプス小胞は[[液胞型プロトンATPase]]よって酸性化される。形成されたプロトンの濃度勾配を利用して[[小胞型グルタミン酸トランスポーター]] | 伝達物質を開口放出したシナプス小胞は、[[エンドサイトーシス]]によってシナプス前終末に回収される。エンドサイトーシスは、[[GTP]]の[[wikipedia:ja:加水分解|加水分解]]を伴う[[ダイナミン]]の活性によって担われる<ref name=ref26><pubmed> 15637282 </pubmed></ref>。エンドサイトーシスの速度はCa<sup>2+</sup>依存的に調節され、高頻度発火によってシナプス前終末のCa<sup>2+</sup>濃度が上昇すると亢進し、実験的に[[カルシウムキレート剤]]をシナプス前終末に注入すると抑制される<ref name=ref27><pubmed> 19640480 </pubmed></ref><ref name=ref28><pubmed> 20562869 </pubmed></ref>。エンドサイトーシスの後、シナプス小胞は[[液胞型プロトンATPase]]よって酸性化される。形成されたプロトンの濃度勾配を利用して[[小胞型グルタミン酸トランスポーター]]がシナプス小胞にグルタミン酸を充填する。カリックスシナプスには、小胞型グルタミン酸トランスポーターの[[VGluT1|VGluT<sub>1</sub>]]と[[VGluT2|VGluT<sub>2</sub>]]が発現しているが<ref name=ref29><pubmed> 15911123 </pubmed></ref>、両者が同一のシナプス小胞上に共存しているのか、別々の小胞上に発現しているのかは明らかでない。グルタミン酸取り込みの時定数(τ)は生理的温度で7秒であり、小胞が完全に充填されるには数十秒を必要とする<ref name=ref30><pubmed> 23141063 </pubmed></ref>。シナプス小胞は再利用のためアクティブゾーンへ輸送される。この過程には[[細胞骨格]]が関与し、[[アクチン]]<ref name=ref31><pubmed> 12574412 </pubmed></ref>や[[インターセクチン]]<ref name=ref32><pubmed> 23633571 </pubmed></ref>を阻害するとシナプス小胞の補充が遅れて高頻度シナプス伝達が障害される。 | ||
=== | === 聴覚の獲得に伴うカリックスシナプスの生後発達変化 === | ||
マウスおよび[[ラット]] | マウスおよび[[ラット]]では生後12日齢頃に聴覚機能が完成するが、この時期にカリックスシナプス伝達の性質が変化することが知られている。 | ||
例えば、シナプス前終末における[[カリウムチャネル]]の発現増加と活性化速度の上昇によって、シナプス前終末の活動電位幅が短縮し(図3)、高頻度での活動電位発生が可能となる<ref name=ref33><pubmed> | 例えば、シナプス前終末における[[カリウムチャネル]]の発現増加と活性化速度の上昇によって、シナプス前終末の活動電位幅が短縮し(図3)、高頻度での活動電位発生が可能となる<ref name=ref33><pubmed> 23633571 </pubmed></ref>。活動電位幅の短縮はCa<sup>2+</sup>流入のタイミングを早めシナプス応答の立ち上がりを早くするが、一方でカルシウムチャネルの開口数の減少と開口時間の短縮をもたらし、シナプス前末端へのCa<sup>2+</sup>流入量の減少によって小胞放出確率を低下させる。しかし、この[[放出確率]]の減少は、生後発達に伴って[[Ca2+センサー|Ca<sup>2+</sup>センサー]]がカルシウムチャネルクラスターに接近して、より高濃度のCa<sup>2+</sup>を感知することによって部分的に補償される<ref name=ref18/><ref name=ref34><pubmed> 15843616 </pubmed></ref>。シナプス強度は、更に[[アクティブゾーン]]の個数<ref name=ref9/>と[[即時放出可能プール]]サイズが増大することによって維持される<ref name=ref35><pubmed> 11483715 </pubmed></ref>。放出確率の減少と放出可能プールの増大は、1回のシナプス伝達で消費されるシナプス小胞の割合を低く抑え、高頻度でのシナプス伝達の持続を可能とする。 | ||
聴覚獲得時期前後でシナプス小胞の開口放出を担う電位依存性[[カルシウムチャネル]]サブタイプの構成にも変化が生じる。生後7日齢シナプス前終末では[[Cav2.1]]([[P/Q型カルシウムチャネル|P/Q型]])、[[Cav2.2]]([[N型カルシウムチャネル|N型]])、[[Cav2.3]]([[R型カルシウムチャネル|R型]])が共存してシナプス伝達を担っているが、生後2週齢までにCav2.2とCav2.3は消失しCav2.1だけが残る<ref name=ref36><pubmed> 10627581 </pubmed></ref>。またシナプス前終末内の[[カルシウム結合タンパク質]] [[カルレチニン]]の発現が増加して、シナプスの短期可塑性に影響を与える<ref name=ref37><pubmed> 15355314 </pubmed></ref>。 | 聴覚獲得時期前後でシナプス小胞の開口放出を担う電位依存性[[カルシウムチャネル]]サブタイプの構成にも変化が生じる。生後7日齢シナプス前終末では[[Cav2.1]]([[P/Q型カルシウムチャネル|P/Q型]])、[[Cav2.2]]([[N型カルシウムチャネル|N型]])、[[Cav2.3]]([[R型カルシウムチャネル|R型]])が共存してシナプス伝達を担っているが、生後2週齢までにCav2.2とCav2.3は消失しCav2.1だけが残る<ref name=ref36><pubmed> 10627581 </pubmed></ref>。またシナプス前終末内の[[カルシウム結合タンパク質]] [[カルレチニン]]の発現が増加して、シナプスの短期可塑性に影響を与える<ref name=ref37><pubmed> 15355314 </pubmed></ref>。 | ||
| 79行目: | 76行目: | ||
=== シナプス伝達の調節機構 === | === シナプス伝達の調節機構 === | ||
==== 伝達物質放出の修飾 ==== | ==== 伝達物質放出の修飾 ==== | ||
シナプス前終末には、[[代謝活性型グルタミン酸受容体]]、代謝型[[GABAB受容体|GABA<sub>B</sub>受容体]]、[[アデノシン]][[A1受容体]]、[[ノルアドレナリン]][[α2受容体]]、[[カンナビノイド]][[CB1受容体]]、[[セロトニン]][[5-HT1B受容体|5-HT<sub>1B</sub>受容体]]が存在する。これら[[Gタンパク質共役型受容体]]の活性化によって、[[三量体Gタンパク質]]から解離されたβγサブユニットは、電位依存性カルシウムチャネルに結合しCa<sup>2+</sup>電流を抑制し、これによって伝達物質放出を抑制する<ref name=ref40>'''Tomoyuki Takahashi, Yoshinao Kajikawa, Masahiro Kimura, Naoto Saitoh, Tetsuhiro Tsujimoto'''<br> Presynaptic mechanism underlying regulation of transmitter release by G protein coupled receptors.<br>''Korean J. Physiol. Pharmacol. '' :2004, 8(2):69-76.</ref><ref name=ref41><pubmed> 17067296 </pubmed></ref> | シナプス前終末には、[[代謝活性型グルタミン酸受容体]]、代謝型[[GABAB受容体|GABA<sub>B</sub>受容体]]、[[アデノシン]][[A1受容体]]、[[ノルアドレナリン]][[α2受容体]]、[[カンナビノイド]][[CB1受容体]]、[[セロトニン]][[5-HT1B受容体|5-HT<sub>1B</sub>受容体]]が存在する。これら[[Gタンパク質共役型受容体]]の活性化によって、[[三量体Gタンパク質]]から解離されたβγサブユニットは、電位依存性カルシウムチャネルに結合しCa<sup>2+</sup>電流を抑制し、これによって伝達物質放出を抑制する<ref name=ref40>'''Tomoyuki Takahashi, Yoshinao Kajikawa, Masahiro Kimura, Naoto Saitoh, Tetsuhiro Tsujimoto'''<br> Presynaptic mechanism underlying regulation of transmitter release by G protein coupled receptors.<br>''Korean J. Physiol. Pharmacol. '' :2004, 8(2):69-76.</ref><ref name=ref41><pubmed> 17067296 </pubmed></ref>。このGタンパク質を介したシナプス伝達の抑制は、カリックスシナプスにおいてはシナプス前性の主要なシナプス伝達調節機構である。Gタンパク質共役受容体のうち、セロトニン5H-T<sub>1B</sub>受容体、アデノシンA1受容体は生後2週齢までに消失するが、代謝活性型グルタミン酸受容体、GABA<sub>B</sub>受容体を介した抑制は、生後発達を通じて存続する。しかし、(<u>編集部コメント:「グルタミン酸を除いて」でしょうか?</u>)これらの代謝活性型受容体のリガンドの由来は必ずしも明らかでない。 | ||
[[シナプス前終末]] | [[シナプス前終末]]の膜電位は伝達物質の放出に影響を与える。シナプス前終末に発現する[[グリシン受容体]]の開口<ref name=ref42><pubmed> 11385573 </pubmed></ref>やカリウムチャネル[[Kv7.5]]の不活化<ref name=ref43><pubmed> 21666672 </pubmed></ref>は[[膜電位]]を上昇させる。この活動電位の閾値には到達しない膜電位上昇は、電位依存性カルシウムチャネルの[[開口確率]]を増大させ、前終末内のCa<sup>2+</sup>濃度上昇につながる。Ca<sup>2+</sup>濃度上昇は[[自発性微小シナプス電流]]の頻度を増加させるとともに、活動電位によって誘発される小胞の放出を促進させる<ref name=ref44><pubmed> 19403620 </pubmed></ref>。 | ||
また、シナプス前終末の[[タンパク質リン酸化酵素A]]の活性化は[[EPAC]]を介してシナプス小胞の[[放出確率]]と即時[[放出可能プール]]サイズを共に増加させて、シナプス伝達を増強する<ref name=ref45><pubmed> 15175390 </pubmed></ref>。さらに[[タンパク質リン酸化酵素C]]は[[小胞Ca2+センサー|小胞Ca<sup>2+</sup>センサー]]のCa<sup>2+</sup>感受性を増加して、高頻度刺激後のシナプス伝達増強をもたらす<ref name=ref46><pubmed> 17884983 </pubmed></ref>。 | また、シナプス前終末の[[タンパク質リン酸化酵素A]]の活性化は[[EPAC]]を介してシナプス小胞の[[放出確率]]と即時[[放出可能プール]]サイズを共に増加させて、シナプス伝達を増強する<ref name=ref45><pubmed> 15175390 </pubmed></ref>。さらに[[タンパク質リン酸化酵素C]]は[[小胞Ca2+センサー|小胞Ca<sup>2+</sup>センサー]]のCa<sup>2+</sup>感受性を増加して、高頻度刺激後のシナプス伝達増強をもたらす<ref name=ref46><pubmed> 17884983 </pubmed></ref>。 | ||
==== エンドサイトーシスの修飾 ==== | ==== エンドサイトーシスの修飾 ==== | ||
開口放出とエンドサイトーシスのバランスは、シナプス伝達の維持に重要である。高頻度でシナプス伝達が起きると、シナプス前終末のCa<sup>2+</sup>濃度が上昇しエンドサイトーシスが亢進する<ref name=ref27 />。またシナプス後細胞では、[[NMDA型グルタミン酸受容体]]を介したCa<sup>2+</sup>流入によってNOSの活性化が誘導され[[一酸化窒素]]が合成される。一酸化窒素は拡散し[[逆行性シグナル]]としてシナプス前終末に入り、前終末の[[可溶性グアニル酸シクラーゼ]]を活性化する。以下、シナプス前終末内[[cGMP]]濃度の上昇→[[ | 開口放出とエンドサイトーシスのバランスは、シナプス伝達の維持に重要である。高頻度でシナプス伝達が起きると、シナプス前終末のCa<sup>2+</sup>濃度が上昇しエンドサイトーシスが亢進する<ref name=ref27 />。またシナプス後細胞では、[[NMDA型グルタミン酸受容体]]を介したCa<sup>2+</sup>流入によってNOSの活性化が誘導され[[一酸化窒素]]が合成される。一酸化窒素は拡散し[[逆行性シグナル]]としてシナプス前終末に入り、前終末の[[可溶性グアニル酸シクラーゼ]]を活性化する。以下、シナプス前終末内[[cGMP]]濃度の上昇→[[タンパク質リン酸化酵素G]] (PKG)の活性化→[[RhoA]]の活性→[[Rhoキナーゼ]]の活性化→[[PIP2|PIP<sub>2</sub>]]の産生というカスケードを経て、エンドサイトーシスを加速する<ref name=ref47><pubmed> 22578503 </pubmed></ref><ref name=ref48><pubmed> 23864695 </pubmed></ref>。 | ||
==== シナプス伝達の短期可塑性 ==== | ==== シナプス伝達の短期可塑性 ==== | ||
シナプスでは、連続する複数の入力を受ける際、2番目以降のシナプス応答が初回の応答に比べて増強(促通)または減弱([[抑圧]])する[[短期可塑性]]が生じる。[[シナプス促通]]と抑圧を担う分子機構は独立かつ共存しており、いずれが優勢となるかは種々の条件によって異なる。 | シナプスでは、連続する複数の入力を受ける際、2番目以降のシナプス応答が初回の応答に比べて増強(促通)または減弱([[抑圧]])する[[短期可塑性]]が生じる。[[シナプス促通]]と抑圧を担う分子機構は独立かつ共存しており、いずれが優勢となるかは種々の条件によって異なる。 | ||
カリックスシナプスにおける短期抑圧の主な要因は、[[放出可能プール]]の枯渇、シナプス前終末カルシウムチャネルの不活性化<ref name=ref49><pubmed> 9581770 </pubmed></ref>、シナプス後細胞のAMPA型グルタミン酸受容体の[[脱感作]]<ref name=ref9/><ref name=ref20/>である。聴覚獲得前のカリックスシナプス前終末は、放出確率が高く、放出可能プールが小さく<ref name=ref35/>、またシナプス小胞の補充再利用も遅いため、短期抑圧を示す。聴覚獲得前のカリックスシナプスにおける[[カルシウム]]チャネルの不活性化は、カルモジュリンによって誘導されるが、カルモジュリンの役割は生後発達と共に減弱する<ref name=ref50><pubmed> 18238813 </pubmed></ref>。AMPA型グルタミン酸受容体の脱感作は高頻度入力の場合に重要となる<ref name=ref20/>。 | |||
シナプス促通は、初回の活動電位によって流入したCa<sup>2+</sup>が原因となって生じる。[[シナプス前終末内]]に残存したCa<sup>2+</sup>が2回目の活動電位によって流入するCa<sup>2+</sup>に加算され、小胞のCa<sup>2+</sup>センサーはより高濃度のCa<sup>2+</sup>を感知する。また残存Ca<sup>2+</sup>はカルシウムチャネルの開口速度を速めて<ref name=ref51><pubmed> 9769416 </pubmed></ref>、[[シナプス促通]]をもたらす<ref name=ref44/>。生後発達に伴い[[放出確率]]が低下し[[放出可能プール]] | シナプス促通は、初回の活動電位によって流入したCa<sup>2+</sup>が原因となって生じる。[[シナプス前終末内]]に残存したCa<sup>2+</sup>が2回目の活動電位によって流入するCa<sup>2+</sup>に加算され、小胞のCa<sup>2+</sup>センサーはより高濃度のCa<sup>2+</sup>を感知する。また残存Ca<sup>2+</sup>はカルシウムチャネルの開口速度を速めて<ref name=ref51><pubmed> 9769416 </pubmed></ref>、[[シナプス促通]]をもたらす<ref name=ref44/>。生後発達に伴い[[放出確率]]が低下し[[放出可能プール]]が大きくなるため、聴覚獲得後のカリックスシナプスでは、促通傾向が優勢になる。 | ||
なお聴覚獲得前のカリックスシナプスでは、連続高頻度刺激によってシナプス伝達の数分にわたる増強([[postsynaptic potentiation]]; [[PTP]])が誘発可能である<ref name=ref52><pubmed> 15695246 </pubmed></ref>。このメカニズムはCa<sup>2+</sup>濃度上昇によって活性化した[[PKC]]が小胞Ca<sup>2+</sup>センサーのCa<sup>2+</sup>感受性を高めることによる<ref name=ref46/>。 | |||
== 関連項目 == | == 関連項目 == | ||
2016年3月31日 (木) 09:40時点における版
英:calyx of Held 独:Held'schen Calyx 仏:calice de Held
同義語:Held杯状シナプス、Heldのカリックスシナプス
蝸牛神経核から伸長した軸索終末端が、対側台形体核の主細胞に形成するカリックス(calyx、萼)状のシナプス。音入力を聴覚中枢へ高速かつ正確に伝達するため、前終末端が台形体核主細胞体を萼状に包み込み、興奮性神経伝達物質グルタミン酸を放出する。巨大なシナプス前終末をもつことから、シナプス前終末とシナプス後細胞からの同時パッチクランプ記録が可能であり、温血動物中枢シナプス伝達機構の研究上、格好のモデルとなっている。
Held萼状シナプスとは
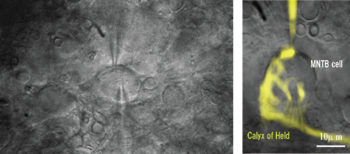
(左)ラット脳幹スライス標本におけるシナプス前終末とシナプス後細胞からの同時パッチクランプ記録の例。画面中央円形の構造が台形体核主細胞の細胞体、その細胞体上部辺縁に位置する三日月形の構造がカリックスシナプス前終末である。(右)パッチ電極より蛍光色素を注入し、カリックスシナプス前終末の形態を可視化した顕微鏡写真。透過光像と重ね合わせてある。
脳幹の蝸牛神経核から伸長した軸索終末端が、対側台形体核の主細胞に形成するカリックス(calyx、萼)状のシナプス。ドイツの解剖学者Hans von Held(1866-1942)がゴルジ染色によって同定した[1]。聴覚神経回路を構成し、音源定位に重要な情報処理機能を果たしている。音入力を聴覚中枢へ高速かつ正確に伝達するため、前終末端が台形体核主細胞体を萼状に包み込み、入力信号に応じて多量の興奮性神経伝達物質グルタミン酸を放出する。1994年、Forsytheはこの巨大シナプス前終末からパッチクランプ記録を行うことに成功した[2]。ついでシナプス前終末とシナプス後細胞からの同時パッチクランプ記録(図1)が可能になり、温血動物中枢シナプス伝達機構の研究上、格好のモデルとなっている[3][4][5]。
構造
聴覚神経回路上での位置づけ
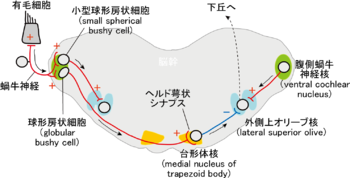
音の振動は内耳の有毛細胞で電気信号に変換され、蝸牛神経を経て蝸牛神経核の細胞へ入力する。内側蝸牛神経核の球形房状細胞は脳幹反対側の台形体核へ興奮性の投射を送る。この軸索終末がカリックスシナプスである。台形体核神経細胞は抑制性の投射を上オリーブ核へ送る。上オリーブ核の細胞は台形体核から抑制性の入力、同側(図右側)の蝸牛神経核から興奮性の入力を受け、左右の耳からの入力が合一する。興奮性投射は赤、抑制性投射は青で示してある。矢印は信号の流れを示す。
カリックスシナプスの高速高信頼性伝達機能は、音源定位の目的に特化したものと考えられる。
音の振動は内耳の有毛細胞で電気信号に変換され、蝸牛神経を経て蝸牛神経核へ入力する。内側蝸牛神経核の細胞のうち、大型球形房状細胞(large spherical bushy cell)は低周波の音を検出し、両側の内側上オリーブ核に投射し、ここで両耳間時間差を検出する。一方、小型球形房状細胞(small spherical bushy cell)と球形房状細胞(globular bushy cell)は高周波の音を検出する。
球形房状細胞(globular bushy cell)は脳幹反対側の台形体核へ興奮性の信号を送り、カリックスシナプスを介して台形体核神経細胞に興奮性入力を与える。台形体核神経細胞は抑制性投射を外側上オリーブ核へ送る(図2)。外側上オリーブ核は、同側(図2右側)の小型球形房状細胞から興奮性の入力を同時に受けることによって、両耳間の音圧差を検出し、高周波の音源定位に貢献する。同一の音源に由来する興奮性入力と抑制性入力を同時に感知するためには、同側の蝸牛神経核小型球形房状細胞からの興奮性入力と反対側の球形房状細胞-台形体核神経細胞からの抑制性入力が時間差なしで外側上オリーブ核に到達する必要がある。
発生
内側蝸牛神経核球形房状細胞の軸索は、Robo3によって脳幹対側への伸長が誘導され、EphBによって台形体核神経細胞にターゲッティングされる[6]。
齧歯類では、軸索末端が台形体核に到達してコンタクトを形成するのは胎生17日齢頃であり、この時点ですでにシナプスは台形体核神経細胞に活動電位を誘発する強度を有している[7]。生後1日齢までは樹状に分岐したシナプス前終末がシナプス後細胞の細胞体や樹状突起に接触しており、1つの後細胞には複数の軸索が投射している。特徴的なカリックス状シナプス前終末は、生後2~4日齢にかけて形成される。この期間に1つの主要な投射入力を残して他の入力線維は排除され、生後5日齢までにはシナプス前終末とシナプス後細胞の間に1:1対応が確立する[8]。しかし、一部の蝸牛神経細胞の軸索は枝分かれして別の台形体核主細胞(編集部コメント:台形体核神経細胞に表記を統一してよいでしょうか。)にも投射するため、蝸牛神経細胞と台形体核主細胞の関係は必ずしも1対1ではない。
形態学的特徴
カリックスシナプス前終末は、後細胞の細胞体に直接、シナプスを形成している。樹状突起を介さないこの軸索細胞体間結合は、樹状突起フィルタリングによる電気信号の減衰や遅延を排除することによって、高速高信頼性のシナプス伝達に寄与している。前終末は生後1週齢では匙状に広がりシナプス後細胞表面の約60%を覆っているが[9]、生後2~3週齢以降では、末端が分岐(fenestration)して、幹(stalk)の先端に多数の隆起部(swelling)が生じてシナプス後細胞を取り囲むようになる[10]。
生後9~14日齢ラットのカリックスシナプス前終末には450~1100個のアクティブゾーンが平均約600 nm間隔で存在している[9][11]。アクティブゾーンは幹と隆起部どちらにも分布し、隆起部当たり平均6.8個存在する[12]。個々のアクティブゾーンは互いに独立してはたらくと考えられている。アクティブゾーンには1個当たり2~3個のシナプス小胞がドックしている様子が電子顕微鏡で観察されている[9]。また隆起部ではシナプス小胞がミトコンドリアの周囲をドーナツ状に取り囲んでいる構造が観察されている[12]。シナプス小胞の直径は約45 nmで[9]、シナプス前終末当たりの総数は7万個にのぼる[11]。
またシナプス前終末内は細胞骨格が発達しており、シナプスの形態的安定性とシナプス小胞の動態に関わっている。シナプスの周囲はアストロサイトとNG2グリア細胞に囲まれており、一部のNG2グリア細胞はカリックスシナプス前終末から直接シナプス入力を受ける[13]。
機能
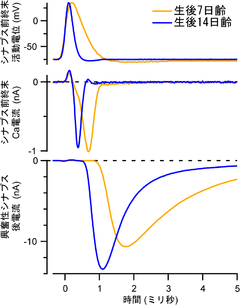
聴覚獲得前生後7日齢(橙)と聴覚獲得後生後14日(青)Wistarラットのカリックスシナプスからパッチクランプ法にて記録した。蝸牛神経核房状細胞の軸索を電気刺激することによって発生するシナプス前終末活動電位波形(上段)を、膜電位固定法におけるコマンド電圧として利用してシナプス前終末Ca2+電流を測定(中段)し、同時に発生する興奮性シナプス後電流(下段)を台形体核神経細胞から記録した。生後発達に伴う活動電位幅の短縮は、Ca2+電流の発生するタイミングを早めることによって、シナプス後電流の立ち上がりを早め、シナプス遅延の短縮に貢献する。
カリックスシナプスには、高速・高信頼性のシナプス伝達を行うための最適化が見られるが、シナプス伝達の基本的な分子機構は、他のシナプスと共通であると考えられている。シナプス伝達機構についての一般的な性質は本辞典の他項目に譲り、本項ではHeldカリックスシナプスを標本として用いた研究で明らかとなった知見に絞って記述する。
シナプス前終末の活動電位
内側蝸牛神経核の房状細胞で発生した活動電位は、軸索を伝導してシナプス前終末端に到達する。電位依存性ナトリウムチャネルは、カリックスシナプス前終末にはほとんど存在せず、前終末起始部に近接するランヴィエ絞輪に局在しているため、活動電位はシナプス前終末へ受動的に伝播すると考えられている[14]。成熟齧歯動物のシナプス前終末の活動電位の振幅は約120 mV、半値幅は約0.2 ms であり[15](図3)、in vivoでは1 KHzもの高頻度で発火する。
活動電位は、電位依存性カリウムチャネルによる修飾をうける。低電位活性型カリウムチャネルファミリーのKv1.1、Kv1.2は主として前終末起始部に発現し、活動電位の発火頻度を調節する[16]。高電位活性型カリウムチャネルKv3.1はシナプス前終末のシナプスの反対側の膜上に高密度で発現し、膜を再分極することによって活動電位の幅を短縮している[17]。
シナプス小胞の開口放出
活動電位によってシナプス前終末が脱分極すると電位依存性カルシウムチャネルCav2が開口し、Ca2+の流入がシナプス小胞の開口放出を誘導する。Cav2はアクティブゾーン内部でクラスター状に分布しており、シナプス小胞はチャネルクラスターの外縁に位置していると推定される[18]。チャネルクラスター近傍でのCa2+の一過性濃度上昇は急峻な濃度勾配(カルシウムドメイン)を形成するため、カルシウムチャネルクラスター外縁とシナプス小胞の距離は、開口放出の確率やタイミングを規定する。成熟した齧歯類のシナプス前終末ではカルシウムチャネルクラスター外縁とシナプス小胞の距離は約20 nmであり、この距離でCa2+濃度は数十 μMに達すると推定される[18]。
カリックスシナプスにおける主要なCa2+センサーはシナプトタグミン2であり、シナプトタグミン2を欠損させたマウスでは活動電位によって誘発される開口放出が著しく減少する[19]。通常、1発の活動電位に対する小胞の放出確率は0.1~0.2[9][20]である。放出されたグルタミン酸は、シナプス間隙で数mMの濃度にまで達し[21]、後シナプス細胞のグルタミン酸受容体を活性化する。放出されたグルタミン酸はアストロサイトのグルタミン酸トランスポーターによって回収される。
シナプス後細胞に発生するシナプス電流と活動電位
シナプス後細胞の伝達物質受容体はAMPA型およびNMDA型グルタミン酸受容体である。成熟したカリックスシナプスでは、シナプス後電流は主としてAMPA型グルタミン酸受容体、なかでも速い開閉キネティクスを備えたflop型GluA4によって担われる[22]。シナプス小胞1個あたりのグルタミン酸によって30~50 pAの微小シナプス電流が発生し[23]、1発の活動電位によってシナプス前終末から100個以上のシナプス小胞が放出されるため[24]、シナプス後電流の振幅は数nA~数十nAに達する。この電流量は活動電位の閾値を超えるシナプス後細胞の脱分極を惹起するのに十分であり、シナプス前終末の1発の活動電位による伝達物質の放出によってシナプス後細胞に確実に活動電位が発生する。
シナプス後細胞の細胞体に発現しているナトリウムチャネルは低密度なため活動電位は軸索起始部で発生して細胞体に逆伝播する[14]。ナトリウムチャネルに加えて、軸索起始部には電位依存性カリウムチャネルKv1.1/Kv1.2が発現しており、活動電位の閾値と振幅を制御するとともに、1回の興奮性シナプス電位によって複数の活動電位が発生するのを防いでいる[16]。シナプス後細胞のKv2およびKv3.1は、活動電位の幅を調節することによって高頻度発火を可能にしている[25]。
シナプス小胞の回収と伝達物質充填、再利用
伝達物質を開口放出したシナプス小胞は、エンドサイトーシスによってシナプス前終末に回収される。エンドサイトーシスは、GTPの加水分解を伴うダイナミンの活性によって担われる[26]。エンドサイトーシスの速度はCa2+依存的に調節され、高頻度発火によってシナプス前終末のCa2+濃度が上昇すると亢進し、実験的にカルシウムキレート剤をシナプス前終末に注入すると抑制される[27][28]。エンドサイトーシスの後、シナプス小胞は液胞型プロトンATPaseよって酸性化される。形成されたプロトンの濃度勾配を利用して小胞型グルタミン酸トランスポーターがシナプス小胞にグルタミン酸を充填する。カリックスシナプスには、小胞型グルタミン酸トランスポーターのVGluT1とVGluT2が発現しているが[29]、両者が同一のシナプス小胞上に共存しているのか、別々の小胞上に発現しているのかは明らかでない。グルタミン酸取り込みの時定数(τ)は生理的温度で7秒であり、小胞が完全に充填されるには数十秒を必要とする[30]。シナプス小胞は再利用のためアクティブゾーンへ輸送される。この過程には細胞骨格が関与し、アクチン[31]やインターセクチン[32]を阻害するとシナプス小胞の補充が遅れて高頻度シナプス伝達が障害される。
聴覚の獲得に伴うカリックスシナプスの生後発達変化
マウスおよびラットでは生後12日齢頃に聴覚機能が完成するが、この時期にカリックスシナプス伝達の性質が変化することが知られている。
例えば、シナプス前終末におけるカリウムチャネルの発現増加と活性化速度の上昇によって、シナプス前終末の活動電位幅が短縮し(図3)、高頻度での活動電位発生が可能となる[33]。活動電位幅の短縮はCa2+流入のタイミングを早めシナプス応答の立ち上がりを早くするが、一方でカルシウムチャネルの開口数の減少と開口時間の短縮をもたらし、シナプス前末端へのCa2+流入量の減少によって小胞放出確率を低下させる。しかし、この放出確率の減少は、生後発達に伴ってCa2+センサーがカルシウムチャネルクラスターに接近して、より高濃度のCa2+を感知することによって部分的に補償される[18][34]。シナプス強度は、更にアクティブゾーンの個数[9]と即時放出可能プールサイズが増大することによって維持される[35]。放出確率の減少と放出可能プールの増大は、1回のシナプス伝達で消費されるシナプス小胞の割合を低く抑え、高頻度でのシナプス伝達の持続を可能とする。
聴覚獲得時期前後でシナプス小胞の開口放出を担う電位依存性カルシウムチャネルサブタイプの構成にも変化が生じる。生後7日齢シナプス前終末ではCav2.1(P/Q型)、Cav2.2(N型)、Cav2.3(R型)が共存してシナプス伝達を担っているが、生後2週齢までにCav2.2とCav2.3は消失しCav2.1だけが残る[36]。またシナプス前終末内のカルシウム結合タンパク質 カルレチニンの発現が増加して、シナプスの短期可塑性に影響を与える[37]。
さらに、シナプス小胞の回収・充填機構でも生後発達変化が生じる。生後7日齢ではCa2+依存性エンドサイトーシスにカルモジュリンが関与するが[38]、生後14日齢ではカルモジュリンは関与しなくなり、より低親和性のCa2+センサーによる機構に置換される[28]。また小胞型グルタミン酸トランスポーターVGluT1の発現が増加して[29]、小胞へのグルタミン酸充填が加速される[30]。
一方、シナプス後細胞においては、NMDA型グルタミン酸受容体の発現がシナプス入力依存的に減少し[39]、シナプス後電流は主としてAMPA型グルタミン酸受容体によって担われるようになる。またAMPA型グルタミン酸受容体サブタイプのうちGluA1が減少し、開閉キネティクスの速いGluA4の比率が上昇する[22]。また単一シナプス小胞の伝達物質によって生じる微小シナプス電流の振幅も増大する[23]。これらの生後発達変化はいずれも高速・高信頼性のシナプス伝達の達成に向けられている。
シナプス伝達の調節機構
伝達物質放出の修飾
シナプス前終末には、代謝活性型グルタミン酸受容体、代謝型GABAB受容体、アデノシンA1受容体、ノルアドレナリンα2受容体、カンナビノイドCB1受容体、セロトニン5-HT1B受容体が存在する。これらGタンパク質共役型受容体の活性化によって、三量体Gタンパク質から解離されたβγサブユニットは、電位依存性カルシウムチャネルに結合しCa2+電流を抑制し、これによって伝達物質放出を抑制する[40][41]。このGタンパク質を介したシナプス伝達の抑制は、カリックスシナプスにおいてはシナプス前性の主要なシナプス伝達調節機構である。Gタンパク質共役受容体のうち、セロトニン5H-T1B受容体、アデノシンA1受容体は生後2週齢までに消失するが、代謝活性型グルタミン酸受容体、GABAB受容体を介した抑制は、生後発達を通じて存続する。しかし、(編集部コメント:「グルタミン酸を除いて」でしょうか?)これらの代謝活性型受容体のリガンドの由来は必ずしも明らかでない。
シナプス前終末の膜電位は伝達物質の放出に影響を与える。シナプス前終末に発現するグリシン受容体の開口[42]やカリウムチャネルKv7.5の不活化[43]は膜電位を上昇させる。この活動電位の閾値には到達しない膜電位上昇は、電位依存性カルシウムチャネルの開口確率を増大させ、前終末内のCa2+濃度上昇につながる。Ca2+濃度上昇は自発性微小シナプス電流の頻度を増加させるとともに、活動電位によって誘発される小胞の放出を促進させる[44]。
また、シナプス前終末のタンパク質リン酸化酵素Aの活性化はEPACを介してシナプス小胞の放出確率と即時放出可能プールサイズを共に増加させて、シナプス伝達を増強する[45]。さらにタンパク質リン酸化酵素Cは小胞Ca2+センサーのCa2+感受性を増加して、高頻度刺激後のシナプス伝達増強をもたらす[46]。
エンドサイトーシスの修飾
開口放出とエンドサイトーシスのバランスは、シナプス伝達の維持に重要である。高頻度でシナプス伝達が起きると、シナプス前終末のCa2+濃度が上昇しエンドサイトーシスが亢進する[27]。またシナプス後細胞では、NMDA型グルタミン酸受容体を介したCa2+流入によってNOSの活性化が誘導され一酸化窒素が合成される。一酸化窒素は拡散し逆行性シグナルとしてシナプス前終末に入り、前終末の可溶性グアニル酸シクラーゼを活性化する。以下、シナプス前終末内cGMP濃度の上昇→タンパク質リン酸化酵素G (PKG)の活性化→RhoAの活性→Rhoキナーゼの活性化→PIP2の産生というカスケードを経て、エンドサイトーシスを加速する[47][48]。
シナプス伝達の短期可塑性
シナプスでは、連続する複数の入力を受ける際、2番目以降のシナプス応答が初回の応答に比べて増強(促通)または減弱(抑圧)する短期可塑性が生じる。シナプス促通と抑圧を担う分子機構は独立かつ共存しており、いずれが優勢となるかは種々の条件によって異なる。
カリックスシナプスにおける短期抑圧の主な要因は、放出可能プールの枯渇、シナプス前終末カルシウムチャネルの不活性化[49]、シナプス後細胞のAMPA型グルタミン酸受容体の脱感作[9][20]である。聴覚獲得前のカリックスシナプス前終末は、放出確率が高く、放出可能プールが小さく[35]、またシナプス小胞の補充再利用も遅いため、短期抑圧を示す。聴覚獲得前のカリックスシナプスにおけるカルシウムチャネルの不活性化は、カルモジュリンによって誘導されるが、カルモジュリンの役割は生後発達と共に減弱する[50]。AMPA型グルタミン酸受容体の脱感作は高頻度入力の場合に重要となる[20]。
シナプス促通は、初回の活動電位によって流入したCa2+が原因となって生じる。シナプス前終末内に残存したCa2+が2回目の活動電位によって流入するCa2+に加算され、小胞のCa2+センサーはより高濃度のCa2+を感知する。また残存Ca2+はカルシウムチャネルの開口速度を速めて[51]、シナプス促通をもたらす[44]。生後発達に伴い放出確率が低下し放出可能プールが大きくなるため、聴覚獲得後のカリックスシナプスでは、促通傾向が優勢になる。
なお聴覚獲得前のカリックスシナプスでは、連続高頻度刺激によってシナプス伝達の数分にわたる増強(postsynaptic potentiation; PTP)が誘発可能である[52]。このメカニズムはCa2+濃度上昇によって活性化したPKCが小胞Ca2+センサーのCa2+感受性を高めることによる[46]。
関連項目
- シナプス
- 興奮性シナプス
- シナプス前終末
- シナプス小胞
- 活動電位
- 放出可能プール
- 放出確率
- 開口放出
- アクティブゾーン
- カルシウムチャネル
- カリウムチャネル
- Gタンパク質共役型受容体
- エンドサイトーシス
- グルタミン酸受容体
- イオンチャンネル型グルタミン酸受容体
参考文献
- ↑ Hans von Held
Die zentrale Gehörleitung.
Arch. Anat. Physiol. Anat. Abt. :1893, 17;201-248. - ↑
Forsythe, I.D. (1994).
Direct patch recording from identified presynaptic terminals mediating glutamatergic EPSCs in the rat CNS, in vitro. The Journal of physiology, 479 ( Pt 3), 381-7. [PubMed:7837096] [PMC] [WorldCat] [DOI] - ↑
Schneggenburger, R., & Forsythe, I.D. (2006).
The calyx of Held. Cell and tissue research, 326(2), 311-37. [PubMed:16896951] [WorldCat] [DOI] - ↑ 高橋 智幸, 堀 哲也, 中村 行宏, 山下 貴之
プレシナプス機構のスライスパッチクランプ研究法
岡田泰伸編 最新パッチクランプ実験技術法, pp.96-102. 吉岡書店(東京):2011 - ↑
Borst, J.G., & Soria van Hoeve, J. (2012).
The calyx of Held synapse: from model synapse to auditory relay. Annual review of physiology, 74, 199-224. [PubMed:22035348] [WorldCat] [DOI] - ↑
Nakamura, P.A., & Cramer, K.S. (2011).
Formation and maturation of the calyx of Held. Hearing research, 276(1-2), 70-8. [PubMed:21093567] [PMC] [WorldCat] [DOI] - ↑
Hoffpauir, B.K., Kolson, D.R., Mathers, P.H., & Spirou, G.A. (2010).
Maturation of synaptic partners: functional phenotype and synaptic organization tuned in synchrony. The Journal of physiology, 588(Pt 22), 4365-85. [PubMed:20855433] [PMC] [WorldCat] [DOI] - ↑
Hoffpauir, B.K., Grimes, J.L., Mathers, P.H., & Spirou, G.A. (2006).
Synaptogenesis of the calyx of Held: rapid onset of function and one-to-one morphological innervation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(20), 5511-23. [PubMed:16707803] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3 9.4 9.5 9.6
Taschenberger, H., Leão, R.M., Rowland, K.C., Spirou, G.A., & von Gersdorff, H. (2002).
Optimizing synaptic architecture and efficiency for high-frequency transmission. Neuron, 36(6), 1127-43. [PubMed:12495627] [WorldCat] [DOI] - ↑
Kandler, K., & Friauf, E. (1993).
Pre- and postnatal development of efferent connections of the cochlear nucleus in the rat. The Journal of comparative neurology, 328(2), 161-84. [PubMed:8423239] [WorldCat] [DOI] - ↑ 11.0 11.1
Sätzler, K., Söhl, L.F., Bollmann, J.H., Borst, J.G., Frotscher, M., Sakmann, B., & Lübke, J.H. (2002).
Three-dimensional reconstruction of a calyx of Held and its postsynaptic principal neuron in the medial nucleus of the trapezoid body. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(24), 10567-79. [PubMed:12486149] [PMC] [WorldCat] - ↑ 12.0 12.1
Wimmer, V.C., Horstmann, H., Groh, A., & Kuner, T. (2006).
Donut-like topology of synaptic vesicles with a central cluster of mitochondria wrapped into membrane protrusions: a novel structure-function module of the adult calyx of Held. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(1), 109-16. [PubMed:16399677] [PMC] [WorldCat] [DOI] - ↑
Müller, J., Reyes-Haro, D., Pivneva, T., Nolte, C., Schaette, R., Lübke, J., & Kettenmann, H. (2009).
The principal neurons of the medial nucleus of the trapezoid body and NG2(+) glial cells receive coordinated excitatory synaptic input. The Journal of general physiology, 134(2), 115-27. [PubMed:19635853] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Leão, R.M., Kushmerick, C., Pinaud, R., Renden, R., Li, G.L., Taschenberger, H., ..., & von Gersdorff, H. (2005).
Presynaptic Na+ channels: locus, development, and recovery from inactivation at a high-fidelity synapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(14), 3724-38. [PubMed:15814803] [PMC] [WorldCat] [DOI] - ↑
Taschenberger, H., & von Gersdorff, H. (2000).
Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(24), 9162-73. [PubMed:11124994] [PMC] [WorldCat] - ↑ 16.0 16.1
Dodson, P.D., Barker, M.C., & Forsythe, I.D. (2002).
Two heteromeric Kv1 potassium channels differentially regulate action potential firing. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(16), 6953-61. [PubMed:12177193] [PMC] [WorldCat] [DOI] - ↑
Ishikawa, T., Nakamura, Y., Saitoh, N., Li, W.B., Iwasaki, S., & Takahashi, T. (2003).
Distinct roles of Kv1 and Kv3 potassium channels at the calyx of Held presynaptic terminal. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(32), 10445-53. [PubMed:14614103] [PMC] [WorldCat] - ↑ 18.0 18.1 18.2
Nakamura, Y., Harada, H., Kamasawa, N., Matsui, K., Rothman, J.S., Shigemoto, R., ..., & Takahashi, T. (2015).
Nanoscale distribution of presynaptic Ca(2+) channels and its impact on vesicular release during development. Neuron, 85(1), 145-158. [PubMed:25533484] [PMC] [WorldCat] [DOI] - ↑
Kochubey, O., & Schneggenburger, R. (2011).
Synaptotagmin increases the dynamic range of synapses by driving Ca²+-evoked release and by clamping a near-linear remaining Ca²+ sensor. Neuron, 69(4), 736-48. [PubMed:21338883] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Koike-Tani, M., Kanda, T., Saitoh, N., Yamashita, T., & Takahashi, T. (2008).
Involvement of AMPA receptor desensitization in short-term synaptic depression at the calyx of Held in developing rats. The Journal of physiology, 586(9), 2263-75. [PubMed:18339695] [PMC] [WorldCat] [DOI] - ↑
Budisantoso, T., Harada, H., Kamasawa, N., Fukazawa, Y., Shigemoto, R., & Matsui, K. (2013).
Evaluation of glutamate concentration transient in the synaptic cleft of the rat calyx of Held. The Journal of physiology, 591(1), 219-39. [PubMed:23070699] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1
Koike-Tani, M., Saitoh, N., & Takahashi, T. (2005).
Mechanisms underlying developmental speeding in AMPA-EPSC decay time at the calyx of Held. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(1), 199-207. [PubMed:15634782] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Yamashita, T., Ishikawa, T., & Takahashi, T. (2003).
Developmental increase in vesicular glutamate content does not cause saturation of AMPA receptors at the calyx of Held synapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(9), 3633-8. [PubMed:12736334] [PMC] [WorldCat] - ↑
Borst, J.G., & Sakmann, B. (1996).
Calcium influx and transmitter release in a fast CNS synapse. Nature, 383(6599), 431-4. [PubMed:8837774] [WorldCat] [DOI] - ↑
Wang, L.Y., Gan, L., Forsythe, I.D., & Kaczmarek, L.K. (1998).
Contribution of the Kv3.1 potassium channel to high-frequency firing in mouse auditory neurones. The Journal of physiology, 509 ( Pt 1), 183-94. [PubMed:9547392] [PMC] [WorldCat] [DOI] - ↑
Yamashita, T., Hige, T., & Takahashi, T. (2005).
Vesicle endocytosis requires dynamin-dependent GTP hydrolysis at a fast CNS synapse. Science (New York, N.Y.), 307(5706), 124-7. [PubMed:15637282] [WorldCat] [DOI] - ↑ 27.0 27.1
Hosoi, N., Holt, M., & Sakaba, T. (2009).
Calcium dependence of exo- and endocytotic coupling at a glutamatergic synapse. Neuron, 63(2), 216-29. [PubMed:19640480] [WorldCat] [DOI] - ↑ 28.0 28.1
Yamashita, T., Eguchi, K., Saitoh, N., von Gersdorff, H., & Takahashi, T. (2010).
Developmental shift to a mechanism of synaptic vesicle endocytosis requiring nanodomain Ca2+. Nature neuroscience, 13(7), 838-44. [PubMed:20562869] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Billups, B. (2005).
Colocalization of vesicular glutamate transporters in the rat superior olivary complex. Neuroscience letters, 382(1-2), 66-70. [PubMed:15911123] [WorldCat] [DOI] - ↑ 30.0 30.1
Hori, T., & Takahashi, T. (2012).
Kinetics of synaptic vesicle refilling with neurotransmitter glutamate. Neuron, 76(3), 511-7. [PubMed:23141063] [WorldCat] [DOI] - ↑
Sakaba, T., & Neher, E. (2003).
Involvement of actin polymerization in vesicle recruitment at the calyx of Held synapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(3), 837-46. [PubMed:12574412] [PMC] [WorldCat] - ↑
Sakaba, T., Kononenko, N.L., Bacetic, J., Pechstein, A., Schmoranzer, J., Yao, L., ..., & Haucke, V. (2013).
Fast neurotransmitter release regulated by the endocytic scaffold intersectin. Proceedings of the National Academy of Sciences of the United States of America, 110(20), 8266-71. [PubMed:23633571] [PMC] [WorldCat] [DOI] - ↑
Sakaba, T., Kononenko, N.L., Bacetic, J., Pechstein, A., Schmoranzer, J., Yao, L., ..., & Haucke, V. (2013).
Fast neurotransmitter release regulated by the endocytic scaffold intersectin. Proceedings of the National Academy of Sciences of the United States of America, 110(20), 8266-71. [PubMed:23633571] [PMC] [WorldCat] [DOI] - ↑
Fedchyshyn, M.J., & Wang, L.Y. (2005).
Developmental transformation of the release modality at the calyx of Held synapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(16), 4131-40. [PubMed:15843616] [PMC] [WorldCat] [DOI] - ↑ 35.0 35.1
Iwasaki, S., & Takahashi, T. (2001).
Developmental regulation of transmitter release at the calyx of Held in rat auditory brainstem. The Journal of physiology, 534(Pt 3), 861-71. [PubMed:11483715] [PMC] [WorldCat] [DOI] - ↑
Iwasaki, S., Momiyama, A., Uchitel, O.D., & Takahashi, T. (2000).
Developmental changes in calcium channel types mediating central synaptic transmission. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(1), 59-65. [PubMed:10627581] [PMC] [WorldCat] - ↑
Felmy, F., & Schneggenburger, R. (2004).
Developmental expression of the Ca2+-binding proteins calretinin and parvalbumin at the calyx of Held of rats and mice. The European journal of neuroscience, 20(6), 1473-82. [PubMed:15355314] [WorldCat] [DOI] - ↑
Wu, X.S., McNeil, B.D., Xu, J., Fan, J., Xue, L., Melicoff, E., ..., & Wu, L.G. (2009).
Ca(2+) and calmodulin initiate all forms of endocytosis during depolarization at a nerve terminal. Nature neuroscience, 12(8), 1003-1010. [PubMed:19633667] [PMC] [WorldCat] [DOI] - ↑
Futai, K., Okada, M., Matsuyama, K., & Takahashi, T. (2001).
High-fidelity transmission acquired via a developmental decrease in NMDA receptor expression at an auditory synapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(10), 3342-9. [PubMed:11331363] [PMC] [WorldCat] - ↑ Tomoyuki Takahashi, Yoshinao Kajikawa, Masahiro Kimura, Naoto Saitoh, Tetsuhiro Tsujimoto
Presynaptic mechanism underlying regulation of transmitter release by G protein coupled receptors.
Korean J. Physiol. Pharmacol. :2004, 8(2):69-76. - ↑
Mizutani, H., Hori, T., & Takahashi, T. (2006).
5-HT1B receptor-mediated presynaptic inhibition at the calyx of Held of immature rats. The European journal of neuroscience, 24(7), 1946-54. [PubMed:17067296] [WorldCat] [DOI] - ↑
Turecek, R., & Trussell, L.O. (2001).
Presynaptic glycine receptors enhance transmitter release at a mammalian central synapse. Nature, 411(6837), 587-90. [PubMed:11385573] [WorldCat] [DOI] - ↑
Huang, H., & Trussell, L.O. (2011).
KCNQ5 channels control resting properties and release probability of a synapse. Nature neuroscience, 14(7), 840-7. [PubMed:21666672] [PMC] [WorldCat] [DOI] - ↑ 44.0 44.1
Hori, T., & Takahashi, T. (2009).
Mechanisms underlying short-term modulation of transmitter release by presynaptic depolarization. The Journal of physiology, 587(Pt 12), 2987-3000. [PubMed:19403620] [PMC] [WorldCat] [DOI] - ↑
Kaneko, M., & Takahashi, T. (2004).
Presynaptic mechanism underlying cAMP-dependent synaptic potentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(22), 5202-8. [PubMed:15175390] [PMC] [WorldCat] [DOI] - ↑ 46.0 46.1
Korogod, N., Lou, X., & Schneggenburger, R. (2007).
Posttetanic potentiation critically depends on an enhanced Ca(2+) sensitivity of vesicle fusion mediated by presynaptic PKC. Proceedings of the National Academy of Sciences of the United States of America, 104(40), 15923-8. [PubMed:17884983] [PMC] [WorldCat] [DOI] - ↑
Eguchi, K., Nakanishi, S., Takagi, H., Taoufiq, Z., & Takahashi, T. (2012).
Maturation of a PKG-dependent retrograde mechanism for exoendocytic coupling of synaptic vesicles. Neuron, 74(3), 517-29. [PubMed:22578503] [WorldCat] [DOI] - ↑
Taoufiq, Z., Eguchi, K., & Takahashi, T. (2013).
Rho-kinase accelerates synaptic vesicle endocytosis by linking cyclic GMP-dependent protein kinase activity to phosphatidylinositol-4,5-bisphosphate synthesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(29), 12099-104. [PubMed:23864695] [PMC] [WorldCat] [DOI] - ↑
Forsythe, I.D., Tsujimoto, T., Barnes-Davies, M., Cuttle, M.F., & Takahashi, T. (1998).
Inactivation of presynaptic calcium current contributes to synaptic depression at a fast central synapse. Neuron, 20(4), 797-807. [PubMed:9581770] [WorldCat] [DOI] - ↑
Nakamura, T., Yamashita, T., Saitoh, N., & Takahashi, T. (2008).
Developmental changes in calcium/calmodulin-dependent inactivation of calcium currents at the rat calyx of Held. The Journal of physiology, 586(9), 2253-61. [PubMed:18238813] [PMC] [WorldCat] [DOI] - ↑
Cuttle, M.F., Tsujimoto, T., Forsythe, I.D., & Takahashi, T. (1998).
Facilitation of the presynaptic calcium current at an auditory synapse in rat brainstem. The Journal of physiology, 512 ( Pt 3), 723-9. [PubMed:9769416] [PMC] [WorldCat] [DOI] - ↑
Habets, R.L., & Borst, J.G. (2005).
Post-tetanic potentiation in the rat calyx of Held synapse. The Journal of physiology, 564(Pt 1), 173-87. [PubMed:15695246] [PMC] [WorldCat] [DOI]