「アラキドン酸」の版間の差分
細 →関連項目 |
細編集の要約なし |
||
| (同じ利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1"> | <font size="+1">聶 翔</font><br> | ||
<font size="+1">永井 裕崇</font><br> | |||
<font size="+1">北岡 志保</font><br> | |||
<font size="+1">[http://researchmap.jp/read0192882 古屋敷 智之]</font><br> | |||
''神戸大学大学院医学研究科・医学部 薬理学分野''<br> | ''神戸大学大学院医学研究科・医学部 薬理学分野''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2012年8月13日 原稿完成日:2012年11月2日<br> | ||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
英:arachidonic acid 独:Arachidonsäure 仏:acide arachidonique | 英:arachidonic acid 独:Arachidonsäure 仏:acide arachidonique | ||
{{box|text= | {{box|text= 1段落程度の要約をお願いいたします。}} | ||
{{Chembox | {{Chembox | ||
| Verifiedfields = changed | | Verifiedfields = changed | ||
| 15行目: | 18行目: | ||
| ImageFile = Arachidonic acid.svg | | ImageFile = Arachidonic acid.svg | ||
| ImageFile_Ref = {{Chemboximage|correct|??}} | | ImageFile_Ref = {{Chemboximage|correct|??}} | ||
| ImageSize = | | ImageSize = 200 | ||
| ImageName = Structural formula of arachidonic acid | | ImageName = Structural formula of arachidonic acid | ||
| ImageFileL2 = Arachidonic acid spacefill.png | | ImageFileL2 = Arachidonic acid spacefill.png | ||
| 77行目: | 80行目: | ||
}} | }} | ||
== アラキドン酸とは == | == アラキドン酸とは == | ||
アラキドン酸は4つのcis二重結合を有する20個の炭素鎖からなる脂肪酸である。メチル末端(ωまたはn)から数えて最初の二重結合が6番目と7番目の炭素の間に位置するため、ω-6 (n-6)多価不飽和脂肪酸に含まれ、20:4ω-6と記載される<ref name=Spector2015><pubmed>25339684</pubmed></ref><ref name=Martin2016><pubmed>27142391</pubmed></ref> 。アラキドン酸は、主に細胞膜のリン脂質のsn-2位にエステル化されて存在する<ref name=Burke2009><pubmed>19011112</pubmed></ref> 。主にグリセロリン脂質にコリンが結合したホスファチジルコリンに含まれるが、ホスファチジルイノシトールなど他のグリセロリン脂質にも含まれる<ref name=Farooqui2000><pubmed>10878232</pubmed></ref> 。アラキドン酸は、刺激に応じてホスホリパーゼA2(phospholipase A2; PLA2)の酵素活性により細胞膜から遊離する他<ref name=Shimizu2006><pubmed>16754327</pubmed></ref><ref name=Murakami2017><pubmed>29129849</pubmed></ref> 、エンドカンナビノイドと称する2-arachodonoyl-glycerol (2-AG)やアナンダマイド(anandamide; arachidonoylethanolamide)の構成成分として細胞膜から遊離する<ref name=DiMarzo2015><pubmed>25524120</pubmed></ref><ref name=Wang2009><pubmed>19126434</pubmed></ref> 。エンドカンナビノイドはそれ自体で生理活性を有するが、代謝されて遊離アラキドン酸を産生する<ref name=Blankman2013><pubmed>23512546</pubmed></ref><ref name=Piomelli2014><pubmed>23954677</pubmed></ref> 。遊離アラキドン酸の大半は細胞膜のリン脂質に再度取り込まれるため、その濃度は低く維持されている<ref name=Chilton1996><pubmed>8555241</pubmed></ref> 。遊離アラキドン酸はプロスタノイドやロイコトリエンなど多様な生理活性脂質に変換され、摂食、睡眠・覚醒、脳血流など生理的な脳機能の他、疾病時の発熱や内分泌応答、疼痛、てんかん、脳虚血、ストレス、神経・精神疾患など様々な病態にも関与する<ref name=Bosetti2007><pubmed>17403135</pubmed></ref><ref name=Samuelsson2012><pubmed>22318727</pubmed></ref><ref name=Vane1998><pubmed>9597150</pubmed></ref><ref name=Narumiya2007><pubmed>24367153</pubmed></ref><ref name=Funk2001><pubmed>11729303</pubmed></ref><ref name=Furuyashiki2011><pubmed>21116297</pubmed></ref><ref name=Back2014><pubmed>24588652</pubmed></ref> 。 | |||
== 摂取・生合成・代謝 == | == 摂取・生合成・代謝 == | ||
アラキドン酸は、肉、卵、魚介類などの食品から得られ、細胞内のリン脂質に取り込まれ、様々な生体膜の合成に使用される<ref name=Abedi2014><pubmed>25473503</pubmed></ref> | アラキドン酸は、肉、卵、魚介類などの食品から得られ、細胞内のリン脂質に取り込まれ、様々な生体膜の合成に使用される<ref name=Abedi2014><pubmed>25473503</pubmed></ref> 。ラットを用いた実験では、離乳後3〜4カ月の間ω-6 多価不飽和脂肪酸を欠乏させると、脳内のアラキドン酸含有量が約30%減少することが示されている<ref name=Igarashi2009><pubmed>19073280</pubmed></ref> 。成人では、脳で代謝されるアラキドン酸は血漿から補われ、脳内のアラキドン酸の含有量は一定に保たれている。ヒトのPETイメージングにより、脳内へ取り込まれる血漿中のアラキドン酸は約18mg/日、脳内におけるアラキドン酸の半減期は約147日と推定されている<ref name=Rapoport2007><pubmed>18060754</pubmed></ref><ref name=Rapoport2008><pubmed>19022981</pubmed></ref> 。 | ||
アラキドン酸は、18個の炭素鎖からなり2つのcis二重結合を含むω-6多価不飽和脂肪酸の一種であるリノール酸(18:2ω-6)からも産生される(図1)。リノール酸は必須脂肪酸であり、ナッツなどの種実類や植物油に豊富に含まれる<ref name=Abedi2014><pubmed>25473503</pubmed></ref> 。体内に取り込まれたリノール酸は、段階的な不飽和化および脂肪鎖伸長によって、アラキドン酸やドコサテトラエン酸(22:4ω-6)などの脂肪酸に変換される。まず、リノール酸はΔ6不飽和化酵素(fatty acid desaturase 2; FADS2)による脱水素化を介して二重結合が付与されてγ-リノレン酸(18:3ω-6)になる。その後、γ-リノレン酸からΔ6脂肪酸伸長酵素(Δ6 elongase)により脂肪酸が伸長されてジホモ-γ-リノレン酸(20:3ω-6)になる。Δ5不飽和化酵素(fatty acid desaturase 1; FADS1)によりジホモ-γ-リノレン酸からアラキドン酸が産生される<ref name=Guillou2010><pubmed>20018209</pubmed></ref><ref name=Wiktorowska-Owczarek2015><pubmed>26771963</pubmed></ref> 。Δ5不飽和化酵素やΔ6不飽和化酵素の活性は、栄養、喫煙、老化などの要因により変動し、肥満に関与することが示唆されている<ref name=Warensjö2006><pubmed>16487913</pubmed></ref> 。 | |||
脳内ではアラキドン酸を含むほとんどの多価不飽和脂肪酸は長鎖脂肪酸CoAリガーゼ(long-chain-fatty-acid-CoA synthase; ACSL)により活性化され、細胞膜のリン脂質にエステル化される他、エネルギー源としてβ酸化により代謝されてアセチルCoAの産生を促す。アラキドン酸の代謝の効率は、細胞膜にある脂肪酸トランスポーターや脂肪酸結合タンパク質(fatty acid-binding protein; FABP)により影響を受けると考えられている<ref name=Bazinet2014><pubmed>25387473</pubmed></ref> 。 | |||
== 細胞膜への取り込み == | == 細胞膜への取り込み == | ||
遊離アラキドン酸はACSLによりアラキドノイルCoA(arachidonoyl-CoA)となって活性化され、アシルトランスフェラーゼ(acyltransferase)により細胞膜のリン脂質のsn-2位に取り込まれる<ref name=Pérez-Chacón2009><pubmed>19715771</pubmed></ref> 。リン脂質の産生には二つの生化学的経路が関与する<ref name=Shindou2009><pubmed>18718904</pubmed></ref> (図2)。 | |||
=== ケネディー経路 === | === ケネディー経路 === | ||
リン脂質はグリセロール-3-リン酸から脂肪酸の付加により新たに合成されるが、この経路は発見者の名にちなんでケネディー経路(Kennedy Pathway)と呼ばれる。この経路では、グリセロール-3-リン酸アシルトランスフェラーゼ(glycerol-3-phosphate acyltransferase; GPAT)がグリセロール-3-リン酸(GP)のsn-1位に脂肪酸をエステル化により付加し、リゾリン脂質の一種であるリゾホスファチジン酸(lysophosphatidic acid)を生成する。続いて、リゾホスファチジン酸アシルトランスフェラーゼ(lysophosphatidic acid acyltransferase; LPAAT)がリゾホスファチジン酸のsn-2位に脂肪酸をエステル化により付加し、ホスファチジン酸(phosphatidic acid)を生成する。ホスファチジン酸はジアシルグリセロール(diacylglycerol; DAG)に変換され、トリアシルグリセロール(triglyceride)、ホスファチジルコリン(phosphatidylcholine; PC)、ホスファチジルエタノラミン(phosphatidylethanolamine; PE)、ホスファチジルセリン(phosphatidylserine; PS)が産生される。また、ホスファチジン酸はシチジン二リン酸ジアシルグリセロール(cytidine diphosphate-DAG; CDP-DAG)にも変換され、ホスファチジルイノシトール(phosphatidylinositol; PI)、ホスファチジルセリン(phosphatidylserine; PS)、ホスファチジルグリセロール(phosphatidylglycerol; PG)、カルジオリピン(cardiolipin; CL)が産生される。 | |||
=== ランズ回路 === | === ランズ回路 === | ||
加えて、一度生成されたリン脂質では、sn-2位に含まれる脂肪酸が代謝回転している。この代謝回路を発見者の名にちなんでランズ回路(Lands | 加えて、一度生成されたリン脂質では、sn-2位に含まれる脂肪酸が代謝回転している。この代謝回路を発見者の名にちなんでランズ回路(Lands Cycle)と称する。ランズ回路では、PLA2によりsn-2位の脂肪酸が遊離し、リゾリン脂質が生成される。リゾリン脂質アシルトランスフェラーゼは、生成されたリゾリン脂質のsn-2位に脂肪酸をエステル化により付加し、その結果、リゾリン脂質はリン脂質に戻る。ランズ回路を担うリゾリン脂質アシルトランスフェラーゼ(lysophospholipid acyltransferase; LPLAT)には数多くのアイソフォームが存在し、それぞれ基質とするリゾリン脂質や脂肪酸の種類に特異性がある<ref name=Shindou2009><pubmed>18718904</pubmed></ref> 。現在、遺伝子欠損マウスを用いた解析が精力的に進められている。例えばLPCAT3 (lysophosphatidylcholine acyltransferase 3)の欠損では、ランズ回路によるホスファチジルコリンへのアラキドン酸の再取り込みが障害され、細胞膜中のアラキドン酸の含有量が大きく減少することが示された<ref name=Hashidate-Yoshida2015><pubmed>25898003</pubmed></ref> 。リゾリン脂質アシルトランスフェラーゼの各アイソフォームは、基質特異性に加え、特異的な細胞内局在や発現分布を取り、その結果、細胞膜のリン脂質の非対称性や多様性が生まれると考えられている<ref name=Hishikawa2008><pubmed>18287005</pubmed></ref> 。 | ||
== 細胞膜からの遊離 == | == 細胞膜からの遊離 == | ||
細胞が成長因子、ホルモン、サイトカインなど様々な細胞外刺激に曝されると遊離アラキドン酸が産生される<ref name=Harizi2008><pubmed>18774339</pubmed></ref> 。遊離アラキドン酸の産生には、PLA2による細胞膜からのアラキドン酸の遊離と、アラキドン酸を構造に含むエンドカンナビノイドの代謝による遊離アラキドン酸の産生といった、少なくとも2種類のメカニズムが存在する(図3)。しかし、いずれの経路が働くかは脳領域や細胞種、刺激によって異なる可能性があるが、実態は不明である。各経路の機能的意義にも関わる問題であり、今後精査が必要である。細胞膜からの放出後は、遊離アラキドン酸の90%以上は直ちにACSLを介してアラキドノイルCoA(arachidonoyl-CoA)となり活性化され、リゾリン脂質アシルトランスフェラーゼにより細胞膜のリン脂質のsn-2位に再エステル化されて再利用される<ref name=Lobo2007><pubmed>17164224</pubmed></ref> 。 | |||
=== アラキドン酸のPLA2による細胞膜からの遊離 === | === アラキドン酸のPLA2による細胞膜からの遊離 === | ||
細胞膜のリン脂質のsn-2位に含まれるアラキドン酸がPLA2によって遊離することは古くより知られてきた<ref name=Burke2009><pubmed>19011112</pubmed></ref><ref name=Shimizu2006><pubmed>16754327</pubmed></ref><ref name=Murakami2017><pubmed>29129849</pubmed></ref> | 細胞膜のリン脂質のsn-2位に含まれるアラキドン酸がPLA2によって遊離することは古くより知られてきた<ref name=Burke2009><pubmed>19011112</pubmed></ref><ref name=Shimizu2006><pubmed>16754327</pubmed></ref><ref name=Murakami2017><pubmed>29129849</pubmed></ref> 。PLA2は分泌型PLA2(secretory PLA2; sPLA2)、細胞質型PLA2(cytosolic PLA2; cPLA2)、Ca2+非依存型PLA2(Ca2+-independent PLA2; iPLA2)に大別される。各グループには異なる遺伝子がコードする複数のアイソフォームが存在し、制御機構や脂質選択性が異なる<ref name=Murakami2017><pubmed>29129849</pubmed></ref> 。cPLA2αを含むcPLA2の多くはその活性化に細胞内Ca2+濃度の上昇を必要とする。アラキドン酸の細胞膜からの遊離にはcPLA2とsPLA2が関与し、iPLA2は脂質リモデリングを司るランズ回路に関与すると考えられている<ref name=Burke2009><pubmed>19011112</pubmed></ref><ref name=Murakami2017><pubmed>29129849</pubmed></ref> 。実際cPLA2α欠損マウスのマクロファージや消化管では、細菌内毒素LPSによるアラキドン酸の遊離が消失していた<ref name=Nomura2011><pubmed>22021672</pubmed></ref><ref name=Uozumi1997><pubmed>9403692</pubmed></ref> 。また、マクロファージ細胞株では、脂質メディエイターの血小板活性化因子(platelet activating factor; PAF)によるアラキドン酸遊離がcPLA2阻害薬MAFPとsPLA2阻害薬diC6SNPEにより抑制された<ref name=Balsinde1996><pubmed>8636097</pubmed></ref> 。 | ||
神経活動依存的にPLA2を介するアラキドン酸遊離が誘導されることも示唆されている。[ | 神経活動依存的にPLA2を介するアラキドン酸遊離が誘導されることも示唆されている。[14C]標識アラキドン酸を用いた実験では、ラットの大脳皮質や線条体でのアラキドン酸の取り込みがドパミンD2受容体のアゴニスト投与により亢進する<ref name=Basselin2012><pubmed>22178644</pubmed></ref> 。また、[3H]標識アラキドン酸を用いた実験では、線条体の初代培養神経細胞におけるアラキドン酸の遊離がNMDA型グルタミン酸受容体の活性化により促進すること<ref name=Dumuis1988><pubmed>2847054</pubmed></ref> 、その促進がPLA2を阻害するmepacrine(quinacrine)により阻害されることが示された<ref name=Tapia-Arancibia1992><pubmed>1355446</pubmed></ref> 。さらに、小脳プルキンエ細胞のシナプス長期抑制(long-term depression; LTD)はcPLA2α欠損マウスで消失し、この異常がアラキドン酸やその生理活性代謝物であるプロスタグランジン(prostaglandin; PG)D2・PGE2の補充により回復することも示されている<ref name=Le2010><pubmed>20133605</pubmed></ref> 。 | ||
=== エンドカナビノイドの代謝による遊離アラキドン酸の産生 === | === エンドカナビノイドの代謝による遊離アラキドン酸の産生 === | ||
近年、脳、肝臓、肺では、LPSの全身性投与による遊離アラキドン酸の上昇はcPLA2α欠損マウスでも大きな影響を受けず、モノアシルグリセロールリパーゼ(monoacylglycerol lipase; MGL)の遺伝子欠損マウスや阻害薬投与により消失することも示された<ref name=Nomura2011><pubmed>22021672</pubmed></ref> 。この結果は、これらの臓器では主にエンドカナビノイドの一種である2-AGがMGLにより代謝されて遊離アラキドン酸を生ずることを示唆する。2-AGはシナプス活動に伴う細胞内のCa2+濃度上昇によりシナプス後部で産生され、シナプス前部のカンナビノイド受容体CB1に作用して、逆行性にシナプス伝達を抑制する<ref name=Kano2014><pubmed>25169670</pubmed></ref> 。2-AGは、主にsn-2位にアラキドン酸を含むホスファチジルイノシトール(phosphatidylinositol)がホスホリパーゼC(phospholipase C; PLC)によりジアシルグリセロール(diacylglycerol; DAG)に代謝され、さらにDAGがジアシルグリセロールリパーゼ(diacylglycerol lipase; DGL)により代謝されて生ずると考えられている<ref name=DiMarzo2015><pubmed>25524120</pubmed></ref><ref name=Wang2009><pubmed>19126434</pubmed></ref><ref name=Blankman2013><pubmed>23512546</pubmed></ref><ref name=Piomelli2014><pubmed>23954677</pubmed></ref> 。 | |||
遊離アラキドン酸はもう一つのエンドカンナビノイドであるアナンダマイド(anandamide; arachidonoylethanolamide)からも産生される。アナンダマイドは、主にsn-2位にアラキドン酸を含むホスファチジルエタノラミンがN-アシルトランスフェラーゼによりN-アラキドノイルホスファチジルエタノラミン(N-arachidonoyl phosphatidylethanolamine)に代謝され、さらにホスホリパーゼD(phospholipase D)により代謝されて生ずると考えられている。アナンダマイドは脂肪酸アミド加水分解酵素(fatty acid amide hydrolase; FAAH)によって代謝されて遊離アラキドン酸を生ずる<ref name=DiMarzo2015><pubmed>25524120</pubmed></ref><ref name=Wang2009><pubmed>19126434</pubmed></ref><ref name=Blankman2013><pubmed>23512546</pubmed></ref><ref name=Piomelli2014><pubmed>23954677</pubmed></ref> 。 | |||
''エンドカンナビノイドの産生・作用については、エンドカナビノイドの項目参照。'' | |||
=== 遊離アラキドン酸の働き === | |||
遊離アラキドン酸は、後述するアラキドン酸カスケードにより産生される生理活性脂質と変換されて機能を発揮する。遊離アラキドン酸そのものも神経突起伸長<ref name=Darios2006><pubmed>16598260</pubmed></ref> 、シナプス可塑性<ref name=Williams1989><pubmed> 2571939 </pubmed></ref><ref name=Bolshakov1995><pubmed>8606806</pubmed></ref> 、細胞内Ca2+濃度上昇<ref name=Mignen2008><pubmed>17991693</pubmed></ref> 、多様なイオンチャネルの活性調節<ref name=Meves2008><pubmed>18552881</pubmed></ref> に関わることが示唆されてきたが、いずれも外来性のアラキドン酸の効果を調べた実験に留まっている。アラキドン酸カスケードの関与も検討しておらず、観察された作用がアラキドン酸によるものか、あるいは、その生理活性代謝物によるものかは定かではない。統合失調症など精神疾患患者の血液における遊離アラキドン酸の濃度の異常も報告されているが、病態との関連は不明である<ref name=McNamara2007><pubmed>17236749</pubmed></ref><ref name=Sethom2010><pubmed>20667702</pubmed></ref><ref name=Kim2011><pubmed>20038946</pubmed></ref> 。 | |||
== アラキドン酸カスケード == | == アラキドン酸カスケード == | ||
細胞膜から遊離したアラキドン酸は、シクロオキシゲナーゼ(cyclooxygenase; COX)、リポキシゲナーゼ(lipoxygenase; LOX)、シトクロム(cytochrome)P-450ファミリーに属するエポキシゲナーゼ(epoxygenase; EOX)のいずれかを律速酵素とする三つの経路により代謝され、特異的な作用を持った生理活性脂質を生ずる<ref name=Bosetti2007><pubmed>17403135</pubmed></ref><ref name=Samuelsson2012><pubmed>22318727</pubmed></ref><ref name=Vane1998><pubmed>9597150</pubmed></ref><ref name=Narumiya2007><pubmed>24367153</pubmed></ref><ref name=Funk2001><pubmed>11729303</pubmed></ref><ref name=Furuyashiki2011><pubmed>21116297</pubmed></ref> 。これらの生理活性脂質はアラキドン酸由来の20個の炭素鎖を持つことから、ギリシャ語で20を意味するeicosaにちなんで、エイコサノイド(eicosanoid)と呼ばれる<ref name=Funk2001><pubmed>11729303</pubmed></ref> 。 | |||
=== シクロオキシゲナーゼ(COX)経路 === | |||
COX経路では、遊離アラキドン酸はCOXによりプロスタグランジン(prostaglandin; PG)G2、さらにPGH2に変換される<ref name=Bosetti2007><pubmed>17403135</pubmed></ref><ref name=Samuelsson2012><pubmed>22318727</pubmed></ref><ref name=Vane1998><pubmed>9597150</pubmed></ref><ref name=Narumiya2007><pubmed>24367153</pubmed></ref><ref name=Funk2001><pubmed>11729303</pubmed></ref><ref name=Furuyashiki2011><pubmed>21116297</pubmed></ref> 。PGH2はPGD合成酵素、PGE合成酵素、PGF合成酵素、PGI合成酵素、トロンボキサンA合成酵素を介してPGD2、PGE2、PGF2α、PGI2、thromboxane A2といったプロスタノイドに変換され、それぞれDP、EP、FP、IP、TPと呼ばれる選択的なGタンパク質共役型受容体に結合して作用を発揮する。プロスタノイドは、循環器・消化器・骨の恒常性維持、生殖器の機能、局所炎症に伴う血管透過性亢進、細胞性免疫応答など全身の様々な機能を担う。特に脳との関連では、摂食、睡眠・覚醒、脳血流など生理的な脳機能の他、疾病時の発熱や内分泌応答、疼痛、てんかん、脳虚血、ストレス、神経・精神疾患など様々な病態に関わる<ref name=Narumiya2007><pubmed>24367153</pubmed></ref><ref name=Furuyashiki2011><pubmed>21116297</pubmed></ref> 。 | |||
'' | ''プロスタノイドの生合成や作用については、プロスタグランジンの項目参照。'' | ||
=== リポキシゲナーゼ経路 === | === リポキシゲナーゼ経路 === | ||
リポキシゲナーゼ (LOX)経路では、遊離アラキドン酸は基質特異性の異なるLOXにより複数のヒドロペルオキシエイコサテトラエン酸(Hydroperoxyeicosatetraenoic acid; HpETE)に変換され、さらに酵素的・非酵素的な反応を介してロイコトリエン(leukotriene)やヒドロキシエイコサテトラエン酸(Hydroxyeicosatetraenoic acid; HETE)などの多様な生理活性脂質に変換される<ref name=Funk2001><pubmed>11729303</pubmed></ref><ref name=Back2014><pubmed>24588652</pubmed></ref><ref name=Ghosh2016><pubmed>27542570</pubmed></ref> 。 | |||
主には12-LOXや15-LOXを介して8-HpETE、12-HpETE、15-HpETEが産生され、5-LOXと5-lipoxygenase-activating protein (FLAP)を介して5-HpETEが産生される。5-HpETEは速やかに脱水反応によりLTA4となり、LTA4はLTA4加水分解酵素(LTA4 hydrolase)により速やかにLTB4を生ずるか、LTC4合成酵素(LTC4 synthase)によりLTC4を生ずる。LTC4はさらにLTD4、LTE4になる。LTA4を産生する酵素を持たない細胞でも、近傍の細胞からLTA4の供給を受けて、LTC4を産生する場合がある。この現象を細胞間生合成経路(transcellular biosynthesis)と呼ぶ。 | |||
LTA4・LTB4とLTC4・LTD4・LTE4は、システイン残基の有無により構造が大きく異なることから、作用する受容体も異なる。BLT1とBLT2はLTA4・LTB4をリガンドとするGタンパク質共役型受容体として同定された。しかし、BLT1の親和性がBLT2に比してはるかに高く、BLT2には親和性のはるかに高い12-hydroxyheptadecatrienoic acid (12-HHT)というリガンドが存在する<ref name=Yokomizo2015><pubmed>25480980</pubmed></ref> 。 | |||
LTC4・LTD4・LTE4からなるシスティニルロイコトリエン(cysteinyl leukotrienes; Cys-LT)は主にCysLT受容体のI型(CysLT1R)とII型(CysLT2R)に結合して作用を発揮する。 | |||
ロイコトリエンは、好中球の走化性・凝集・細胞接着・脱顆粒化、平滑筋収縮、血管の透過性や収縮の調節、粘液分泌の増強、免疫制御、炎症性疼痛、喘息、アレルギー性鼻炎、アレルギー性結膜炎、アトピー性皮膚炎、嚢胞性線維症、慢性閉塞性肺疾患、糸球体腎炎、麻痺性関節炎、乾癬、炎症性腸疾患、間質性肺疾患などの様々な生理的機能や疾患に関与する。また、ロイコトリエンは、脳損傷、多発性硬化症、アルツハイマー病、パーキンソン病、ハンチントン舞踏病、てんかん、うつ、加齢など多様な脳疾患との関連が示唆されている<ref name=Ghosh2016><pubmed>27542570</pubmed></ref> 。ロイコトリエンの生合成や作用については、他の総説もご参照いただきたい<ref name=Funk2001><pubmed>11729303</pubmed></ref><ref name=Back2014><pubmed>24588652</pubmed></ref><ref name=Ghosh2016><pubmed>27542570</pubmed></ref> 。 | |||
=== エポキシゲナーゼ経路 === | === エポキシゲナーゼ経路 === | ||
エポキシゲナーゼ(EOX) | エポキシゲナーゼ(EOX)経路では、遊離アラキドン酸は基質特異性の異なるEOXにより複数のHETEやエポキシエイコサトリエン酸(Epoxyeicosatrienoic acid; EET)に変換され、さらにEETはエポキシド加水分解酵素(epoxide hydrolase; EH)により多様なジヒドロキシエイコサトリエン酸(dihydroxyeicosatrienoic acid; DHET)に変換される<ref name=Spector2015b><pubmed>25093613</pubmed></ref><ref name=Arita2012><pubmed>22923733</pubmed></ref> 。EETは、血管拡張、血管新生制御、抗炎症作用、さらに虚血再灌流への保護作用を有することが報告されている。しかしこれら脂質の受容体は確定しておらず、その作用機序には不明な点が多い。 | ||
脳機能との関連では、ラットの[[洞毛|ひげ]] | 脳機能との関連では、ラットの[[洞毛|ひげ]]刺激に伴う感覚野での機能性充血がEOXの二つの異なる阻害薬であるMS-PPOHとmiconazoleにより阻害される<ref name=Peng2002><pubmed>12384482</pubmed></ref> 。一方、神経細胞の過興奮に続く抑制が次第に広がるcortical spreading depressionの病態のモデルとして、アストロサイトでのCa<sup>2+</sup>上昇による大脳皮質の脳血管収縮の研究が行われており、この脳血管収縮がPLA2を阻害するMAFPや、血管収縮活性を持つ20-HETEの生合成酵素であるEOXの一種CYP4Aを阻害するHET0016の処置により消失することが示されている<ref name=Mulligan2004><pubmed>15356633</pubmed></ref> 。 | ||
これらの研究は、神経活動に伴う脳血管制御へのEOX代謝物の関与を示唆するが、いずれも薬理学的な解析に留まっており、受容体同定を含めた作用機序の解明が不可欠である。 | これらの研究は、神経活動に伴う脳血管制御へのEOX代謝物の関与を示唆するが、いずれも薬理学的な解析に留まっており、受容体同定を含めた作用機序の解明が不可欠である。 | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2018年10月17日 (水) 19:49時点における版
聶 翔
永井 裕崇
北岡 志保
古屋敷 智之
神戸大学大学院医学研究科・医学部 薬理学分野
DOI:10.14931/bsd.7743 原稿受付日:2012年8月13日 原稿完成日:2012年11月2日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:arachidonic acid 独:Arachidonsäure 仏:acide arachidonique
1段落程度の要約をお願いいたします。
| アラキドン酸 | |
|---|---|
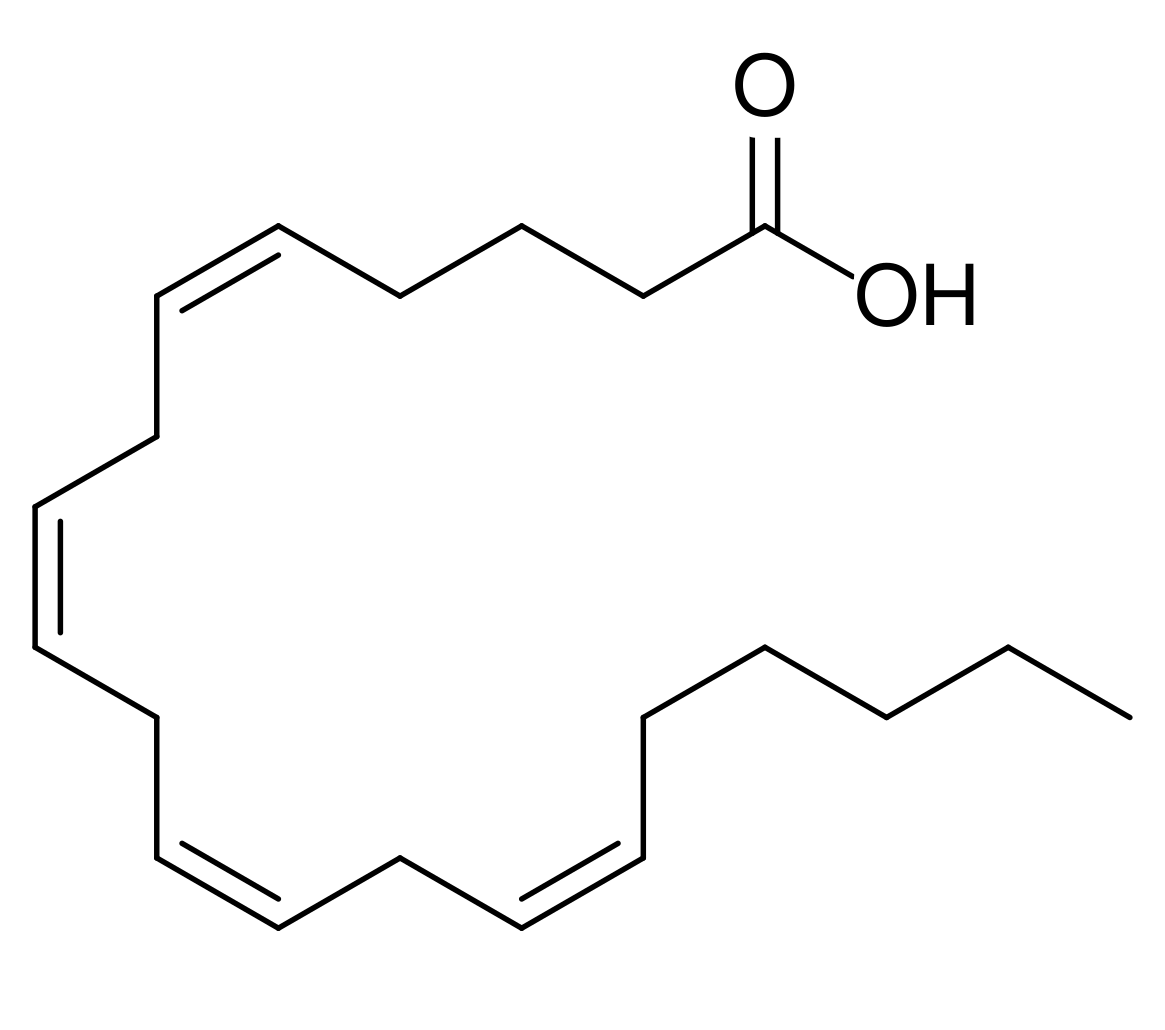
| |
(5Z,8Z,11Z,14Z)-5,8,11,14-Eicosatetraenoic acid | |
(5Z,8Z,11Z,14Z)-Icosa-5,8,11,14-tetraenoic acid[1] | |
別称 5,8,11,14-all-cis-Eicosatetraenoic acid; all-cis-5,8,11,14-Eicosatetraenoic acid; Arachidonate | |
| Identifiers | |
| 506-32-1 | |
| 3DMet | B00061 |
| Beilstein Reference | 1713889 |
| ChEBI | |
| ChEMBL | ChEMBL15594 |
| ChemSpider | 392692 |
| DrugBank | {{{value}}} |
| EC-number | [1] |
| |
| 2391 | |
| Jmol-3D images | Image |
| KEGG | C00219 |
| MeSH | Arachidonic+acid |
| PubChem | 444899 |
| RTECS番号 | CE6675000 |
| |
| UNII | 27YG812J1I |
| Properties | |
| C20H32O2 | |
| Molar mass | 304.474 g·mol−1 |
| Density | 0.922 g/cm3 |
| Melting point | −49 °C (−56 °F; 224 K) |
| Boiling point | |
| log P | 6.994 |
| Acidity (pKa) | 4.752 |
| 危険性 | |
| Rフレーズ | R19 |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
アラキドン酸とは
アラキドン酸は4つのcis二重結合を有する20個の炭素鎖からなる脂肪酸である。メチル末端(ωまたはn)から数えて最初の二重結合が6番目と7番目の炭素の間に位置するため、ω-6 (n-6)多価不飽和脂肪酸に含まれ、20:4ω-6と記載される[2][3] 。アラキドン酸は、主に細胞膜のリン脂質のsn-2位にエステル化されて存在する[4] 。主にグリセロリン脂質にコリンが結合したホスファチジルコリンに含まれるが、ホスファチジルイノシトールなど他のグリセロリン脂質にも含まれる[5] 。アラキドン酸は、刺激に応じてホスホリパーゼA2(phospholipase A2; PLA2)の酵素活性により細胞膜から遊離する他[6][7] 、エンドカンナビノイドと称する2-arachodonoyl-glycerol (2-AG)やアナンダマイド(anandamide; arachidonoylethanolamide)の構成成分として細胞膜から遊離する[8][9] 。エンドカンナビノイドはそれ自体で生理活性を有するが、代謝されて遊離アラキドン酸を産生する[10][11] 。遊離アラキドン酸の大半は細胞膜のリン脂質に再度取り込まれるため、その濃度は低く維持されている[12] 。遊離アラキドン酸はプロスタノイドやロイコトリエンなど多様な生理活性脂質に変換され、摂食、睡眠・覚醒、脳血流など生理的な脳機能の他、疾病時の発熱や内分泌応答、疼痛、てんかん、脳虚血、ストレス、神経・精神疾患など様々な病態にも関与する[13][14][15][16][17][18][19] 。
摂取・生合成・代謝
アラキドン酸は、肉、卵、魚介類などの食品から得られ、細胞内のリン脂質に取り込まれ、様々な生体膜の合成に使用される[20] 。ラットを用いた実験では、離乳後3〜4カ月の間ω-6 多価不飽和脂肪酸を欠乏させると、脳内のアラキドン酸含有量が約30%減少することが示されている[21] 。成人では、脳で代謝されるアラキドン酸は血漿から補われ、脳内のアラキドン酸の含有量は一定に保たれている。ヒトのPETイメージングにより、脳内へ取り込まれる血漿中のアラキドン酸は約18mg/日、脳内におけるアラキドン酸の半減期は約147日と推定されている[22][23] 。
アラキドン酸は、18個の炭素鎖からなり2つのcis二重結合を含むω-6多価不飽和脂肪酸の一種であるリノール酸(18:2ω-6)からも産生される(図1)。リノール酸は必須脂肪酸であり、ナッツなどの種実類や植物油に豊富に含まれる[20] 。体内に取り込まれたリノール酸は、段階的な不飽和化および脂肪鎖伸長によって、アラキドン酸やドコサテトラエン酸(22:4ω-6)などの脂肪酸に変換される。まず、リノール酸はΔ6不飽和化酵素(fatty acid desaturase 2; FADS2)による脱水素化を介して二重結合が付与されてγ-リノレン酸(18:3ω-6)になる。その後、γ-リノレン酸からΔ6脂肪酸伸長酵素(Δ6 elongase)により脂肪酸が伸長されてジホモ-γ-リノレン酸(20:3ω-6)になる。Δ5不飽和化酵素(fatty acid desaturase 1; FADS1)によりジホモ-γ-リノレン酸からアラキドン酸が産生される[24][25] 。Δ5不飽和化酵素やΔ6不飽和化酵素の活性は、栄養、喫煙、老化などの要因により変動し、肥満に関与することが示唆されている[26] 。
脳内ではアラキドン酸を含むほとんどの多価不飽和脂肪酸は長鎖脂肪酸CoAリガーゼ(long-chain-fatty-acid-CoA synthase; ACSL)により活性化され、細胞膜のリン脂質にエステル化される他、エネルギー源としてβ酸化により代謝されてアセチルCoAの産生を促す。アラキドン酸の代謝の効率は、細胞膜にある脂肪酸トランスポーターや脂肪酸結合タンパク質(fatty acid-binding protein; FABP)により影響を受けると考えられている[27] 。
細胞膜への取り込み
遊離アラキドン酸はACSLによりアラキドノイルCoA(arachidonoyl-CoA)となって活性化され、アシルトランスフェラーゼ(acyltransferase)により細胞膜のリン脂質のsn-2位に取り込まれる[28] 。リン脂質の産生には二つの生化学的経路が関与する[29] (図2)。
ケネディー経路
リン脂質はグリセロール-3-リン酸から脂肪酸の付加により新たに合成されるが、この経路は発見者の名にちなんでケネディー経路(Kennedy Pathway)と呼ばれる。この経路では、グリセロール-3-リン酸アシルトランスフェラーゼ(glycerol-3-phosphate acyltransferase; GPAT)がグリセロール-3-リン酸(GP)のsn-1位に脂肪酸をエステル化により付加し、リゾリン脂質の一種であるリゾホスファチジン酸(lysophosphatidic acid)を生成する。続いて、リゾホスファチジン酸アシルトランスフェラーゼ(lysophosphatidic acid acyltransferase; LPAAT)がリゾホスファチジン酸のsn-2位に脂肪酸をエステル化により付加し、ホスファチジン酸(phosphatidic acid)を生成する。ホスファチジン酸はジアシルグリセロール(diacylglycerol; DAG)に変換され、トリアシルグリセロール(triglyceride)、ホスファチジルコリン(phosphatidylcholine; PC)、ホスファチジルエタノラミン(phosphatidylethanolamine; PE)、ホスファチジルセリン(phosphatidylserine; PS)が産生される。また、ホスファチジン酸はシチジン二リン酸ジアシルグリセロール(cytidine diphosphate-DAG; CDP-DAG)にも変換され、ホスファチジルイノシトール(phosphatidylinositol; PI)、ホスファチジルセリン(phosphatidylserine; PS)、ホスファチジルグリセロール(phosphatidylglycerol; PG)、カルジオリピン(cardiolipin; CL)が産生される。
ランズ回路
加えて、一度生成されたリン脂質では、sn-2位に含まれる脂肪酸が代謝回転している。この代謝回路を発見者の名にちなんでランズ回路(Lands Cycle)と称する。ランズ回路では、PLA2によりsn-2位の脂肪酸が遊離し、リゾリン脂質が生成される。リゾリン脂質アシルトランスフェラーゼは、生成されたリゾリン脂質のsn-2位に脂肪酸をエステル化により付加し、その結果、リゾリン脂質はリン脂質に戻る。ランズ回路を担うリゾリン脂質アシルトランスフェラーゼ(lysophospholipid acyltransferase; LPLAT)には数多くのアイソフォームが存在し、それぞれ基質とするリゾリン脂質や脂肪酸の種類に特異性がある[29] 。現在、遺伝子欠損マウスを用いた解析が精力的に進められている。例えばLPCAT3 (lysophosphatidylcholine acyltransferase 3)の欠損では、ランズ回路によるホスファチジルコリンへのアラキドン酸の再取り込みが障害され、細胞膜中のアラキドン酸の含有量が大きく減少することが示された[30] 。リゾリン脂質アシルトランスフェラーゼの各アイソフォームは、基質特異性に加え、特異的な細胞内局在や発現分布を取り、その結果、細胞膜のリン脂質の非対称性や多様性が生まれると考えられている[31] 。
細胞膜からの遊離
細胞が成長因子、ホルモン、サイトカインなど様々な細胞外刺激に曝されると遊離アラキドン酸が産生される[32] 。遊離アラキドン酸の産生には、PLA2による細胞膜からのアラキドン酸の遊離と、アラキドン酸を構造に含むエンドカンナビノイドの代謝による遊離アラキドン酸の産生といった、少なくとも2種類のメカニズムが存在する(図3)。しかし、いずれの経路が働くかは脳領域や細胞種、刺激によって異なる可能性があるが、実態は不明である。各経路の機能的意義にも関わる問題であり、今後精査が必要である。細胞膜からの放出後は、遊離アラキドン酸の90%以上は直ちにACSLを介してアラキドノイルCoA(arachidonoyl-CoA)となり活性化され、リゾリン脂質アシルトランスフェラーゼにより細胞膜のリン脂質のsn-2位に再エステル化されて再利用される[33] 。
アラキドン酸のPLA2による細胞膜からの遊離
細胞膜のリン脂質のsn-2位に含まれるアラキドン酸がPLA2によって遊離することは古くより知られてきた[4][6][7] 。PLA2は分泌型PLA2(secretory PLA2; sPLA2)、細胞質型PLA2(cytosolic PLA2; cPLA2)、Ca2+非依存型PLA2(Ca2+-independent PLA2; iPLA2)に大別される。各グループには異なる遺伝子がコードする複数のアイソフォームが存在し、制御機構や脂質選択性が異なる[7] 。cPLA2αを含むcPLA2の多くはその活性化に細胞内Ca2+濃度の上昇を必要とする。アラキドン酸の細胞膜からの遊離にはcPLA2とsPLA2が関与し、iPLA2は脂質リモデリングを司るランズ回路に関与すると考えられている[4][7] 。実際cPLA2α欠損マウスのマクロファージや消化管では、細菌内毒素LPSによるアラキドン酸の遊離が消失していた[34][35] 。また、マクロファージ細胞株では、脂質メディエイターの血小板活性化因子(platelet activating factor; PAF)によるアラキドン酸遊離がcPLA2阻害薬MAFPとsPLA2阻害薬diC6SNPEにより抑制された[36] 。
神経活動依存的にPLA2を介するアラキドン酸遊離が誘導されることも示唆されている。[14C]標識アラキドン酸を用いた実験では、ラットの大脳皮質や線条体でのアラキドン酸の取り込みがドパミンD2受容体のアゴニスト投与により亢進する[37] 。また、[3H]標識アラキドン酸を用いた実験では、線条体の初代培養神経細胞におけるアラキドン酸の遊離がNMDA型グルタミン酸受容体の活性化により促進すること[38] 、その促進がPLA2を阻害するmepacrine(quinacrine)により阻害されることが示された[39] 。さらに、小脳プルキンエ細胞のシナプス長期抑制(long-term depression; LTD)はcPLA2α欠損マウスで消失し、この異常がアラキドン酸やその生理活性代謝物であるプロスタグランジン(prostaglandin; PG)D2・PGE2の補充により回復することも示されている[40] 。
エンドカナビノイドの代謝による遊離アラキドン酸の産生
近年、脳、肝臓、肺では、LPSの全身性投与による遊離アラキドン酸の上昇はcPLA2α欠損マウスでも大きな影響を受けず、モノアシルグリセロールリパーゼ(monoacylglycerol lipase; MGL)の遺伝子欠損マウスや阻害薬投与により消失することも示された[34] 。この結果は、これらの臓器では主にエンドカナビノイドの一種である2-AGがMGLにより代謝されて遊離アラキドン酸を生ずることを示唆する。2-AGはシナプス活動に伴う細胞内のCa2+濃度上昇によりシナプス後部で産生され、シナプス前部のカンナビノイド受容体CB1に作用して、逆行性にシナプス伝達を抑制する[41] 。2-AGは、主にsn-2位にアラキドン酸を含むホスファチジルイノシトール(phosphatidylinositol)がホスホリパーゼC(phospholipase C; PLC)によりジアシルグリセロール(diacylglycerol; DAG)に代謝され、さらにDAGがジアシルグリセロールリパーゼ(diacylglycerol lipase; DGL)により代謝されて生ずると考えられている[8][9][10][11] 。
遊離アラキドン酸はもう一つのエンドカンナビノイドであるアナンダマイド(anandamide; arachidonoylethanolamide)からも産生される。アナンダマイドは、主にsn-2位にアラキドン酸を含むホスファチジルエタノラミンがN-アシルトランスフェラーゼによりN-アラキドノイルホスファチジルエタノラミン(N-arachidonoyl phosphatidylethanolamine)に代謝され、さらにホスホリパーゼD(phospholipase D)により代謝されて生ずると考えられている。アナンダマイドは脂肪酸アミド加水分解酵素(fatty acid amide hydrolase; FAAH)によって代謝されて遊離アラキドン酸を生ずる[8][9][10][11] 。
エンドカンナビノイドの産生・作用については、エンドカナビノイドの項目参照。
遊離アラキドン酸の働き
遊離アラキドン酸は、後述するアラキドン酸カスケードにより産生される生理活性脂質と変換されて機能を発揮する。遊離アラキドン酸そのものも神経突起伸長[42] 、シナプス可塑性[43][44] 、細胞内Ca2+濃度上昇[45] 、多様なイオンチャネルの活性調節[46] に関わることが示唆されてきたが、いずれも外来性のアラキドン酸の効果を調べた実験に留まっている。アラキドン酸カスケードの関与も検討しておらず、観察された作用がアラキドン酸によるものか、あるいは、その生理活性代謝物によるものかは定かではない。統合失調症など精神疾患患者の血液における遊離アラキドン酸の濃度の異常も報告されているが、病態との関連は不明である[47][48][49] 。
アラキドン酸カスケード
細胞膜から遊離したアラキドン酸は、シクロオキシゲナーゼ(cyclooxygenase; COX)、リポキシゲナーゼ(lipoxygenase; LOX)、シトクロム(cytochrome)P-450ファミリーに属するエポキシゲナーゼ(epoxygenase; EOX)のいずれかを律速酵素とする三つの経路により代謝され、特異的な作用を持った生理活性脂質を生ずる[13][14][15][16][17][18] 。これらの生理活性脂質はアラキドン酸由来の20個の炭素鎖を持つことから、ギリシャ語で20を意味するeicosaにちなんで、エイコサノイド(eicosanoid)と呼ばれる[17] 。
シクロオキシゲナーゼ(COX)経路
COX経路では、遊離アラキドン酸はCOXによりプロスタグランジン(prostaglandin; PG)G2、さらにPGH2に変換される[13][14][15][16][17][18] 。PGH2はPGD合成酵素、PGE合成酵素、PGF合成酵素、PGI合成酵素、トロンボキサンA合成酵素を介してPGD2、PGE2、PGF2α、PGI2、thromboxane A2といったプロスタノイドに変換され、それぞれDP、EP、FP、IP、TPと呼ばれる選択的なGタンパク質共役型受容体に結合して作用を発揮する。プロスタノイドは、循環器・消化器・骨の恒常性維持、生殖器の機能、局所炎症に伴う血管透過性亢進、細胞性免疫応答など全身の様々な機能を担う。特に脳との関連では、摂食、睡眠・覚醒、脳血流など生理的な脳機能の他、疾病時の発熱や内分泌応答、疼痛、てんかん、脳虚血、ストレス、神経・精神疾患など様々な病態に関わる[16][18] 。
プロスタノイドの生合成や作用については、プロスタグランジンの項目参照。
リポキシゲナーゼ経路
リポキシゲナーゼ (LOX)経路では、遊離アラキドン酸は基質特異性の異なるLOXにより複数のヒドロペルオキシエイコサテトラエン酸(Hydroperoxyeicosatetraenoic acid; HpETE)に変換され、さらに酵素的・非酵素的な反応を介してロイコトリエン(leukotriene)やヒドロキシエイコサテトラエン酸(Hydroxyeicosatetraenoic acid; HETE)などの多様な生理活性脂質に変換される[17][19][50] 。
主には12-LOXや15-LOXを介して8-HpETE、12-HpETE、15-HpETEが産生され、5-LOXと5-lipoxygenase-activating protein (FLAP)を介して5-HpETEが産生される。5-HpETEは速やかに脱水反応によりLTA4となり、LTA4はLTA4加水分解酵素(LTA4 hydrolase)により速やかにLTB4を生ずるか、LTC4合成酵素(LTC4 synthase)によりLTC4を生ずる。LTC4はさらにLTD4、LTE4になる。LTA4を産生する酵素を持たない細胞でも、近傍の細胞からLTA4の供給を受けて、LTC4を産生する場合がある。この現象を細胞間生合成経路(transcellular biosynthesis)と呼ぶ。
LTA4・LTB4とLTC4・LTD4・LTE4は、システイン残基の有無により構造が大きく異なることから、作用する受容体も異なる。BLT1とBLT2はLTA4・LTB4をリガンドとするGタンパク質共役型受容体として同定された。しかし、BLT1の親和性がBLT2に比してはるかに高く、BLT2には親和性のはるかに高い12-hydroxyheptadecatrienoic acid (12-HHT)というリガンドが存在する[51] 。
LTC4・LTD4・LTE4からなるシスティニルロイコトリエン(cysteinyl leukotrienes; Cys-LT)は主にCysLT受容体のI型(CysLT1R)とII型(CysLT2R)に結合して作用を発揮する。
ロイコトリエンは、好中球の走化性・凝集・細胞接着・脱顆粒化、平滑筋収縮、血管の透過性や収縮の調節、粘液分泌の増強、免疫制御、炎症性疼痛、喘息、アレルギー性鼻炎、アレルギー性結膜炎、アトピー性皮膚炎、嚢胞性線維症、慢性閉塞性肺疾患、糸球体腎炎、麻痺性関節炎、乾癬、炎症性腸疾患、間質性肺疾患などの様々な生理的機能や疾患に関与する。また、ロイコトリエンは、脳損傷、多発性硬化症、アルツハイマー病、パーキンソン病、ハンチントン舞踏病、てんかん、うつ、加齢など多様な脳疾患との関連が示唆されている[50] 。ロイコトリエンの生合成や作用については、他の総説もご参照いただきたい[17][19][50] 。
エポキシゲナーゼ経路
エポキシゲナーゼ(EOX)経路では、遊離アラキドン酸は基質特異性の異なるEOXにより複数のHETEやエポキシエイコサトリエン酸(Epoxyeicosatrienoic acid; EET)に変換され、さらにEETはエポキシド加水分解酵素(epoxide hydrolase; EH)により多様なジヒドロキシエイコサトリエン酸(dihydroxyeicosatrienoic acid; DHET)に変換される[52][53] 。EETは、血管拡張、血管新生制御、抗炎症作用、さらに虚血再灌流への保護作用を有することが報告されている。しかしこれら脂質の受容体は確定しておらず、その作用機序には不明な点が多い。
脳機能との関連では、ラットのひげ刺激に伴う感覚野での機能性充血がEOXの二つの異なる阻害薬であるMS-PPOHとmiconazoleにより阻害される[54] 。一方、神経細胞の過興奮に続く抑制が次第に広がるcortical spreading depressionの病態のモデルとして、アストロサイトでのCa2+上昇による大脳皮質の脳血管収縮の研究が行われており、この脳血管収縮がPLA2を阻害するMAFPや、血管収縮活性を持つ20-HETEの生合成酵素であるEOXの一種CYP4Aを阻害するHET0016の処置により消失することが示されている[55] 。
これらの研究は、神経活動に伴う脳血管制御へのEOX代謝物の関与を示唆するが、いずれも薬理学的な解析に留まっており、受容体同定を含めた作用機序の解明が不可欠である。
参考文献
- ↑ Pubchem. "5,8,11,14-Eicosatetraenoic acid | C20H32O2 - PubChem". pubchem.ncbi.nlm.nih.gov. Retrieved 2016-03-31.
- ↑
Spector, A.A., & Kim, H.Y. (2015).
Discovery of essential fatty acids. Journal of lipid research, 56(1), 11-21. [PubMed:25339684] [PMC] [WorldCat] [DOI] - ↑
Martin, S.A., Brash, A.R., & Murphy, R.C. (2016).
The discovery and early structural studies of arachidonic acid. Journal of lipid research, 57(7), 1126-32. [PubMed:27142391] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Burke, J.E., & Dennis, E.A. (2009).
Phospholipase A2 structure/function, mechanism, and signaling. Journal of lipid research, 50 Suppl, S237-42. [PubMed:19011112] [PMC] [WorldCat] [DOI] - ↑
Farooqui, A.A., Horrocks, L.A., & Farooqui, T. (2000).
Glycerophospholipids in brain: their metabolism, incorporation into membranes, functions, and involvement in neurological disorders. Chemistry and physics of lipids, 106(1), 1-29. [PubMed:10878232] [WorldCat] [DOI] - ↑ 6.0 6.1
Shimizu, T., Ohto, T., & Kita, Y. (2006).
Cytosolic phospholipase A2: biochemical properties and physiological roles. IUBMB life, 58(5-6), 328-33. [PubMed:16754327] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3
Murakami, M. (2017).
Lipoquality control by phospholipase A2 enzymes. Proceedings of the Japan Academy. Series B, Physical and biological sciences, 93(9), 677-702. [PubMed:29129849] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Di Marzo, V., Stella, N., & Zimmer, A. (2015).
Endocannabinoid signalling and the deteriorating brain. Nature reviews. Neuroscience, 16(1), 30-42. [PubMed:25524120] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Wang, J., & Ueda, N. (2009).
Biology of endocannabinoid synthesis system. Prostaglandins & other lipid mediators, 89(3-4), 112-9. [PubMed:19126434] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Blankman, J.L., & Cravatt, B.F. (2013).
Chemical probes of endocannabinoid metabolism. Pharmacological reviews, 65(2), 849-71. [PubMed:23512546] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Piomelli, D. (2014).
More surprises lying ahead. The endocannabinoids keep us guessing. Neuropharmacology, 76 Pt B, 228-34. [PubMed:23954677] [PMC] [WorldCat] [DOI] - ↑
Chilton, F.H., Fonteh, A.N., Surette, M.E., Triggiani, M., & Winkler, J.D. (1996).
Control of arachidonate levels within inflammatory cells. Biochimica et biophysica acta, 1299(1), 1-15. [PubMed:8555241] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Bosetti, F. (2007).
Arachidonic acid metabolism in brain physiology and pathology: lessons from genetically altered mouse models. Journal of neurochemistry, 102(3), 577-86. [PubMed:17403135] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Samuelsson, B. (2012).
Role of basic science in the development of new medicines: examples from the eicosanoid field. The Journal of biological chemistry, 287(13), 10070-80. [PubMed:22318727] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
Vane, J.R., Bakhle, Y.S., & Botting, R.M. (1998).
Cyclooxygenases 1 and 2. Annual review of pharmacology and toxicology, 38, 97-120. [PubMed:9597150] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3
Narumiya, S. (2007).
Physiology and pathophysiology of prostanoid receptors. Proceedings of the Japan Academy. Series B, Physical and biological sciences, 83(9-10), 296-319. [PubMed:24367153] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3 17.4 17.5
Funk, C.D. (2001).
Prostaglandins and leukotrienes: advances in eicosanoid biology. Science (New York, N.Y.), 294(5548), 1871-5. [PubMed:11729303] [WorldCat] [DOI] - ↑ 18.0 18.1 18.2 18.3
Furuyashiki, T., & Narumiya, S. (2011).
Stress responses: the contribution of prostaglandin E(2) and its receptors. Nature reviews. Endocrinology, 7(3), 163-75. [PubMed:21116297] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2
Bäck, M., Powell, W.S., Dahlén, S.E., Drazen, J.M., Evans, J.F., Serhan, C.N., ..., & Rovati, G.E. (2014).
Update on leukotriene, lipoxin and oxoeicosanoid receptors: IUPHAR Review 7. British journal of pharmacology, 171(15), 3551-74. [PubMed:24588652] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1
Abedi, E., & Sahari, M.A. (2014).
Long-chain polyunsaturated fatty acid sources and evaluation of their nutritional and functional properties. Food science & nutrition, 2(5), 443-63. [PubMed:25473503] [PMC] [WorldCat] [DOI] - ↑
Igarashi, M., Gao, F., Kim, H.W., Ma, K., Bell, J.M., & Rapoport, S.I. (2009).
Dietary n-6 PUFA deprivation for 15 weeks reduces arachidonic acid concentrations while increasing n-3 PUFA concentrations in organs of post-weaning male rats. Biochimica et biophysica acta, 1791(2), 132-9. [PubMed:19073280] [PMC] [WorldCat] [DOI] - ↑
Rapoport, S.I., Rao, J.S., & Igarashi, M. (2007).
Brain metabolism of nutritionally essential polyunsaturated fatty acids depends on both the diet and the liver. Prostaglandins, leukotrienes, and essential fatty acids, 77(5-6), 251-61. [PubMed:18060754] [PMC] [WorldCat] [DOI] - ↑
Rapoport, S.I. (2008).
Arachidonic acid and the brain. The Journal of nutrition, 138(12), 2515-20. [PubMed:19022981] [PMC] [WorldCat] [DOI] - ↑
Guillou, H., Zadravec, D., Martin, P.G., & Jacobsson, A. (2010).
The key roles of elongases and desaturases in mammalian fatty acid metabolism: Insights from transgenic mice. Progress in lipid research, 49(2), 186-99. [PubMed:20018209] [WorldCat] [DOI] - ↑
Wiktorowska-Owczarek, A., Berezińska, M., & Nowak, J.Z. (2016).
PUFAs: Structures, Metabolism and Functions. Advances in clinical and experimental medicine : official organ Wroclaw Medical University, 24(6), 931-41. [PubMed:26771963] [WorldCat] [DOI] - ↑
Warensjö, E., Ohrvall, M., & Vessby, B. (2006).
Fatty acid composition and estimated desaturase activities are associated with obesity and lifestyle variables in men and women. Nutrition, metabolism, and cardiovascular diseases : NMCD, 16(2), 128-36. [PubMed:16487913] [WorldCat] [DOI] - ↑
Bazinet, R.P., & Layé, S. (2014).
Polyunsaturated fatty acids and their metabolites in brain function and disease. Nature reviews. Neuroscience, 15(12), 771-85. [PubMed:25387473] [WorldCat] [DOI] - ↑
Pérez-Chacón, G., Astudillo, A.M., Balgoma, D., Balboa, M.A., & Balsinde, J. (2009).
Control of free arachidonic acid levels by phospholipases A2 and lysophospholipid acyltransferases. Biochimica et biophysica acta, 1791(12), 1103-13. [PubMed:19715771] [WorldCat] [DOI] - ↑ 29.0 29.1
Shindou, H., & Shimizu, T. (2009).
Acyl-CoA:lysophospholipid acyltransferases. The Journal of biological chemistry, 284(1), 1-5. [PubMed:18718904] [WorldCat] [DOI] - ↑
Hashidate-Yoshida, T., Harayama, T., Hishikawa, D., Morimoto, R., Hamano, F., Tokuoka, S.M., ..., & Shimizu, T. (2015).
Fatty acid remodeling by LPCAT3 enriches arachidonate in phospholipid membranes and regulates triglyceride transport. eLife, 4. [PubMed:25898003] [PMC] [WorldCat] [DOI] - ↑
Hishikawa, D., Shindou, H., Kobayashi, S., Nakanishi, H., Taguchi, R., & Shimizu, T. (2008).
Discovery of a lysophospholipid acyltransferase family essential for membrane asymmetry and diversity. Proceedings of the National Academy of Sciences of the United States of America, 105(8), 2830-5. [PubMed:18287005] [PMC] [WorldCat] [DOI] - ↑
Harizi, H., Corcuff, J.B., & Gualde, N. (2008).
Arachidonic-acid-derived eicosanoids: roles in biology and immunopathology. Trends in molecular medicine, 14(10), 461-9. [PubMed:18774339] [WorldCat] [DOI] - ↑
Lobo, S., Wiczer, B.M., Smith, A.J., Hall, A.M., & Bernlohr, D.A. (2007).
Fatty acid metabolism in adipocytes: functional analysis of fatty acid transport proteins 1 and 4. Journal of lipid research, 48(3), 609-20. [PubMed:17164224] [WorldCat] [DOI] - ↑ 34.0 34.1
Nomura, D.K., Morrison, B.E., Blankman, J.L., Long, J.Z., Kinsey, S.G., Marcondes, M.C., ..., & Cravatt, B.F. (2011).
Endocannabinoid hydrolysis generates brain prostaglandins that promote neuroinflammation. Science (New York, N.Y.), 334(6057), 809-13. [PubMed:22021672] [PMC] [WorldCat] [DOI] - ↑
Uozumi, N., Kume, K., Nagase, T., Nakatani, N., Ishii, S., Tashiro, F., ..., & Shimizu, T. (1997).
Role of cytosolic phospholipase A2 in allergic response and parturition. Nature, 390(6660), 618-22. [PubMed:9403692] [WorldCat] [DOI] - ↑
Balsinde, J., & Dennis, E.A. (1996).
Distinct roles in signal transduction for each of the phospholipase A2 enzymes present in P388D1 macrophages. The Journal of biological chemistry, 271(12), 6758-65. [PubMed:8636097] [WorldCat] [DOI] - ↑
Basselin, M., Ramadan, E., & Rapoport, S.I. (2012).
Imaging brain signal transduction and metabolism via arachidonic and docosahexaenoic acid in animals and humans. Brain research bulletin, 87(2-3), 154-71. [PubMed:22178644] [PMC] [WorldCat] [DOI] - ↑
Dumuis, A., Sebben, M., Haynes, L., Pin, J.P., & Bockaert, J. (1988).
NMDA receptors activate the arachidonic acid cascade system in striatal neurons. Nature, 336(6194), 68-70. [PubMed:2847054] [WorldCat] [DOI] - ↑
Tapia-Arancibia, L., Rage, F., Récasens, M., & Pin, J.P. (1992).
NMDA receptor activation stimulates phospholipase A2 and somatostatin release from rat cortical neurons in primary cultures. European journal of pharmacology, 225(3), 253-62. [PubMed:1355446] [WorldCat] [DOI] - ↑
Le, T.D., Shirai, Y., Okamoto, T., Tatsukawa, T., Nagao, S., Shimizu, T., & Ito, M. (2010).
Lipid signaling in cytosolic phospholipase A2alpha-cyclooxygenase-2 cascade mediates cerebellar long-term depression and motor learning. Proceedings of the National Academy of Sciences of the United States of America, 107(7), 3198-203. [PubMed:20133605] [PMC] [WorldCat] [DOI] - ↑
Kano, M. (2014).
Control of synaptic function by endocannabinoid-mediated retrograde signaling. Proceedings of the Japan Academy. Series B, Physical and biological sciences, 90(7), 235-50. [PubMed:25169670] [PMC] [WorldCat] [DOI] - ↑
Darios, F., & Davletov, B. (2006).
Omega-3 and omega-6 fatty acids stimulate cell membrane expansion by acting on syntaxin 3. Nature, 440(7085), 813-7. [PubMed:16598260] [WorldCat] [DOI] - ↑
Williams, J.H., Errington, M.L., Lynch, M.A., & Bliss, T.V. (1989).
Arachidonic acid induces a long-term activity-dependent enhancement of synaptic transmission in the hippocampus. Nature, 341(6244), 739-42. [PubMed:2571939] [WorldCat] [DOI] - ↑
Bolshakov, V.Y., & Siegelbaum, S.A. (1995).
Hippocampal long-term depression: arachidonic acid as a potential retrograde messenger. Neuropharmacology, 34(11), 1581-7. [PubMed:8606806] [WorldCat] [DOI] - ↑
Mignen, O., Thompson, J.L., & Shuttleworth, T.J. (2008).
Both Orai1 and Orai3 are essential components of the arachidonate-regulated Ca2+-selective (ARC) channels. The Journal of physiology, 586(1), 185-95. [PubMed:17991693] [PMC] [WorldCat] [DOI] - ↑
Meves, H. (2008).
Arachidonic acid and ion channels: an update. British journal of pharmacology, 155(1), 4-16. [PubMed:18552881] [PMC] [WorldCat] [DOI] - ↑
McNamara, R.K., Jandacek, R., Rider, T., Tso, P., Hahn, C.G., Richtand, N.M., & Stanford, K.E. (2007).
Abnormalities in the fatty acid composition of the postmortem orbitofrontal cortex of schizophrenic patients: gender differences and partial normalization with antipsychotic medications. Schizophrenia research, 91(1-3), 37-50. [PubMed:17236749] [PMC] [WorldCat] [DOI] - ↑
Sethom, M.M., Fares, S., Bouaziz, N., Melki, W., Jemaa, R., Feki, M., ..., & Kaabachi, N. (2010).
Polyunsaturated fatty acids deficits are associated with psychotic state and negative symptoms in patients with schizophrenia. Prostaglandins, leukotrienes, and essential fatty acids, 83(3), 131-6. [PubMed:20667702] [WorldCat] [DOI] - ↑
Kim, H.W., Rapoport, S.I., & Rao, J.S. (2011).
Altered arachidonic acid cascade enzymes in postmortem brain from bipolar disorder patients. Molecular psychiatry, 16(4), 419-28. [PubMed:20038946] [PMC] [WorldCat] [DOI] - ↑ 50.0 50.1 50.2
Ghosh, A., Chen, F., Thakur, A., & Hong, H. (2016).
Cysteinyl Leukotrienes and Their Receptors: Emerging Therapeutic Targets in Central Nervous System Disorders. CNS neuroscience & therapeutics, 22(12), 943-951. [PubMed:27542570] [PMC] [WorldCat] [DOI] - ↑
Yokomizo, T. (2015).
Two distinct leukotriene B4 receptors, BLT1 and BLT2. Journal of biochemistry, 157(2), 65-71. [PubMed:25480980] [WorldCat] [DOI] - ↑
Spector, A.A., & Kim, H.Y. (2015).
Cytochrome P450 epoxygenase pathway of polyunsaturated fatty acid metabolism. Biochimica et biophysica acta, 1851(4), 356-65. [PubMed:25093613] [PMC] [WorldCat] [DOI] - ↑
Arita, M. (2012).
Mediator lipidomics in acute inflammation and resolution. Journal of biochemistry, 152(4), 313-9. [PubMed:22923733] [WorldCat] [DOI] - ↑
Peng, X., Carhuapoma, J.R., Bhardwaj, A., Alkayed, N.J., Falck, J.R., Harder, D.R., ..., & Koehler, R.C. (2002).
Suppression of cortical functional hyperemia to vibrissal stimulation in the rat by epoxygenase inhibitors. American journal of physiology. Heart and circulatory physiology, 283(5), H2029-37. [PubMed:12384482] [WorldCat] [DOI] - ↑
Mulligan, S.J., & MacVicar, B.A. (2004).
Calcium transients in astrocyte endfeet cause cerebrovascular constrictions. Nature, 431(7005), 195-9. [PubMed:15356633] [WorldCat] [DOI]