「樹状突起スパイン」の版間の差分
細 →内部構造 |
細編集の要約なし |
||
| (同じ利用者による、間の11版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/read0123542 野口 潤]</font><br> | <font size="+1">[https://researchmap.jp/read0123542 野口 潤]</font><br> | ||
''国立精神・神経医療研究センター 神経研究所 微細構造研究部''<br> | ''国立精神・神経医療研究センター 神経研究所 微細構造研究部''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2019年12月1日 原稿完成日:201X年X月X日<br> | ||
担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター)<br> | 担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター)<br> | ||
</div></div> | </div></div> | ||
| 13行目: | 13行目: | ||
== 樹状突起スパインとは == | == 樹状突起スパインとは == | ||
[[ファイル:Noguchi | [[ファイル:Noguchi spine Fig1.png|サムネイル|'''図1. 樹状突起の蛍光画像<br>A.''' 生体マーモセット前頭前皮質2/3層錐体細胞樹状突起の2光子顕微鏡画像。*印は他の樹状突起。'''B.''' シナプス各部の名称。'''C.''' 樹状突起(赤)と軸索(緑)が重なった箇所でシナプスを形成している可能性がある。]] | ||
大脳皮質や海馬など脳に存在する神経細胞は、樹状突起や細胞体に形成されるシナプスで他の神経細胞からの入力を受け取り、計算結果を軸索に発生する活動電位として出力する。大脳皮質や海馬などの興奮性神経細胞や小脳のプルキンエ細胞などの樹状突起に形成される興奮性シナプスのほとんどは、樹状突起スパイン(以下スパインと記載)と呼ばれるトゲ状の構造に接続する('''図1''')。スパインは、神経細胞の形態がゴルジ染色法を用いて詳細に検討され始めた神経科学の黎明期(1880年~)にスペインの神経科学者Ramon y Cajalによって既に認識され、神経細胞同士のつなぎ目と推測されていた<ref name=DeFelipe2015><pubmed>25798090</pubmed></ref> 。スパインに形態が似たシナプス構造は線虫''C. elegans''でも報告されており<ref name=Cuentas-Condori2019><pubmed>31584430</pubmed></ref> 、比較的下等な動物から哺乳類にいたるまで保存された機能構造と考えられる。 | |||
哺乳類において、海馬や大脳皮質などの興奮性神経細胞の神経伝達物質はグルタミン酸であり、興奮性シナプスのシナプス後部であるスパインの表面にはいくつかの種類のグルタミン酸受容体が発現している。AMPA型グルタミン酸受容体やNMDA型グルタミン酸受容体はイオンチャネルでもあり、シナプス前部から放出されたグルタミン酸を結合することによってイオンチャネルが開き、ナトリウムイオンやカルシウムイオンなどの陽イオンを細胞内に流入させ、シナプス後電位を生じさせることにより活動電位の発生に貢献する。 | |||
スパインは1つの神経細胞あたり1000~ | スパインは1つの神経細胞あたり1000~10000個存在する。スパインはバクテリアと同程度の0.5~3 µm程度の長さで<ref name=Maiti2015><pubmed>26562682</pubmed></ref> 、樹状突起の本幹と部分的に隔離された袋状の空間を作ることによって各々のシナプス個別の情報処理を容易にしている。 | ||
== 構造と機能 == | == 構造と機能 == | ||
=== シナプス接続の潜在的選択肢の拡大 === | === シナプス接続の潜在的選択肢の拡大 === | ||
シナプスが新たに作られるとき、スパインによらずに樹状突起の本幹にシナプスが直接形成されるとすると、シナプス後部は樹状突起のごく近傍を通過する軸索とシナプスを形成することになる。これに対して、樹状突起本幹と直交する様に突き出たスパインの先端でシナプス結合する場合には、本幹から離れた位置を通過する軸索ともシナプス結合できる(図'''2''')。つまり、本幹から3 µm程度の距離までを通過する、より多くの軸索の候補から実際に接続する軸索を選択できることになる。これは、経験依存的なシナプス形成による神経回路構築の選択肢を大幅に広げると考えられる<ref name=Stepanyants2005><pubmed>15935485</pubmed></ref> 。 | |||
=== スパイン頭部、スパインネックと機能 === | === スパイン頭部、スパインネックと機能 === | ||
[[ファイル:Noguchi | [[ファイル:Noguchi spine Fig2.png|サムネイル|'''図2. シナプス形成とスパインの有無の関係のモデル<br>樹状突起本幹において直接シナプスが形成される場合('''A''')とスパインを介してシナプス形成する場合('''B''')。単純なモデルでは、スパインを介することにより、近傍を通過する軸索(図の軸索3, 4)に加え、スパインの長さの分より遠くの軸索にも接続可能となる(軸索1, 2)(文献4参照)。<ref name=Noguchi2011 />参照]] | ||
スパインは、ふくらんだスパイン頭部(spine head)と、樹状突起本幹と頭部とを結ぶ細いスパインネック(頚部)(spine neck)から成る('''図1''')。形態的特徴から、頭部が大きい「mushroom spine」、頭部が比較的小さく細長い「thin spine」、ネックがほとんど無い「stubby | スパインは、ふくらんだスパイン頭部(spine head)と、樹状突起本幹と頭部とを結ぶ細いスパインネック(頚部)(spine neck)から成る('''図1''')。形態的特徴から、頭部が大きい「mushroom spine」、頭部が比較的小さく細長い「thin spine」、ネックがほとんど無い「stubby spine」に分類されることもある。スパイン頭部が不明瞭で細長い「フィロポディア」も存在するが厳密にはスパインに分類されない。実際の樹状突起の電子顕微鏡画像や蛍光顕微鏡画像を詳細にみると、頭部あるいはネックの形態はそれぞれのスパインごとに異なっており、それぞれのスパインで独立した制御が可能であることを示している。 | ||
シナプス機能と形態との関連として、スパイン頭部体積が大きいほど、機能的なAMPA型グルタミン酸受容体がより多く存在し、スパイン体積に比例的であることがラット海馬脳スライスや生体マウス大脳皮質錐体細胞スパインにおいて示されている('''図3''')<ref name=Matsuzaki2001><pubmed>11687814</pubmed></ref><ref name=Noguchi2011><pubmed>21486811</pubmed></ref> 。 | シナプス機能と形態との関連として、スパイン頭部体積が大きいほど、機能的なAMPA型グルタミン酸受容体がより多く存在し、スパイン体積に比例的であることがラット海馬脳スライスや生体マウス大脳皮質錐体細胞スパインにおいて示されている('''図3''')<ref name=Matsuzaki2001><pubmed>11687814</pubmed></ref><ref name=Noguchi2011><pubmed>21486811</pubmed></ref> 。 | ||
| 34行目: | 33行目: | ||
また、一定時間ごとに一部のスパインが取り除かれていくが、数日以上の時間スケールでは、体積の大きいスパインの方が小さいスパインより長寿命である傾向が報告されている<ref name=Holtmaat2005><pubmed>15664179</pubmed></ref><ref name=Yasumatsu2008><pubmed>19074033</pubmed></ref> 。体積の大きいスパインは前述のようにグルタミン酸受容体が多く存在して情報伝達効率も大きいことから、記憶・学習に伴って変更された神経回路が体積の大きいスパインによって長期間維持されると考えられる。 | また、一定時間ごとに一部のスパインが取り除かれていくが、数日以上の時間スケールでは、体積の大きいスパインの方が小さいスパインより長寿命である傾向が報告されている<ref name=Holtmaat2005><pubmed>15664179</pubmed></ref><ref name=Yasumatsu2008><pubmed>19074033</pubmed></ref> 。体積の大きいスパインは前述のようにグルタミン酸受容体が多く存在して情報伝達効率も大きいことから、記憶・学習に伴って変更された神経回路が体積の大きいスパインによって長期間維持されると考えられる。 | ||
抑制性シナプスを有する樹状突起スパインが大脳皮質や線条体などでみられる (図4、文献54)。抑制性入力はこれらの領域において、同時に入力する興奮性入力を制御(gating, ゲーティング)することによって、必要なタイミングで特定の神経回路を働かせたり、複数の神経回路の相互に排他的な活動を実現している可能性がある(文献55)。 | |||
=== 内部構造 === | === 内部構造 === | ||
スパイン頭部のシナプス膜近傍には[[シナプス後肥厚]] ([[post synaptic density]]; [[PSD]])と呼ばれる多種類のタンパク質複合体からなる構造がある。PSDにはグルタミン酸受容体やシナプス前部と後部を橋渡しする架橋タンパク質あるいは[[PSD-95]], [[Shank]], | スパイン頭部のシナプス膜近傍には[[シナプス後肥厚]] ([[post synaptic density]]; [[PSD]])と呼ばれる多種類のタンパク質複合体からなる構造がある。PSDにはグルタミン酸受容体やシナプス前部と後部を橋渡しする架橋タンパク質あるいは[[PSD-95]], [[Shank]], Homerといったグルタミン酸受容体を保持する部位を提供する足場タンパク質群が存在し、電子顕微鏡で電子密度の高い領域として観察される。 | ||
スパイン内には細胞骨格タンパク質であるアクチン線維が樹状突起本幹よりも高密度に存在する。アクチン線維は一方の断端から継続的に単量体アクチン分子が重合し、反対側の断端から継続的に脱重合を行うトレッドミルを行なって、スパイン形態を内側から支える力を発生する<ref name=Honkura2008><pubmed>18341992</pubmed></ref> 。スパイン内のアクチン線維はターンオーバーの速度の違いなどから、「dynamic pool」「stable pool」とネックのアクチン線維の少なくとも3種類に分類される<ref name=Honkura2008><pubmed>18341992</pubmed></ref> 。アクチン線維は後述するシナプス可塑性にも重要な役割を果たすことが明らかになりつつある<ref name=Bosch2014><pubmed>24742465</pubmed></ref><ref name=Fukazawa2003><pubmed>12741991</pubmed></ref><ref name=Honkura2008><pubmed>18341992</pubmed></ref> 。アクチンのスパイン内の分布と重合-脱重合はコフィリン、コータクチン、ドレブリンなどのアクチン結合タンパク質や[[RhoA]]、[[Rac]]、Cdc42などのGタンパク質等によって制御される。 | |||
スパインに存在するオルガネラ(細胞内小器官)として、大きいスパインにspine apparatus(スパインアパラタス)と呼ばれる複雑な形状をした滑面小胞体が存在してカルシウムイオンなどの物質の回収・貯蔵を行う。また新規タンパク合成に関係するポリリボゾーム(複数のリボゾームとmRNAの複合体)がLTP刺激(後述)によって樹状突起本幹からスパインに移動するという報告がある<ref name=Ostroff2002><pubmed>12165474</pubmed></ref> 。 | |||
スパイン内のタンパク質は常に新陳代謝を繰り返しながら一定の範囲内の数に制御されて、スパイン内の定められた位置に局在しスパインの機能を実行している<ref name=Cajigas2010><pubmed>20717144</pubmed></ref> 。しかし、スパイン体積が0.02~0.8 µm<sup>3</sup>と小さいので、分子によってはスパインあたりの存在数が少なく、スパイン機能に大きなバラツキを与える分子もある(例えばNMDA型グルタミン酸受容体は1つのスパインにつき0-20個程度しか存在しないとされる)<ref name=Ribrault2011><pubmed>21685931</pubmed></ref> 。このような神経回路にゆらぎを与える要因の存在は興味深い。 | スパイン内のタンパク質は常に新陳代謝を繰り返しながら一定の範囲内の数に制御されて、スパイン内の定められた位置に局在しスパインの機能を実行している<ref name=Cajigas2010><pubmed>20717144</pubmed></ref> 。しかし、スパイン体積が0.02~0.8 µm<sup>3</sup>と小さいので、分子によってはスパインあたりの存在数が少なく、スパイン機能に大きなバラツキを与える分子もある(例えばNMDA型グルタミン酸受容体は1つのスパインにつき0-20個程度しか存在しないとされる)<ref name=Ribrault2011><pubmed>21685931</pubmed></ref> 。このような神経回路にゆらぎを与える要因の存在は興味深い。 | ||
=== グリア細胞、細胞外マトリクスとの相互作用 === | === グリア細胞、細胞外マトリクスとの相互作用 === | ||
脳内に存在するグリア細胞もまた神経細胞と協調して脳機能を実行する。アストログリア細胞はシナプスを取り囲みいわゆる三者間[[シナプス]](tripartite synapse)を形成し、神経伝達物質の回収を行うほか、BDNFなどの神経栄養因子やD-セリンなどを放出してシナプス機能を修飾する。ミクログリア細胞はスパインに時々接触し、スパインの状態を確認しているという報告がある<ref name=Wake2009><pubmed>19339593</pubmed></ref> 。神経細胞からミクログリアに対してはシナプスの消去(刈り込み; pruning)を促すシグナル、あるいは逆に消去を忌避するシグナルが呈示される<ref name=Brown2014><pubmed>24646669</pubmed></ref><ref name=Miyamoto2013><pubmed>23720611</pubmed></ref> 。シナプス後部がスパインの様に突き出た形態をとっていることは、シナプス単位でグリア細胞による管理がなされやすいという効用もあるのかもしれない。 | |||
スパインの外部に存在するプロテオグリカンなどで構成される細胞外マトリクスは軸索やグリア細胞等とスパインとのアクセスを制限し、もしくは物理的にスパインを支持して形態を安定させ、シナプスを長期間保持するのに役立つ可能性がある<ref name=Ferrer-Ferrer2018><pubmed>29867379</pubmed></ref><ref name=Levy2014><pubmed>25368556</pubmed></ref> 。実際に細胞外マトリクスを切断する酵素によって臨界期を過ぎた成体の動物で眼優位性可塑性が回復したという報告がある<ref name=Pizzorusso2002><pubmed>12424383</pubmed></ref> 。 | |||
== シナプス可塑性とスパイン形態可塑性 == | == シナプス可塑性とスパイン形態可塑性 == | ||
記憶・学習の際、各シナプスにおいてシナプス活動刺激に応じて伝達効率(シナプスの重み)を変化させることをシナプス可塑性と呼んでいる。実際の生体での記憶・学習等において、可塑性を誘導するシナプスの活動パターンやそれを修飾する因子について、未だ体系的に明らかでないので、実験的に設定された刺激パターンによるシナプスの変化やシグナル伝達がこれまで研究されてきている。 | |||
培養神経細胞や脳スライス標本、あるいは生体を用いた実験でシナプス可塑性が確認されている刺激条件として、長期増強(long-term potentiation; LTP)刺激、あるいは[[長期抑制]](long-term depression; [[LTD]])刺激などがある。実際に、生体の記憶・学習の結果、長期増強などの実験的なシナプス可塑性の生じやすさも影響を受けることから、実験的なシナプス可塑性と実際の記憶・学習におけるシナプス可塑性のシグナルの伝達経路は(少なくとも部分的に)共通であると考えられる。 | |||
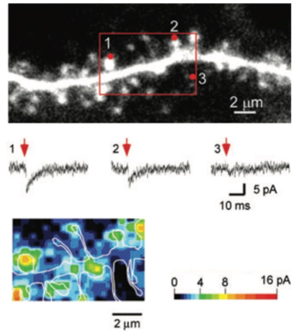
[[ファイル:Noguchi spine Fig3.png|サムネイル|'''図3. 樹状突起スパインの体積とスパイン表面の機能的なグルタミン酸受容体数の関係のモデル | |||
(文献5, 6参照)。<br>A, B.''' ラット海馬培養スライスや生体マウス大脳皮質の神経細胞の樹状突起において、機能的なAMPA型グルタミン酸受容体数はスパイン頭部体積に比例的であることが示された。また、単一スパイン(図の3番のスパイン)にシナプス可塑性刺激(長期増強; Long-term potentiation (LTP) 刺激) を加えたとき、刺激スパインのグルタミン酸受容体数が増加し、スパイン頭部体積も増加した(文献24参照)。]] | |||
ケイジドグルタミン酸の2光子光分解法(アンケイジング)を用いて、グルタミン酸を目的スパインに頻回投与することによって、実験的なシナプス可塑性刺激を単一のスパインに与えることが実施されている<ref name=Bosch2014><pubmed>24742465</pubmed></ref><ref name=Harvey2007><pubmed>18097401</pubmed></ref><ref name=Hayama2013><pubmed>23974706</pubmed></ref><ref name=Matsuzaki2004><pubmed>15190253</pubmed></ref><ref name=Murakoshi2011><pubmed>21423166</pubmed></ref><ref name=Noguchi2019><pubmed>31558759</pubmed></ref><ref name=Oh2013><pubmed>23269840</pubmed></ref> 。この方法やその他の実験方法を用いた報告から、シナプス長期増強刺激に応じて、樹状突起スパイン表面の機能的なグルタミン酸受容体が増加し、これと同時にスパイン体積の増大が生じることが、げっ歯類海馬脳スライス標本において示された('''図3''')<ref name=Matsuzaki2004><pubmed>15190253</pubmed></ref> 。同様にシナプス長期抑制刺激では、表面のグルタミン酸受容体数が減少し、これと同時にスパイン体積減少が生じた<ref name=Oh2013><pubmed>23269840</pubmed></ref><ref name=Zhou2004><pubmed>15572107</pubmed></ref> 。長期増強の際、グルタミン酸受容体は、エキソサイトーシスによって細胞内から細胞膜へ移行し、側方拡散によってシナプス部位へ移動するとされる。一方、長期抑制の際は、受容体のエンドサイトーシスによるスパイン表面からの除去が増加すると考えらえる<ref name=Choquet2018><pubmed>30381423</pubmed></ref> 。エンドサイトーシスはPSD近傍のエンドサイトーシスゾーン(endocytic zones)において主に生じるとされる(文献56)。スパイン体積変化に伴ってアクチン線維のリモデリング(再構成)が生じるが、リモデリング中やリモデリング後もしばらく以前の状態を何らかの形で保持しているのか否かといった問題など、記憶・学習などの基盤となる興味深い課題と思われる<ref name=Borovac2018><pubmed>30004015</pubmed></ref><ref name=Bosch2014><pubmed>24742465</pubmed></ref><ref name=Honkura2008><pubmed>18341992</pubmed></ref><ref name=Nakahata2018><pubmed>30210329</pubmed></ref> 。 | |||
== スパインが伝える情報と学習 == | == スパインが伝える情報と学習 == | ||
カルシウム感受性蛍光タンパク質を神経細胞に発現させることにより、シナプス活動によってスパインに流入したカルシウムを検出できる。この方法を用いて、動物に一定の感覚刺激を与えたり、タスクを行わせたりした時にどのスパインが活動するのか(=スパインに伝達される情報)を知ることが可能である。その結果、樹状突起上で物理的な距離が近いスパイン同士は、それに伝達される情報も類似している可能性が報告されている<ref name=Kerlin2019><pubmed>31663507</pubmed></ref><ref name=Lee2019><pubmed>30658859</pubmed></ref><ref name=Scholl2017><pubmed>29103806</pubmed></ref> 。例えば、1次視覚野の神経細胞樹状突起で、視覚刺激の方位選択性をそれぞれのスパインで求めることができるが、樹状突起上の物理的距離の近いスパインは方位選択性の角度も近い傾向にあるという。 | |||
樹状突起では、距離の近いシナプスへの入力が電位依存性チャネルなどの影響を受け、膜電位が非線形的な増幅を受けて、いわゆる樹状突起スパイク(dendritic spike)を発生することが知られている<ref name=Losonczy2006><pubmed>16630839</pubmed></ref><ref name=Polsky2009><pubmed>19776275</pubmed></ref> 。距離の近いスパイン同士が類似の機能を持っていることは、樹状突起が、このような非線形的な膜電位の増幅を利用した計算を行っている可能性を示唆している<ref name=Mel2017><pubmed>28453975</pubmed></ref><ref name=Poirazi2003><pubmed>12670427</pubmed></ref> 。 | |||
実際に、上肢による運動学習の際にマウス大脳皮質運動野の5層錐体細胞の樹状突起に新規生成されたスパインは先行して新生したスパインの近傍に生じる傾向があったという<ref name=Fu2012><pubmed>22343892</pubmed></ref><ref name=Lu2017><pubmed>27637453</pubmed></ref> 。また、運動学習によって新規生成された樹状突起スパインが睡眠時に消去されやすいことも別のグループから報告されている<ref name=Li2017><pubmed>28092659</pubmed></ref> 。学習によって、スパインは冗長的に生成され、比較的不安定な状態にあり、その後の学習や睡眠で適したものを選択して神経回路を最適化するのかもしれない。記憶・学習に関係する神経回路に組み込まれるためには、スパイン体積増大によって消去を免れる処置がその過程に関与するか否か、今後調べられていくと思われる<ref name=Hayashi-Takagi2015><pubmed>26352471</pubmed></ref><ref name=Roberts2010><pubmed>20164928</pubmed></ref> 。 | |||
== 樹状突起スパインと精神・神経疾患、発達障害 == | == 樹状突起スパインと精神・神経疾患、発達障害 == | ||
ヒト由来の標本の場合、疾患によっては標本の入手の困難さがあり、また死後から標本作製までの時間や標本作製の手順も一様にそろえることが難しい。しかしながら、現在までに神経疾患や精神疾患あるいは発達障害において、スパイン形態やスパイン密度の変異が報告されてきている<ref name=Penzes2011><pubmed>21346746</pubmed></ref> | [[File:Noguchi_spine_Fig4.png|サムネイル|'''図4. 抑制性シナプスも有する樹状突起スパインのモデル<br>A.''' 大脳皮質や線条体などのスパインには、興奮性のグルタミン酸シナプスに加えて、抑制性のGABAシナプスも持つものが存在する。'''B.''' 抑制性シナプス入力は、静止膜電位付近においては、シャンティング(shunting; 短絡)によって興奮性入力によるシナプス後電位の上昇を抑制する。すなわち、抑制性シナプスが興奮性シナプスの機能を制御(ゲーティング)することが考えられる。]] | ||
ヒト由来の標本の場合、疾患によっては標本の入手の困難さがあり、また死後から標本作製までの時間や標本作製の手順も一様にそろえることが難しい。しかしながら、現在までに神経疾患や精神疾患あるいは発達障害において、スパイン形態やスパイン密度の変異が報告されてきている<ref name=Penzes2011><pubmed>21346746</pubmed></ref> 。脳バンクの整備と疾患モデル動物を用いた解析などによって、今後さらに病態とシナプス形態との関係の理解が深められると期待される。 | |||
[[自閉スペクトラム症]](autism spectrum disorder; ASD) | [[自閉スペクトラム症]](autism spectrum disorder; ASD) やASDの類縁疾患である脆弱X症候群患者の死後脳から得られた大脳皮質の錐体細胞ではスパイン密度が増加することが報告されている<ref name=Hutsler2010><pubmed>19896929</pubmed></ref><ref name=Purpura1974><pubmed>4469701</pubmed></ref> 。ASDモデル動物ではシナプスの安定性が低下して、スパインの消去と新規生成が亢進しているという報告もある<ref name=Isshiki2014><pubmed>25144834</pubmed></ref> 。局所神経結合の増加と長距離神経結合の低下がASDで見られるとされていることと、スパイン密度の増加・スパインの安定性の低下は、相互に関連している可能性がある。 | ||
統合失調症においては、大脳皮質聴覚野や背外側前頭前野を含む多くの脳領域で、思春期頃の発症以降の樹状突起スパイン密度の減少が報告されている。特に大脳皮質3層錐体細胞におけるスパイン密度の減少が顕著であるとされる。特に細いスパインの減少が見られるとの報告もある<ref name=Glausier2013><pubmed>22546337</pubmed></ref><ref name=MacDonald2017><pubmed>28359200</pubmed></ref> 。 | |||
アルツハイマー病では、老年期に大脳皮質を含む脳領域における樹状突起スパインの減少が示唆されている。プリオン病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症などを含む神経変性疾患においても、疾患関連脳部位におけるスパインの異常が見出されている<ref name=Boros2017><pubmed>28921611</pubmed></ref><ref name=Herms2016><pubmed>26907528</pubmed></ref> 。 | |||
== 関連項目 == | == 関連項目 == | ||
2020年3月6日 (金) 08:21時点における版
野口 潤
国立精神・神経医療研究センター 神経研究所 微細構造研究部
DOI:10.14931/bsd.8025 原稿受付日:2019年12月1日 原稿完成日:201X年X月X日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英語名:dendritic spine 独:dendritische Spine 仏:épine dendritique 中:樹突棘
同義語:スパイン、樹状突起棘、棘突起
樹状突起スパインは神経細胞の樹状突起にあるトゲ(棘)状の構造であり、シナプス後部を形成する。樹状突起スパインはその表面にある受容体がシナプス前部から放出された神経伝達物質と結合し、シナプス後電位を発生させることにより神経細胞の活動電位の発生に寄与する。スパインが樹状突起本幹から突出した部分的に区画された構造であることは、記憶・学習などの機能を神経細胞が実行する上で意味を持つと考えられる。実際に精神・神経疾患あるいは発達障害のモデル動物において、樹状突起スパインの密度などの変異が報告されていることから、脳機能に重要な役割を担うと予想される。
樹状突起スパインとは

A. 生体マーモセット前頭前皮質2/3層錐体細胞樹状突起の2光子顕微鏡画像。*印は他の樹状突起。B. シナプス各部の名称。C. 樹状突起(赤)と軸索(緑)が重なった箇所でシナプスを形成している可能性がある。
大脳皮質や海馬など脳に存在する神経細胞は、樹状突起や細胞体に形成されるシナプスで他の神経細胞からの入力を受け取り、計算結果を軸索に発生する活動電位として出力する。大脳皮質や海馬などの興奮性神経細胞や小脳のプルキンエ細胞などの樹状突起に形成される興奮性シナプスのほとんどは、樹状突起スパイン(以下スパインと記載)と呼ばれるトゲ状の構造に接続する(図1)。スパインは、神経細胞の形態がゴルジ染色法を用いて詳細に検討され始めた神経科学の黎明期(1880年~)にスペインの神経科学者Ramon y Cajalによって既に認識され、神経細胞同士のつなぎ目と推測されていた[1] 。スパインに形態が似たシナプス構造は線虫C. elegansでも報告されており[2] 、比較的下等な動物から哺乳類にいたるまで保存された機能構造と考えられる。
哺乳類において、海馬や大脳皮質などの興奮性神経細胞の神経伝達物質はグルタミン酸であり、興奮性シナプスのシナプス後部であるスパインの表面にはいくつかの種類のグルタミン酸受容体が発現している。AMPA型グルタミン酸受容体やNMDA型グルタミン酸受容体はイオンチャネルでもあり、シナプス前部から放出されたグルタミン酸を結合することによってイオンチャネルが開き、ナトリウムイオンやカルシウムイオンなどの陽イオンを細胞内に流入させ、シナプス後電位を生じさせることにより活動電位の発生に貢献する。
スパインは1つの神経細胞あたり1000~10000個存在する。スパインはバクテリアと同程度の0.5~3 µm程度の長さで[3] 、樹状突起の本幹と部分的に隔離された袋状の空間を作ることによって各々のシナプス個別の情報処理を容易にしている。
構造と機能
シナプス接続の潜在的選択肢の拡大
シナプスが新たに作られるとき、スパインによらずに樹状突起の本幹にシナプスが直接形成されるとすると、シナプス後部は樹状突起のごく近傍を通過する軸索とシナプスを形成することになる。これに対して、樹状突起本幹と直交する様に突き出たスパインの先端でシナプス結合する場合には、本幹から離れた位置を通過する軸索ともシナプス結合できる(図2)。つまり、本幹から3 µm程度の距離までを通過する、より多くの軸索の候補から実際に接続する軸索を選択できることになる。これは、経験依存的なシナプス形成による神経回路構築の選択肢を大幅に広げると考えられる[4] 。
スパイン頭部、スパインネックと機能
樹状突起本幹において直接シナプスが形成される場合(A)とスパインを介してシナプス形成する場合(B)。単純なモデルでは、スパインを介することにより、近傍を通過する軸索(図の軸索3, 4)に加え、スパインの長さの分より遠くの軸索にも接続可能となる(軸索1, 2)(文献4参照)。[5]参照
スパインは、ふくらんだスパイン頭部(spine head)と、樹状突起本幹と頭部とを結ぶ細いスパインネック(頚部)(spine neck)から成る(図1)。形態的特徴から、頭部が大きい「mushroom spine」、頭部が比較的小さく細長い「thin spine」、ネックがほとんど無い「stubby spine」に分類されることもある。スパイン頭部が不明瞭で細長い「フィロポディア」も存在するが厳密にはスパインに分類されない。実際の樹状突起の電子顕微鏡画像や蛍光顕微鏡画像を詳細にみると、頭部あるいはネックの形態はそれぞれのスパインごとに異なっており、それぞれのスパインで独立した制御が可能であることを示している。
シナプス機能と形態との関連として、スパイン頭部体積が大きいほど、機能的なAMPA型グルタミン酸受容体がより多く存在し、スパイン体積に比例的であることがラット海馬脳スライスや生体マウス大脳皮質錐体細胞スパインにおいて示されている(図3)[6][5] 。
一方、細いスパインネックを持つことにより、離れた軸索とシナプスを作る場合でも脳のスペースを節約できる。それと同時に、細いネックは物質が細胞質中あるいは細胞膜に沿って樹状突起本幹からスパイン内へ、あるいはその逆方向に、自由拡散することに一定の制限を与える。つまり細いネックはスパイン内をある程度、樹状突起本幹から独立したコンパートメントにする[7][8][9] 。
また、一定時間ごとに一部のスパインが取り除かれていくが、数日以上の時間スケールでは、体積の大きいスパインの方が小さいスパインより長寿命である傾向が報告されている[10][11] 。体積の大きいスパインは前述のようにグルタミン酸受容体が多く存在して情報伝達効率も大きいことから、記憶・学習に伴って変更された神経回路が体積の大きいスパインによって長期間維持されると考えられる。
抑制性シナプスを有する樹状突起スパインが大脳皮質や線条体などでみられる (図4、文献54)。抑制性入力はこれらの領域において、同時に入力する興奮性入力を制御(gating, ゲーティング)することによって、必要なタイミングで特定の神経回路を働かせたり、複数の神経回路の相互に排他的な活動を実現している可能性がある(文献55)。
内部構造
スパイン頭部のシナプス膜近傍にはシナプス後肥厚 (post synaptic density; PSD)と呼ばれる多種類のタンパク質複合体からなる構造がある。PSDにはグルタミン酸受容体やシナプス前部と後部を橋渡しする架橋タンパク質あるいはPSD-95, Shank, Homerといったグルタミン酸受容体を保持する部位を提供する足場タンパク質群が存在し、電子顕微鏡で電子密度の高い領域として観察される。
スパイン内には細胞骨格タンパク質であるアクチン線維が樹状突起本幹よりも高密度に存在する。アクチン線維は一方の断端から継続的に単量体アクチン分子が重合し、反対側の断端から継続的に脱重合を行うトレッドミルを行なって、スパイン形態を内側から支える力を発生する[12] 。スパイン内のアクチン線維はターンオーバーの速度の違いなどから、「dynamic pool」「stable pool」とネックのアクチン線維の少なくとも3種類に分類される[12] 。アクチン線維は後述するシナプス可塑性にも重要な役割を果たすことが明らかになりつつある[13][14][12] 。アクチンのスパイン内の分布と重合-脱重合はコフィリン、コータクチン、ドレブリンなどのアクチン結合タンパク質やRhoA、Rac、Cdc42などのGタンパク質等によって制御される。
スパインに存在するオルガネラ(細胞内小器官)として、大きいスパインにspine apparatus(スパインアパラタス)と呼ばれる複雑な形状をした滑面小胞体が存在してカルシウムイオンなどの物質の回収・貯蔵を行う。また新規タンパク合成に関係するポリリボゾーム(複数のリボゾームとmRNAの複合体)がLTP刺激(後述)によって樹状突起本幹からスパインに移動するという報告がある[15] 。
スパイン内のタンパク質は常に新陳代謝を繰り返しながら一定の範囲内の数に制御されて、スパイン内の定められた位置に局在しスパインの機能を実行している[16] 。しかし、スパイン体積が0.02~0.8 µm3と小さいので、分子によってはスパインあたりの存在数が少なく、スパイン機能に大きなバラツキを与える分子もある(例えばNMDA型グルタミン酸受容体は1つのスパインにつき0-20個程度しか存在しないとされる)[17] 。このような神経回路にゆらぎを与える要因の存在は興味深い。
グリア細胞、細胞外マトリクスとの相互作用
脳内に存在するグリア細胞もまた神経細胞と協調して脳機能を実行する。アストログリア細胞はシナプスを取り囲みいわゆる三者間シナプス(tripartite synapse)を形成し、神経伝達物質の回収を行うほか、BDNFなどの神経栄養因子やD-セリンなどを放出してシナプス機能を修飾する。ミクログリア細胞はスパインに時々接触し、スパインの状態を確認しているという報告がある[18] 。神経細胞からミクログリアに対してはシナプスの消去(刈り込み; pruning)を促すシグナル、あるいは逆に消去を忌避するシグナルが呈示される[19][20] 。シナプス後部がスパインの様に突き出た形態をとっていることは、シナプス単位でグリア細胞による管理がなされやすいという効用もあるのかもしれない。
スパインの外部に存在するプロテオグリカンなどで構成される細胞外マトリクスは軸索やグリア細胞等とスパインとのアクセスを制限し、もしくは物理的にスパインを支持して形態を安定させ、シナプスを長期間保持するのに役立つ可能性がある[21][22] 。実際に細胞外マトリクスを切断する酵素によって臨界期を過ぎた成体の動物で眼優位性可塑性が回復したという報告がある[23] 。
シナプス可塑性とスパイン形態可塑性
記憶・学習の際、各シナプスにおいてシナプス活動刺激に応じて伝達効率(シナプスの重み)を変化させることをシナプス可塑性と呼んでいる。実際の生体での記憶・学習等において、可塑性を誘導するシナプスの活動パターンやそれを修飾する因子について、未だ体系的に明らかでないので、実験的に設定された刺激パターンによるシナプスの変化やシグナル伝達がこれまで研究されてきている。
培養神経細胞や脳スライス標本、あるいは生体を用いた実験でシナプス可塑性が確認されている刺激条件として、長期増強(long-term potentiation; LTP)刺激、あるいは長期抑制(long-term depression; LTD)刺激などがある。実際に、生体の記憶・学習の結果、長期増強などの実験的なシナプス可塑性の生じやすさも影響を受けることから、実験的なシナプス可塑性と実際の記憶・学習におけるシナプス可塑性のシグナルの伝達経路は(少なくとも部分的に)共通であると考えられる。
A, B. ラット海馬培養スライスや生体マウス大脳皮質の神経細胞の樹状突起において、機能的なAMPA型グルタミン酸受容体数はスパイン頭部体積に比例的であることが示された。また、単一スパイン(図の3番のスパイン)にシナプス可塑性刺激(長期増強; Long-term potentiation (LTP) 刺激) を加えたとき、刺激スパインのグルタミン酸受容体数が増加し、スパイン頭部体積も増加した(文献24参照)。
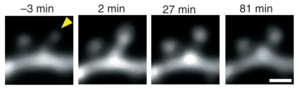
ケイジドグルタミン酸の2光子光分解法(アンケイジング)を用いて、グルタミン酸を目的スパインに頻回投与することによって、実験的なシナプス可塑性刺激を単一のスパインに与えることが実施されている[13][24][25][26][27][28][29] 。この方法やその他の実験方法を用いた報告から、シナプス長期増強刺激に応じて、樹状突起スパイン表面の機能的なグルタミン酸受容体が増加し、これと同時にスパイン体積の増大が生じることが、げっ歯類海馬脳スライス標本において示された(図3)[26] 。同様にシナプス長期抑制刺激では、表面のグルタミン酸受容体数が減少し、これと同時にスパイン体積減少が生じた[29][30] 。長期増強の際、グルタミン酸受容体は、エキソサイトーシスによって細胞内から細胞膜へ移行し、側方拡散によってシナプス部位へ移動するとされる。一方、長期抑制の際は、受容体のエンドサイトーシスによるスパイン表面からの除去が増加すると考えらえる[31] 。エンドサイトーシスはPSD近傍のエンドサイトーシスゾーン(endocytic zones)において主に生じるとされる(文献56)。スパイン体積変化に伴ってアクチン線維のリモデリング(再構成)が生じるが、リモデリング中やリモデリング後もしばらく以前の状態を何らかの形で保持しているのか否かといった問題など、記憶・学習などの基盤となる興味深い課題と思われる[32][13][12][33] 。
スパインが伝える情報と学習
カルシウム感受性蛍光タンパク質を神経細胞に発現させることにより、シナプス活動によってスパインに流入したカルシウムを検出できる。この方法を用いて、動物に一定の感覚刺激を与えたり、タスクを行わせたりした時にどのスパインが活動するのか(=スパインに伝達される情報)を知ることが可能である。その結果、樹状突起上で物理的な距離が近いスパイン同士は、それに伝達される情報も類似している可能性が報告されている[34][35][36] 。例えば、1次視覚野の神経細胞樹状突起で、視覚刺激の方位選択性をそれぞれのスパインで求めることができるが、樹状突起上の物理的距離の近いスパインは方位選択性の角度も近い傾向にあるという。
樹状突起では、距離の近いシナプスへの入力が電位依存性チャネルなどの影響を受け、膜電位が非線形的な増幅を受けて、いわゆる樹状突起スパイク(dendritic spike)を発生することが知られている[37][38] 。距離の近いスパイン同士が類似の機能を持っていることは、樹状突起が、このような非線形的な膜電位の増幅を利用した計算を行っている可能性を示唆している[39][40] 。
実際に、上肢による運動学習の際にマウス大脳皮質運動野の5層錐体細胞の樹状突起に新規生成されたスパインは先行して新生したスパインの近傍に生じる傾向があったという[41][42] 。また、運動学習によって新規生成された樹状突起スパインが睡眠時に消去されやすいことも別のグループから報告されている[43] 。学習によって、スパインは冗長的に生成され、比較的不安定な状態にあり、その後の学習や睡眠で適したものを選択して神経回路を最適化するのかもしれない。記憶・学習に関係する神経回路に組み込まれるためには、スパイン体積増大によって消去を免れる処置がその過程に関与するか否か、今後調べられていくと思われる[44][45] 。
樹状突起スパインと精神・神経疾患、発達障害
A. 大脳皮質や線条体などのスパインには、興奮性のグルタミン酸シナプスに加えて、抑制性のGABAシナプスも持つものが存在する。B. 抑制性シナプス入力は、静止膜電位付近においては、シャンティング(shunting; 短絡)によって興奮性入力によるシナプス後電位の上昇を抑制する。すなわち、抑制性シナプスが興奮性シナプスの機能を制御(ゲーティング)することが考えられる。
ヒト由来の標本の場合、疾患によっては標本の入手の困難さがあり、また死後から標本作製までの時間や標本作製の手順も一様にそろえることが難しい。しかしながら、現在までに神経疾患や精神疾患あるいは発達障害において、スパイン形態やスパイン密度の変異が報告されてきている[46] 。脳バンクの整備と疾患モデル動物を用いた解析などによって、今後さらに病態とシナプス形態との関係の理解が深められると期待される。
自閉スペクトラム症(autism spectrum disorder; ASD) やASDの類縁疾患である脆弱X症候群患者の死後脳から得られた大脳皮質の錐体細胞ではスパイン密度が増加することが報告されている[47][48] 。ASDモデル動物ではシナプスの安定性が低下して、スパインの消去と新規生成が亢進しているという報告もある[49] 。局所神経結合の増加と長距離神経結合の低下がASDで見られるとされていることと、スパイン密度の増加・スパインの安定性の低下は、相互に関連している可能性がある。
統合失調症においては、大脳皮質聴覚野や背外側前頭前野を含む多くの脳領域で、思春期頃の発症以降の樹状突起スパイン密度の減少が報告されている。特に大脳皮質3層錐体細胞におけるスパイン密度の減少が顕著であるとされる。特に細いスパインの減少が見られるとの報告もある[50][51] 。
アルツハイマー病では、老年期に大脳皮質を含む脳領域における樹状突起スパインの減少が示唆されている。プリオン病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症などを含む神経変性疾患においても、疾患関連脳部位におけるスパインの異常が見出されている[52][53] 。
関連項目
参考文献
- ↑
DeFelipe, J. (2015).
The dendritic spine story: an intriguing process of discovery. Frontiers in neuroanatomy, 9, 14. [PubMed:25798090] [PMC] [WorldCat] [DOI] - ↑
Cuentas-Condori, A., Mulcahy, B., He, S., Palumbos, S., Zhen, M., & Miller, D.M. (2019).
C. elegans neurons have functional dendritic spines. eLife, 8. [PubMed:31584430] [PMC] [WorldCat] [DOI] - ↑
Maiti, P., Manna, J., Ilavazhagan, G., Rossignol, J., & Dunbar, G.L. (2015).
Molecular regulation of dendritic spine dynamics and their potential impact on synaptic plasticity and neurological diseases. Neuroscience and biobehavioral reviews, 59, 208-37. [PubMed:26562682] [WorldCat] [DOI] - ↑
Stepanyants, A., & Chklovskii, D.B. (2005).
Neurogeometry and potential synaptic connectivity. Trends in neurosciences, 28(7), 387-94. [PubMed:15935485] [WorldCat] [DOI] - ↑ 5.0 5.1
Noguchi, J., Nagaoka, A., Watanabe, S., Ellis-Davies, G.C., Kitamura, K., Kano, M., ..., & Kasai, H. (2011).
In vivo two-photon uncaging of glutamate revealing the structure-function relationships of dendritic spines in the neocortex of adult mice. The Journal of physiology, 589(Pt 10), 2447-57. [PubMed:21486811] [PMC] [WorldCat] [DOI] - ↑
Matsuzaki, M., Ellis-Davies, G.C., Nemoto, T., Miyashita, Y., Iino, M., & Kasai, H. (2001).
Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature neuroscience, 4(11), 1086-92. [PubMed:11687814] [PMC] [WorldCat] [DOI] - ↑
Adrian, M., Kusters, R., Wierenga, C.J., Storm, C., Hoogenraad, C.C., & Kapitein, L.C. (2014).
Barriers in the brain: resolving dendritic spine morphology and compartmentalization. Frontiers in neuroanatomy, 8, 142. [PubMed:25538570] [PMC] [WorldCat] [DOI] - ↑
Ewers, H., Tada, T., Petersen, J.D., Racz, B., Sheng, M., & Choquet, D. (2014).
A Septin-Dependent Diffusion Barrier at Dendritic Spine Necks. PloS one, 9(12), e113916. [PubMed:25494357] [PMC] [WorldCat] [DOI] - ↑
Holcman, D., & Schuss, Z. (2011).
Diffusion laws in dendritic spines. Journal of mathematical neuroscience, 1(1), 10. [PubMed:22655862] [PMC] [WorldCat] [DOI] - ↑
Holtmaat, A.J., Trachtenberg, J.T., Wilbrecht, L., Shepherd, G.M., Zhang, X., Knott, G.W., & Svoboda, K. (2005).
Transient and persistent dendritic spines in the neocortex in vivo. Neuron, 45(2), 279-91. [PubMed:15664179] [WorldCat] [DOI] - ↑
Yasumatsu, N., Matsuzaki, M., Miyazaki, T., Noguchi, J., & Kasai, H. (2008).
Principles of long-term dynamics of dendritic spines. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(50), 13592-608. [PubMed:19074033] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2 12.3
Honkura, N., Matsuzaki, M., Noguchi, J., Ellis-Davies, G.C., & Kasai, H. (2008).
The subspine organization of actin fibers regulates the structure and plasticity of dendritic spines. Neuron, 57(5), 719-29. [PubMed:18341992] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Bosch, M., Castro, J., Saneyoshi, T., Matsuno, H., Sur, M., & Hayashi, Y. (2014).
Structural and molecular remodeling of dendritic spine substructures during long-term potentiation. Neuron, 82(2), 444-59. [PubMed:24742465] [PMC] [WorldCat] [DOI] - ↑
Fukazawa, Y., Saitoh, Y., Ozawa, F., Ohta, Y., Mizuno, K., & Inokuchi, K. (2003).
Hippocampal LTP is accompanied by enhanced F-actin content within the dendritic spine that is essential for late LTP maintenance in vivo. Neuron, 38(3), 447-60. [PubMed:12741991] [WorldCat] [DOI] - ↑
Ostroff, L.E., Fiala, J.C., Allwardt, B., & Harris, K.M. (2002).
Polyribosomes redistribute from dendritic shafts into spines with enlarged synapses during LTP in developing rat hippocampal slices. Neuron, 35(3), 535-45. [PubMed:12165474] [WorldCat] [DOI] - ↑
Cajigas, I.J., Will, T., & Schuman, E.M. (2010).
Protein homeostasis and synaptic plasticity. The EMBO journal, 29(16), 2746-52. [PubMed:20717144] [PMC] [WorldCat] [DOI] - ↑
Ribrault, C., Sekimoto, K., & Triller, A. (2011).
From the stochasticity of molecular processes to the variability of synaptic transmission. Nature reviews. Neuroscience, 12(7), 375-87. [PubMed:21685931] [WorldCat] [DOI] - ↑
Wake, H., Moorhouse, A.J., Jinno, S., Kohsaka, S., & Nabekura, J. (2009).
Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(13), 3974-80. [PubMed:19339593] [PMC] [WorldCat] [DOI] - ↑
Brown, G.C., & Neher, J.J. (2014).
Microglial phagocytosis of live neurons. Nature reviews. Neuroscience, 15(4), 209-16. [PubMed:24646669] [WorldCat] [DOI] - ↑
Miyamoto, A., Wake, H., Moorhouse, A.J., & Nabekura, J. (2013).
Microglia and synapse interactions: fine tuning neural circuits and candidate molecules. Frontiers in cellular neuroscience, 7, 70. [PubMed:23720611] [PMC] [WorldCat] [DOI] - ↑
Ferrer-Ferrer, M., & Dityatev, A. (2018).
Shaping Synapses by the Neural Extracellular Matrix. Frontiers in neuroanatomy, 12, 40. [PubMed:29867379] [PMC] [WorldCat] [DOI] - ↑
Levy, A.D., Omar, M.H., & Koleske, A.J. (2014).
Extracellular matrix control of dendritic spine and synapse structure and plasticity in adulthood. Frontiers in neuroanatomy, 8, 116. [PubMed:25368556] [PMC] [WorldCat] [DOI] - ↑
Pizzorusso, T., Medini, P., Berardi, N., Chierzi, S., Fawcett, J.W., & Maffei, L. (2002).
Reactivation of ocular dominance plasticity in the adult visual cortex. Science (New York, N.Y.), 298(5596), 1248-51. [PubMed:12424383] [WorldCat] [DOI] - ↑
Harvey, C.D., & Svoboda, K. (2007).
Locally dynamic synaptic learning rules in pyramidal neuron dendrites. Nature, 450(7173), 1195-200. [PubMed:18097401] [PMC] [WorldCat] [DOI] - ↑
Hayama, T., Noguchi, J., Watanabe, S., Takahashi, N., Hayashi-Takagi, A., Ellis-Davies, G.C., ..., & Kasai, H. (2013).
GABA promotes the competitive selection of dendritic spines by controlling local Ca2+ signaling. Nature neuroscience, 16(10), 1409-16. [PubMed:23974706] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Matsuzaki, M., Honkura, N., Ellis-Davies, G.C., & Kasai, H. (2004).
Structural basis of long-term potentiation in single dendritic spines. Nature, 429(6993), 761-6. [PubMed:15190253] [PMC] [WorldCat] [DOI] - ↑
Murakoshi, H., Wang, H., & Yasuda, R. (2011).
Local, persistent activation of Rho GTPases during plasticity of single dendritic spines. Nature, 472(7341), 100-4. [PubMed:21423166] [PMC] [WorldCat] [DOI] - ↑
Noguchi, J., Nagaoka, A., Hayama, T., Ucar, H., Yagishita, S., Takahashi, N., & Kasai, H. (2019).
Bidirectional in vivo structural dendritic spine plasticity revealed by two-photon glutamate uncaging in the mouse neocortex. Scientific reports, 9(1), 13922. [PubMed:31558759] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Oh, W.C., Hill, T.C., & Zito, K. (2013).
Synapse-specific and size-dependent mechanisms of spine structural plasticity accompanying synaptic weakening. Proceedings of the National Academy of Sciences of the United States of America, 110(4), E305-12. [PubMed:23269840] [PMC] [WorldCat] [DOI] - ↑
Zhou, Q., Homma, K.J., & Poo, M.M. (2004).
Shrinkage of dendritic spines associated with long-term depression of hippocampal synapses. Neuron, 44(5), 749-57. [PubMed:15572107] [WorldCat] [DOI] - ↑
Choquet, D. (2018).
Linking Nanoscale Dynamics of AMPA Receptor Organization to Plasticity of Excitatory Synapses and Learning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 38(44), 9318-9329. [PubMed:30381423] [PMC] [WorldCat] [DOI] - ↑
Borovac, J., Bosch, M., & Okamoto, K. (2018).
Regulation of actin dynamics during structural plasticity of dendritic spines: Signaling messengers and actin-binding proteins. Molecular and cellular neurosciences, 91, 122-130. [PubMed:30004015] [WorldCat] [DOI] - ↑
Nakahata, Y., & Yasuda, R. (2018).
Plasticity of Spine Structure: Local Signaling, Translation and Cytoskeletal Reorganization. Frontiers in synaptic neuroscience, 10, 29. [PubMed:30210329] [PMC] [WorldCat] [DOI] - ↑
Kerlin, A., Boaz, M., Flickinger, D., MacLennan, B.J., Dean, M.B., Davis, C., ..., & Svoboda, K. (2019).
Functional clustering of dendritic activity during decision-making. eLife, 8. [PubMed:31663507] [PMC] [WorldCat] [DOI] - ↑
Lee, K.S., Vandemark, K., Mezey, D., Shultz, N., & Fitzpatrick, D. (2019).
Functional Synaptic Architecture of Callosal Inputs in Mouse Primary Visual Cortex. Neuron, 101(3), 421-428.e5. [PubMed:30658859] [WorldCat] [DOI] - ↑
Scholl, B., Wilson, D.E., & Fitzpatrick, D. (2017).
Local Order within Global Disorder: Synaptic Architecture of Visual Space. Neuron, 96(5), 1127-1138.e4. [PubMed:29103806] [PMC] [WorldCat] [DOI] - ↑
Losonczy, A., & Magee, J.C. (2006).
Integrative properties of radial oblique dendrites in hippocampal CA1 pyramidal neurons. Neuron, 50(2), 291-307. [PubMed:16630839] [WorldCat] [DOI] - ↑
Polsky, A., Mel, B., & Schiller, J. (2009).
Encoding and decoding bursts by NMDA spikes in basal dendrites of layer 5 pyramidal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(38), 11891-903. [PubMed:19776275] [PMC] [WorldCat] [DOI] - ↑
Mel, B.W., Schiller, J., & Poirazi, P. (2017).
Synaptic plasticity in dendrites: complications and coping strategies. Current opinion in neurobiology, 43, 177-186. [PubMed:28453975] [WorldCat] [DOI] - ↑
Poirazi, P., Brannon, T., & Mel, B.W. (2003).
Pyramidal neuron as two-layer neural network. Neuron, 37(6), 989-99. [PubMed:12670427] [WorldCat] [DOI] - ↑
Fu, M., Yu, X., Lu, J., & Zuo, Y. (2012).
Repetitive motor learning induces coordinated formation of clustered dendritic spines in vivo. Nature, 483(7387), 92-5. [PubMed:22343892] [PMC] [WorldCat] [DOI] - ↑
Lu, J., & Zuo, Y. (2017).
Clustered structural and functional plasticity of dendritic spines. Brain research bulletin, 129, 18-22. [PubMed:27637453] [PMC] [WorldCat] [DOI] - ↑
Li, W., Ma, L., Yang, G., & Gan, W.B. (2017).
REM sleep selectively prunes and maintains new synapses in development and learning. Nature neuroscience, 20(3), 427-437. [PubMed:28092659] [PMC] [WorldCat] [DOI] - ↑
Hayashi-Takagi, A., Yagishita, S., Nakamura, M., Shirai, F., Wu, Y.I., Loshbaugh, A.L., ..., & Kasai, H. (2015).
Labelling and optical erasure of synaptic memory traces in the motor cortex. Nature, 525(7569), 333-8. [PubMed:26352471] [PMC] [WorldCat] [DOI] - ↑
Roberts, T.F., Tschida, K.A., Klein, M.E., & Mooney, R. (2010).
Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning. Nature, 463(7283), 948-52. [PubMed:20164928] [PMC] [WorldCat] [DOI] - ↑
Penzes, P., Cahill, M.E., Jones, K.A., VanLeeuwen, J.E., & Woolfrey, K.M. (2011).
Dendritic spine pathology in neuropsychiatric disorders. Nature neuroscience, 14(3), 285-93. [PubMed:21346746] [PMC] [WorldCat] [DOI] - ↑
Hutsler, J.J., & Zhang, H. (2010).
Increased dendritic spine densities on cortical projection neurons in autism spectrum disorders. Brain research, 1309, 83-94. [PubMed:19896929] [WorldCat] [DOI] - ↑
Purpura, D.P. (1974).
Dendritic spine "dysgenesis" and mental retardation. Science (New York, N.Y.), 186(4169), 1126-8. [PubMed:4469701] [WorldCat] [DOI] - ↑
Isshiki, M., Tanaka, S., Kuriu, T., Tabuchi, K., Takumi, T., & Okabe, S. (2014).
Enhanced synapse remodelling as a common phenotype in mouse models of autism. Nature communications, 5, 4742. [PubMed:25144834] [WorldCat] [DOI] - ↑
Glausier, J.R., & Lewis, D.A. (2013).
Dendritic spine pathology in schizophrenia. Neuroscience, 251, 90-107. [PubMed:22546337] [PMC] [WorldCat] [DOI] - ↑
MacDonald, M.L., Alhassan, J., Newman, J.T., Richard, M., Gu, H., Kelly, R.M., ..., & Sweet, R.A. (2017).
Selective Loss of Smaller Spines in Schizophrenia. The American journal of psychiatry, 174(6), 586-594. [PubMed:28359200] [PMC] [WorldCat] [DOI] - ↑
Boros, B.D., Greathouse, K.M., Gentry, E.G., Curtis, K.A., Birchall, E.L., Gearing, M., & Herskowitz, J.H. (2017).
Dendritic spines provide cognitive resilience against Alzheimer's disease. Annals of neurology, 82(4), 602-614. [PubMed:28921611] [PMC] [WorldCat] [DOI] - ↑
Herms, J., & Dorostkar, M.M. (2016).
Dendritic Spine Pathology in Neurodegenerative Diseases. Annual review of pathology, 11, 221-50. [PubMed:26907528] [WorldCat] [DOI]