「大脳皮質介在ニューロンの発生」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の8版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/Goichi.Miyoshi 三好 悟一]</font><br> | <font size="+1">[https://researchmap.jp/Goichi.Miyoshi 三好 悟一]</font><br> | ||
''東京女子医科大学''<br> | ''東京女子医科大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年9月14日 原稿完成日:2020年X月XX日<br> | ||
担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | 担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | ||
</div> | </div> | ||
英:migration of cortical interneurons | |||
{{box|text= 高次機能を司る哺乳類大脳皮質神経の約2割を占める介在ニューロンは、神経伝達物質GABAを放出する抑制機構により神経活動伝播の局所的な調整、修飾や同期を行い脳波生成にも重要な役割を果たす。大脳皮質の各層に存在する介在ニューロンに認められる形態、軸索投射、分子発現ならびに電気生理活性など極めて多様な性質は発生発達過程において獲得される。介在ニューロンは投射ニューロンである錐体細胞のように皮質内で生まれるのではなく、遠く離れた大脳腹側の増殖細胞から産生され、あらゆる皮質領野まで長距離を移動し、最終目的地の皮質層に到着した後は、最終分化する過程で取捨選択され回路に組み込まれるという特徴的な発生の過程をたどる。}} | {{box|text= 高次機能を司る哺乳類大脳皮質神経の約2割を占める介在ニューロンは、神経伝達物質GABAを放出する抑制機構により神経活動伝播の局所的な調整、修飾や同期を行い脳波生成にも重要な役割を果たす。大脳皮質の各層に存在する介在ニューロンに認められる形態、軸索投射、分子発現ならびに電気生理活性など極めて多様な性質は発生発達過程において獲得される。介在ニューロンは投射ニューロンである錐体細胞のように皮質内で生まれるのではなく、遠く離れた大脳腹側の増殖細胞から産生され、あらゆる皮質領野まで長距離を移動し、最終目的地の皮質層に到着した後は、最終分化する過程で取捨選択され回路に組み込まれるという特徴的な発生の過程をたどる。}} | ||
[[ファイル:Miyoshi Interneuron.png|サムネイル| | [[ファイル:Miyoshi Interneuron.png|サムネイル|300px|'''図. 介在ニューロン発生の模式図'''<br><ref name=Miyoshi2013>'''Miyoshi, G., Machold, R.P., Fishell, G. (2013).'''<br>Specification of GABAergic Neocortical Interneurons. In: Cortical Development (Kageyama R, Yamamori T, eds), pp 89-126: Springer Japan.</ref> より改変]] | ||
==発生起源== | ==発生起源== | ||
哺乳類大脳皮質にある錐体細胞が皮質自身の脳室帯で生まれるのとは異なり、介在ニューロンの全ては皮質とは離れた終脳胞の腹側で産生される。このことは、1997年にマウスで示され<ref name=Anderson1997><pubmed>9334308</pubmed></ref> 、後にサルおよびヒトにおいてもほぼ同様であることが確認された<ref name=Hansen2013><pubmed>24097039</pubmed></ref><ref name=Ma2013><pubmed>24097041</pubmed></ref> 。現在では、大脳皮質にある介在ニューロンのほぼ全てが胎仔終脳胞に一過性に存在する内側基底核原基 (Medial ganglionic eminence, MGE)<ref name=Sussel1999><pubmed>10393115</pubmed></ref><ref name=Wichterle2001><pubmed>11585802</pubmed></ref> と尾側基底核原基(caudal ganglionic eminence, CGE)<ref name=Nery2002><pubmed>12411960</pubmed></ref> という構造でつくられると考えられている('''図左''')。胎仔の大脳腹側に位置する構造の中では、胎生13日目の外側基底核原基(lateral ganglionic eminence)<ref name=Wichterle2001><pubmed>11585802</pubmed></ref> や中隔(Septum)<ref name=Rubin2010><pubmed>20826668</pubmed></ref> は介在ニューロンの発生起源として否定されている。一方、内側基底核原基の腹側に隣接し、また内側基底核原基と同じNkx2-1因子<ref name=Sussel1999><pubmed>10393115</pubmed></ref> を発現するする視索前野(Preoptic area)から少量の介在ニューロンが分化すると報告されている<ref name=Gelman2009><pubmed>19625528</pubmed></ref><ref name=Gelman2011><pubmed>22090484</pubmed></ref> 。 | |||
==皮質への大移動== | ==皮質への大移動== | ||
胎仔大脳腹側の増殖細胞から最終分化し産生された未分化介在ニューロンは('''図左''')、内側基底核原基起源のものは尾側基底核原基内部<ref name=Butt2005><pubmed>16301176</pubmed></ref> や将来に線条体となる構造の内側を通過して背側にある皮質にたどりつく<ref name=Flames2004><pubmed>15473965</pubmed></ref> 。 | |||
一方、尾側基底核原基起源のものの多くは後方へ遊走し直接皮質へと到達する<ref name=Kanatani2008><pubmed>19074032</pubmed></ref> 。皮質では、構築途中である皮質板(将来の皮質2-6層)の上(辺縁帯)と下(中間帯と脳室下帯)にある経路をまるで高速道路のように使って「接線方向移動(tangential migration)」により皮質全域に拡散していく('''図上'''、胎生期)。大脳の内側外側(左右)のみならず吻尾(前後)方向へも大移動し、あらゆる皮質領野へと到達する<ref name=Tanaka2006><pubmed>16672340</pubmed></ref> 。 | |||
皮質板へは「放射状方向移動(radial migration)」によって侵入するが、一旦皮質層全体に散らばった後に特定の層に落ち着く('''図上'''、生後初期)<ref name=Miyoshi2011><pubmed>20732898</pubmed></ref> 。介在ニューロンの移動は生後1週には終了する<ref name=Inamura2012><pubmed>22539863</pubmed></ref><ref name=Bortone2009><pubmed>19376067</pubmed></ref> 。 | |||
==過剰生産と細胞死== | ==過剰生産と細胞死== | ||
生後発達期の皮質では、未分化介在ニューロンの約40%が死滅する('''図上'''、生後一週)<ref name=Southwell2012><pubmed>23041929</pubmed></ref> | 生後発達期の皮質では、未分化介在ニューロンの約40%が死滅する('''図上'''、生後一週)<ref name=Southwell2012><pubmed>23041929</pubmed></ref> 。生後5日目に始まり生後7日目にピークを迎える細胞死は、介在ニューロンに内在する「発生時計」によりあらかじめプログラムされている。胎仔由来の未分化介在ニューロンを生後皮質に移植すると、移植先の発達度合いとは関係なく本来の細胞死が起こる時期になってはじめて移植された細胞が減り始める('''図下''')。未分化介在ニューロンは長距離かつ複雑な移動を経た後に精密な局所回路を形成するので、大脳皮質のあらゆる領域に多様な介在ニューロンを正確に配置するには過剰に供給して必要なものだけを残す必要があると考えられる。一方で、過剰供給には生物学的意義があることも予想され検証が待たれる(皮質のGABA量確保、集団での移動は効率が良い、など)。 | ||
==皮質層への配置と産生時期== | ==皮質層への配置と産生時期== | ||
大脳皮質の錐体細胞は早期に産生された細胞が深い層、後期に産生された細胞が浅い層とインサイドアウト配置されることが知られている。介在ニューロンでは、錐体細胞よりもゆるやかなインサイドアウト傾向で配置されることが知られている(古典的DNAアナログ取り込みによる誕生日ラベル法と、GABA合成酵素Gadによる標識の組み合わせ)<ref name=Miller1985><pubmed>3910166</pubmed></ref><ref name=Fairen1986><pubmed>3760259</pubmed></ref> 。より詳細には、内側基底核原基起源の介在ニューロンは錐体細胞層と同様に6層から2層にインサイドアウト配置される('''図上'''、成熟期)<ref name=Miyoshi2007><pubmed>17634372</pubmed></ref> 。その一方、尾側基底核原基起源のものは皮質1層でも分化し、また誕生時期に関わらず常に約75%が1-3層に配置される<ref name=Miyoshi2010><pubmed>20130169</pubmed></ref> 。内側基底核原基起源の介在ニューロン発生の開始は胎生9日目でピークが13日目であるのに対して、尾側基底核原基起源ではいずれもが3日遅れることで、介在ニューロン全体としては6層から1層への緩やかなインサイドアウト配置となる。 | |||
==神経伝達物質GABAによる発生制御== | ==神経伝達物質GABAによる発生制御== | ||
介在ニューロンが成熟回路で抑制機能を発揮する上で欠かせない神経伝達物質GABAは、発生過程においても未分化な介在ニューロンから放出され重要な役割を果たす。成熟したニューロンが神経伝達物質GABAを受容すると、細胞内外のCl-濃度勾配にしたがってCl-イオンが受容体から流入し神経活動が抑制される。ところが、未分化ニューロンではCl-トランスポーター(Kcc2/Slc12a5)が未発現のために細胞内外のCl-濃度勾配が成熟細胞とは逆転しており、したがってGABAは興奮性に働く<ref name=BenAri2002><pubmed>12209121</pubmed></ref> 。皮質錐体細胞の発生過程では、細胞の増殖や遊走をGABAが制御することが報告されている<ref name=Owens2002><pubmed>12209120</pubmed></ref> 。また遊走中の未分化な介在ニューロンはKcc2を発現することで移動を停止する('''図上'''、生後初期)<ref name=Bortone2009><pubmed>19376067</pubmed></ref> 。介在ニューロンの移動が生後1週にほぼ停止するのは主にKcc2発現機構によると考えられている<ref name=Inamura2012><pubmed>22539863</pubmed></ref><ref name=Inada2011><pubmed>22180776</pubmed></ref> 。介在ニューロンの発達は皮質視覚野で観察される眼優位性可塑性の臨界期の制御に関わり、GABAが可塑性を産み出す機構が示されている<ref name=Hensch2005><pubmed>16261181</pubmed></ref> 。生後回路発達期においては、皮質GABA総量を増やしたり(GABA受容体リガンドの投与)減らしたり(GABA合成酵素Gadの機能損失変異)することによって、発達臨界期を早めたり遅らせることができる('''図上'''、成熟期)。 | |||
==サブタイプ特異的な局所抑制シナプスの形成== | ==サブタイプ特異的な局所抑制シナプスの形成== | ||
皮質介在ニューロンの多様性を分類するには層位置、形態、軸索投射様式、分子発現、電気生理活性などの指標を統合的に理解する必要がある<ref name=Yuste2020><pubmed>32839617</pubmed></ref> 。介在ニューロンの特性と発生起源には密接な関係があり、おおまかには4種類が内側基底核原基と尾側基底核原基の2箇所からつくられると考えられている<ref name=Miyoshi2010><pubmed>20130169</pubmed></ref><ref name=Fishell2020><pubmed>31299170</pubmed></ref> ('''図右上'''、抑制回路)。 | |||
皮質介在ニューロン全体の約7割を占める内側基底核原基起源では主に、4割のパルブアルブミン (Pvalb)陽性細胞と3割のソマトスタチン (Sst)細胞に分類される。パルブアルブミン陽性細胞は主に細胞体付近を抑制するバスケット細胞と軸索を抑制するシャンデリア細胞<ref name=Taniguchi2013><pubmed>23180771</pubmed></ref> 、ソマトスタチン陽性細胞は主に尖端樹状突起を抑制するマルチノッチ細胞である('''図右上'''、赤と橙)。 | |||
介在ニューロン全体の約3割である尾側基底核原基起源では、その約半分がリーリン (Reln)/Id2陽性細胞で残りは血管作動性腸管ペプチド(vasoactive intestinal peptide, Vip)陽性の2つに分類される<ref name=Miyoshi2010><pubmed>20130169</pubmed></ref><ref name=Miyoshi2015><pubmed>26377473</pubmed></ref> 。リーリン陽性細胞の多くはニューログリアフォーム形態をもつ細胞で主に1層で拡散性伝達(Volume transmission)による抑制を担い('''図右上'''、濃青)、Vip陽性細胞の多くは双極性細胞でありまた抑制細胞を抑制する脱抑制機能を果たす('''図右上'''、青)。 | |||
つまり発達過程において介在ニューロンの軸索が標的細胞(錐体か介在か)、特異的部位(細胞体か、軸索か、樹状突起か、その尖端か)を認識しシナプス形成することが機能を発揮する上で必須である('''図上'''、成熟期)。一方、生後発達期のどの時期に、どのような機構によって、特異的な抑制性シナプスが形成されるのかはほとんど理解されておらず、分子機構の一部が示されたのみである<ref name=Favuzzi2019><pubmed>30679375</pubmed></ref> 。 | |||
==海馬の介在ニューロンは皮質を通過して発生する== | ==海馬の介在ニューロンは皮質を通過して発生する== | ||
海馬にみられる多様な介在ニューロンは<ref name=Pelkey2017><pubmed>28954853</pubmed></ref><ref name=Klausberger2008><pubmed>18599766</pubmed></ref> 、胎仔の大脳腹側で産生されたのちに多くが皮質を通過して海馬へ到達するが<ref name=Pleasure2000><pubmed>11163262</pubmed></ref><ref name=Polleux2002><pubmed>12070090</pubmed></ref> 、尾側基底核原基からは海馬に直接侵入するものも報告されている<ref name=Yozu2005><pubmed>16079409</pubmed></ref> 。海馬介在ニューロンの発生起源は基本的には大脳皮質と同様のサブタイプが内側基底核原基と尾側基底核原基に起源をもつ傾向がみられる<ref name=Tricoire2010><pubmed>20147544</pubmed></ref><ref name=Tricoire2011><pubmed>21795545</pubmed></ref> 。その一方で、皮質とは異なり多くの一酸化窒素合成酵素1(nitric oxide synthase 1, Nos1)およびコレシストキニン (cholecystokinin, CcK)陽性細胞がみられ、また内側基底核原基起源のニューログリアフォーム細胞が確認されることから<ref name=OverstreetWadiche2015><pubmed>26189693</pubmed></ref> 、これらの介在ニューロンは皮質を通過しないルートで供給されている可能性が示唆されている。 | |||
==細胞系譜== | ==細胞系譜== | ||
内側基底核原基からパルブアルブミンとソマトスタチン陽性、尾側基底核原基からリーリンとVip陽性の介在ニューロンが個別に分化する発生機構は未だに解明されていない。内側基底核原基の腹側からはパルブアルブミン、背側からはソマトスタチンという場所仮説<ref name=Flames2007><pubmed>17804629</pubmed></ref><ref name=Wonders2008><pubmed>18155689</pubmed></ref> 、増殖細胞層の中でも脳室下帯(Subventricular zone)からはパルブアルブミン、脳室帯(Ventricular zone)からはソマトスタチンという空間仮説が提唱されているが<ref name=Glickstein2007><pubmed>17965053</pubmed></ref><ref name=Petros2015><pubmed>26526999</pubmed></ref> 、いずれも片方にバイアスがみられる程度である。尾側基底核原基の各部位をエレクトロポレーション法を用いて蛍光ラベルすることで、尾側基底核原基の前方からVip、後方からはリーリン陽性細胞が生まれることが示唆されている <ref name=Torigoe2016><pubmed>26865626</pubmed></ref> 。 | 内側基底核原基からパルブアルブミンとソマトスタチン陽性、尾側基底核原基からリーリンとVip陽性の介在ニューロンが個別に分化する発生機構は未だに解明されていない。内側基底核原基の腹側からはパルブアルブミン、背側からはソマトスタチンという場所仮説<ref name=Flames2007><pubmed>17804629</pubmed></ref><ref name=Wonders2008><pubmed>18155689</pubmed></ref> 、増殖細胞層の中でも脳室下帯(Subventricular zone)からはパルブアルブミン、脳室帯(Ventricular zone)からはソマトスタチンという空間仮説が提唱されているが<ref name=Glickstein2007><pubmed>17965053</pubmed></ref><ref name=Petros2015><pubmed>26526999</pubmed></ref> 、いずれも片方にバイアスがみられる程度である。尾側基底核原基の各部位をエレクトロポレーション法を用いて蛍光ラベルすることで、尾側基底核原基の前方からVip、後方からはリーリン陽性細胞が生まれることが示唆されている <ref name=Torigoe2016><pubmed>26865626</pubmed></ref> 。 | ||
単一細胞の運命を追跡するクローナル解析(バーコードタグをもつウイルスを胎仔増殖細胞に感染させる手法)では、内側基底核原基に在る1つの増殖細胞からパルブアルブミンとソマトスタチン陽性の両者が確認されており、大脳腹側の増殖細胞レベルで両者の運命が別れていることは否定されている<ref name=Harwell2015><pubmed>26299474</pubmed></ref><ref name=Mayer2015><pubmed>26299473</pubmed></ref> | 単一細胞の運命を追跡するクローナル解析(バーコードタグをもつウイルスを胎仔増殖細胞に感染させる手法)では、内側基底核原基に在る1つの増殖細胞からパルブアルブミンとソマトスタチン陽性の両者が確認されており、大脳腹側の増殖細胞レベルで両者の運命が別れていることは否定されている<ref name=Harwell2015><pubmed>26299474</pubmed></ref><ref name=Mayer2015><pubmed>26299473</pubmed></ref> 。発生ステージごとに単一細胞RNAシークエンシング法を網羅的に実施し、得られた遺伝子発現の比較相関解析による細胞系譜の構築が盛んに行われている<ref name=Nowakowski2017><pubmed>29217575</pubmed></ref><ref name=Wagner2018><pubmed>29700229</pubmed></ref> 。介在ニューロン発生においても同様の試みがなされたが<ref name=Mayer2018><pubmed>29513653</pubmed></ref><ref name=Mi2018><pubmed>29472441</pubmed></ref> 、未だにパルブアルブミンとソマトスタチン、リーリンとVip系譜の分岐点は解明されていない。より密接した発生ステージを比較解析することで、詳細な細胞系譜が解明されることが期待される。 | ||
== | ==介在ニューロン発生の分子制御機構== | ||
ホメオドメイン転写因子Dlx、ArxやZeb2は未分化介在ニューロンの移動を制御する。中でもDlx1/2ダブルノックアウトマウスでは皮質に到達するGABA細胞が見られないことを利用し、介在ニューロンの起源が大脳腹側がであることが解明された<ref name=Anderson1997><pubmed>9334308</pubmed></ref> 。内側基底核原基起源の介在ニューロンの分化発生は、Nkx2-1>Lhx6>Sox6/SatB1という転写因子カスケードにより制御されることが示されている<ref name=Sussel1999><pubmed>10393115</pubmed></ref><ref name=Azim2009><pubmed>19657336</pubmed></ref><ref name=Batista-Brito2009><pubmed>19709629</pubmed></ref><ref name=Close2012><pubmed>23223290</pubmed></ref><ref name=Denaxa2012><pubmed>23142661</pubmed></ref><ref name=Liodis2007><pubmed>17376969</pubmed></ref><ref name=Butt2008><pubmed>18786356</pubmed></ref> 。一方、尾側基底核原基起源の介在ニューロンに特異的な分子制御プログラムはProx1転写因子しか現在同定されていない<ref name=Miyoshi2015><pubmed>26377473</pubmed></ref> 。さらには、パルブアルブミンとソマトスタチン、リーリンとVip系譜の分岐を制御するような因子も現在のところ報告されていない。 | |||
== | ==細胞移植を用いた介在ニューロン発生研究とその応用== | ||
細胞移植実験は発生機構を理解するための強力な手法であり、古典的にはニワトリとウズラという多種間の細胞と組織の組み合わせから、移植された細胞が移動し分化する機構が解析されてきた。介在ニューロン発生研究においてもマウス遺伝学手法を組み合わせた細胞移植実験が多用されてきた歴史があり、起源である大脳腹側(内側基底核原基や尾側基底核原基)や蛍光ラベルされた移動中の介在ニューロンを単離調製し、胎児や生後の特定脳部位へ細胞移植する実験が盛んに行われてきた。介在ニューロンの発生起源、分子制御機構、細胞外環境の影響、細胞死などの多くが検証され解明されてきた<ref name=Miyoshi2019><pubmed>30227162</pubmed></ref> 。 | |||
介在ニューロンは発生過程において長距離を移動し、GABA放出により細胞移動のみならず可塑性をも制御し、過剰に産生され不要なものが除去される特徴がみられる。この発生機構を応用し、胎仔大脳腹側から未分化介在ニューロンを単離調製し生後の皮質に移植すると、移植場所から周囲に拡散移動し、GABA放出により可塑性を生み出し局所回路に組み込まれ、抑制回路を形成しないものは消失することが知られている('''図下''')。 | |||
胎仔や胚性幹細胞(ES細胞)などから調製した未分化介在ニューロン移植による治療効果が多数報告されており、てんかん、パーキンソン病、慢性痛などの疾患モデルマウスにおいてその有用性が示されている<ref name=Southwell2014><pubmed>24723614</pubmed></ref> 。今後も介在ニューロン発生研究が進展することによって治療法開発に繋がる新たな知見が得られることが期待される。 | |||
==参考文献== | ==参考文献== | ||
2020年9月19日 (土) 23:23時点における版
三好 悟一
東京女子医科大学
DOI:10.14931/bsd.9420 原稿受付日:2020年9月14日 原稿完成日:2020年X月XX日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英:migration of cortical interneurons
高次機能を司る哺乳類大脳皮質神経の約2割を占める介在ニューロンは、神経伝達物質GABAを放出する抑制機構により神経活動伝播の局所的な調整、修飾や同期を行い脳波生成にも重要な役割を果たす。大脳皮質の各層に存在する介在ニューロンに認められる形態、軸索投射、分子発現ならびに電気生理活性など極めて多様な性質は発生発達過程において獲得される。介在ニューロンは投射ニューロンである錐体細胞のように皮質内で生まれるのではなく、遠く離れた大脳腹側の増殖細胞から産生され、あらゆる皮質領野まで長距離を移動し、最終目的地の皮質層に到着した後は、最終分化する過程で取捨選択され回路に組み込まれるという特徴的な発生の過程をたどる。
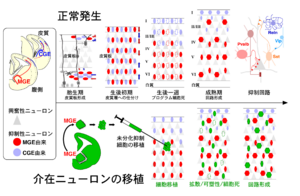
[1] より改変
発生起源
哺乳類大脳皮質にある錐体細胞が皮質自身の脳室帯で生まれるのとは異なり、介在ニューロンの全ては皮質とは離れた終脳胞の腹側で産生される。このことは、1997年にマウスで示され[2] 、後にサルおよびヒトにおいてもほぼ同様であることが確認された[3][4] 。現在では、大脳皮質にある介在ニューロンのほぼ全てが胎仔終脳胞に一過性に存在する内側基底核原基 (Medial ganglionic eminence, MGE)[5][6] と尾側基底核原基(caudal ganglionic eminence, CGE)[7] という構造でつくられると考えられている(図左)。胎仔の大脳腹側に位置する構造の中では、胎生13日目の外側基底核原基(lateral ganglionic eminence)[6] や中隔(Septum)[8] は介在ニューロンの発生起源として否定されている。一方、内側基底核原基の腹側に隣接し、また内側基底核原基と同じNkx2-1因子[5] を発現するする視索前野(Preoptic area)から少量の介在ニューロンが分化すると報告されている[9][10] 。
皮質への大移動
胎仔大脳腹側の増殖細胞から最終分化し産生された未分化介在ニューロンは(図左)、内側基底核原基起源のものは尾側基底核原基内部[11] や将来に線条体となる構造の内側を通過して背側にある皮質にたどりつく[12] 。
一方、尾側基底核原基起源のものの多くは後方へ遊走し直接皮質へと到達する[13] 。皮質では、構築途中である皮質板(将来の皮質2-6層)の上(辺縁帯)と下(中間帯と脳室下帯)にある経路をまるで高速道路のように使って「接線方向移動(tangential migration)」により皮質全域に拡散していく(図上、胎生期)。大脳の内側外側(左右)のみならず吻尾(前後)方向へも大移動し、あらゆる皮質領野へと到達する[14] 。
皮質板へは「放射状方向移動(radial migration)」によって侵入するが、一旦皮質層全体に散らばった後に特定の層に落ち着く(図上、生後初期)[15] 。介在ニューロンの移動は生後1週には終了する[16][17] 。
過剰生産と細胞死
生後発達期の皮質では、未分化介在ニューロンの約40%が死滅する(図上、生後一週)[18] 。生後5日目に始まり生後7日目にピークを迎える細胞死は、介在ニューロンに内在する「発生時計」によりあらかじめプログラムされている。胎仔由来の未分化介在ニューロンを生後皮質に移植すると、移植先の発達度合いとは関係なく本来の細胞死が起こる時期になってはじめて移植された細胞が減り始める(図下)。未分化介在ニューロンは長距離かつ複雑な移動を経た後に精密な局所回路を形成するので、大脳皮質のあらゆる領域に多様な介在ニューロンを正確に配置するには過剰に供給して必要なものだけを残す必要があると考えられる。一方で、過剰供給には生物学的意義があることも予想され検証が待たれる(皮質のGABA量確保、集団での移動は効率が良い、など)。
皮質層への配置と産生時期
大脳皮質の錐体細胞は早期に産生された細胞が深い層、後期に産生された細胞が浅い層とインサイドアウト配置されることが知られている。介在ニューロンでは、錐体細胞よりもゆるやかなインサイドアウト傾向で配置されることが知られている(古典的DNAアナログ取り込みによる誕生日ラベル法と、GABA合成酵素Gadによる標識の組み合わせ)[19][20] 。より詳細には、内側基底核原基起源の介在ニューロンは錐体細胞層と同様に6層から2層にインサイドアウト配置される(図上、成熟期)[21] 。その一方、尾側基底核原基起源のものは皮質1層でも分化し、また誕生時期に関わらず常に約75%が1-3層に配置される[22] 。内側基底核原基起源の介在ニューロン発生の開始は胎生9日目でピークが13日目であるのに対して、尾側基底核原基起源ではいずれもが3日遅れることで、介在ニューロン全体としては6層から1層への緩やかなインサイドアウト配置となる。
神経伝達物質GABAによる発生制御
介在ニューロンが成熟回路で抑制機能を発揮する上で欠かせない神経伝達物質GABAは、発生過程においても未分化な介在ニューロンから放出され重要な役割を果たす。成熟したニューロンが神経伝達物質GABAを受容すると、細胞内外のCl-濃度勾配にしたがってCl-イオンが受容体から流入し神経活動が抑制される。ところが、未分化ニューロンではCl-トランスポーター(Kcc2/Slc12a5)が未発現のために細胞内外のCl-濃度勾配が成熟細胞とは逆転しており、したがってGABAは興奮性に働く[23] 。皮質錐体細胞の発生過程では、細胞の増殖や遊走をGABAが制御することが報告されている[24] 。また遊走中の未分化な介在ニューロンはKcc2を発現することで移動を停止する(図上、生後初期)[17] 。介在ニューロンの移動が生後1週にほぼ停止するのは主にKcc2発現機構によると考えられている[16][25] 。介在ニューロンの発達は皮質視覚野で観察される眼優位性可塑性の臨界期の制御に関わり、GABAが可塑性を産み出す機構が示されている[26] 。生後回路発達期においては、皮質GABA総量を増やしたり(GABA受容体リガンドの投与)減らしたり(GABA合成酵素Gadの機能損失変異)することによって、発達臨界期を早めたり遅らせることができる(図上、成熟期)。
サブタイプ特異的な局所抑制シナプスの形成
皮質介在ニューロンの多様性を分類するには層位置、形態、軸索投射様式、分子発現、電気生理活性などの指標を統合的に理解する必要がある[27] 。介在ニューロンの特性と発生起源には密接な関係があり、おおまかには4種類が内側基底核原基と尾側基底核原基の2箇所からつくられると考えられている[22][28] (図右上、抑制回路)。
皮質介在ニューロン全体の約7割を占める内側基底核原基起源では主に、4割のパルブアルブミン (Pvalb)陽性細胞と3割のソマトスタチン (Sst)細胞に分類される。パルブアルブミン陽性細胞は主に細胞体付近を抑制するバスケット細胞と軸索を抑制するシャンデリア細胞[29] 、ソマトスタチン陽性細胞は主に尖端樹状突起を抑制するマルチノッチ細胞である(図右上、赤と橙)。
介在ニューロン全体の約3割である尾側基底核原基起源では、その約半分がリーリン (Reln)/Id2陽性細胞で残りは血管作動性腸管ペプチド(vasoactive intestinal peptide, Vip)陽性の2つに分類される[22][30] 。リーリン陽性細胞の多くはニューログリアフォーム形態をもつ細胞で主に1層で拡散性伝達(Volume transmission)による抑制を担い(図右上、濃青)、Vip陽性細胞の多くは双極性細胞でありまた抑制細胞を抑制する脱抑制機能を果たす(図右上、青)。
つまり発達過程において介在ニューロンの軸索が標的細胞(錐体か介在か)、特異的部位(細胞体か、軸索か、樹状突起か、その尖端か)を認識しシナプス形成することが機能を発揮する上で必須である(図上、成熟期)。一方、生後発達期のどの時期に、どのような機構によって、特異的な抑制性シナプスが形成されるのかはほとんど理解されておらず、分子機構の一部が示されたのみである[31] 。
海馬の介在ニューロンは皮質を通過して発生する
海馬にみられる多様な介在ニューロンは[32][33] 、胎仔の大脳腹側で産生されたのちに多くが皮質を通過して海馬へ到達するが[34][35] 、尾側基底核原基からは海馬に直接侵入するものも報告されている[36] 。海馬介在ニューロンの発生起源は基本的には大脳皮質と同様のサブタイプが内側基底核原基と尾側基底核原基に起源をもつ傾向がみられる[37][38] 。その一方で、皮質とは異なり多くの一酸化窒素合成酵素1(nitric oxide synthase 1, Nos1)およびコレシストキニン (cholecystokinin, CcK)陽性細胞がみられ、また内側基底核原基起源のニューログリアフォーム細胞が確認されることから[39] 、これらの介在ニューロンは皮質を通過しないルートで供給されている可能性が示唆されている。
細胞系譜
内側基底核原基からパルブアルブミンとソマトスタチン陽性、尾側基底核原基からリーリンとVip陽性の介在ニューロンが個別に分化する発生機構は未だに解明されていない。内側基底核原基の腹側からはパルブアルブミン、背側からはソマトスタチンという場所仮説[40][41] 、増殖細胞層の中でも脳室下帯(Subventricular zone)からはパルブアルブミン、脳室帯(Ventricular zone)からはソマトスタチンという空間仮説が提唱されているが[42][43] 、いずれも片方にバイアスがみられる程度である。尾側基底核原基の各部位をエレクトロポレーション法を用いて蛍光ラベルすることで、尾側基底核原基の前方からVip、後方からはリーリン陽性細胞が生まれることが示唆されている [44] 。
単一細胞の運命を追跡するクローナル解析(バーコードタグをもつウイルスを胎仔増殖細胞に感染させる手法)では、内側基底核原基に在る1つの増殖細胞からパルブアルブミンとソマトスタチン陽性の両者が確認されており、大脳腹側の増殖細胞レベルで両者の運命が別れていることは否定されている[45][46] 。発生ステージごとに単一細胞RNAシークエンシング法を網羅的に実施し、得られた遺伝子発現の比較相関解析による細胞系譜の構築が盛んに行われている[47][48] 。介在ニューロン発生においても同様の試みがなされたが[49][50] 、未だにパルブアルブミンとソマトスタチン、リーリンとVip系譜の分岐点は解明されていない。より密接した発生ステージを比較解析することで、詳細な細胞系譜が解明されることが期待される。
介在ニューロン発生の分子制御機構
ホメオドメイン転写因子Dlx、ArxやZeb2は未分化介在ニューロンの移動を制御する。中でもDlx1/2ダブルノックアウトマウスでは皮質に到達するGABA細胞が見られないことを利用し、介在ニューロンの起源が大脳腹側がであることが解明された[2] 。内側基底核原基起源の介在ニューロンの分化発生は、Nkx2-1>Lhx6>Sox6/SatB1という転写因子カスケードにより制御されることが示されている[5][51][52][53][54][55][56] 。一方、尾側基底核原基起源の介在ニューロンに特異的な分子制御プログラムはProx1転写因子しか現在同定されていない[30] 。さらには、パルブアルブミンとソマトスタチン、リーリンとVip系譜の分岐を制御するような因子も現在のところ報告されていない。
細胞移植を用いた介在ニューロン発生研究とその応用
細胞移植実験は発生機構を理解するための強力な手法であり、古典的にはニワトリとウズラという多種間の細胞と組織の組み合わせから、移植された細胞が移動し分化する機構が解析されてきた。介在ニューロン発生研究においてもマウス遺伝学手法を組み合わせた細胞移植実験が多用されてきた歴史があり、起源である大脳腹側(内側基底核原基や尾側基底核原基)や蛍光ラベルされた移動中の介在ニューロンを単離調製し、胎児や生後の特定脳部位へ細胞移植する実験が盛んに行われてきた。介在ニューロンの発生起源、分子制御機構、細胞外環境の影響、細胞死などの多くが検証され解明されてきた[57] 。
介在ニューロンは発生過程において長距離を移動し、GABA放出により細胞移動のみならず可塑性をも制御し、過剰に産生され不要なものが除去される特徴がみられる。この発生機構を応用し、胎仔大脳腹側から未分化介在ニューロンを単離調製し生後の皮質に移植すると、移植場所から周囲に拡散移動し、GABA放出により可塑性を生み出し局所回路に組み込まれ、抑制回路を形成しないものは消失することが知られている(図下)。
胎仔や胚性幹細胞(ES細胞)などから調製した未分化介在ニューロン移植による治療効果が多数報告されており、てんかん、パーキンソン病、慢性痛などの疾患モデルマウスにおいてその有用性が示されている[58] 。今後も介在ニューロン発生研究が進展することによって治療法開発に繋がる新たな知見が得られることが期待される。
参考文献
- ↑ Miyoshi, G., Machold, R.P., Fishell, G. (2013).
Specification of GABAergic Neocortical Interneurons. In: Cortical Development (Kageyama R, Yamamori T, eds), pp 89-126: Springer Japan. - ↑ 2.0 2.1
Anderson, S.A., Eisenstat, D.D., Shi, L., & Rubenstein, J.L. (1997).
Interneuron migration from basal forebrain to neocortex: dependence on Dlx genes. Science (New York, N.Y.), 278(5337), 474-6. [PubMed:9334308] [WorldCat] [DOI] - ↑
Hansen, D.V., Lui, J.H., Flandin, P., Yoshikawa, K., Rubenstein, J.L., Alvarez-Buylla, A., & Kriegstein, A.R. (2013).
Non-epithelial stem cells and cortical interneuron production in the human ganglionic eminences. Nature neuroscience, 16(11), 1576-87. [PubMed:24097039] [PMC] [WorldCat] [DOI] - ↑
Ma, T., Wang, C., Wang, L., Zhou, X., Tian, M., Zhang, Q., ..., & Yang, Z. (2013).
Subcortical origins of human and monkey neocortical interneurons. Nature neuroscience, 16(11), 1588-97. [PubMed:24097041] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Sussel, L., Marin, O., Kimura, S., & Rubenstein, J.L. (1999).
Loss of Nkx2.1 homeobox gene function results in a ventral to dorsal molecular respecification within the basal telencephalon: evidence for a transformation of the pallidum into the striatum. Development (Cambridge, England), 126(15), 3359-70. [PubMed:10393115] [WorldCat] - ↑ 6.0 6.1
Wichterle, H., Turnbull, D.H., Nery, S., Fishell, G., & Alvarez-Buylla, A. (2001).
In utero fate mapping reveals distinct migratory pathways and fates of neurons born in the mammalian basal forebrain. Development (Cambridge, England), 128(19), 3759-71. [PubMed:11585802] [WorldCat] - ↑
Nery, S., Fishell, G., & Corbin, J.G. (2002).
The caudal ganglionic eminence is a source of distinct cortical and subcortical cell populations. Nature neuroscience, 5(12), 1279-87. [PubMed:12411960] [WorldCat] [DOI] - ↑
Rubin, A.N., Alfonsi, F., Humphreys, M.P., Choi, C.K., Rocha, S.F., & Kessaris, N. (2010).
The germinal zones of the basal ganglia but not the septum generate GABAergic interneurons for the cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(36), 12050-62. [PubMed:20826668] [PMC] [WorldCat] [DOI] - ↑
Gelman, D.M., Martini, F.J., Nóbrega-Pereira, S., Pierani, A., Kessaris, N., & Marín, O. (2009).
The embryonic preoptic area is a novel source of cortical GABAergic interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(29), 9380-9. [PubMed:19625528] [PMC] [WorldCat] [DOI] - ↑
Gelman, D., Griveau, A., Dehorter, N., Teissier, A., Varela, C., Pla, R., ..., & Marín, O. (2011).
A wide diversity of cortical GABAergic interneurons derives from the embryonic preoptic area. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(46), 16570-80. [PubMed:22090484] [PMC] [WorldCat] [DOI] - ↑
Butt, S.J., Fuccillo, M., Nery, S., Noctor, S., Kriegstein, A., Corbin, J.G., & Fishell, G. (2005).
The temporal and spatial origins of cortical interneurons predict their physiological subtype. Neuron, 48(4), 591-604. [PubMed:16301176] [WorldCat] [DOI] - ↑
Flames, N., Long, J.E., Garratt, A.N., Fischer, T.M., Gassmann, M., Birchmeier, C., ..., & Marín, O. (2004).
Short- and long-range attraction of cortical GABAergic interneurons by neuregulin-1. Neuron, 44(2), 251-61. [PubMed:15473965] [WorldCat] [DOI] - ↑
Kanatani, S., Yozu, M., Tabata, H., & Nakajima, K. (2008).
COUP-TFII is preferentially expressed in the caudal ganglionic eminence and is involved in the caudal migratory stream. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(50), 13582-91. [PubMed:19074032] [PMC] [WorldCat] [DOI] - ↑
Tanaka, D.H., Maekawa, K., Yanagawa, Y., Obata, K., & Murakami, F. (2006).
Multidirectional and multizonal tangential migration of GABAergic interneurons in the developing cerebral cortex. Development (Cambridge, England), 133(11), 2167-76. [PubMed:16672340] [WorldCat] [DOI] - ↑
Miyoshi, G., & Fishell, G. (2011).
GABAergic interneuron lineages selectively sort into specific cortical layers during early postnatal development. Cerebral cortex (New York, N.Y. : 1991), 21(4), 845-52. [PubMed:20732898] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Inamura, N., Kimura, T., Tada, S., Kurahashi, T., Yanagida, M., Yanagawa, Y., ..., & Murakami, F. (2012).
Intrinsic and extrinsic mechanisms control the termination of cortical interneuron migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(17), 6032-42. [PubMed:22539863] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Bortone, D., & Polleux, F. (2009).
KCC2 expression promotes the termination of cortical interneuron migration in a voltage-sensitive calcium-dependent manner. Neuron, 62(1), 53-71. [PubMed:19376067] [PMC] [WorldCat] [DOI] - ↑
Southwell, D.G., Paredes, M.F., Galvao, R.P., Jones, D.L., Froemke, R.C., Sebe, J.Y., ..., & Alvarez-Buylla, A. (2012).
Intrinsically determined cell death of developing cortical interneurons. Nature, 491(7422), 109-13. [PubMed:23041929] [PMC] [WorldCat] [DOI] - ↑
Miller, M.W. (1985).
Cogeneration of retrogradely labeled corticocortical projection and GABA-immunoreactive local circuit neurons in cerebral cortex. Brain research, 355(2), 187-92. [PubMed:3910166] [WorldCat] [DOI] - ↑
Fairén, A., Cobas, A., & Fonseca, M. (1986).
Times of generation of glutamic acid decarboxylase immunoreactive neurons in mouse somatosensory cortex. The Journal of comparative neurology, 251(1), 67-83. [PubMed:3760259] [WorldCat] [DOI] - ↑
Miyoshi, G., Butt, S.J., Takebayashi, H., & Fishell, G. (2007).
Physiologically distinct temporal cohorts of cortical interneurons arise from telencephalic Olig2-expressing precursors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(29), 7786-98. [PubMed:17634372] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2
Miyoshi, G., Hjerling-Leffler, J., Karayannis, T., Sousa, V.H., Butt, S.J., Battiste, J., ..., & Fishell, G. (2010).
Genetic fate mapping reveals that the caudal ganglionic eminence produces a large and diverse population of superficial cortical interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(5), 1582-94. [PubMed:20130169] [PMC] [WorldCat] [DOI] - ↑
Ben-Ari, Y. (2002).
Excitatory actions of gaba during development: the nature of the nurture. Nature reviews. Neuroscience, 3(9), 728-39. [PubMed:12209121] [WorldCat] [DOI] - ↑
Owens, D.F., & Kriegstein, A.R. (2002).
Is there more to GABA than synaptic inhibition? Nature reviews. Neuroscience, 3(9), 715-27. [PubMed:12209120] [WorldCat] [DOI] - ↑
Inada, H., Watanabe, M., Uchida, T., Ishibashi, H., Wake, H., Nemoto, T., ..., & Nabekura, J. (2011).
GABA regulates the multidirectional tangential migration of GABAergic interneurons in living neonatal mice. PloS one, 6(12), e27048. [PubMed:22180776] [PMC] [WorldCat] [DOI] - ↑
Hensch, T.K. (2005).
Critical period plasticity in local cortical circuits. Nature reviews. Neuroscience, 6(11), 877-88. [PubMed:16261181] [WorldCat] [DOI] - ↑
Yuste, R., Hawrylycz, M., Aalling, N., Aguilar-Valles, A., Arendt, D., Arnedillo, R.A., ..., & Lein, E. (2020).
A community-based transcriptomics classification and nomenclature of neocortical cell types. Nature neuroscience. [PubMed:32839617] [WorldCat] [DOI] - ↑
Fishell, G., & Kepecs, A. (2020).
Interneuron Types as Attractors and Controllers. Annual review of neuroscience, 43, 1-30. [PubMed:31299170] [PMC] [WorldCat] [DOI] - ↑
Taniguchi, H., Lu, J., & Huang, Z.J. (2013).
The spatial and temporal origin of chandelier cells in mouse neocortex. Science (New York, N.Y.), 339(6115), 70-4. [PubMed:23180771] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Miyoshi, G., Young, A., Petros, T., Karayannis, T., McKenzie Chang, M., Lavado, A., ..., & Fishell, G. (2015).
Prox1 Regulates the Subtype-Specific Development of Caudal Ganglionic Eminence-Derived GABAergic Cortical Interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(37), 12869-89. [PubMed:26377473] [PMC] [WorldCat] [DOI] - ↑
Favuzzi, E., Deogracias, R., Marques-Smith, A., Maeso, P., Jezequel, J., Exposito-Alonso, D., ..., & Rico, B. (2019).
Distinct molecular programs regulate synapse specificity in cortical inhibitory circuits. Science (New York, N.Y.), 363(6425), 413-417. [PubMed:30679375] [WorldCat] [DOI] - ↑
Pelkey, K.A., Chittajallu, R., Craig, M.T., Tricoire, L., Wester, J.C., & McBain, C.J. (2017).
Hippocampal GABAergic Inhibitory Interneurons. Physiological reviews, 97(4), 1619-1747. [PubMed:28954853] [PMC] [WorldCat] [DOI] - ↑
Klausberger, T., & Somogyi, P. (2008).
Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science (New York, N.Y.), 321(5885), 53-7. [PubMed:18599766] [PMC] [WorldCat] [DOI] - ↑
Pleasure, S.J., Anderson, S., Hevner, R., Bagri, A., Marin, O., Lowenstein, D.H., & Rubenstein, J.L. (2000).
Cell migration from the ganglionic eminences is required for the development of hippocampal GABAergic interneurons. Neuron, 28(3), 727-40. [PubMed:11163262] [WorldCat] [DOI] - ↑
Polleux, F., Whitford, K.L., Dijkhuizen, P.A., Vitalis, T., & Ghosh, A. (2002).
Control of cortical interneuron migration by neurotrophins and PI3-kinase signaling. Development (Cambridge, England), 129(13), 3147-60. [PubMed:12070090] [WorldCat] - ↑
Yozu, M., Tabata, H., & Nakajima, K. (2005).
The caudal migratory stream: a novel migratory stream of interneurons derived from the caudal ganglionic eminence in the developing mouse forebrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(31), 7268-77. [PubMed:16079409] [PMC] [WorldCat] [DOI] - ↑
Tricoire, L., Pelkey, K.A., Daw, M.I., Sousa, V.H., Miyoshi, G., Jeffries, B., ..., & McBain, C.J. (2010).
Common origins of hippocampal Ivy and nitric oxide synthase expressing neurogliaform cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(6), 2165-76. [PubMed:20147544] [PMC] [WorldCat] [DOI] - ↑
Tricoire, L., Pelkey, K.A., Erkkila, B.E., Jeffries, B.W., Yuan, X., & McBain, C.J. (2011).
A blueprint for the spatiotemporal origins of mouse hippocampal interneuron diversity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(30), 10948-70. [PubMed:21795545] [PMC] [WorldCat] [DOI] - ↑
Overstreet-Wadiche, L., & McBain, C.J. (2015).
Neurogliaform cells in cortical circuits. Nature reviews. Neuroscience, 16(8), 458-68. [PubMed:26189693] [PMC] [WorldCat] [DOI] - ↑
Flames, N., Pla, R., Gelman, D.M., Rubenstein, J.L., Puelles, L., & Marín, O. (2007).
Delineation of multiple subpallial progenitor domains by the combinatorial expression of transcriptional codes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(36), 9682-95. [PubMed:17804629] [PMC] [WorldCat] [DOI] - ↑
Wonders, C.P., Taylor, L., Welagen, J., Mbata, I.C., Xiang, J.Z., & Anderson, S.A. (2008).
A spatial bias for the origins of interneuron subgroups within the medial ganglionic eminence. Developmental biology, 314(1), 127-36. [PubMed:18155689] [PMC] [WorldCat] [DOI] - ↑
Glickstein, S.B., Moore, H., Slowinska, B., Racchumi, J., Suh, M., Chuhma, N., & Ross, M.E. (2007).
Selective cortical interneuron and GABA deficits in cyclin D2-null mice. Development (Cambridge, England), 134(22), 4083-93. [PubMed:17965053] [PMC] [WorldCat] [DOI] - ↑
Petros, T.J., Bultje, R.S., Ross, M.E., Fishell, G., & Anderson, S.A. (2015).
Apical versus Basal Neurogenesis Directs Cortical Interneuron Subclass Fate. Cell reports, 13(6), 1090-1095. [PubMed:26526999] [PMC] [WorldCat] [DOI] - ↑
Torigoe, M., Yamauchi, K., Kimura, T., Uemura, Y., & Murakami, F. (2016).
Evidence That the Laminar Fate of LGE/CGE-Derived Neocortical Interneurons Is Dependent on Their Progenitor Domains. The Journal of neuroscience : the official journal of the Society for Neuroscience, 36(6), 2044-56. [PubMed:26865626] [PMC] [WorldCat] [DOI] - ↑
Harwell, C.C., Fuentealba, L.C., Gonzalez-Cerrillo, A., Parker, P.R., Gertz, C.C., Mazzola, E., ..., & Kriegstein, A.R. (2015).
Wide Dispersion and Diversity of Clonally Related Inhibitory Interneurons. Neuron, 87(5), 999-1007. [PubMed:26299474] [PMC] [WorldCat] [DOI] - ↑
Mayer, C., Jaglin, X.H., Cobbs, L.V., Bandler, R.C., Streicher, C., Cepko, C.L., ..., & Fishell, G. (2015).
Clonally Related Forebrain Interneurons Disperse Broadly across Both Functional Areas and Structural Boundaries. Neuron, 87(5), 989-98. [PubMed:26299473] [PMC] [WorldCat] [DOI] - ↑
Nowakowski, T.J., Bhaduri, A., Pollen, A.A., Alvarado, B., Mostajo-Radji, M.A., Di Lullo, E., ..., & Kriegstein, A.R. (2017).
Spatiotemporal gene expression trajectories reveal developmental hierarchies of the human cortex. Science (New York, N.Y.), 358(6368), 1318-1323. [PubMed:29217575] [PMC] [WorldCat] [DOI] - ↑
Wagner, D.E., Weinreb, C., Collins, Z.M., Briggs, J.A., Megason, S.G., & Klein, A.M. (2018).
Single-cell mapping of gene expression landscapes and lineage in the zebrafish embryo. Science (New York, N.Y.), 360(6392), 981-987. [PubMed:29700229] [PMC] [WorldCat] [DOI] - ↑
Mayer, C., Hafemeister, C., Bandler, R.C., Machold, R., Batista Brito, R., Jaglin, X., ..., & Satija, R. (2018).
Developmental diversification of cortical inhibitory interneurons. Nature, 555(7697), 457-462. [PubMed:29513653] [PMC] [WorldCat] [DOI] - ↑
Mi, D., Li, Z., Lim, L., Li, M., Moissidis, M., Yang, Y., ..., & Marín, O. (2018).
Early emergence of cortical interneuron diversity in the mouse embryo. Science (New York, N.Y.), 360(6384), 81-85. [PubMed:29472441] [PMC] [WorldCat] [DOI] - ↑
Azim, E., Jabaudon, D., Fame, R.M., & Macklis, J.D. (2009).
SOX6 controls dorsal progenitor identity and interneuron diversity during neocortical development. Nature neuroscience, 12(10), 1238-47. [PubMed:19657336] [PMC] [WorldCat] [DOI] - ↑
Batista-Brito, R., Rossignol, E., Hjerling-Leffler, J., Denaxa, M., Wegner, M., Lefebvre, V., ..., & Fishell, G. (2009).
The cell-intrinsic requirement of Sox6 for cortical interneuron development. Neuron, 63(4), 466-81. [PubMed:19709629] [PMC] [WorldCat] [DOI] - ↑
Close, J., Xu, H., De Marco García, N., Batista-Brito, R., Rossignol, E., Rudy, B., & Fishell, G. (2012).
Satb1 is an activity-modulated transcription factor required for the terminal differentiation and connectivity of medial ganglionic eminence-derived cortical interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(49), 17690-705. [PubMed:23223290] [PMC] [WorldCat] [DOI] - ↑
Denaxa, M., Kalaitzidou, M., Garefalaki, A., Achimastou, A., Lasrado, R., Maes, T., & Pachnis, V. (2012).
Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell reports, 2(5), 1351-62. [PubMed:23142661] [PMC] [WorldCat] [DOI] - ↑
Liodis, P., Denaxa, M., Grigoriou, M., Akufo-Addo, C., Yanagawa, Y., & Pachnis, V. (2007).
Lhx6 activity is required for the normal migration and specification of cortical interneuron subtypes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(12), 3078-89. [PubMed:17376969] [PMC] [WorldCat] [DOI] - ↑
Butt, S.J., Sousa, V.H., Fuccillo, M.V., Hjerling-Leffler, J., Miyoshi, G., Kimura, S., & Fishell, G. (2008).
The requirement of Nkx2-1 in the temporal specification of cortical interneuron subtypes. Neuron, 59(5), 722-32. [PubMed:18786356] [PMC] [WorldCat] [DOI] - ↑
Miyoshi, G. (2019).
Elucidating the developmental trajectories of GABAergic cortical interneuron subtypes. Neuroscience research, 138, 26-32. [PubMed:30227162] [WorldCat] [DOI] - ↑
Southwell, D.G., Nicholas, C.R., Basbaum, A.I., Stryker, M.P., Kriegstein, A.R., Rubenstein, J.L., & Alvarez-Buylla, A. (2014).
Interneurons from embryonic development to cell-based therapy. Science (New York, N.Y.), 344(6180), 1240622. [PubMed:24723614] [PMC] [WorldCat] [DOI]