「慢性炎症性脱髄性多発ニューロパチー」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の11版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/abababab 小池 春樹]</font><br> | <font size="+1">[https://researchmap.jp/abababab 小池 春樹]</font><br> | ||
''名古屋大学大学院医学系研究科 神経内科''<br> | ''名古屋大学大学院医学系研究科 神経内科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年10月12日 原稿完成日:2020年XX月XX日<br> | ||
担当編集委員:[http://researchmap.jp/read0141446/ 漆谷 真](滋賀医科大学 脳神経内科)<br> | 担当編集委員:[http://researchmap.jp/read0141446/ 漆谷 真](滋賀医科大学 脳神経内科)<br> | ||
</div> | </div> | ||
英:chronic inflammatory demyelinating | 英:chronic inflammatory demyelinating polyneuropathy 独:Chronische inflammatorische demyelinisierende Polyneuropathie 仏:polyradiculonévrite inflammatoire démyélinisante chronique<br> | ||
英略語:CIDP<br> | 英略語:CIDP<br> | ||
同義語:慢性炎症性脱髄性多発ニューロパチー | |||
{{box|text= 慢性炎症性脱髄性多発ニューロパチーは慢性進行性、または再発性の経過を呈する免疫介在性の末梢神経疾患である。多様な臨床病型が含まれており、病態は単一ではないと考えられている。古典的にはマクロファージによる髄鞘の貪食が重要な役割を果たすとされてきたが、近年では傍絞輪部に存在するニューロファシン155などに対するIgG4自己抗体を介したマクロファージを介さない病態が存在することが明らかになっている。第一選択の治療として経静脈的免疫グロブリン療法(IVIg)、副腎皮質ステロイド薬、血液浄化療法があるが、有効性には個人差がある。これらのうち現在最も多く用いられているのはIVIgであるが、一定期間有効であっても再発が多くみられることやIgG4自己抗体陽性例に対する効果が乏しいことを念頭に置く必要がある。繰り返しのIVIgで再発がみられる患者に対しては、病態の再燃による軸索障害などの不可逆的な障害の蓄積を回避するという観点から、再発を未然に防ぐための定期的なIVIgまたは免疫グロブリン製剤の皮下投与による維持療法を行うことが可能になっている。}} | |||
== 慢性炎症性脱髄性多発ニューロパチーとは == | == 慢性炎症性脱髄性多発ニューロパチーとは == | ||
慢性炎症性脱髄性多発ニューロパチーは慢性進行性、または再発性の経過で筋力低下と感覚障害をきたす後天性の末梢神経疾患である<ref name=Koike2018><pubmed>30429275</pubmed></ref><ref name=Koike2020><pubmed>32410146</pubmed></ref> [1,2]。発症には免疫性の機序が関与すると推測されているが、十分明らかになっていない部分が多い。再発性の経過を呈する後天性の脱髄性末梢神経障害という概念は1958年にAustinによって提唱され<ref name=Austin1958><pubmed>13572689</pubmed></ref> [3]、1975年にDyckらによって慢性進行性や再発性の経過を呈し、左右対称で四肢近位部と遠位部同程度の障害をきたす、いわゆる典型的CIDPの疾患概念が確立された<ref name=Dyck1975><pubmed>1186294</pubmed></ref> [4]。 | |||
現在の日常診療における慢性炎症性脱髄性多発神経炎診断の際には臨床症候と電気生理学的所見が重要視されており、これまでに多くの診断基準が提唱されてきた。中でも有名なものとして、American Academy of Neurology(AAN)の診断基準とEuropean Federation of Neurological Societies/Peripheral Nerve Society(EFNS/PNS)ガイドラインの診断基準の2つがあり<ref name=ref2027473><pubmed>2027473</pubmed></ref><ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref> [5,6]、現在は後者(EFNS/PNS診断基準)が頻用されている。 | |||
EFNS/ | EFNS/PNS診断基準では先に述べた典型的慢性炎症性脱髄性多発神経炎の他に、非典型的慢性炎症性脱髄性多発神経炎として、遠位部優位型(distal acquired demyelinating symmetric; DADS)、多巣性感覚運動型(multifocal acquired demyelinating sensory and motor neuropathy; MADSAM)、局所型、純粋運動型、および純粋感覚型の5種類の病型を定義している('''表1''')<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref> [6]。多巣性感覚運動型 はEFNS/PNS診断基準が提唱される以前に報告されていたLewis-Sumner症候群と同義であると考えられている[6]。病型別の割合は報告によって異なるが、後方視的な連続106例の検討では、典型的慢性炎症性脱髄性多発神経炎が52%(55例)、遠位部優位型が15%(16例)、多巣性感覚運動型が14%(15例)、局所型が1%(1例)、純粋運動型が4%(4例)、純粋感覚型が14%(15例)であった<ref name=Ikeda2019><pubmed>31227562</pubmed></ref> [7]。 | ||
近年、典型的慢性炎症性脱髄性多発神経炎と遠位部優位型の病型を呈する患者の一部で傍絞輪部に存在するニューロファシン155やコンタクチン1に対する自己抗体が検出されることが明らかとなり、これらの抗体陽性例は後述するように従来型の慢性炎症性脱髄性多発神経炎とは異なる病態を有する一群と考えられるようになっている<ref name=Koike2020><pubmed>32410146</pubmed></ref> [2]。 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+ | |+表1 慢性炎症性脱髄性多発神経炎の病型(EFNS/PNS診療ガイドラインから引用)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref> [6] | ||
|- | |- | ||
| '''(1) | | '''(1) 典型的慢性炎症性脱髄性多発神経炎(typical CIDP)'''<br> | ||
'''(2) | '''(2) 非典型的慢性炎症性脱髄性多発神経炎(atypical CIDP)'''<br> | ||
(a) | (a) 遠位部優位型(distal acquired demyelinating symmetric; DADS)<br> | ||
(b) | (b) 多巣性感覚運動型(multifocal acquired demyelinating sensory and motor neuropathy; MADSAM)<br> | ||
(c) 局所型(focal)<br> | (c) 局所型(focal)<br> | ||
(d) 純粋運動型(pure sensory)<br> | (d) 純粋運動型(pure sensory)<br> | ||
| 33行目: | 33行目: | ||
== 疫学 == | == 疫学 == | ||
我が国における慢性炎症性脱髄性多発神経炎の有病率と発症率は、AANの診断基準を用いて2004年から2005年にかけて行われた全国疫学調査によると、それぞれ10万人あたり1.61人と0.48人であった<ref name=Iijima2008><pubmed>18223015</pubmed></ref> [8]。AANの診断基準は1991年に典型的慢性炎症性脱髄性多発神経炎を想定して作成されたものであり、2005年に発表され2010年に改訂されたEFNS/PNS診断基準を採用した場合、非典型的慢性炎症性脱髄性多発神経炎が加わることから、これらの数値はより高くなると考えられる。 | |||
== 診断 == | == 診断 == | ||
現在頻用されているEFNS/ | 現在頻用されているEFNS/PNSガイドラインの診断基準では、2ヶ月以上にわたる慢性進行、階段状増悪、あるいは再発型の経過を呈し、左右対称性で近位部と遠位部同程度、すなわちびまん性の四肢筋力低下と感覚異常をきたす病型を典型的慢性炎症性脱髄性多発神経炎と定義している(表2)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref> [6]。慢性炎症性脱髄性多発神経炎の診断にあたっては、典型的慢性炎症性脱髄性多発神経炎に加えて先に述べた非典型的慢性炎症性脱髄性多発神経炎、すなわち遠位部優位型、多巣性感覚運動型、局所型、純粋運動型、純粋感覚型のような臨床病型も念頭に入れながら、末梢神経伝導検査で脱髄を示唆する所見の有無を検討する。EFNS/PNSのガイドラインでは詳細は電気診断基準が定められており、これに基づいて運動神経伝導速度の遅延、終末潜時の延長、伝導ブロック、時間的分散、F波の異常などを見いだすことが重要である(表3)。電気診断基準に加えて脳脊髄液検査、MRI、感覚神経伝導検査、免疫療法に対する反応性、神経生検などの所見が支持基準に含まれており(表4)、これらをあわせて総合的に診断する(表5)。 | ||
典型的慢性炎症性脱髄性多発神経炎では感覚障害よりも運動障害が前景に立つ場合が多く、自律神経症候は通常みられない<ref name=ガイドライン>慢性炎症性脱髄性多発根ニューロパチー、多巣性運動ニューロパチー診療ガイドライン 2013.東京, 南光堂 2013</ref> [9]。感覚障害に関しては、四肢のしびれ感を自覚する場合が多いが、痛みを訴えることは少ない。EFNS/PNS診断基準は治療に反応しうる患者を網羅する診断感度への配慮が見られる反面、AAN診断基準に比べて特異度が低く、当初診断基準があてはまっても、後にPOEMS症候群、リンパ腫、家族性アミロイドポリニューロパチーなど、慢性炎症性脱髄性多発神経炎以外の疾患が明らかになる場合もあり注意を要する<ref name=Koike2008><pubmed>18356256</pubmed></ref><ref name=Koike2011><pubmed>21463231</pubmed></ref><ref name=Tomita2013><pubmed>23884813</pubmed></ref> [10-12]。これらの疾患では痛みを訴えることが多いため、痛みを伴う脱髄性のニューロパチー患者では慢性炎症性脱髄性多発神経炎以外の疾患の可能性も考慮に入れて原因を精査する必要がある。 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+表2. | |+表2. 慢性炎症性脱髄性多発神経炎の臨床診断基準(EFNS/PNS診療ガイドラインから引用)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref>[6] | ||
|- | |- | ||
! style="text-align:left"| (1) 選択基準 | ! style="text-align:left"| (1) 選択基準 | ||
|- | |- | ||
|'''(a) | |'''(a)典型的慢性炎症性脱髄性多発神経炎(typical CIDP)'''<br> | ||
少なくとも2ヶ月以上かけて慢性・階段状の進行、あるいは再発性の経過を呈する四肢対称性の近位部および遠位部の筋力低下と感覚障害。脳神経が障害されることがある。腱反射は四肢で低下または消失する。<br> | 少なくとも2ヶ月以上かけて慢性・階段状の進行、あるいは再発性の経過を呈する四肢対称性の近位部および遠位部の筋力低下と感覚障害。脳神経が障害されることがある。腱反射は四肢で低下または消失する。<br> | ||
'''(b) | '''(b)非典型的慢性炎症性脱髄性多発神経炎(atypical CIDP)'''<br> | ||
下記のいずれかを呈するが、他は(a) | 下記のいずれかを呈するが、他は(a)と同様(腱反射は障害のない部位では正常なことがある)。<br> | ||
・遠位部優位型:(distal acquired demyelinating symmetric; DADS)<br> | |||
・非対称、すなわち多巣性感覚運動型:(multifocal acquired demyelinating sensory and motor neuropathy; MADSAM、Lewis-Sumner症候群)<br> | |||
・局所型(1側の腕神経叢や腰仙神経叢、または1側上肢や下肢の1本かそれ以上の神経の障害など):(focal)<br> | ・局所型(1側の腕神経叢や腰仙神経叢、または1側上肢や下肢の1本かそれ以上の神経の障害など):(focal)<br> | ||
・純粋運動型:(pure sensory)<br> | ・純粋運動型:(pure sensory)<br> | ||
| 57行目: | 57行目: | ||
! style="text-align:left"| (2) 除外基準 | ! style="text-align:left"| (2) 除外基準 | ||
|- | |- | ||
| | | ・ボレリア感染症(ライム病)、ジフテリア、末梢神経障害をきたしうる薬物や毒物への暴露<br> | ||
・遺伝性脱髄性ニューロパチー<br> | |||
・著明な括約筋(排尿・排便)障害<br> | |||
・多巣性運動ニューロパチー <br> | |||
・高力価の抗髄鞘関連糖タンパク質(MAG)抗体を伴う単クローン性IgM-Mタンパク質血症<br> | |||
・POEMS症候群、骨硬化性骨髄腫、糖尿病性・非糖尿病性腰仙部神経根叢ニューロパチーなどの脱髄性ニューロパチーをきたすその他の原因。リンパ腫、アミロイドーシスは脱髄所見を呈することがある。<br> | |||
|} | |} | ||
{| class="wikitable" | {| class="wikitable" | ||
|+表3. | |+表3. 慢性炎症性脱髄性多発神経炎の電気診断基準(EFNS/PNS診療ガイドラインから引用)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref>[6] | ||
! style="text-align:left"|(1) Definite: 以下のうち少なくとも1項目を満たす | ! style="text-align:left"|(1) Definite: 以下のうち少なくとも1項目を満たす | ||
|- | |- | ||
| 73行目: | 72行目: | ||
(b) 2神経以上で運動神経伝導速度が正常下限値の30%以下に低下。<br> | (b) 2神経以上で運動神経伝導速度が正常下限値の30%以下に低下。<br> | ||
(c) 2神経以上でF波潜時が正常上限値の30%以上延長(複合筋活動電位振幅が正常下限値の80%未満の場合には50%以上延長)。<br> | (c) 2神経以上でF波潜時が正常上限値の30%以上延長(複合筋活動電位振幅が正常下限値の80%未満の場合には50%以上延長)。<br> | ||
(d) | (d) 複合筋活動電位振幅が正常下限値の20%以上の2神経でF波消失、および他の1神経以上でその他の脱髄所見aのいずれかを満たす。<br> | ||
(e) | (e) 伝導ブロック:遠位部複合筋活動電位振幅が正常下限値の20%以上である2神経で近位部の複合筋活動電位振幅が遠位部と比較して50%以上低下、または1神経で伝導ブロックがみられ他の1神経以上でその他の脱髄所見aのいずれか満たす。<br> | ||
(f) 異常な時間的分散(2神経以上で近位部・遠位部間での30%以上の複合筋活動電位持続時間延長)。<br> | (f) 異常な時間的分散(2神経以上で近位部・遠位部間での30%以上の複合筋活動電位持続時間延長)。<br> | ||
(g) 遠位部複合筋活動電位持続時間が1神経以上で延長(フィルターが20Hz〜2kHzの場合、正中神経6.6ms以上、尺骨神経6.7 ms以上、腓骨神経7.6 ms以上、脛骨神経8.8 | (g) 遠位部複合筋活動電位持続時間が1神経以上で延長(フィルターが20Hz〜2kHzの場合、正中神経6.6ms以上、尺骨神経6.7 ms以上、腓骨神経7.6 ms以上、脛骨神経8.8 ms以上)、および他の1神経以上でその他の脱髄所見aのいずれかを満たす。<br> | ||
|- | |- | ||
! style="text-align:left"|(2) Probable | ! style="text-align:left"|(2) Probable | ||
|- | |- | ||
| 脛骨神経以外の遠位部複合筋活動電位振幅が正常下限値の20%以上である2神経で近位部の複合筋活動電位振幅が遠位部と比較して30%以上低下、または1神経でこの基準を満たし他の1神経以上でその他の脱髄所見 | | 脛骨神経以外の遠位部複合筋活動電位振幅が正常下限値の20%以上である2神経で近位部の複合筋活動電位振幅が遠位部と比較して30%以上低下、または1神経でこの基準を満たし他の1神経以上でその他の脱髄所見''<sup>a</sup>''のいずれかを満たす。 | ||
|- | |- | ||
! style="text-align:left"|(3) Possible | ! style="text-align:left"|(3) Possible | ||
| 86行目: | 85行目: | ||
| (1)の基準を1神経のみで満たす。 | | (1)の基準を1神経のみで満たす。 | ||
|} | |} | ||
''<sup>a</sup>''(a)から(g)で定めた所見 | |||
(a)から(g)で定めた所見 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+ 表4. | |+ 表4. 慢性炎症性脱髄性多発神経炎診断の支持基準(EFNS/PNS診療ガイドラインから引用)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref>[6] | ||
|- | |- | ||
| 1. 脳脊髄液のタンパク質細胞解離(白血球数<10/mm<sup>3</sup>)<br> | | 1. 脳脊髄液のタンパク質細胞解離(白血球数<10/mm<sup>3</sup>)<br> | ||
2. | 2. MRIでの馬尾、神経根、神経叢のガドリニウム造影効果・腫大<br> | ||
3. 少なくとも1神経における電気生理学的な感覚神経の異常所見(下記のいずれか)<br> | 3. 少なくとも1神経における電気生理学的な感覚神経の異常所見(下記のいずれか)<br> | ||
a. | a. 感覚神経活動電位振幅の腓腹神経における正常所見、および正中神経(手根管症候群による正中神経障害を除く)または橈骨神経における異常所見<br> | ||
b. 伝導速度が正常下限値の80%未満(感覚神経活動電位振幅が正常下限値の80%未満である場合は70%未満)<br> | b. 伝導速度が正常下限値の80%未満(感覚神経活動電位振幅が正常下限値の80%未満である場合は70%未満)<br> | ||
c. | c. 中枢神経系の疾患を伴わない体性感覚誘発電位の遅延<br> | ||
4. 免疫治療による客観的な改善<br> | 4. 免疫治療による客観的な改善<br> | ||
5. 神経生検の電子顕微鏡またはときほぐし線維標本での解析による明確な脱髄・再髄鞘化<br> | 5. 神経生検の電子顕微鏡またはときほぐし線維標本での解析による明確な脱髄・再髄鞘化<br> | ||
| 103行目: | 101行目: | ||
{| class="wikitable" | {| class="wikitable" | ||
|+表5. CIDP診断カテゴリー(EFNS/PNS診療ガイドラインから引用)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref> | |+表5. CIDP診断カテゴリー(EFNS/PNS診療ガイドラインから引用)<ref name=JointTaskForceofthe2010><pubmed>20433600</pubmed></ref>[6] | ||
|- | |- | ||
| '''Definite CIDP'''<br> | | '''Definite CIDP'''<br> | ||
臨床診断基準(表2)の1(aまたはb)と2を満たし、電気診断基準(表3)がdefinite;または、<br> | |||
Probable CIDP + 支持基準(表4)の少なくとも1項目を満たす;または、<br> | Probable CIDP + 支持基準(表4)の少なくとも1項目を満たす;または、<br> | ||
Possible CIDP + 支持基準の少なくとも2項目を満たす<br> | Possible CIDP + 支持基準の少なくとも2項目を満たす<br> | ||
| 116行目: | 114行目: | ||
'''合併症に関連したCIDP(definite、probable、possible)''' | '''合併症に関連したCIDP(definite、probable、possible)''' | ||
|} | |} | ||
[[ファイル:Koike_CIDP_Fig1.png|サムネイル|'''図1. マクロファージによる髄鞘の破壊。'''<br> | [[ファイル:Koike_CIDP_Fig1.png|サムネイル|'''図1.マクロファージによる髄鞘の破壊。'''<br> | ||
(A) 髄鞘を囲む基底膜(矢頭)内には髄鞘の残渣を多量に含んだマクロファージの細胞質がみられる。黒枠の拡大を(B)に示す。(B) マクロファージによる髄鞘の層構造の破壊がみられる。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bars = 2 μm (A) and 0.5 μm (B)。]] | (A) 髄鞘を囲む基底膜(矢頭)内には髄鞘の残渣を多量に含んだマクロファージの細胞質がみられる。黒枠の拡大を(B)に示す。(B) マクロファージによる髄鞘の層構造の破壊がみられる。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bars = 2 μm (A) and 0.5 μm (B)。]] | ||
[[ファイル:Koike_CIDP_Fig2.png|サムネイル|'''図2. 髄鞘の消失。'''<br> | [[ファイル:Koike_CIDP_Fig2.png|サムネイル|'''図2.髄鞘の消失。'''<br> | ||
星印で示した有髄線維の軸索はマクロファージによる貪食によって周囲の髄鞘が消失している。正常な無髄線維の軸索を矢頭で示す。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 0.5 μm。]] | 星印で示した有髄線維の軸索はマクロファージによる貪食によって周囲の髄鞘が消失している。正常な無髄線維の軸索を矢頭で示す。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 0.5 μm。]] | ||
[[ファイル:Koike_CIDP_Fig3.png|サムネイル|'''図3. 貪食が終了して基底膜外に出て行くマクロファージ。'''<br> | [[ファイル:Koike_CIDP_Fig3.png|サムネイル|'''図3.貪食が終了して基底膜外に出て行くマクロファージ。'''<br> | ||
マクロファージは矢頭の部分で有髄線維を囲む基底膜を貫通している。髄鞘が消失した軸索を星印で示す。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 1 μm。]] | マクロファージは矢頭の部分で有髄線維を囲む基底膜を貫通している。髄鞘が消失した軸索を星印で示す。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 1 μm。]] | ||
[[ファイル:Koike_CIDP_Fig4.png|サムネイル|'''図4. 脱髄像と基底膜外に出たマクロファージ。'''<br> | [[ファイル:Koike_CIDP_Fig4.png|サムネイル|'''図4.脱髄像と基底膜外に出たマクロファージ。'''<br> | ||
脱髄像を星印で示す。基底膜外のマクロファージ(矢印)の細胞質には髄鞘の残渣が含まれている。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 2 μm。]] | 脱髄像を星印で示す。基底膜外のマクロファージ(矢印)の細胞質には髄鞘の残渣が含まれている。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 2 μm。]] | ||
[[ファイル:Koike_CIDP_Fig5.png|サムネイル|''' | [[ファイル:Koike_CIDP_Fig5.png|サムネイル|'''図5.有髄線維における傍絞輪部周辺の構造とタンパク質の局在。'''<br> | ||
有髄線維は長軸方向にみた場合、ランビエ絞輪部、傍絞輪部、傍絞輪近接部、絞輪間部の4つの部位に区分することができる。ニューロファシン155とコンタクチン1は傍絞輪部に局在しており、軸索膜と髄鞘終末ループを接着させる役割を担っている。Caspr1 = contactin-associated protein 1; Caspr2 = contactin-associated protein 2; CNTN1 = コンタクチン1; CNTN2 = コンタクチン2; NF155 = ニューロファシン155; NF186 = ニューロファシン186.]] | 有髄線維は長軸方向にみた場合、ランビエ絞輪部、傍絞輪部、傍絞輪近接部、絞輪間部の4つの部位に区分することができる。ニューロファシン155とコンタクチン1は傍絞輪部に局在しており、軸索膜と髄鞘終末ループを接着させる役割を担っている。Caspr1 = contactin-associated protein 1; Caspr2 = contactin-associated protein 2; CNTN1 = コンタクチン1; CNTN2 = コンタクチン2; NF155 = ニューロファシン155; NF186 = ニューロファシン186.]] | ||
[[ファイル:Koike_CIDP_Fig6.png|サムネイル|'''図6.抗ニューロファシン155抗体陽性例でみられた傍絞輪部の解離。'''<br> | [[ファイル:Koike_CIDP_Fig6.png|サムネイル|'''図6.抗ニューロファシン155抗体陽性例でみられた傍絞輪部の解離。'''<br> | ||
髄鞘の終末ループと軸索の間隙を矢印で示す。(A)の黒枠の拡大を(B)に示す。腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bars = 0.5 μm (A) and 0.2 μm (B)。]] | 髄鞘の終末ループと軸索の間隙を矢印で示す。(A)の黒枠の拡大を(B)に示す。腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bars = 0.5 μm (A) and 0.2 μm (B)。]] | ||
== 病態生理 == | == 病態生理 == | ||
=== マクロファージによる脱髄 === | === マクロファージによる脱髄 === | ||
慢性炎症性脱髄性多発神経炎ではマクロファージによる髄鞘の貪食像が初期から報告されており('''図1-4''')、これによって生じる脱髄が神経の伝導障害を引き起こすと考えられてきた<ref name=Koike2018><pubmed>30429275</pubmed></ref> [1]。腓腹神経生検の検討では、主要な病型である典型的慢性炎症性脱髄性多発神経炎、遠位部優位型、多巣性感覚運動型、純粋感覚型の全てにおいて、全例ではないものの、マクロファージによる髄鞘貪食像が確認されている<ref name=Ikeda2019><pubmed>31227562</pubmed></ref> [7]。これらのうち非典型的慢性炎症性脱髄性多発神経炎、すなわち遠位部優位型、多巣性感覚運動型、純粋感覚型では有髄線維の脱落の程度や、繰り返しの脱髄・再髄鞘化の機転を示唆するオニオンバルブの分布に部位差を認めることが多いのに対し、典型的慢性炎症性脱髄性多発神経炎ではこのような部位差がみられず均一な所見を呈する傾向があることが示されている<ref name=Ikeda2019><pubmed>31227562</pubmed></ref> [7]。このことから、それぞれの病型にはマクロファージに関連した共通の病態を有する患者が含まれており、近位部・中間部・遠位部などの障害部位や髄鞘の修復機転などが臨床的な病型の差異を規定していることが推測される<ref name=Koike2020><pubmed>32410146</pubmed></ref> [2]。 | |||
マクロファージによる脱髄と自己抗体との関係は十分明らかになっていなかったが、最近になって抗LM1抗体陽性慢性炎症性脱髄性多発神経炎患者の腓腹神経生検で、髄鞘への補体沈着とマクロファージによる髄鞘貪食像がみられたと報告された<ref name=Koike2020b><pubmed>31698166</pubmed></ref> [13]。LM1は髄鞘に豊富に存在するガングリオシドの一種であり、これに対する抗体はGM1やGD1bなど他のガングリオシドとの複合体に反応するものも含めると全慢性炎症性脱髄性多発神経炎患者の約10%で検出され、抗体陽性例は高齢の男性が多く、典型的慢性炎症性脱髄性多発神経炎の病型を呈し、失調がみられる頻度が高いといわれている<ref name=Kuwahara2013><pubmed>23138763</pubmed></ref> [14]。 | |||
=== IgG4自己抗体による傍絞輪部の解離 === | === IgG4自己抗体による傍絞輪部の解離 === | ||
近年になってニューロファシン155やコンタクチン1などの傍絞輪部に局在するタンパク質に対する自己抗体による、古典的なマクロファージを介さない病態も存在することが明らかとなり注目を集めている('''図5''')<ref name=Koike2017><pubmed>28073817</pubmed></ref> [15]。なかでも傍絞輪部において髄鞘の終末ループと軸索を接着させる機能をもつニューロファシン155に対する抗体陽性例は慢性炎症性脱髄性多発神経炎患者全体の5-10%程度を占めており<ref name=Koike2017><pubmed>28073817</pubmed></ref><ref name=Kadoya2016><pubmed>27852440</pubmed></ref> [15,16]、若年で発症する傾向があり、感覚性運動失調や振戦が高率にみられ、経静脈的免疫グロブリン(IVIg)療法に対して抵抗性であるなどの特徴を有することが明らかになっている<ref name=Kadoya2016><pubmed>27852440</pubmed></ref><ref name=Ogata2015><pubmed>26478896</pubmed></ref> [16,17]。抗ニューロファシン155抗体陽性例の腓腹神経生検の検討では、マクロファージによる髄鞘の貪食像やオニオンバルブがみられないことなど、従来から報告されてきた古典的な慢性炎症性脱髄性多発神経炎の病理像とは異なる病理所見を呈することが明らかになっている<ref name=Koike2017><pubmed>28073817</pubmed></ref> [15]。電子顕微鏡による神経の縦断像の検討では、抗ニューロファシン155抗体陽性例では傍絞輪部における髄鞘の終末ループと軸索間の離開がみられ('''図6''')、抗体の沈着によってニューロファシン155が両者を接着させる機能が失われていることが示されている<ref name=Koike2017><pubmed>28073817</pubmed></ref> [15]。本抗体の主な免疫グロブリンサブクラスはIgG4であり<ref name=Kadoya2016><pubmed>27852440</pubmed></ref><ref name=Ogata2015><pubmed>26478896</pubmed></ref> [16,17]、IgG4に対する抗体を用いた抗ニューロファシン155抗体陽性例の腓腹神経の免疫染色ではIgG4の傍絞輪部への沈着が確認されている<ref name=Koike2017><pubmed>28073817</pubmed></ref> [15]。IgG4沈着部位には補体の沈着がみられないことから<ref name=Koike2017><pubmed>28073817</pubmed></ref> [15]、IgG4自己抗体が補体を介した炎症反応を惹起することなく標的抗原の機能を阻害して神経の伝導障害を惹起していると推測される。 | |||
== 治療 == | == 治療 == | ||
=== 従来型の治療戦略 === | === 従来型の治療戦略 === | ||
慢性炎症性脱髄性多発神経炎患者に対する第一選択の治療としてはIVIg、副腎皮質ステロイド薬、血液浄化療法があり、効果は同等と言われている<ref name=ガイドライン></ref>。その他の補足的治療としては、シクロホスファミド、アザチオプリン、シクロスポリン、メトトレキサート、インターフェロンβ、ミコフェノール酸モフェチルなどの有効性を示唆する報告があるが、第一選択治療のうち一つの治療が無効と判断された場合でも他の第一選択の治療が有効な症例が報告されていることから、原則としてこれらの補足的治療を考慮する前に、他の第一選択治療を試みることが推奨されている<ref name=ガイドライン></ref> [9]。 | |||
第一選択治療のうち、IVIgは比較的簡便に行えることから、近年は慢性炎症性脱髄性多発神経炎患者に対する最初の治療として最も多く用いられている。 IVIgの作用機序に関しては十分明らかになっていないが、抗体の中和、補体活性化の抑制、マクロファージに発現するFc受容体に対する作用、サイトカインプロフィールの変化などが関与していると考えられている<ref name=Koike2020><pubmed>32410146</pubmed></ref> [2]。通常は400mg/kg体重を1日量として5日間の連日点滴静注を行うが、効果が早く発現し、場合によっては5日間の投与中でも病状の進行の停止や改善がみられることがある。しかしながらIVIgに対しては一定の割合で無効例が存在することと、再発を繰り返す患者も多いことも念頭におく必要がある<ref name=Iijima2009><pubmed>19776380</pubmed></ref> [18]。1回目の投与で明らかな効果がみられない場合でも2回目の投与で初めて有効性を示すこともあることから、無効と判断するには2回までの投与は試みる価値はあるとされている<ref name=ガイドライン></ref>[9]。副腎皮質ステロイド薬に関しては通常プレドニゾロンを1日あたり60mgまたは1mg/kg体重(小児では1-1.5 mg/kg体重)経口投与から開始し、ゆっくり減量する方法がとられる<ref name=ガイドライン></ref>[9]。ステロイドパルス療法も同等の効果があると言われており、経口ステロイド薬の内服開始前に経静脈的メチルプレドニゾロンパルス療法が行われることもある<ref name=ガイドライン></ref>[9]。 | |||
=== 病型による治療反応性の違い === | === 病型による治療反応性の違い === | ||
先に述べた通り慢性炎症性脱髄性多発神経炎には多様な病型が含まれている。例えば、EFNS/PNS診断基準が定義する典型的慢性炎症性脱髄性多発神経炎、遠位部優位型、多巣性感覚運動型、局所型、純粋運動型、および純粋感覚型の6病型を規定する病態の差異に関しては明らかになっていないため、これら6病型全てに同一の治療方針を適用するべきかどうかに関しては今後の知見の積み重ねが必要である。後方視的な検討では遠位部優位型と多巣性感覚運動型 のIVIgに対する治療反応性は典型的慢性炎症性脱髄性多発神経炎 と比較して不良であったとされている<ref name=Kuwabara2015><pubmed>25424435</pubmed></ref><ref name=Doneddu2019><pubmed>30297520</pubmed></ref> [19,20]。また、純粋運動型に関してはステロイドによる治療で悪化したという報告があり注意を要する<ref name=ガイドライン></ref>[9]。抗ニューロファシン155抗体のようなIgG4自己抗体陽性例ではIVIgに対する反応性が乏しい反面、副腎皮質ステロイド薬や血漿浄化療法は有効とされている<ref name=Koike2020><pubmed>32410146</pubmed></ref> [2]。血漿浄化療法を選択する際には一般的な免疫吸着療法はIgG4を吸着しにくいことを考慮にいれる必要がある<ref name=Kuwahara2018><pubmed>28796305</pubmed></ref> [21]。また、これらの抗体陽性例に対してはリツキシマブの有効性が示唆されている<ref name=Shimizu2020><pubmed>32234705</pubmed></ref> [22]。 | |||
=== 新たな治療戦略 === | === 新たな治療戦略 === | ||
慢性炎症性脱髄性多発神経炎では末梢神経の髄鞘をマクロファージが貪食することによって生じる脱髄や、抗ニューロファシン155抗体や抗コンタクチン1抗体などのIgG4自己抗体による傍絞輪部の髄鞘と軸索間の離開が病態の中で重要な役割を果たしていると推測されるが、このような脱髄や離開に伴って軸索障害も生じることが知られている<ref name=Koike2017><pubmed>28073817</pubmed></ref> [15]。このような、いわゆる二次性の軸索障害が目立つ患者では筋萎縮が出現し、治療への反応性が不良となることが示唆されている<ref name=Iijima2005><pubmed>15851750</pubmed></ref><ref name=Ohyama2014><pubmed>24684299</pubmed></ref> [23,24]。現在頻用されているIVIgは効果があっても再発することが多く、その都度IVIgを施行することが多かったが、このような治療戦略では反復する末梢神経障害の蓄積により徐々に不可逆的な軸索障害が生じることが予想される<ref name=Lin2011><pubmed>21747028</pubmed></ref> [25]。このことから、患者の長期的な機能予後を考慮して、症状が再発してから対処するのではなく、病態の再燃を未然に防いで障害の蓄積を回避するという治療戦略、すなわち維持療法の有用性が提唱されるようになり<ref name=Hughes2008><pubmed>18178525</pubmed></ref> [26]、現在では運動機能低下の進行抑制のための維持療法、すなわち3週間ごとのIVIg反復投与(1000mg/kg体重を1日または500mg/kg体重を2日間連日)が再発性の慢性炎症性脱髄性多発神経炎患者に対する重要な治療の選択肢となっている<ref name=Kuwabara2018><pubmed>29635876</pubmed></ref> [27]。また、高濃度(20%)の免疫グロブリン製剤の皮下投与(1週間あたり200-400mg/kg体重を1日または連続する2日で分割投与)も維持療法として有効であることが示されており<ref name=vanSchaik2016><pubmed>27455854</pubmed></ref> [28]、我が国でも保健適用となっている。 | |||
== 参考文献 == | == 参考文献 == | ||
2020年12月14日 (月) 09:54時点における版
小池 春樹
名古屋大学大学院医学系研究科 神経内科
DOI:10.14931/bsd.9563 原稿受付日:2020年10月12日 原稿完成日:2020年XX月XX日
担当編集委員:漆谷 真(滋賀医科大学 脳神経内科)
英:chronic inflammatory demyelinating polyneuropathy 独:Chronische inflammatorische demyelinisierende Polyneuropathie 仏:polyradiculonévrite inflammatoire démyélinisante chronique
英略語:CIDP
同義語:慢性炎症性脱髄性多発ニューロパチー
慢性炎症性脱髄性多発ニューロパチーは慢性進行性、または再発性の経過を呈する免疫介在性の末梢神経疾患である。多様な臨床病型が含まれており、病態は単一ではないと考えられている。古典的にはマクロファージによる髄鞘の貪食が重要な役割を果たすとされてきたが、近年では傍絞輪部に存在するニューロファシン155などに対するIgG4自己抗体を介したマクロファージを介さない病態が存在することが明らかになっている。第一選択の治療として経静脈的免疫グロブリン療法(IVIg)、副腎皮質ステロイド薬、血液浄化療法があるが、有効性には個人差がある。これらのうち現在最も多く用いられているのはIVIgであるが、一定期間有効であっても再発が多くみられることやIgG4自己抗体陽性例に対する効果が乏しいことを念頭に置く必要がある。繰り返しのIVIgで再発がみられる患者に対しては、病態の再燃による軸索障害などの不可逆的な障害の蓄積を回避するという観点から、再発を未然に防ぐための定期的なIVIgまたは免疫グロブリン製剤の皮下投与による維持療法を行うことが可能になっている。
慢性炎症性脱髄性多発ニューロパチーとは
慢性炎症性脱髄性多発ニューロパチーは慢性進行性、または再発性の経過で筋力低下と感覚障害をきたす後天性の末梢神経疾患である[1][2] [1,2]。発症には免疫性の機序が関与すると推測されているが、十分明らかになっていない部分が多い。再発性の経過を呈する後天性の脱髄性末梢神経障害という概念は1958年にAustinによって提唱され[3] [3]、1975年にDyckらによって慢性進行性や再発性の経過を呈し、左右対称で四肢近位部と遠位部同程度の障害をきたす、いわゆる典型的CIDPの疾患概念が確立された[4] [4]。
現在の日常診療における慢性炎症性脱髄性多発神経炎診断の際には臨床症候と電気生理学的所見が重要視されており、これまでに多くの診断基準が提唱されてきた。中でも有名なものとして、American Academy of Neurology(AAN)の診断基準とEuropean Federation of Neurological Societies/Peripheral Nerve Society(EFNS/PNS)ガイドラインの診断基準の2つがあり[5][6] [5,6]、現在は後者(EFNS/PNS診断基準)が頻用されている。
EFNS/PNS診断基準では先に述べた典型的慢性炎症性脱髄性多発神経炎の他に、非典型的慢性炎症性脱髄性多発神経炎として、遠位部優位型(distal acquired demyelinating symmetric; DADS)、多巣性感覚運動型(multifocal acquired demyelinating sensory and motor neuropathy; MADSAM)、局所型、純粋運動型、および純粋感覚型の5種類の病型を定義している(表1)[6] [6]。多巣性感覚運動型 はEFNS/PNS診断基準が提唱される以前に報告されていたLewis-Sumner症候群と同義であると考えられている[6]。病型別の割合は報告によって異なるが、後方視的な連続106例の検討では、典型的慢性炎症性脱髄性多発神経炎が52%(55例)、遠位部優位型が15%(16例)、多巣性感覚運動型が14%(15例)、局所型が1%(1例)、純粋運動型が4%(4例)、純粋感覚型が14%(15例)であった[7] [7]。
近年、典型的慢性炎症性脱髄性多発神経炎と遠位部優位型の病型を呈する患者の一部で傍絞輪部に存在するニューロファシン155やコンタクチン1に対する自己抗体が検出されることが明らかとなり、これらの抗体陽性例は後述するように従来型の慢性炎症性脱髄性多発神経炎とは異なる病態を有する一群と考えられるようになっている[2] [2]。
| (1) 典型的慢性炎症性脱髄性多発神経炎(typical CIDP) (2) 非典型的慢性炎症性脱髄性多発神経炎(atypical CIDP) |
疫学
我が国における慢性炎症性脱髄性多発神経炎の有病率と発症率は、AANの診断基準を用いて2004年から2005年にかけて行われた全国疫学調査によると、それぞれ10万人あたり1.61人と0.48人であった[8] [8]。AANの診断基準は1991年に典型的慢性炎症性脱髄性多発神経炎を想定して作成されたものであり、2005年に発表され2010年に改訂されたEFNS/PNS診断基準を採用した場合、非典型的慢性炎症性脱髄性多発神経炎が加わることから、これらの数値はより高くなると考えられる。
診断
現在頻用されているEFNS/PNSガイドラインの診断基準では、2ヶ月以上にわたる慢性進行、階段状増悪、あるいは再発型の経過を呈し、左右対称性で近位部と遠位部同程度、すなわちびまん性の四肢筋力低下と感覚異常をきたす病型を典型的慢性炎症性脱髄性多発神経炎と定義している(表2)[6] [6]。慢性炎症性脱髄性多発神経炎の診断にあたっては、典型的慢性炎症性脱髄性多発神経炎に加えて先に述べた非典型的慢性炎症性脱髄性多発神経炎、すなわち遠位部優位型、多巣性感覚運動型、局所型、純粋運動型、純粋感覚型のような臨床病型も念頭に入れながら、末梢神経伝導検査で脱髄を示唆する所見の有無を検討する。EFNS/PNSのガイドラインでは詳細は電気診断基準が定められており、これに基づいて運動神経伝導速度の遅延、終末潜時の延長、伝導ブロック、時間的分散、F波の異常などを見いだすことが重要である(表3)。電気診断基準に加えて脳脊髄液検査、MRI、感覚神経伝導検査、免疫療法に対する反応性、神経生検などの所見が支持基準に含まれており(表4)、これらをあわせて総合的に診断する(表5)。
典型的慢性炎症性脱髄性多発神経炎では感覚障害よりも運動障害が前景に立つ場合が多く、自律神経症候は通常みられない[9] [9]。感覚障害に関しては、四肢のしびれ感を自覚する場合が多いが、痛みを訴えることは少ない。EFNS/PNS診断基準は治療に反応しうる患者を網羅する診断感度への配慮が見られる反面、AAN診断基準に比べて特異度が低く、当初診断基準があてはまっても、後にPOEMS症候群、リンパ腫、家族性アミロイドポリニューロパチーなど、慢性炎症性脱髄性多発神経炎以外の疾患が明らかになる場合もあり注意を要する[10][11][12] [10-12]。これらの疾患では痛みを訴えることが多いため、痛みを伴う脱髄性のニューロパチー患者では慢性炎症性脱髄性多発神経炎以外の疾患の可能性も考慮に入れて原因を精査する必要がある。
| (1) 選択基準 |
|---|
| (a)典型的慢性炎症性脱髄性多発神経炎(typical CIDP) 少なくとも2ヶ月以上かけて慢性・階段状の進行、あるいは再発性の経過を呈する四肢対称性の近位部および遠位部の筋力低下と感覚障害。脳神経が障害されることがある。腱反射は四肢で低下または消失する。 |
| (2) 除外基準 |
| ・ボレリア感染症(ライム病)、ジフテリア、末梢神経障害をきたしうる薬物や毒物への暴露 ・遺伝性脱髄性ニューロパチー |
| (1) Definite: 以下のうち少なくとも1項目を満たす |
|---|
| (a) 2神経以上で遠位潜時が正常上限値の50%以上延長。 (b) 2神経以上で運動神経伝導速度が正常下限値の30%以下に低下。 |
| (2) Probable |
| 脛骨神経以外の遠位部複合筋活動電位振幅が正常下限値の20%以上である2神経で近位部の複合筋活動電位振幅が遠位部と比較して30%以上低下、または1神経でこの基準を満たし他の1神経以上でその他の脱髄所見aのいずれかを満たす。 |
| (3) Possible |
| (1)の基準を1神経のみで満たす。 |
a(a)から(g)で定めた所見
| 1. 脳脊髄液のタンパク質細胞解離(白血球数<10/mm3) 2. MRIでの馬尾、神経根、神経叢のガドリニウム造影効果・腫大 |
| Definite CIDP 臨床診断基準(表2)の1(aまたはb)と2を満たし、電気診断基準(表3)がdefinite;または、 |

(A) 髄鞘を囲む基底膜(矢頭)内には髄鞘の残渣を多量に含んだマクロファージの細胞質がみられる。黒枠の拡大を(B)に示す。(B) マクロファージによる髄鞘の層構造の破壊がみられる。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bars = 2 μm (A) and 0.5 μm (B)。
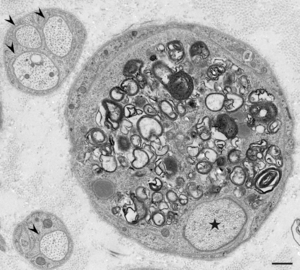
星印で示した有髄線維の軸索はマクロファージによる貪食によって周囲の髄鞘が消失している。正常な無髄線維の軸索を矢頭で示す。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 0.5 μm。
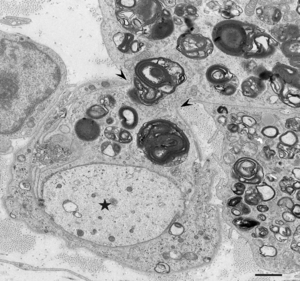
マクロファージは矢頭の部分で有髄線維を囲む基底膜を貫通している。髄鞘が消失した軸索を星印で示す。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 1 μm。
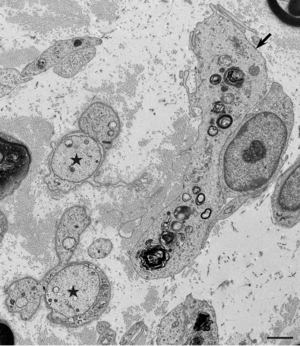
脱髄像を星印で示す。基底膜外のマクロファージ(矢印)の細胞質には髄鞘の残渣が含まれている。CIDP患者の腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bar = 2 μm。
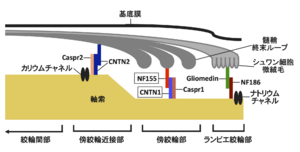
有髄線維は長軸方向にみた場合、ランビエ絞輪部、傍絞輪部、傍絞輪近接部、絞輪間部の4つの部位に区分することができる。ニューロファシン155とコンタクチン1は傍絞輪部に局在しており、軸索膜と髄鞘終末ループを接着させる役割を担っている。Caspr1 = contactin-associated protein 1; Caspr2 = contactin-associated protein 2; CNTN1 = コンタクチン1; CNTN2 = コンタクチン2; NF155 = ニューロファシン155; NF186 = ニューロファシン186.
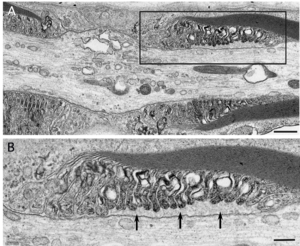
髄鞘の終末ループと軸索の間隙を矢印で示す。(A)の黒枠の拡大を(B)に示す。腓腹神経生検電顕横断像。酢酸ウラン・クエン酸鉛染色。Scale bars = 0.5 μm (A) and 0.2 μm (B)。
病態生理
マクロファージによる脱髄
慢性炎症性脱髄性多発神経炎ではマクロファージによる髄鞘の貪食像が初期から報告されており(図1-4)、これによって生じる脱髄が神経の伝導障害を引き起こすと考えられてきた[1] [1]。腓腹神経生検の検討では、主要な病型である典型的慢性炎症性脱髄性多発神経炎、遠位部優位型、多巣性感覚運動型、純粋感覚型の全てにおいて、全例ではないものの、マクロファージによる髄鞘貪食像が確認されている[7] [7]。これらのうち非典型的慢性炎症性脱髄性多発神経炎、すなわち遠位部優位型、多巣性感覚運動型、純粋感覚型では有髄線維の脱落の程度や、繰り返しの脱髄・再髄鞘化の機転を示唆するオニオンバルブの分布に部位差を認めることが多いのに対し、典型的慢性炎症性脱髄性多発神経炎ではこのような部位差がみられず均一な所見を呈する傾向があることが示されている[7] [7]。このことから、それぞれの病型にはマクロファージに関連した共通の病態を有する患者が含まれており、近位部・中間部・遠位部などの障害部位や髄鞘の修復機転などが臨床的な病型の差異を規定していることが推測される[2] [2]。
マクロファージによる脱髄と自己抗体との関係は十分明らかになっていなかったが、最近になって抗LM1抗体陽性慢性炎症性脱髄性多発神経炎患者の腓腹神経生検で、髄鞘への補体沈着とマクロファージによる髄鞘貪食像がみられたと報告された[13] [13]。LM1は髄鞘に豊富に存在するガングリオシドの一種であり、これに対する抗体はGM1やGD1bなど他のガングリオシドとの複合体に反応するものも含めると全慢性炎症性脱髄性多発神経炎患者の約10%で検出され、抗体陽性例は高齢の男性が多く、典型的慢性炎症性脱髄性多発神経炎の病型を呈し、失調がみられる頻度が高いといわれている[14] [14]。
IgG4自己抗体による傍絞輪部の解離
近年になってニューロファシン155やコンタクチン1などの傍絞輪部に局在するタンパク質に対する自己抗体による、古典的なマクロファージを介さない病態も存在することが明らかとなり注目を集めている(図5)[15] [15]。なかでも傍絞輪部において髄鞘の終末ループと軸索を接着させる機能をもつニューロファシン155に対する抗体陽性例は慢性炎症性脱髄性多発神経炎患者全体の5-10%程度を占めており[15][16] [15,16]、若年で発症する傾向があり、感覚性運動失調や振戦が高率にみられ、経静脈的免疫グロブリン(IVIg)療法に対して抵抗性であるなどの特徴を有することが明らかになっている[16][17] [16,17]。抗ニューロファシン155抗体陽性例の腓腹神経生検の検討では、マクロファージによる髄鞘の貪食像やオニオンバルブがみられないことなど、従来から報告されてきた古典的な慢性炎症性脱髄性多発神経炎の病理像とは異なる病理所見を呈することが明らかになっている[15] [15]。電子顕微鏡による神経の縦断像の検討では、抗ニューロファシン155抗体陽性例では傍絞輪部における髄鞘の終末ループと軸索間の離開がみられ(図6)、抗体の沈着によってニューロファシン155が両者を接着させる機能が失われていることが示されている[15] [15]。本抗体の主な免疫グロブリンサブクラスはIgG4であり[16][17] [16,17]、IgG4に対する抗体を用いた抗ニューロファシン155抗体陽性例の腓腹神経の免疫染色ではIgG4の傍絞輪部への沈着が確認されている[15] [15]。IgG4沈着部位には補体の沈着がみられないことから[15] [15]、IgG4自己抗体が補体を介した炎症反応を惹起することなく標的抗原の機能を阻害して神経の伝導障害を惹起していると推測される。
治療
従来型の治療戦略
慢性炎症性脱髄性多発神経炎患者に対する第一選択の治療としてはIVIg、副腎皮質ステロイド薬、血液浄化療法があり、効果は同等と言われている[9]。その他の補足的治療としては、シクロホスファミド、アザチオプリン、シクロスポリン、メトトレキサート、インターフェロンβ、ミコフェノール酸モフェチルなどの有効性を示唆する報告があるが、第一選択治療のうち一つの治療が無効と判断された場合でも他の第一選択の治療が有効な症例が報告されていることから、原則としてこれらの補足的治療を考慮する前に、他の第一選択治療を試みることが推奨されている[9] [9]。
第一選択治療のうち、IVIgは比較的簡便に行えることから、近年は慢性炎症性脱髄性多発神経炎患者に対する最初の治療として最も多く用いられている。 IVIgの作用機序に関しては十分明らかになっていないが、抗体の中和、補体活性化の抑制、マクロファージに発現するFc受容体に対する作用、サイトカインプロフィールの変化などが関与していると考えられている[2] [2]。通常は400mg/kg体重を1日量として5日間の連日点滴静注を行うが、効果が早く発現し、場合によっては5日間の投与中でも病状の進行の停止や改善がみられることがある。しかしながらIVIgに対しては一定の割合で無効例が存在することと、再発を繰り返す患者も多いことも念頭におく必要がある[18] [18]。1回目の投与で明らかな効果がみられない場合でも2回目の投与で初めて有効性を示すこともあることから、無効と判断するには2回までの投与は試みる価値はあるとされている[9][9]。副腎皮質ステロイド薬に関しては通常プレドニゾロンを1日あたり60mgまたは1mg/kg体重(小児では1-1.5 mg/kg体重)経口投与から開始し、ゆっくり減量する方法がとられる[9][9]。ステロイドパルス療法も同等の効果があると言われており、経口ステロイド薬の内服開始前に経静脈的メチルプレドニゾロンパルス療法が行われることもある[9][9]。
病型による治療反応性の違い
先に述べた通り慢性炎症性脱髄性多発神経炎には多様な病型が含まれている。例えば、EFNS/PNS診断基準が定義する典型的慢性炎症性脱髄性多発神経炎、遠位部優位型、多巣性感覚運動型、局所型、純粋運動型、および純粋感覚型の6病型を規定する病態の差異に関しては明らかになっていないため、これら6病型全てに同一の治療方針を適用するべきかどうかに関しては今後の知見の積み重ねが必要である。後方視的な検討では遠位部優位型と多巣性感覚運動型 のIVIgに対する治療反応性は典型的慢性炎症性脱髄性多発神経炎 と比較して不良であったとされている[19][20] [19,20]。また、純粋運動型に関してはステロイドによる治療で悪化したという報告があり注意を要する[9][9]。抗ニューロファシン155抗体のようなIgG4自己抗体陽性例ではIVIgに対する反応性が乏しい反面、副腎皮質ステロイド薬や血漿浄化療法は有効とされている[2] [2]。血漿浄化療法を選択する際には一般的な免疫吸着療法はIgG4を吸着しにくいことを考慮にいれる必要がある[21] [21]。また、これらの抗体陽性例に対してはリツキシマブの有効性が示唆されている[22] [22]。
新たな治療戦略
慢性炎症性脱髄性多発神経炎では末梢神経の髄鞘をマクロファージが貪食することによって生じる脱髄や、抗ニューロファシン155抗体や抗コンタクチン1抗体などのIgG4自己抗体による傍絞輪部の髄鞘と軸索間の離開が病態の中で重要な役割を果たしていると推測されるが、このような脱髄や離開に伴って軸索障害も生じることが知られている[15] [15]。このような、いわゆる二次性の軸索障害が目立つ患者では筋萎縮が出現し、治療への反応性が不良となることが示唆されている[23][24] [23,24]。現在頻用されているIVIgは効果があっても再発することが多く、その都度IVIgを施行することが多かったが、このような治療戦略では反復する末梢神経障害の蓄積により徐々に不可逆的な軸索障害が生じることが予想される[25] [25]。このことから、患者の長期的な機能予後を考慮して、症状が再発してから対処するのではなく、病態の再燃を未然に防いで障害の蓄積を回避するという治療戦略、すなわち維持療法の有用性が提唱されるようになり[26] [26]、現在では運動機能低下の進行抑制のための維持療法、すなわち3週間ごとのIVIg反復投与(1000mg/kg体重を1日または500mg/kg体重を2日間連日)が再発性の慢性炎症性脱髄性多発神経炎患者に対する重要な治療の選択肢となっている[27] [27]。また、高濃度(20%)の免疫グロブリン製剤の皮下投与(1週間あたり200-400mg/kg体重を1日または連続する2日で分割投与)も維持療法として有効であることが示されており[28] [28]、我が国でも保健適用となっている。
参考文献
- ↑ 1.0 1.1
Koike, H., Nishi, R., Ikeda, S., Kawagashira, Y., Iijima, M., Katsuno, M., & Sobue, G. (2018).
Ultrastructural mechanisms of macrophage-induced demyelination in CIDP. Neurology, 91(23), 1051-1060. [PubMed:30429275] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4
Koike, H., & Katsuno, M. (2020).
Pathophysiology of Chronic Inflammatory Demyelinating Polyneuropathy: Insights into Classification and Therapeutic Strategy. Neurology and therapy, 9(2), 213-227. [PubMed:32410146] [PMC] [WorldCat] [DOI] - ↑
AUSTIN, J.H. (1958).
Recurrent polyneuropathies and their corticosteroid treatment; with five-year observations of a placebo-controlled case treated with corticotrophin, cortisone, and prednisone. Brain : a journal of neurology, 81(2), 157-92. [PubMed:13572689] [WorldCat] [DOI] - ↑
Dyck, P.J., Lais, A.C., Ohta, M., Bastron, J.A., Okazaki, H., & Groover, R.V. (1975).
Chronic inflammatory polyradiculoneuropathy. Mayo Clinic proceedings, 50(11), 621-37. [PubMed:1186294] [WorldCat] - ↑
(1991).
Research criteria for diagnosis of chronic inflammatory demyelinating polyneuropathy (CIDP). Report from an Ad Hoc Subcommittee of the American Academy of Neurology AIDS Task Force. Neurology, 41(5), 617-8. [PubMed:2027473] [WorldCat] - ↑ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7
Joint Task Force of the EFNS and the PNS (2010).
European Federation of Neurological Societies/Peripheral Nerve Society Guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society--First Revision. Journal of the peripheral nervous system : JPNS, 15(1), 1-9. [PubMed:20433600] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Ikeda, S., Koike, H., Nishi, R., Kawagashira, Y., Iijima, M., Katsuno, M., & Sobue, G. (2019).
Clinicopathological characteristics of subtypes of chronic inflammatory demyelinating polyradiculoneuropathy. Journal of neurology, neurosurgery, and psychiatry, 90(9), 988-996. [PubMed:31227562] [WorldCat] [DOI] - ↑
Iijima, M., Koike, H., Hattori, N., Tamakoshi, A., Katsuno, M., Tanaka, F., ..., & Refractory Peripheral Neuropathy Study Group of Japan (2008).
Prevalence and incidence rates of chronic inflammatory demyelinating polyneuropathy in the Japanese population. Journal of neurology, neurosurgery, and psychiatry, 79(9), 1040-3. [PubMed:18223015] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3 9.4 9.5 9.6 慢性炎症性脱髄性多発根ニューロパチー、多巣性運動ニューロパチー診療ガイドライン 2013.東京, 南光堂 2013
- ↑
Koike, H., Iijima, M., Mori, K., Yamamoto, M., Hattori, N., Watanabe, H., ..., & Sobue, G. (2008).
Neuropathic pain correlates with myelinated fibre loss and cytokine profile in POEMS syndrome. Journal of neurology, neurosurgery, and psychiatry, 79(10), 1171-9. [PubMed:18356256] [WorldCat] [DOI] - ↑
Koike, H., Hashimoto, R., Tomita, M., Kawagashira, Y., Iijima, M., Tanaka, F., & Sobue, G. (2011).
Diagnosis of sporadic transthyretin Val30Met familial amyloid polyneuropathy: a practical analysis. Amyloid : the international journal of experimental and clinical investigation : the official journal of the International Society of Amyloidosis, 18(2), 53-62. [PubMed:21463231] [WorldCat] [DOI] - ↑
Tomita, M., Koike, H., Kawagashira, Y., Iijima, M., Adachi, H., Taguchi, J., ..., & Sobue, G. (2013).
Clinicopathological features of neuropathy associated with lymphoma. Brain : a journal of neurology, 136(Pt 8), 2563-78. [PubMed:23884813] [WorldCat] [DOI] - ↑
Koike, H., Ikeda, S., Fukami, Y., Nishi, R., Kawagashira, Y., Iijima, M., ..., & Sobue, G. (2020).
Complement deposition and macrophage-induced demyelination in CIDP with anti-LM1 antibodies. Journal of the neurological sciences, 408, 116509. [PubMed:31698166] [WorldCat] [DOI] - ↑
Kuwahara, M., Suzuki, H., Samukawa, M., Hamada, Y., Takada, K., & Kusunoki, S. (2013).
Clinical features of CIDP with LM1-associated antibodies. Journal of neurology, neurosurgery, and psychiatry, 84(5), 573-5. [PubMed:23138763] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2 15.3 15.4 15.5 15.6
Koike, H., Kadoya, M., Kaida, K.I., Ikeda, S., Kawagashira, Y., Iijima, M., ..., & Sobue, G. (2017).
Paranodal dissection in chronic inflammatory demyelinating polyneuropathy with anti-neurofascin-155 and anti-contactin-1 antibodies. Journal of neurology, neurosurgery, and psychiatry, 88(6), 465-473. [PubMed:28073817] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Kadoya, M., Kaida, K., Koike, H., Takazaki, H., Ogata, H., Moriguchi, K., ..., & Ikewaki, K. (2016).
IgG4 anti-neurofascin155 antibodies in chronic inflammatory demyelinating polyradiculoneuropathy: Clinical significance and diagnostic utility of a conventional assay. Journal of neuroimmunology, 301, 16-22. [PubMed:27852440] [WorldCat] [DOI] - ↑ 17.0 17.1
Ogata, H., Yamasaki, R., Hiwatashi, A., Oka, N., Kawamura, N., Matsuse, D., ..., & Kira, J. (2015).
Characterization of IgG4 anti-neurofascin 155 antibody-positive polyneuropathy. Annals of clinical and translational neurology, 2(10), 960-71. [PubMed:26478896] [PMC] [WorldCat] [DOI] - ↑
Iijima, M., Tomita, M., Morozumi, S., Kawagashira, Y., Nakamura, T., Koike, H., ..., & Sobue, G. (2009).
Single nucleotide polymorphism of TAG-1 influences IVIg responsiveness of Japanese patients with CIDP. Neurology, 73(17), 1348-52. [PubMed:19776380] [WorldCat] [DOI] - ↑
Kuwabara, S., Isose, S., Mori, M., Mitsuma, S., Sawai, S., Beppu, M., ..., & Misawa, S. (2015).
Different electrophysiological profiles and treatment response in 'typical' and 'atypical' chronic inflammatory demyelinating polyneuropathy. Journal of neurology, neurosurgery, and psychiatry, 86(10), 1054-9. [PubMed:25424435] [WorldCat] [DOI] - ↑
Doneddu, P.E., Cocito, D., Manganelli, F., Fazio, R., Briani, C., Filosto, M., ..., & Italian CIDP Database study group (2019).
Atypical CIDP: diagnostic criteria, progression and treatment response. Data from the Italian CIDP Database. Journal of neurology, neurosurgery, and psychiatry, 90(2), 125-132. [PubMed:30297520] [WorldCat] [DOI] - ↑
Kuwahara, M., Suzuki, H., Oka, N., Ogata, H., Yanagimoto, S., Sadakane, S., ..., & Kusunoki, S. (2018).
ELectron microscopic abnormality and therapeutic efficacy in chronic inflammatory demyelinating polyneuropathy with anti-neurofascin155 immunoglobulin G4 antibody. Muscle & nerve, 57(3), 498-502. [PubMed:28796305] [WorldCat] [DOI] - ↑
Shimizu, S., Iijima, M., Fukami, Y., Tamura, N., Nakatochi, M., Ando, M., ..., & Katsuno, M. (2020).
Efficacy and Safety of Rituximab in Refractory CIDP With or Without IgG4 Autoantibodies (RECIPE): Protocol for a Double-Blind, Randomized, Placebo-Controlled Clinical Trial. JMIR research protocols, 9(4), e17117. [PubMed:32234705] [PMC] [WorldCat] [DOI] - ↑
Iijima, M., Yamamoto, M., Hirayama, M., Tanaka, F., Katsuno, M., Mori, K., ..., & Sobue, G. (2005).
Clinical and electrophysiologic correlates of IVIg responsiveness in CIDP. Neurology, 64(8), 1471-5. [PubMed:15851750] [WorldCat] [DOI] - ↑
Ohyama, K., Koike, H., Katsuno, M., Takahashi, M., Hashimoto, R., Kawagashira, Y., ..., & Sobue, G. (2014).
Muscle atrophy in chronic inflammatory demyelinating polyneuropathy: a computed tomography assessment. European journal of neurology, 21(7), 1002-10. [PubMed:24684299] [WorldCat] [DOI] - ↑
Lin, C.S., Krishnan, A.V., Park, S.B., & Kiernan, M.C. (2011).
Modulatory effects on axonal function after intravenous immunoglobulin therapy in chronic inflammatory demyelinating polyneuropathy. Archives of neurology, 68(7), 862-9. [PubMed:21747028] [WorldCat] [DOI] - ↑
Hughes, R.A., Donofrio, P., Bril, V., Dalakas, M.C., Deng, C., Hanna, K., ..., & ICE Study Group (2008).
Intravenous immune globulin (10% caprylate-chromatography purified) for the treatment of chronic inflammatory demyelinating polyradiculoneuropathy (ICE study): a randomised placebo-controlled trial. The Lancet. Neurology, 7(2), 136-44. [PubMed:18178525] [WorldCat] [DOI] - ↑
Kuwabara, S., Misawa, S., Mori, M., Iwai, Y., Ochi, K., Suzuki, H., ..., & Glovenin-I MMN Study Group (2018).
Intravenous immunoglobulin for maintenance treatment of multifocal motor neuropathy: A multi-center, open-label, 52-week phase 3 trial. Journal of the peripheral nervous system : JPNS, 23(2), 115-119. [PubMed:29635876] [PMC] [WorldCat] [DOI] - ↑
van Schaik, I.N., van Geloven, N., Bril, V., Hartung, H.P., Lewis, R.A., Sobue, G., ..., & PATH study group (2016).
Subcutaneous immunoglobulin for maintenance treatment in chronic inflammatory demyelinating polyneuropathy (The PATH Study): study protocol for a randomized controlled trial. Trials, 17(1), 345. [PubMed:27455854] [PMC] [WorldCat] [DOI]