「銅・亜鉛-スーパーオキシドディスムターゼ」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の3版が非表示) | |||
| 9行目: | 9行目: | ||
英略語:Cu/Zn-SOD, SOD1 | 英略語:Cu/Zn-SOD, SOD1 | ||
{{box|text= | {{box|text= 銅・亜鉛スーパーオキシドディスムターゼは、スーパーオキシドアニオンラジカルを酸素と過酸化水素に変換する抗酸化酵素の一つで、生体を酸化ストレスから守る役目を果たしている。SOD1をコードする遺伝子の変異は筋萎縮性側索硬化症 (ALS) を来たし、家族性ALSの20%に存在する。変異SOD1を高発現させたマウスはALS症状を示すが、SOD1を欠損させたマウスはALSとは異なる表現型を示す。}} | ||
== 発見の歴史 == | == 発見の歴史 == | ||
| 145行目: | 145行目: | ||
その2歳と6歳の患者は進行性の運動失調を伴う[[精神運動遅滞]]、[[過剰驚愕症]]([[びっくり病]])、[[痙性麻痺]]、[[耳介]]低位などの症状がみられており、SOD1の機能喪失とALS病態の関わりを再考する症例となっている<ref name=Park2019><pubmed>31332433</pubmed></ref><ref name=Andersen2019><pubmed>31314961</pubmed></ref>。これらの症例の家族にALS症状は見られていないものの、SOD1の機能喪失によるのかC末端が欠失したSOD1タンパク質の影響なのかも議論の余地がある。 | その2歳と6歳の患者は進行性の運動失調を伴う[[精神運動遅滞]]、[[過剰驚愕症]]([[びっくり病]])、[[痙性麻痺]]、[[耳介]]低位などの症状がみられており、SOD1の機能喪失とALS病態の関わりを再考する症例となっている<ref name=Park2019><pubmed>31332433</pubmed></ref><ref name=Andersen2019><pubmed>31314961</pubmed></ref>。これらの症例の家族にALS症状は見られていないものの、SOD1の機能喪失によるのかC末端が欠失したSOD1タンパク質の影響なのかも議論の余地がある。 | ||
SOD1ノックアウトマウスはALS症状を示さず一見正常に生育するものの雌の不妊が見つかり<ref name=Reaume1996><pubmed>8673102</pubmed></ref>、その後多くの異常が報告されるようになった。SOD1は赤血球に多く発現しているため、その欠損は[[溶血性貧血]]を引き起こし<ref name=Iuchi2007><pubmed>17059387</pubmed></ref>、腎臓や肝臓に鉄が蓄積すると考えられる<ref name=Yoshihara2012><pubmed>22435664</pubmed></ref><ref name= | SOD1ノックアウトマウスはALS症状を示さず一見正常に生育するものの雌の不妊が見つかり<ref name=Reaume1996><pubmed>8673102</pubmed></ref>、その後多くの異常が報告されるようになった。SOD1は赤血球に多く発現しているため、その欠損は[[溶血性貧血]]を引き起こし<ref name=Iuchi2007><pubmed>17059387</pubmed></ref>、腎臓や肝臓に鉄が蓄積すると考えられる<ref name=Yoshihara2012><pubmed>22435664</pubmed></ref><ref name=Yoshihara2016><pubmed>27629432</pubmed></ref>。また、普通食でも脂肪肝から肝硬変になり<ref name=Uchiyama2006><pubmed>16921198</pubmed></ref><ref name=Sakiyama2016><pubmed>26981929</pubmed></ref>、高齢になると肝腫瘍が発生する<ref name=Elchuri2005><pubmed>15531919</pubmed></ref>。さらに、[[難聴]]<ref name=McFadden1999><pubmed>10466888</pubmed></ref>、骨減少症<ref name=Nojiri2011><pubmed>22025246</pubmed></ref>、[[骨格筋]]の萎縮<ref name=Muller2006><pubmed>16716900</pubmed></ref>、[[皮膚萎縮症]]<ref name=Murakami2009><pubmed>19289104</pubmed></ref>、[[加齢黄斑変性]]<ref name=Imamura2006><pubmed>16844785</pubmed></ref>などの老化症状が見られている。[[アルツハイマー病]]モデルマウスと掛け合わせると認知機能がさらに低下することも報告されている<ref name=Murakami2011><pubmed>22072713</pubmed></ref>]。またSOD1ノックアウトマウスは行動異常を起こし、[[大脳]]では[[ドーパミントランスポーター]]の発現が上昇していることが観察されている<ref name=Yoshihara2016><pubmed>27629432</pubmed></ref>。 | ||
== 関連項目 == | == 関連項目 == | ||
2021年3月11日 (木) 23:10時点における版
藤原範子
兵庫医科大学医学部医学科生化学
DOI:10.14931/bsd.9795 原稿受付日:2021年1月14日 原稿完成日:2021年3月11日
担当編集委員:漆谷 真(滋賀医科大学 医学部 脳神経内科)
英:Cu/Zn-superoxide dismutase
英略語:Cu/Zn-SOD, SOD1
銅・亜鉛スーパーオキシドディスムターゼは、スーパーオキシドアニオンラジカルを酸素と過酸化水素に変換する抗酸化酵素の一つで、生体を酸化ストレスから守る役目を果たしている。SOD1をコードする遺伝子の変異は筋萎縮性側索硬化症 (ALS) を来たし、家族性ALSの20%に存在する。変異SOD1を高発現させたマウスはALS症状を示すが、SOD1を欠損させたマウスはALSとは異なる表現型を示す。
発見の歴史
銅と亜鉛を含有するSOD(SOD1)は1969年にMcCordとFridovichによって同定された[1]。1930年代にウシの肝臓やヒト血液等から精製されていた薄青色の機能不明な銅タンパク質が見出されていたが、これらの銅タンパク質とSOD1が同一のタンパク質であることが触媒機構とともに証明された[1]。SOD1はサブユニットあたり1分子ずつのCuとZnを持つ二量体(32 kDa)(図1A)で、あらゆる細胞に存在するが、特に肝臓と赤血球に多く発現している。
1970年にマンガンを含むMn-SOD(SOD2)が大腸菌で発見され[2]、ニワトリ肝臓からも精製された[3]。SOD2はMnを活性部位に持つ四量体(88 kDa)で、あらゆる細胞のミトコンドリアマトリックスに存在している。1973年には鉄を含有するFe-SODが大腸菌中で発見された[4]。Fe-SODは最も古い形のSODと考えられている。
1982年になって、ヒトの血清から、SOD1と同じく銅と亜鉛を含み、シアンに阻害されるがSOD1抗体には反応しない第4のSOD(細胞外SOD, extracellular-SOD, SOD3)が発見された[5][6]]。SOD3はサブユニットあたり1分子ずつのCuとZnを持つ四量体(135 kDa)で、SOD1と60%の相同性を持ち、ヘパリン結合性の糖タンパク質である。立体構造もSOD1ダイマーを2つ重ね合わせた構造を有するが、血管内皮細胞や気管上皮細胞で多く発現し、細胞外に分泌されている。
なお、SOD1は大腸菌のような原核生物や酵母、カビにも存在している。嫌気性細菌にもSODがあり、酸素が地球上に発生する前(30億年前)から生物はSODを獲得していたことがわかっている。嫌気性のメタン菌や硫酸還元菌はFe-SODをもっており、好気性の非硫黄細菌はMn-SODをもっている。Mn-SODとFe-SODはほぼ同一の活性中心と50%近い配列相同性を有しており、よく似た性質をもつ[7]。微生物の中にはニッケルを含有するNi-SODをもつものもある[8]。
アイソザイム
ヒトではCu,Zn-SOD(SOD1)、Mn-SOD(SOD2)、 EC-SOD(SOD3)の3種類のSODアイソザイムが存在し、それぞれ、主に細胞質、ミトコンドリア、細胞外に局在して抗酸化作用を発揮している(表)。SOD2の欠損マウスだけが出生直後に致死となることから、SODアイソザイムの中で最も重要であるといえる[9]。
| Cu/Zn-SOD (SOD1) | Mn-SOD (SOD2) | EC-SOD (SOD3) | |
|---|---|---|---|
| 分布 | 細胞質 | ミトコンドリア | 細胞外腔 |
| 分子量(オリゴマーあたり) | 32,000 | 88,000 | 135,000 |
| サブユニット | 二量体 | 四量体 | 四量体 |
| 金属含量(原子/サブユニット) | 1Cu, 1Zn | 1Mn | 1Cu, 1Zn |
| 染色体 | 21q22 | 6q21 | 4pter-q21 |
| 特徴 | 遺伝子変異がALSの原因 | サイトカインによって誘導 | ヘパリン親和性 分泌性 糖タンパク質 |
| KOマウス | 溶血性貧血、脂肪肝、肝癌、骨密度・筋肉量低下 | 新生児期に死亡 | 見かけは正常 高酸素状態に弱い |
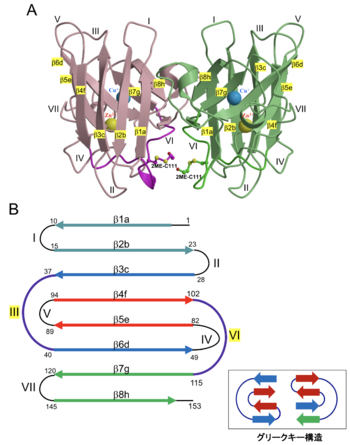
A. Cys111に2-メルカプトエタノール修飾させた野生型SOD1の立体構造(PDB: 3T5Wを改変) 2-メルカプトエタノールの有無に関わらず、野生型SOD1結晶構造のCys111付近は非対称で向き合う構造が多く、ALS変異型SOD1では対称になっている場合が多い[10]。
B. SOD1のβストランドとループ構造の模式図 同じ色のβストランドが水素結合により、逆平行βシートを形成する。SOD1のアミノ酸配列から見たβストランドはa, b, c, d. e. f. g. hの順に並んでいる。SOD1ではグリークキー (Greek key) 構造 が2つ存在する。この構造は、隣接する4本の逆平行βストランドとそれらを連結するループで構成され、このうちの3本はヘアピン構造で結合している。1番目のβストランドに隣接する4番目のβストランドは、グリークキーループ (SOD1ではループIIIとループVI) によって3番目のストランドと結合している。
構造
SOD1の分子量は生物種によって多少異なるが、サブユニットあたり約16,000 (アミノ酸残基:151から155個)で、ヒトSOD1は153個のアミノ酸残基を有している。
N末端のメチオニン残基は脱落し、アセチル化されたアラニン残基から始まっている。そのためSOD1のアミノ酸残基の番号は、ヒトSOD1のアミノ酸配列を基本とし、アラニンを1番目として表記されている(メチオニンを1番目とする表記法もある)。例えば家族性ALSの変異を表すG37Rは、アラニンから数えて37番目のグリシンがアルギニンに変異したことを表している。
SOD1は分子量も小さく安定であることから非常に多くの立体構造が決定されており、Protein Databankに登録されている(図1A)。SOD1サブユニットは8本のβストランドが逆平行βシートを形成しており、グリークキー構造を2つ有したβバレル構造である(図1B)。グリークキー構造は隣接する4本の逆平行βストランドとそれらを連結するループで構成され、このうちの3本はヘアピン構造で結合している。1番目のβストランドに隣接する4番目のβストランドは、グリークキーループによって3番目のストランドと結合している。SOD1では、ループIIIとループVIがグリークキーループと呼ばれる。グリークキー構造はギリシャ美術で見られる雷門模様に似ていることから命名された。
SOD1のサブユニット同士のダイマー化は疎水性アミノ酸残基間の相互作用と主鎖同士の水素結合から成り立っている。またサブユニットあたり酵素活性に必須であるCuイオンと酵素の構造安定性に寄与するZnイオンを1つずつ配位している。金属の配位とサブユニット内に1ヶ所あるジスルフィド結合(Cys57-Cys146)はSOD1タンパク質の安定性に大きく寄与している。
システイン残基
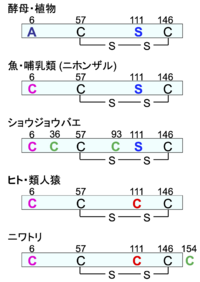
図2は進化の過程におけるSOD1のシステイン残基の位置を示したものである。SOD1構造の維持に重要なCys57とCys146の分子内S-S結合は存在しており、種を超えて完全に保存されている。一方、進化の過程でフリー(S-S結合していない)のシステイン残基は増えてきた。ヒトSOD1のCys6に相当する6番目のアミノ酸は酵母や植物ではアラニンで、ヒトのCys111に相当するアミノ酸はセリンになっている。魚類やニホンザルを含む哺乳類のSOD1では6番目のアミノ酸がフリーのシステインに変異し、ヒト・類人猿およびニワトリのSOD1は111番目もフリーのシステインを持つようになった。
なお、ショウジョウバエやニワトリのSOD1はフリーのシステイン残基を余分に持つ。大きな脳をもつ高等動物や酸素を大量に消費する飛行を行う昆虫と鳥類は多くの酸化ストレスに曝されることから、フリーのシステイン残基のチオール基(SH)による抗酸化作用が必要になってきたと考えられる。しかし、フリーのシステイン残基は反応性が高く酸化されやすいため、SOD1タンパク質自体にとっては有利なことではない。特にグリークキーループVIに存在するCys111は非常に酸化されやすく、スルフォン酸への不可逆的酸化[11]や分子間ジスルフィド結合[12]が起こり、ミスフォールディングや凝集に進む。このCys111を2-メルカプトエタノール(2-ME)(図1A)[10]やシステイン[13]などでブロックすると酸化による分解や凝集を防ぐことができる。
機能
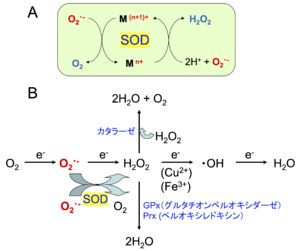
A. SODの酵素反応 SODの活性中心では金属イオン(M)の酸化還元を利用してスーパーオキシドを酸素への酸化と過酸化水素への還元を行っている。
B. 酸素から水への還元時における活性酸素の発生と各抗酸化酵素の働き。
酵素活性
好気性生物の細胞内呼吸であるミトコンドリアの電子伝達系からは、酸素が不完全に還元されたスーパーオキシドアニオンラジカル(以下スーパーオキシド)が漏れ出ている。SODは最初のラジカル消去に働く最も重要な抗酸化酵素である。
SODはスーパーオキシドを過酸化水素と酸素に変換する不均化反応 『 2O2・- + 2H+ → O2 + H2O2 』 を触媒する。不均化反応とは、同一種の基質が2種類以上の異なる種類の生成物を与える化学反応のことである。SOD1の場合は、2価の銅イオンがO2・-をO2に酸化して銅イオンは1価になり、その1価の銅イオンがO2・-をH2O2に還元して銅イオンは2価に戻ることを繰り返している。活性中心がFe (3価 ⇔ 2価)やMn (3価 ⇔ 2価)でも同様の触媒機構が働いている(図3A)。
銅イオンや鉄イオンが存在すると過酸化水素と反応してより毒性の高いヒドロキシラジカル(・OH)ができてしまうので、生成した過酸化水素はカタラーゼやグルタチオンペルオキシダーゼなどによって水にまで還元される(図3B)。
電子伝達系以外にキサンチンオキシダーゼやNADPHオキシダーゼによってもスーパーオキシドは産生される。
ミトコンドリア呼吸抑制能
SOD1はミトコンドリアから漏出するスーパーオキシドの消去以外に、ミトコンドリアの酸素呼吸そのものを低下させる役割を持つことが明らかになってきた[14][15]。Lys122残基(図4, ALS変異未定)のアセチル化がSOD1の酵素活性には影響せずにSOD1がもつミトコンドリア呼吸抑制能を低下させることも報告されている[16]。多くの代謝酵素や転写因子のリシン残基のアセチル化やスクシニル化がミトコンドリア呼吸をはじめとする細胞内代謝を制御することがわかってきており[17]、SOD1のアセチル化もその一つだと考えられている。
転写制御因子としての作用
SOD1が酸化ストレス刺激で核内に入り、DNAに結合し、DNA修復遺伝子、ALSに関係する遺伝子、がん遺伝子やCu/Fe恒常遺伝子などの発現を制御する機能が報告されている[18][19]。
分泌SOD1のパラクライン作用
細胞質に存在するSOD1が小胞体(ER)-ゴルジ体経路で細胞外に輸送され[20]、特に変異SOD1はクロモグラニンBと結合して分泌され細胞毒性に関与していることが報告された[21]。さらに、細胞外のカリウムイオンによって誘導された脱分極によってSOD1が細胞外に分泌されること[22]や神経細胞においてSOD1がムスカリン性アセチルコリン受容体を介してERK1/2とAKTを活性化すること[23]が報告されている。
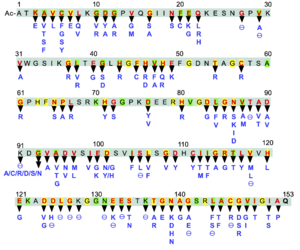
θは終止コドンやフレームシフト変異、インサートによってSOD1全長が変化している欠失変異を表している。 黄色マーカーは酵母、植物、魚類、他の哺乳動物でも保存されたアミノ酸残基を示し、黄緑色マーカーは魚類や哺乳動物など脊椎動物で保存されているアミノ酸残基を示している。
疾患との関わり
筋萎縮性側索硬化症
SOD1変異
1993年に家族性ALSの原因遺伝子として最初に同定されたのがSOD1である[24][25]。当初はSOD1活性の低下がALSの原因になると考えられたが、SOD1ノックアウトマウスはALS症状を示さず[26]、変異SOD1の高発現マウスがALS症状を示したことで、その考えは否定された。全ALS患者の2%程度がSOD1遺伝子の変異によるものと推定されている。
執筆時点(2021年3月)で153個のアミノ酸残基から成るサブユニットに180個以上の点変異やC末端を欠損するフレームシフト変異が報告されている(図4)[Amyotrophic Lateral Sclerosis online Database]。ALSを引き起こす変異はあらゆる場所に起こっているが、真核生物間でよく保存されているアミノ酸残基での変異がALS変異になる傾向が高い。あまり保存されていないループIIからβ3cストランド(K23~K36)及びループIV(F50~E78)には比較的ALS変異が少ない(図1、4)。
構成するアミノ酸残基による違いも見られ、システイン残基は4ヶ所すべてにおいてALS変異が見つかっている。SOD1に多く存在するグリシン残基は25ヶ所あるが、そのうち15ヶ所でALS変異が見つかっており、変異率は60%である。G37R、G85R、G93Aは早期に発見されたALS変異で、ALSモデルマウスが作製されている。特にGly93においてはAla以外に5種類のアミノ酸変異が報告されている。14ヶ所あるバリン残基も10ヶ所でALS変異が見つかっており、変異率は70%に上る。一方、11ヶ所あるリシン残基の点変異は1ヶ所(K3E)のみで、フレームシフトなどによる欠失変異が3ヶ所見つかっている。
SOD1のミスフォールディングと凝集
SOD1が酵素タンパク質として機能を発揮するには、金属(CuとZn)の配位、Cys57とCys146のジスルフィド結合、そしてサブユニット同士のダイマー化という翻訳後修飾過程が必要である。この翻訳後修飾を失わせるような処理、つまり、金属を除いてジスルフィド結合を還元すると、野生型SOD1であってもモノマーになり凝集化やアミロイド化が起こり[27]、高濃度のSOD1アミロイドはヒドロゲルを形成する[28]。
ALS変異SOD1は野生型SOD1よりも金属がはずれやすくジスルフィド結合も還元されやすいため[29]、熱安定性が低くプロテアーゼの攻撃を受けやすい[30]。そのため、ALS変異SOD1はモノマーになりやすく凝集体やアミロイドになりやすい性質を有している[31][32][33]。一方、SOD1は酸化処理によってもアミロイド形成や凝集が起こる[34]。
酸化ストレスと神経変性疾患との関係はアルツハイマー病やパーキンソン病でも示唆されているが、SOD1自体の酸化修飾もALS病態に関与している可能性がある[11][35]。ALSにおける酸化ストレス軽減のために、ラジカル消去剤であるエダラボン(ラジカット)が2番目のALS治療薬として認可された。また、SOD1の凝集が運動神経細胞死に関わっているかは議論の余地がある。最近は凝集体よりもミスフォールディングした可溶性SOD1の方に細胞毒性があると報告されている[36][37]。
ALSモデル動物
家族性ALSで見つかったSOD1の変異遺伝子を高発現させたマウス(変異SOD1トランスジェニックマウス、変異SOD1 tgマウス)がALSと同様の症状を示した[38]ことから、多くの変異SOD1を高発現させたマウスやラットがALSモデル動物として作製された。
ALSの進行や病態の解析、発症機構の解明、治療方法の開発などに利用され、ALSの研究は大きく飛躍した。長年唯一のALS治療薬として使用されてきたリルゾールは、神経毒性を示す興奮性神経伝達物質のグルタミン酸の遊離阻害作用をもつ。実際、変異SOD1 tgマウスを用いた研究では、グルタミン酸を再取込みするグルタミン酸トランスポーター1 (GLT1) の発現量が低下し、ALS発症前からグルタミン酸量が多くなっていること[39]やイオノマイシン処理などの刺激で放出されるグルタミン酸量が野生型SOD1 tgマウスよりも多いこと[40]が報告されている。しかし、GLT1を過剰発現させてもG93A tgマウスの生存期間に変化は見られなかった[41]。
ALSモデル動物の研究により、変異の種類によってALSの発症時期や罹病期間が異なることや、変異SOD1の発現量が多いほどALSの発症が早くなり罹病期間が短くなる(生存期間が短い)ことがわかってきた。またALS患者同様、病変部位である脊髄前角細胞にはSOD1免疫陽性の封入体やレビー小体様硝子様封入体(Lewy body-like hyaline inclusions)が見つかっている。興味深いことにA4V発現マウス(A4V tgマウス)はALS症状を示さなかったが、野生型SOD1を共発現させるとALS症状が現れた。G93A tgマウスやL126Z tg マウスにおいても野生型SOD1の共発現によって発症が早まり、生存期間も短くなった[42]。さらに野生型SOD1のみを高発現させたマウスでもALS様の症状が見られたことから[43]、孤発性ALSにおいても野生型SOD1の関与が示唆されている。実際、変異SOD1のみならず野生型SOD1高発現マウスから樹立させたiPS細胞由来の運動神経細胞においてもミスフォールドしたSOD1タンパク質の蓄積が観察されている[44]。従って、変異の有無に関わらずSOD1タンパク質自体のミスフォールディングや凝集化がALS発症に関与する可能性が考えられている。
銅シャペロンタンパク質との関係
真核生物ではSOD1に銅イオンを渡す銅シャペロンタンパク質(Copper chaperon for SOD1, CCS)が働いており、CCSを欠損した酵母は致死となる[45]。しかし、CCSをノックアウトさせたマウスとALSモデルマウスであるG37R、G93A、G85R tgマウスをそれぞれ掛け合わせても発症時期や罹病期間に変化は見られず、CCSによる銅配位とALSには関係がないと思われた[46]。一方、CCSの高発現はALS病態を増悪させてしまうこともある。
ヒトCCSとG93AまたはG37Rとのダブルトランスジェニックマウスでは早期からミトコンドリアの空胞化が見られ、生存期間が元のG93AやG37Rトランスジェニックマウスの生存期間より著しく短縮した。一方、銅イオンを配位できない変異SOD1とのダブルトランスジェニックマウスでは変化は見られなかった [47][48]。つまり、銅イオンが少ない条件でCCSと銅配位できる変異SOD1を高発現させると変異SOD1に銅が輸送されてしまい、他の銅要求性タンパク質(ミトコンドリアのシトクロムCオキシダーゼなど)が銅不足になったことがALS増悪の原因だと考えられている。なお、CCSの一次構造は中央部分がSOD1と相同性が高く(47%)、N末とC末の両側に拡張した領域を持つ。結晶構造解析によると、相同性の高いCCSの中央部分のダイマー構造はSOD1ダイマーと非常によく似ていた[49]。ALS患者の脊髄でSOD1-CCSヘテロダイマー中間体も検出されている[50]。
タンパク質分解機構の関与
異常タンパク質の分解に関わるユビキチン-プロテアソーム系やオートファジー・リソソーム系の機能低下は、ミスフォールドタンパク質を分解できず凝集化を促進するため神経変性疾患の原因と考えられている[51][52]。ユビキチン免疫陽性の封入体はALSをはじめ神経変性疾患患者の病変部位でよく観察される。細胞の実験においてもプロテアソーム阻害剤は変異SOD1の分解を阻害し、ポリユビキチン化SOD1の蓄積を誘導する[53]。
また神経細胞特異的にオートファジー経路をノックアウトしたマウス(Atg5KO)は運動機能の低下を示し、脳にもユビキチン免疫陽性の封入体が多く見つかっている[54]。しかし、オートファジー経路をノックアウトしたマウスとG93A tgマウスを掛け合わせたところ、発症は早くなったが生存期間は逆に延長した[55]。
さらに、運動ニューロン特異的にプロテアソーム系を障害させたマウスはALSに似た運動ニューロン死を誘導したが、オートファジー系を障害させたマウスでは運動機能に異常が認められなかった。つまり、運動ニューロン障害においてはオートファジー・リソソーム系よりもユビキチン・プロテアソーム系が主因となっている可能性がある[56]。
ミトコンドリア機能障害
ALSでミトコンドリア機能障害が起こることは研究早期から提唱されてきた。変異SOD1 tgマウスの運動ニューロンでミトコンドリア内のCa2+緩衝作用と呼吸能障害が見出されている[57][58]。ミトコンドリアが傷害されるとシトクロムCが放出されアポトーシスが誘導されるが、アポトーシス経路を遮断するとALSモデルマウスの生存期間が延長したとの報告もある[59]。
変異SOD1 tgマウスの筋肉細胞で見られるミトコンドリアのuncoupling protein 3 (UCP3) の上昇は、ALSにおけるエネルギー代謝の亢進による脂肪量の減少に関与している[60]。一方、神経保護に働くUCP2を高発現させたG93A tgマウスは逆にALSの進行が早まった[61]。
オルガネラ異常
神経変性疾患の原因の一つとして小胞体ストレスが考えられている。ALSにおいても、ミスフォールディングした変異SOD1が運動ニューロン内の小胞体に蓄積して小胞体ストレスを誘導することで脆弱な運動ニューロンが細胞死に至ると考えられている[62][63][64]。さらに、ALS患者や変異SOD1 tgマウスにおいて、ゴルジ体の断片化[65][66]や核膜形態異常[67]、核輸送障害[68]なども観察されており、ミトコンドリア以外のオルガネラ異常の関与が注目されている。
非細胞自律性神経細胞死
変異SOD1 tgマウスにおいて、ミクログリアやアストロサイトでの変異SOD1の発現量が多いほどALSの進行速度が速くなり、逆にミクログリアやアストロサイトでの変異SOD1を除去するとALSの進行速度が遅くなることが証明された。つまり、変異SOD1を発現している運動神経細胞が自律的に細胞死をきたすわけではない『非細胞自律性神経細胞死』の概念が提唱されている[69][70]。
プリオン伝播作用とワクチン療法
また細胞外に放出されたミスフォールドSOD1が隣接する細胞に取り込まれ、その細胞内のSOD1をミスフォールディングさせるプリオン伝播作用を示すことが提唱された[71][72]。さらに、ALS患者脳脊髄液中に存在する可溶性ミスフォールド野生型SOD1が運動ニューロン様細胞に対して細胞毒性を示す[37]。そこで、細胞外(脳脊髄液)のミスフォールドSOD1をターゲットにした新たなALS治療法が開発されるようになってきた。マウスを用いた実験段階であるが、ミスフォールドSOD1に特異的な抗体を髄腔内投与する療法やSOD1を投与して生体内で抗体を作らせるワクチン療法の効果が報告されている[73][74]。
SOD1に対する核酸医薬
SOD1の翻訳を阻害する核酸医薬の開発競争も始まっている[75][76][77]。既にSOD1変異を持つ患者に対して、SOD1 mRNAを分解するアンチセンス薬tofersenの髄腔内投与の効果・安全性を検討する第1/第2相試験が行われており、第3相試験への期待が高まっている[78]。
SOD1欠損症
1993年以降SOD1の変異がALS患者で続々と見つかってきたのとは対照的に、SOD1の欠損症は2019年に初めてホモ接合性SOD1トランケーション変異(c.335dupG, p.C112Wfs*11, SOD活性なし)の症例が2例報告された。なお、p.C112Wfs*11はメチオニンから数えて112番目のCys(従来の表記ではCys111)がTrpになるフレームシフトが起こり、さらに10個の余分なアミノ酸の後に終止コドンになった欠失変異を意味している。
その2歳と6歳の患者は進行性の運動失調を伴う精神運動遅滞、過剰驚愕症(びっくり病)、痙性麻痺、耳介低位などの症状がみられており、SOD1の機能喪失とALS病態の関わりを再考する症例となっている[79][80]。これらの症例の家族にALS症状は見られていないものの、SOD1の機能喪失によるのかC末端が欠失したSOD1タンパク質の影響なのかも議論の余地がある。
SOD1ノックアウトマウスはALS症状を示さず一見正常に生育するものの雌の不妊が見つかり[26]、その後多くの異常が報告されるようになった。SOD1は赤血球に多く発現しているため、その欠損は溶血性貧血を引き起こし[81]、腎臓や肝臓に鉄が蓄積すると考えられる[82][83]。また、普通食でも脂肪肝から肝硬変になり[84][85]、高齢になると肝腫瘍が発生する[86]。さらに、難聴[87]、骨減少症[88]、骨格筋の萎縮[89]、皮膚萎縮症[90]、加齢黄斑変性[91]などの老化症状が見られている。アルツハイマー病モデルマウスと掛け合わせると認知機能がさらに低下することも報告されている[92]]。またSOD1ノックアウトマウスは行動異常を起こし、大脳ではドーパミントランスポーターの発現が上昇していることが観察されている[83]。
関連項目
参考文献
- ↑ 1.0 1.1
Li, Y., Huang, T.T., Carlson, E.J., Melov, S., Ursell, P.C., Olson, J.L., ..., & Epstein, C.J. (1995).
Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nature genetics, 11(4), 376-81. [PubMed:7493016] [WorldCat] [DOI] - ↑
McCord, J.M., & Fridovich, I. (1969).
Superoxide dismutase. An enzymic function for erythrocuprein (hemocuprein). The Journal of biological chemistry, 244(22), 6049-55. [PubMed:5389100] [WorldCat] - ↑
Keele, B.B., McCord, J.M., & Fridovich, I. (1970).
Superoxide dismutase from escherichia coli B. A new manganese-containing enzyme. The Journal of biological chemistry, 245(22), 6176-81. [PubMed:4921969] [WorldCat] - ↑
Weisiger, R.A., & Fridovich, I. (1973).
Superoxide dismutase. Organelle specificity. The Journal of biological chemistry, 248(10), 3582-92. [PubMed:4702877] [WorldCat] - ↑
Yost, F.J., & Fridovich, I. (1973).
An iron-containing superoxide dismutase from Escherichia coli. The Journal of biological chemistry, 248(14), 4905-8. [PubMed:4352182] [WorldCat] - ↑
Marklund, S.L., Holme, E., & Hellner, L. (1982).
Superoxide dismutase in extracellular fluids. Clinica chimica acta; international journal of clinical chemistry, 126(1), 41-51. [PubMed:7172448] [WorldCat] [DOI] - ↑
Vance, C.K., & Miller, A.F. (1998).
Spectroscopic comparisons of the pH dependencies of Fe-substituted (Mn)superoxide dismutase and Fe-superoxide dismutase. Biochemistry, 37(16), 5518-27. [PubMed:9548935] [WorldCat] [DOI] - ↑
Youn, H.D., Youn, H., Lee, J.W., Yim, Y.I., Lee, J.K., Hah, Y.C., & Kang, S.O. (1996).
Unique isozymes of superoxide dismutase in Streptomyces griseus. Archives of biochemistry and biophysics, 334(2), 341-8. [PubMed:8900409] [WorldCat] [DOI] - ↑
Marklund, S.L. (1982).
Human copper-containing superoxide dismutase of high molecular weight. Proceedings of the National Academy of Sciences of the United States of America, 79(24), 7634-8. [PubMed:6961438] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Ihara, K., Fujiwara, N., Yamaguchi, Y., Torigoe, H., Wakatsuki, S., Taniguchi, N., & Suzuki, K. (2012).
Structural switching of Cu,Zn-superoxide dismutases at loop VI: insights from the crystal structure of 2-mercaptoethanol-modified enzyme. Bioscience reports, 32(6), 539-48. [PubMed:22804629] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Fujiwara, N., Nakano, M., Kato, S., Yoshihara, D., Ookawara, T., Eguchi, H., ..., & Suzuki, K. (2007).
Oxidative modification to cysteine sulfonic acid of Cys111 in human copper-zinc superoxide dismutase. The Journal of biological chemistry, 282(49), 35933-44. [PubMed:17913710] [WorldCat] [DOI] - ↑
Furukawa, Y., Fu, R., Deng, H.X., Siddique, T., & O'Halloran, T.V. (2006).
Disulfide cross-linked protein represents a significant fraction of ALS-associated Cu, Zn-superoxide dismutase aggregates in spinal cords of model mice. Proceedings of the National Academy of Sciences of the United States of America, 103(18), 7148-53. [PubMed:16636274] [PMC] [WorldCat] [DOI] - ↑
Auclair, J.R., Johnson, J.L., Liu, Q., Salisbury, J.P., Rotunno, M.S., Petsko, G.A., ..., & Agar, J.N. (2013).
Post-translational modification by cysteine protects Cu/Zn-superoxide dismutase from oxidative damage. Biochemistry, 52(36), 6137-44. [PubMed:23927036] [PMC] [WorldCat] [DOI] - ↑
Sehati, S., Clement, M.H., Martins, J., Xu, L., Longo, V.D., Valentine, J.S., & Gralla, E.B. (2011).
Metabolic alterations in yeast lacking copper-zinc superoxide dismutase. Free radical biology & medicine, 50(11), 1591-8. [PubMed:21397007] [PMC] [WorldCat] [DOI] - ↑
Reddi, A.R., & Culotta, V.C. (2013).
SOD1 integrates signals from oxygen and glucose to repress respiration. Cell, 152(1-2), 224-35. [PubMed:23332757] [PMC] [WorldCat] [DOI] - ↑
Banks, C.J., Rodriguez, N.W., Gashler, K.R., Pandya, R.R., Mortenson, J.B., Whited, M.D., ..., & Andersen, J.L. (2017).
Acylation of Superoxide Dismutase 1 (SOD1) at K122 Governs SOD1-Mediated Inhibition of Mitochondrial Respiration. Molecular and cellular biology, 37(20). [PubMed:28739857] [PMC] [WorldCat] [DOI] - ↑
Zhao, S., Xu, W., Jiang, W., Yu, W., Lin, Y., Zhang, T., ..., & Guan, K.L. (2010).
Regulation of cellular metabolism by protein lysine acetylation. Science (New York, N.Y.), 327(5968), 1000-4. [PubMed:20167786] [PMC] [WorldCat] [DOI] - ↑
Tsang, C.K., Liu, Y., Thomas, J., Zhang, Y., & Zheng, X.F. (2014).
Superoxide dismutase 1 acts as a nuclear transcription factor to regulate oxidative stress resistance. Nature communications, 5, 3446. [PubMed:24647101] [PMC] [WorldCat] [DOI] - ↑
Li, X., Qiu, S., Shi, J., Wang, S., Wang, M., Xu, Y., ..., & Liu, C. (2019).
A new function of copper zinc superoxide dismutase: as a regulatory DNA-binding protein in gene expression in response to intracellular hydrogen peroxide. Nucleic acids research, 47(10), 5074-5085. [PubMed:31162603] [PMC] [WorldCat] [DOI] - ↑
Urushitani, M., Ezzi, S.A., Matsuo, A., Tooyama, I., & Julien, J.P. (2008).
The endoplasmic reticulum-Golgi pathway is a target for translocation and aggregation of mutant superoxide dismutase linked to ALS. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 22(7), 2476-87. [PubMed:18337461] [WorldCat] [DOI] - ↑
Urushitani, M., Sik, A., Sakurai, T., Nukina, N., Takahashi, R., & Julien, J.P. (2006).
Chromogranin-mediated secretion of mutant superoxide dismutase proteins linked to amyotrophic lateral sclerosis. Nature neuroscience, 9(1), 108-18. [PubMed:16369483] [WorldCat] [DOI] - ↑
Cruz-Garcia, D., Brouwers, N., Duran, J.M., Mora, G., Curwin, A.J., & Malhotra, V. (2017).
A diacidic motif determines unconventional secretion of wild-type and ALS-linked mutant SOD1. The Journal of cell biology, 216(9), 2691-2700. [PubMed:28794127] [PMC] [WorldCat] [DOI] - ↑
Damiano, S., Petrozziello, T., Ucci, V., Amente, S., Santillo, M., & Mondola, P. (2013).
Cu-Zn superoxide dismutase activates muscarinic acetylcholine M1 receptor pathway in neuroblastoma cells. Molecular and cellular neurosciences, 52, 31-7. [PubMed:23147108] [WorldCat] [DOI] - ↑
Deng, H.X., Hentati, A., Tainer, J.A., Iqbal, Z., Cayabyab, A., Hung, W.Y., ..., & Roos, R.P. (1993).
Amyotrophic lateral sclerosis and structural defects in Cu,Zn superoxide dismutase. Science (New York, N.Y.), 261(5124), 1047-51. [PubMed:8351519] [WorldCat] [DOI] - ↑
Rosen, D.R., Siddique, T., Patterson, D., Figlewicz, D.A., Sapp, P., Hentati, A., ..., & Deng, H.X. (1993).
Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature, 362(6415), 59-62. [PubMed:8446170] [WorldCat] [DOI] - ↑ 26.0 26.1
Reaume, A.G., Elliott, J.L., Hoffman, E.K., Kowall, N.W., Ferrante, R.J., Siwek, D.F., ..., & Snider, W.D. (1996).
Motor neurons in Cu/Zn superoxide dismutase-deficient mice develop normally but exhibit enhanced cell death after axonal injury. Nature genetics, 13(1), 43-7. [PubMed:8673102] [WorldCat] [DOI] - ↑
Furukawa, Y., Kaneko, K., Yamanaka, K., O'Halloran, T.V., & Nukina, N. (2008).
Complete loss of post-translational modifications triggers fibrillar aggregation of SOD1 in the familial form of amyotrophic lateral sclerosis. The Journal of biological chemistry, 283(35), 24167-76. [PubMed:18552350] [PMC] [WorldCat] [DOI] - ↑
Fujiwara, N., Wagatsuma, M., Oba, N., Yoshihara, D., Tokuda, E., Sakiyama, H., ..., & Suzuki, K. (2018).
Cu/Zn-superoxide dismutase forms fibrillar hydrogels in a pH-dependent manner via a water-rich extended intermediate state. PloS one, 13(10), e0205090. [PubMed:30289953] [PMC] [WorldCat] [DOI] - ↑
Tiwari, A., & Hayward, L.J. (2003).
Familial amyotrophic lateral sclerosis mutants of copper/zinc superoxide dismutase are susceptible to disulfide reduction. The Journal of biological chemistry, 278(8), 5984-92. [PubMed:12458194] [WorldCat] [DOI] - ↑
Rodriguez, J.A., Valentine, J.S., Eggers, D.K., Roe, J.A., Tiwari, A., Brown, R.H., & Hayward, L.J. (2002).
Familial amyotrophic lateral sclerosis-associated mutations decrease the thermal stability of distinctly metallated species of human copper/zinc superoxide dismutase. The Journal of biological chemistry, 277(18), 15932-7. [PubMed:11854285] [WorldCat] [DOI] - ↑
Khare, S.D., Caplow, M., & Dokholyan, N.V. (2004).
The rate and equilibrium constants for a multistep reaction sequence for the aggregation of superoxide dismutase in amyotrophic lateral sclerosis. Proceedings of the National Academy of Sciences of the United States of America, 101(42), 15094-9. [PubMed:15475574] [PMC] [WorldCat] [DOI] - ↑
Rakhit, R., Robertson, J., Vande Velde, C., Horne, P., Ruth, D.M., Griffin, J., ..., & Chakrabartty, A. (2007).
An immunological epitope selective for pathological monomer-misfolded SOD1 in ALS. Nature medicine, 13(6), 754-9. [PubMed:17486090] [WorldCat] [DOI] - ↑
Chattopadhyay, M., Durazo, A., Sohn, S.H., Strong, C.D., Gralla, E.B., Whitelegge, J.P., & Valentine, J.S. (2008).
Initiation and elongation in fibrillation of ALS-linked superoxide dismutase. Proceedings of the National Academy of Sciences of the United States of America, 105(48), 18663-8. [PubMed:19022905] [PMC] [WorldCat] [DOI] - ↑
Rakhit, R., Cunningham, P., Furtos-Matei, A., Dahan, S., Qi, X.F., Crow, J.P., ..., & Chakrabartty, A. (2002).
Oxidation-induced misfolding and aggregation of superoxide dismutase and its implications for amyotrophic lateral sclerosis. The Journal of biological chemistry, 277(49), 47551-6. [PubMed:12356748] [WorldCat] [DOI] - ↑
Bosco, D.A., Morfini, G., Karabacak, N.M., Song, Y., Gros-Louis, F., Pasinelli, P., ..., & Brown, R.H. (2010).
Wild-type and mutant SOD1 share an aberrant conformation and a common pathogenic pathway in ALS. Nature neuroscience, 13(11), 1396-403. [PubMed:20953194] [PMC] [WorldCat] [DOI] - ↑
Proctor, E.A., Fee, L., Tao, Y., Redler, R.L., Fay, J.M., Zhang, Y., ..., & Dokholyan, N.V. (2016).
Nonnative SOD1 trimer is toxic to motor neurons in a model of amyotrophic lateral sclerosis. Proceedings of the National Academy of Sciences of the United States of America, 113(3), 614-9. [PubMed:26719414] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1
Tokuda, E., Takei, Y.I., Ohara, S., Fujiwara, N., Hozumi, I., & Furukawa, Y. (2019).
Wild-type Cu/Zn-superoxide dismutase is misfolded in cerebrospinal fluid of sporadic amyotrophic lateral sclerosis. Molecular neurodegeneration, 14(1), 42. [PubMed:31744522] [PMC] [WorldCat] [DOI] - ↑
Gurney, M.E., Pu, H., Chiu, A.Y., Dal Canto, M.C., Polchow, C.Y., Alexander, D.D., ..., & Deng, H.X. (1994).
Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science (New York, N.Y.), 264(5166), 1772-5. [PubMed:8209258] [WorldCat] [DOI] - ↑
Howland, D.S., Liu, J., She, Y., Goad, B., Maragakis, N.J., Kim, B., ..., & Rothstein, J.D. (2002).
Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proceedings of the National Academy of Sciences of the United States of America, 99(3), 1604-9. [PubMed:11818550] [PMC] [WorldCat] [DOI] - ↑
Milanese, M., Zappettini, S., Onofri, F., Musazzi, L., Tardito, D., Bonifacino, T., ..., & Bonanno, G. (2011).
Abnormal exocytotic release of glutamate in a mouse model of amyotrophic lateral sclerosis. Journal of neurochemistry, 116(6), 1028-42. [PubMed:21175617] [WorldCat] [DOI] - ↑
Li, K., Hala, T.J., Seetharam, S., Poulsen, D.J., Wright, M.C., & Lepore, A.C. (2015).
GLT1 overexpression in SOD1(G93A) mouse cervical spinal cord does not preserve diaphragm function or extend disease. Neurobiology of disease, 78, 12-23. [PubMed:25818008] [WorldCat] [DOI] - ↑
Deng, H.X., Shi, Y., Furukawa, Y., Zhai, H., Fu, R., Liu, E., ..., & Siddique, T. (2006).
Conversion to the amyotrophic lateral sclerosis phenotype is associated with intermolecular linked insoluble aggregates of SOD1 in mitochondria. Proceedings of the National Academy of Sciences of the United States of America, 103(18), 7142-7. [PubMed:16636275] [PMC] [WorldCat] [DOI] - ↑
Jaarsma, D., Haasdijk, E.D., Grashorn, J.A., Hawkins, R., van Duijn, W., Verspaget, H.W., ..., & Holstege, J.C. (2000).
Human Cu/Zn superoxide dismutase (SOD1) overexpression in mice causes mitochondrial vacuolization, axonal degeneration, and premature motoneuron death and accelerates motoneuron disease in mice expressing a familial amyotrophic lateral sclerosis mutant SOD1. Neurobiology of disease, 7(6 Pt B), 623-43. [PubMed:11114261] [WorldCat] [DOI] - ↑
Komatsu, K., Imamura, K., Yamashita, H., Julien, J.P., Takahashi, R., & Inoue, H. (2018).
Overexpressed wild-type superoxide dismutase 1 exhibits amyotrophic lateral sclerosis-related misfolded conformation in induced pluripotent stem cell-derived spinal motor neurons. Neuroreport, 29(1), 25-29. [PubMed:29140847] [WorldCat] [DOI] - ↑
Culotta, V.C., Klomp, L.W., Strain, J., Casareno, R.L., Krems, B., & Gitlin, J.D. (1997).
The copper chaperone for superoxide dismutase. The Journal of biological chemistry, 272(38), 23469-72. [PubMed:9295278] [WorldCat] [DOI] - ↑
Subramaniam, J.R., Lyons, W.E., Liu, J., Bartnikas, T.B., Rothstein, J., Price, D.L., ..., & Wong, P.C. (2002).
Mutant SOD1 causes motor neuron disease independent of copper chaperone-mediated copper loading. Nature neuroscience, 5(4), 301-7. [PubMed:11889469] [WorldCat] [DOI] - ↑
Son, M., Puttaparthi, K., Kawamata, H., Rajendran, B., Boyer, P.J., Manfredi, G., & Elliott, J.L. (2007).
Overexpression of CCS in G93A-SOD1 mice leads to accelerated neurological deficits with severe mitochondrial pathology. Proceedings of the National Academy of Sciences of the United States of America, 104(14), 6072-7. [PubMed:17389365] [PMC] [WorldCat] [DOI] - ↑
Son, M., Fu, Q., Puttaparthi, K., Matthews, C.M., & Elliott, J.L. (2009).
Redox susceptibility of SOD1 mutants is associated with the differential response to CCS over-expression in vivo. Neurobiology of disease, 34(1), 155-62. [PubMed:19320055] [PMC] [WorldCat] [DOI] - ↑
Lamb, A.L., Wernimont, A.K., Pufahl, R.A., Culotta, V.C., O'Halloran, T.V., & Rosenzweig, A.C. (1999).
Crystal structure of the copper chaperone for superoxide dismutase. Nature structural biology, 6(8), 724-9. [PubMed:10426947] [WorldCat] [DOI] - ↑
Antinone, S.E., Ghadge, G.D., Ostrow, L.W., Roos, R.P., & Green, W.N. (2017).
S-acylation of SOD1, CCS, and a stable SOD1-CCS heterodimer in human spinal cords from ALS and non-ALS subjects. Scientific reports, 7, 41141. [PubMed:28120938] [PMC] [WorldCat] [DOI] - ↑
Bence, N.F., Sampat, R.M., & Kopito, R.R. (2001).
Impairment of the ubiquitin-proteasome system by protein aggregation. Science (New York, N.Y.), 292(5521), 1552-5. [PubMed:11375494] [WorldCat] [DOI] - ↑
Cuervo, A.M. (2004).
Autophagy: in sickness and in health. Trends in cell biology, 14(2), 70-7. [PubMed:15102438] [WorldCat] [DOI] - ↑
Urushitani, M., Kurisu, J., Tsukita, K., & Takahashi, R. (2002).
Proteasomal inhibition by misfolded mutant superoxide dismutase 1 induces selective motor neuron death in familial amyotrophic lateral sclerosis. Journal of neurochemistry, 83(5), 1030-42. [PubMed:12437574] [WorldCat] [DOI] - ↑
Hara, T., Nakamura, K., Matsui, M., Yamamoto, A., Nakahara, Y., Suzuki-Migishima, R., ..., & Mizushima, N. (2006).
Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice. Nature, 441(7095), 885-9. [PubMed:16625204] [WorldCat] [DOI] - ↑
Rudnick, N.D., Griffey, C.J., Guarnieri, P., Gerbino, V., Wang, X., Piersaint, J.A., ..., & Maniatis, T. (2017).
Distinct roles for motor neuron autophagy early and late in the SOD1G93A mouse model of ALS. Proceedings of the National Academy of Sciences of the United States of America, 114(39), E8294-E8303. [PubMed:28904095] [PMC] [WorldCat] [DOI] - ↑
Tashiro, Y., Urushitani, M., Inoue, H., Koike, M., Uchiyama, Y., Komatsu, M., ..., & Takahashi, R. (2012).
Motor neuron-specific disruption of proteasomes, but not autophagy, replicates amyotrophic lateral sclerosis. The Journal of biological chemistry, 287(51), 42984-94. [PubMed:23095749] [PMC] [WorldCat] [DOI] - ↑
Mattiazzi, M., D'Aurelio, M., Gajewski, C.D., Martushova, K., Kiaei, M., Beal, M.F., & Manfredi, G. (2002).
Mutated human SOD1 causes dysfunction of oxidative phosphorylation in mitochondria of transgenic mice. The Journal of biological chemistry, 277(33), 29626-33. [PubMed:12050154] [WorldCat] [DOI] - ↑
Damiano, M., Starkov, A.A., Petri, S., Kipiani, K., Kiaei, M., Mattiazzi, M., ..., & Manfredi, G. (2006).
Neural mitochondrial Ca2+ capacity impairment precedes the onset of motor symptoms in G93A Cu/Zn-superoxide dismutase mutant mice. Journal of neurochemistry, 96(5), 1349-61. [PubMed:16478527] [WorldCat] [DOI] - ↑
Reyes, N.A., Fisher, J.K., Austgen, K., VandenBerg, S., Huang, E.J., & Oakes, S.A. (2010).
Blocking the mitochondrial apoptotic pathway preserves motor neuron viability and function in a mouse model of amyotrophic lateral sclerosis. The Journal of clinical investigation, 120(10), 3673-9. [PubMed:20890041] [PMC] [WorldCat] [DOI] - ↑
Dupuis, L., di Scala, F., Rene, F., de Tapia, M., Oudart, H., Pradat, P.F., ..., & Loeffler, J.P. (2003).
Up-regulation of mitochondrial uncoupling protein 3 reveals an early muscular metabolic defect in amyotrophic lateral sclerosis. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 17(14), 2091-3. [PubMed:14500553] [WorldCat] [DOI] - ↑
Peixoto, P.M., Kim, H.J., Sider, B., Starkov, A., Horvath, T.L., & Manfredi, G. (2013).
UCP2 overexpression worsens mitochondrial dysfunction and accelerates disease progression in a mouse model of amyotrophic lateral sclerosis. Molecular and cellular neurosciences, 57, 104-10. [PubMed:24141050] [PMC] [WorldCat] [DOI] - ↑
Nishitoh, H., Kadowaki, H., Nagai, A., Maruyama, T., Yokota, T., Fukutomi, H., ..., & Ichijo, H. (2008).
ALS-linked mutant SOD1 induces ER stress- and ASK1-dependent motor neuron death by targeting Derlin-1. Genes & development, 22(11), 1451-64. [PubMed:18519638] [PMC] [WorldCat] [DOI] - ↑
Atkin, J.D., Farg, M.A., Walker, A.K., McLean, C., Tomas, D., & Horne, M.K. (2008).
Endoplasmic reticulum stress and induction of the unfolded protein response in human sporadic amyotrophic lateral sclerosis. Neurobiology of disease, 30(3), 400-407. [PubMed:18440237] [WorldCat] [DOI] - ↑
Saxena, S., Cabuy, E., & Caroni, P. (2009).
A role for motoneuron subtype-selective ER stress in disease manifestations of FALS mice. Nature neuroscience, 12(5), 627-36. [PubMed:19330001] [WorldCat] [DOI] - ↑
Mourelatos, Z., Gonatas, N.K., Stieber, A., Gurney, M.E., & Dal Canto, M.C. (1996).
The Golgi apparatus of spinal cord motor neurons in transgenic mice expressing mutant Cu,Zn superoxide dismutase becomes fragmented in early, preclinical stages of the disease. Proceedings of the National Academy of Sciences of the United States of America, 93(11), 5472-7. [PubMed:8643599] [PMC] [WorldCat] [DOI] - ↑
Bellouze, S., Baillat, G., Buttigieg, D., de la Grange, P., Rabouille, C., & Haase, G. (2016).
Stathmin 1/2-triggered microtubule loss mediates Golgi fragmentation in mutant SOD1 motor neurons. Molecular neurodegeneration, 11(1), 43. [PubMed:27277231] [PMC] [WorldCat] [DOI] - ↑
Kinoshita, Y., Ito, H., Hirano, A., Fujita, K., Wate, R., Nakamura, M., ..., & Kusaka, H. (2009).
Nuclear contour irregularity and abnormal transporter protein distribution in anterior horn cells in amyotrophic lateral sclerosis. Journal of neuropathology and experimental neurology, 68(11), 1184-92. [PubMed:19816199] [WorldCat] [DOI] - ↑
Zhong, Y., Wang, J., Henderson, M.J., Yang, P., Hagen, B.M., Siddique, T., ..., & Fang, S. (2017).
Nuclear export of misfolded SOD1 mediated by a normally buried NES-like sequence reduces proteotoxicity in the nucleus. eLife, 6. [PubMed:28463106] [PMC] [WorldCat] [DOI] - ↑
Boillée, S., Yamanaka, K., Lobsiger, C.S., Copeland, N.G., Jenkins, N.A., Kassiotis, G., ..., & Cleveland, D.W. (2006).
Onset and progression in inherited ALS determined by motor neurons and microglia. Science (New York, N.Y.), 312(5778), 1389-92. [PubMed:16741123] [WorldCat] [DOI] - ↑
Yamanaka, K., Chun, S.J., Boillee, S., Fujimori-Tonou, N., Yamashita, H., Gutmann, D.H., ..., & Cleveland, D.W. (2008).
Astrocytes as determinants of disease progression in inherited amyotrophic lateral sclerosis. Nature neuroscience, 11(3), 251-3. [PubMed:18246065] [PMC] [WorldCat] [DOI] - ↑
Münch, C., O'Brien, J., & Bertolotti, A. (2011).
Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proceedings of the National Academy of Sciences of the United States of America, 108(9), 3548-53. [PubMed:21321227] [PMC] [WorldCat] [DOI] - ↑
Grad, L.I., Pokrishevsky, E., Silverman, J.M., & Cashman, N.R. (2014).
Exosome-dependent and independent mechanisms are involved in prion-like transmission of propagated Cu/Zn superoxide dismutase misfolding. Prion, 8(5), 331-5. [PubMed:25551548] [PMC] [WorldCat] [DOI] - ↑
Urushitani, M., Ezzi, S.A., & Julien, J.P. (2007).
Therapeutic effects of immunization with mutant superoxide dismutase in mice models of amyotrophic lateral sclerosis. Proceedings of the National Academy of Sciences of the United States of America, 104(7), 2495-500. [PubMed:17277077] [PMC] [WorldCat] [DOI] - ↑
Takeuchi, S., Fujiwara, N., Ido, A., Oono, M., Takeuchi, Y., Tateno, M., ..., & Urushitani, M. (2010).
Induction of protective immunity by vaccination with wild-type apo superoxide dismutase 1 in mutant SOD1 transgenic mice. Journal of neuropathology and experimental neurology, 69(10), 1044-56. [PubMed:20838241] [WorldCat] [DOI] - ↑
Ralph, G.S., Radcliffe, P.A., Day, D.M., Carthy, J.M., Leroux, M.A., Lee, D.C., ..., & Azzouz, M. (2005).
Silencing mutant SOD1 using RNAi protects against neurodegeneration and extends survival in an ALS model. Nature medicine, 11(4), 429-33. [PubMed:15768029] [WorldCat] [DOI] - ↑
Stoica, L., Todeasa, S.H., Cabrera, G.T., Salameh, J.S., ElMallah, M.K., Mueller, C., ..., & Sena-Esteves, M. (2016).
Adeno-associated virus-delivered artificial microRNA extends survival and delays paralysis in an amyotrophic lateral sclerosis mouse model. Annals of neurology, 79(4), 687-700. [PubMed:26891182] [PMC] [WorldCat] [DOI] - ↑
Mueller, C., Berry, J.D., McKenna-Yasek, D.M., Gernoux, G., Owegi, M.A., Pothier, L.M., ..., & Brown, R.H. (2020).
SOD1 Suppression with Adeno-Associated Virus and MicroRNA in Familial ALS. The New England journal of medicine, 383(2), 151-158. [PubMed:32640133] [WorldCat] [DOI] - ↑
Miller, T., Cudkowicz, M., Shaw, P.J., Andersen, P.M., Atassi, N., Bucelli, R.C., ..., & Ferguson, T.A. (2020).
Phase 1-2 Trial of Antisense Oligonucleotide Tofersen for SOD1 ALS. The New England journal of medicine, 383(2), 109-119. [PubMed:32640130] [WorldCat] [DOI] - ↑
Park, J.H., Elpers, C., Reunert, J., McCormick, M.L., Mohr, J., Biskup, S., ..., & Marquardt, T. (2019).
SOD1 deficiency: a novel syndrome distinct from amyotrophic lateral sclerosis. Brain : a journal of neurology, 142(8), 2230-2237. [PubMed:31332433] [PMC] [WorldCat] [DOI] - ↑
Andersen, P.M., Nordström, U., Tsiakas, K., Johannsen, J., Volk, A.E., Bierhals, T., ..., & Santer, R. (2019).
Phenotype in an Infant with SOD1 Homozygous Truncating Mutation. The New England journal of medicine, 381(5), 486-488. [PubMed:31314961] [WorldCat] [DOI] - ↑
Iuchi, Y., Okada, F., Onuma, K., Onoda, T., Asao, H., Kobayashi, M., & Fujii, J. (2007).
Elevated oxidative stress in erythrocytes due to a SOD1 deficiency causes anaemia and triggers autoantibody production. The Biochemical journal, 402(2), 219-27. [PubMed:17059387] [PMC] [WorldCat] [DOI] - ↑
Yoshihara, D., Fujiwara, N., Kato, S., Sakiyama, H., Eguchi, H., & Suzuki, K. (2012).
Alterations in renal iron metabolism caused by a copper/zinc-superoxide dismutase deficiency. Free radical research, 46(6), 750-7. [PubMed:22435664] [WorldCat] [DOI] - ↑ 83.0 83.1
Yoshihara, D., Fujiwara, N., Kitanaka, N., Kitanaka, J., Sakiyama, H., Eguchi, H., ..., & Suzuki, K. (2016).
The absence of the SOD1 gene causes abnormal monoaminergic neurotransmission and motivational impairment-like behavior in mice. Free radical research, 50(11), 1245-1256. [PubMed:27629432] [WorldCat] [DOI] - ↑
Uchiyama, S., Shimizu, T., & Shirasawa, T. (2006).
CuZn-SOD deficiency causes ApoB degradation and induces hepatic lipid accumulation by impaired lipoprotein secretion in mice. The Journal of biological chemistry, 281(42), 31713-9. [PubMed:16921198] [WorldCat] [DOI] - ↑
Sakiyama, H., Fujiwara, N., Yoneoka, Y., Yoshihara, D., Eguchi, H., & Suzuki, K. (2016).
Cu,Zn-SOD deficiency induces the accumulation of hepatic collagen. Free radical research, 50(6), 666-77. [PubMed:26981929] [WorldCat] [DOI] - ↑
Elchuri, S., Oberley, T.D., Qi, W., Eisenstein, R.S., Jackson Roberts, L., Van Remmen, H., ..., & Huang, T.T. (2005).
CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene, 24(3), 367-80. [PubMed:15531919] [WorldCat] [DOI] - ↑
McFadden, S.L., Ding, D., Reaume, A.G., Flood, D.G., & Salvi, R.J. (1999).
Age-related cochlear hair cell loss is enhanced in mice lacking copper/zinc superoxide dismutase. Neurobiology of aging, 20(1), 1-8. [PubMed:10466888] [WorldCat] [DOI] - ↑
Nojiri, H., Saita, Y., Morikawa, D., Kobayashi, K., Tsuda, C., Miyazaki, T., ..., & Shimizu, T. (2011).
Cytoplasmic superoxide causes bone fragility owing to low-turnover osteoporosis and impaired collagen cross-linking. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research, 26(11), 2682-94. [PubMed:22025246] [WorldCat] [DOI] - ↑
Muller, F.L., Song, W., Liu, Y., Chaudhuri, A., Pieke-Dahl, S., Strong, R., ..., & Van Remmen, H. (2006).
Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy. Free radical biology & medicine, 40(11), 1993-2004. [PubMed:16716900] [WorldCat] [DOI] - ↑
Murakami, K., Inagaki, J., Saito, M., Ikeda, Y., Tsuda, C., Noda, Y., ..., & Shimizu, T. (2009).
Skin atrophy in cytoplasmic SOD-deficient mice and its complete recovery using a vitamin C derivative. Biochemical and biophysical research communications, 382(2), 457-61. [PubMed:19289104] [WorldCat] [DOI] - ↑
Imamura, Y., Noda, S., Hashizume, K., Shinoda, K., Yamaguchi, M., Uchiyama, S., ..., & Tsubota, K. (2006).
Drusen, choroidal neovascularization, and retinal pigment epithelium dysfunction in SOD1-deficient mice: a model of age-related macular degeneration. Proceedings of the National Academy of Sciences of the United States of America, 103(30), 11282-7. [PubMed:16844785] [PMC] [WorldCat] [DOI] - ↑
Murakami, K., Murata, N., Noda, Y., Tahara, S., Kaneko, T., Kinoshita, N., ..., & Shimizu, T. (2011).
SOD1 (copper/zinc superoxide dismutase) deficiency drives amyloid β protein oligomerization and memory loss in mouse model of Alzheimer disease. The Journal of biological chemistry, 286(52), 44557-68. [PubMed:22072713] [PMC] [WorldCat] [DOI]