「アクチビン」の版間の差分
細 →骨格筋 |
細編集の要約なし |
||
| (同じ利用者による、間の23版が非表示) | |||
| 8行目: | 8行目: | ||
{{box|text= アクチビンは、下垂体前葉細胞から卵胞刺激ホルモン(FSH)の分泌を促進する分子として発見されたTGF-βファミリーに属するポリペプチドである。アクチビンは、アクチビンβ鎖のホモ二量体またはヘテロ二量体として存在し、共通したβ鎖サブユニットを持つインヒビンとは異なる生理作用を示す。主要なサブファミリーにはアクチビンA、B、ABがあり、肝臓特異的なアクチビンC、Eも知られている。アクチビンは、神経内分泌系や細胞の分化誘導に関与するペプチドホルモンであり、細胞分化、アポトーシス、初期発生、細胞周期調節、創傷治癒、免疫調節など多様な生理作用を持つ。特に神経系においては記憶調節や神経栄養因子様の作用があり、疾患との関連も注目されている。}} | {{box|text= アクチビンは、下垂体前葉細胞から卵胞刺激ホルモン(FSH)の分泌を促進する分子として発見されたTGF-βファミリーに属するポリペプチドである。アクチビンは、アクチビンβ鎖のホモ二量体またはヘテロ二量体として存在し、共通したβ鎖サブユニットを持つインヒビンとは異なる生理作用を示す。主要なサブファミリーにはアクチビンA、B、ABがあり、肝臓特異的なアクチビンC、Eも知られている。アクチビンは、神経内分泌系や細胞の分化誘導に関与するペプチドホルモンであり、細胞分化、アポトーシス、初期発生、細胞周期調節、創傷治癒、免疫調節など多様な生理作用を持つ。特に神経系においては記憶調節や神経栄養因子様の作用があり、疾患との関連も注目されている。}} | ||
[[ファイル:Tsuchida Activin Fig1.png|サムネイル|'''図1. アクチビンとインヒビン''']] | |||
== アクチビンとは == | == アクチビンとは == | ||
アクチビンは、下垂体前葉細胞からの卵胞刺激ホルモン(FSH)分泌を抑制するインビビンをブタ卵胞液から精製する過程で、インヒビンとは逆にFSHの分泌を促進する分子として偶然に発見された <ref name=Ling1986><pubmed>3086749</pubmed></ref><ref name=Vale1986><pubmed>3012369</pubmed></ref>。 | |||
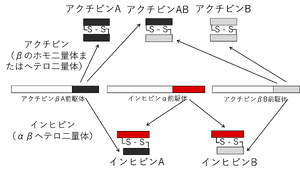
内分泌の要である視床下部―下垂体―生殖腺系では、視床下部由来のGnRH(gonadotropin-releasing hormone)が下垂体前葉からのゴナドトロピン(FSH, LH(黄体形成ホルモン))の分泌を促進し、生殖腺でのステロイド産生と成熟を促す。生殖腺ではエストロゲンなどのステロイドホルモンやFSH, LHが視床下部へのネガティブ・フィードバック機構でGnRH産生を抑制している。生殖腺由来の非ステロイド性の分子が下垂体前葉からのFSHの産生や分泌を特異的に抑制する機構が提唱されていた。これが1932年に提唱されたインヒビン仮説である<ref name=McCullagh1932><pubmed>17815236</pubmed></ref>。1985年になるとインヒビンがブタ卵胞液からタンパク質として精製され、その存在が証明された <ref name=Makanji2014><pubmed>25051334</pubmed></ref>。インヒビンは18kDaのインヒビンα鎖と13kDaのアクチビンβ鎖(βAあるいはβB)のペプチドがS-S結合を介してヘテロ二量体の構造を有する。インヒビンA(αβA)とインヒビンB(αβB)である('''図1''')。このインヒビン精製の過程で、逆にFSHの分泌を促進するペプチドも発見されアクチビンと命名された。その際、精製されたのは、アクチビンA(βAβA:アクチビンβA鎖のホモ二量体)とアクチビンAB(βAβB:アクチビンはβA鎖とアクチビンβB鎖のヘテロ二量体)である。その後、卵巣、卵胞液、フォリスタチン/アクチビンを複合体として精製することで、アクチビンB(βBβB:アクチビンβB鎖のホモ二量体)も生体内で存在することが証明されている。なお、フォリスタチンは、細胞外でアクチビンに結合しその生理活性を強く阻害する。 | |||
構造的には、アクチビンはTGF-βファミリーに属するポリペプチドであり、アクチビンβ鎖(インヒビンβ鎖とも称されるが、本稿ではアクチビンβ鎖と呼ぶ。)のホモ二量体またはヘテロ二量体として存在する。インヒビンはインヒビンα鎖とアクチビンβ鎖のヘテロ二量体であり、インヒビンとアクチビンは共通のβ鎖を持つことから部分的に類似した構造を有する。しかしながら、生理学的作用は正反対である。インヒビンのサブユニットのインヒビンα鎖は1種類のみであり、アクチビンβ鎖の違いによりインヒビンAとインヒビンBが存在する。アクチビンを構成するβ鎖サブユニットにはβA鎖とβB鎖が知られている。主要なサブファミリーとしては、アクチビンA(βAβA), B(βBβB), AB(βAβB)が生体に存在する('''図1''')。なお、肝臓特異的に発現するアクチビンC(βCβC)とアクチビンE(βEβE)も知られている。アクチビンは、神経内分泌系や細胞の分化誘導に関わるペプチドホルモンであるが、それ以外にも様々な生理作用を有する重要なシグナル分子である。生殖器系への作用が主に解析されてきたがその機能は極めて多彩で、細胞分化、アポトーシス、初期発生、細胞周期調節、創傷治癒、免疫調節など多岐に渡る。神経系でも興味深い作用を発揮する。 | |||
アクチビン/インヒビン/フォリスタチン系は神経内分泌系、下垂体制御系で重要な生理作用を持つ。生殖腺由来のインヒビンはフィードバック調節による下垂体での作用が主要であり低濃度でFSH産生を抑制する。これはFSHの基礎分泌がアクチビンにより維持されており、それをインヒビンがアンタゴニストとして作用し、それを阻害するためと考えられている。アクチビンの作用は産生組織周辺のオートクライン作用あるいはパラクリン作用が主体である。例えば、下垂体内ではオートクライン作用でFSHの転写や分泌を調節している。卵巣顆粒膜細胞では、アクチビンはプロゲステロン産生やLH受容体を増加させ黄体化を促進する。この作用は主としてパラクライン作用と考えられている。アクチビンは多くの組織で産生され、視床下部―下垂体―生殖腺以外の組織でも多彩な機能を発揮する。神経系でもアクチビンは極めてユニークな作用を発揮する。 | |||
== 構造 == | == 構造 == | ||
アクチビンは,アクチビンβA鎖あるいはアクチビンβB鎖のホモ二量体あるいはヘテロ二量体である。前駆体ペプチドがS-S結合で二量体を形成した後にプロセシングを受けて約26 kDaの二量体の成熟型が生成される。アクチビンはTGF-β(transforming growth factor-β)ファミリーに属する細胞増殖因子である(下記サブファミリーの項目を参照)。主要な二量体のアクチビンはアクチビンA,B,ABである('''図1''')。立体構造も解明されており、各サブユニットは、複数のβシート構造とαヘリックス構造からなり、全体として、二量体はバタフライ様の構造を取る('''図2''')。いわば両手を組合わせたような構造であり、リスト部分のα-ヘリックス構造、4本の指に相当する4つのβ-シート部分が逆並行に配置され、先端はシステイン・ノットと称される結び目構造を取る。アクチビンは他のTGF-βファミリーに比べて、受容体に結合していない状態では、比較的柔軟な構造を取りうる<ref name=Greenwald2004><pubmed>15304227</pubmed></ref><ref name=Thompson2003><pubmed>12660162</pubmed></ref> <ref name=Thompson2005><pubmed>16198295</pubmed></ref>。バタフライ構造がより引き寄せられた構造やより開いた構造も取る。アクチビン・I型受容体・II型受容体複合体は、1:2:2の比率で複合体を形成する。I型受容体はアクチビン二量体のくぼみの部分に、II型受容体にはナックル領域に結合する <ref name=Greenwald2004><pubmed>15304227</pubmed></ref><ref name=Thompson2003><pubmed>12660162</pubmed></ref>。フォリスタチンとの結合はフォリスタチンの項を参照されたい。 | |||
インヒビンは,2種の異なった遺伝子由来のα鎖サブユニットとβ鎖サブユニットの前駆体が二量体を形成し,プロセシングを受けて,カルボキシル末端の成熟型の二量体として成熟体インヒビンが産生される.インヒビンAとインヒビンBが存在する('''図1''')。インヒビンもTGF-βファミリーに属する細胞増殖分化因子である。インヒビンAはアクチビンII型受容体に結合し、βグリカンを共受容体とすることでアクチビンのII型受容体への結合を抑制しアクチビンに拮抗する。インヒビンBのアクチビンII型受容体への結合は下垂体前葉の性線刺激ホルモン産生細胞(ゴナドトロフ)に特異的に発現するTGFBR3L(transforming growth factor beta receptor 3 like)を共受容体とすることで高まりアクチビンと拮抗する <ref name=Brule2021><pubmed>34910520</pubmed></ref><ref name=Lewis2000><pubmed>10746731</pubmed></ref>'''(表1)'''。 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+表1. アクチビンの受容体の構成 | |+表1. アクチビンの受容体の構成 | ||
! リガンド !! タイプII受容体 !! タイプI受容体 !! | ! リガンド !! タイプII受容体 !! タイプI受容体 !! コ・レセプター !! Smad | ||
|- | |- | ||
| | | アクチビン A || ACVR2A, ACVR2B || ACVR1B, (ACVR1C) || || Smad 2,3 with Smad4 | ||
|- | |- | ||
| | | アクチビン B || ACVR2A, ACVR2B || ACVR1C, ACVR1B || - || | ||
|- | |- | ||
| | | アクチビン AB || ACVR2A, ACVR2B || ACVR1B, (ACVR1C) || - || | ||
|- | |- | ||
| | | インヒビン A || ACVR2A, ACVR2B || - || Betaglycan || | ||
|- | |- | ||
| | | インヒビン B || ACVR2A, ACVR2B || - || TGFBR3L || | ||
|} | |} | ||
| 74行目: | 43行目: | ||
! 構造 !! PDB !! 参考文献 | ! 構造 !! PDB !! 参考文献 | ||
|- | |- | ||
| アクチビンA || | | アクチビンA || 2ARV, 915W || <ref name=Harrington2006><pubmed>16482217</pubmed></ref> | ||
|- | |- | ||
| アクチビンAとアクチビンII型受容体 (ACVR2A, | | アクチビンAとアクチビンII型受容体 (ACVR2A, ActRIIA) 複合体 || 7U5P || <ref name=Chu2022><pubmed>35643319</pubmed></ref> | ||
|- | |- | ||
| アクチビンAとアクチビンII型受容体 (ACVR2B, ActRIIB) 複合体(''' | | アクチビンAとアクチビンII型受容体 (ACVR2B, ActRIIB) 複合体('''図3''') || 1NYU 1NYS || <ref name=Thompson2003><pubmed>12660162</pubmed></ref> | ||
|- | |- | ||
| アクチビンAとフォリスタチン複合体 || | | アクチビンAとフォリスタチン複合体 || 2B0U || <ref name=Cash2009><pubmed>19644449</pubmed></ref><ref name=Thompson2005><pubmed>16198295</pubmed></ref> | ||
|- | |- | ||
| アクチビンAとFSTL3(FLRG)複合体 || | | アクチビンAとFSTL3(FLRG)複合体 || 3B4V || <ref name=Stamler2008><pubmed>18768470</pubmed></ref> | ||
|} | |} | ||
== サブファミリー == | |||
一般的に単にアクチビンと表記される場合は、アクチビンAを示すことが多い。主要な二量体のアクチビンはアクチビンA,B,ABである。TGF-βスーパーファミリーに属する細胞増殖分化因子である。TGF-βスーパーファミリーには、多くのリガンドが知られており、TGF-βサブグループ、BMP(骨形成因子)サブグループ、アクチビン/nodalサブグループに大別される。構造上、アクチビンは、マイオスタチン、GDF11に類似している。アクチビンを構成するアクチビンβ鎖はそれぞれ9個のシステインを持つが、多くのTGF-βファミリーに属する分子で保存されている。そのうちの1つのシステインがアクチビンβ鎖の二量体形成に寄与し、他のシステインはサブユニット内のジスルフィド結合に関与し二量体の安定化を支持している。サブファミリーとして、アクチビンには、アクチビンβ鎖を共有した阻害因子のインヒビンが存在することがTGF-βスーパーファミリーの中でユニークである。肝臓特異的な発現をするアクチビンCとアクチビンEは代謝調節に関与している。すべてTGF-βスーパーファミリーに属するポリペプチド型の細胞増殖分化制御因子である。 | |||
[[ファイル:Tsuchida Activin Fig4.png|サムネイル|'''図4. アクチビンのII型およびI型受容体''']] | |||
[[ファイル:Tsuchida Activin Fig5.png|サムネイル|'''図5. アクチビンのシグナル伝達の概要''']] | [[ファイル:Tsuchida Activin Fig5.png|サムネイル|'''図5. アクチビンのシグナル伝達の概要''']] | ||
== アクチビン受容体 == | |||
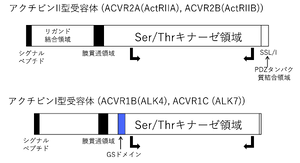
アクチビンを含めたTGF-βファミリーの受容体は、1回膜貫通型で細胞内にセリン/スレオニンキナーゼの構造を有する('''図4''')。I型受容体とII型受容体が存在する。アクチビンは、II型受容体の細胞外領域に結合する。II型受容体は恒常的にリン酸化されている。I型受容体は単独ではアクチビンへの結合は示さないが、アクチビン/II型受容体の複合体に会合する。アクチビンが結合すると、受容体各々の二量体が会合したヘテロ四量体として機能している。II型受容体としては、ActRIIA(ACVR2A)が発現クローニングの手法でTGF-βファミリーの受容体として最初に同定された。その後、ActRIIB(ACVR2B)が発見された <ref name=Mathews1991><pubmed>1646080</pubmed></ref> <ref name=Attisano1992><pubmed>1310075</pubmed></ref><ref name=Tsuchida2008><pubmed>17878607</pubmed></ref>。ACVR2AとACVR2Bの両者はアクチビンのII型受容体として働く。I型受容体は、ALK(activin-receptor like kinase)と総称され、ALK1~7まで存在する。アクチビンのI型受容体は、主にALK4(ActRIB, ACVRIB)であり、アクチビンA, ABのシグナルを伝達する。アクチビンBに関しては、その生理活性がアクチビンAより弱いことが知られていたが、II型受容体への結合が弱いためと考えられている。そして、I型受容体として主としてALK7(ACVR1C、ActRIC)を活性化する <ref name=Bernard2006><pubmed>17040568</pubmed></ref><ref name=Tsuchida2004><pubmed>15196700</pubmed></ref>(Table 1)。ALK7(ACVR1C)は神経系と脂肪組織での発現が高く、アクチビンB以外に、GDF3 (growth differentiation factor 3), GDF1, nodalの受容体としても働く <ref name=Reissmann2001><pubmed>11485994</pubmed></ref> <ref name=Bertolino2008><pubmed>18480258</pubmed></ref>。GDF3, GDF1, Nodalの場合はEGF-CFCファミリーに属するcriptoまたはcrypticが補助因子として受容体の活性化に寄与する。 | |||
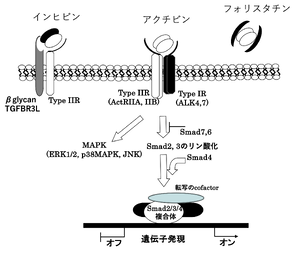
アクチビンがII型受容体の細胞外領域と結合しI型受容体と複合体を形成すると、I型受容体の細胞内領域にあるグリシン/セリンに富んだGS領域がII型受容体によりリン酸化を受ける。アクチビンの細胞内シグナルは、受容体の下流ではTGF-β型のSmadであるSmad2/3をリン酸化し、Smad4と共に核移行し様々な転写活性因子と相互作用し転写を調節している('''図5''')。フィードバックにより、抑制型SmadであるSmad6/7で阻害される。アクチビンのI型受容体(ACVR1BとACVR1C)はTGF-βのI型受容体であるALK5と構造及び機能面で類似しており、細胞内シグナルもTGF-βと共通点が多い <ref name=Tsuchida2008><pubmed>17878607</pubmed></ref>。 | |||
アクチビン受容体にはスプライシングの違いによるアイソフォームが存在する。ActRIIA(ACVR2A)には、神経系特異的なActRIIA-Nが知られている <ref name=Shoji1998><pubmed>9610356</pubmed></ref>。ActRIIB(ACVR2B)にも4種のスプライシングバリアントが報告されている <ref name=Attisano1992><pubmed>1310075</pubmed></ref>。ActRIB (ACVRIB)には下垂体腺腫特異的バリアントが存在する。カルボキシル末端欠損型が見られ、優性阻害体として作用する <ref name=Alexander1996><pubmed>8636304</pubmed></ref>。ActRIC(ACVR1C)にもバリアントが知られている <ref name=Roberts2003><pubmed>12606401</pubmed></ref>。 | |||
細胞外では、アクチビンの結合タンパク質としてフォリスタチンが知られている。フォリスタチンは、細胞外でアクチビンと2:1(フォリスタチン2分子にアクチビン1分子)で結合しその機能を阻害する。 | |||
== 発現 == | == 発現 == | ||
アクチビンAのmRNAやタンパク質は多くの組織で発現が確認される。神経系では、内在性アクチビンAは、海馬ではCA1, CA3, DGでの発現が確認されている。長期増強(LTP, long-term potentiation)誘導刺激で、海馬での発現が顕著に上昇する <ref name=Andreasson1995><pubmed>8596648</pubmed></ref> <ref name=Inokuchi1996><pubmed>8612762</pubmed></ref> <ref name=Tretter1996><pubmed>8905672</pubmed></ref>。神経系では、アクチビンBのmRNAやタンパク質は、皮質、海馬、嗅球、延髄、小脳、視床で発現する。ACVR2Aの神経系での発現は、皮質サブプレート、海馬、嗅球で多く見られる。ACVR1Bは、神経系で大脳皮質、海馬、嗅球、線状体など多くの組織で発現する。ACVR1Cは、前脳、海馬CA3、基底核、視床、小脳での発現が見られる <ref name=Tsuchida1996><pubmed>8875430</pubmed></ref>。ACVR1Cの神経系における機能は最近報告されている。 | |||
== 機能 == | == 機能 == | ||
アクチビンは、多くの細胞・臓器に発現しその作用も多彩である。 | |||
ラット下垂体前葉細胞では主にオートクリンの機構で作用する。阻害抗体でFSH分泌が抑制されることから下垂体ではアクチビンBが自己分泌機能により基礎的なFSH分泌・産生を主に調節している <ref name=Corrigan1991><pubmed>1900235</pubmed></ref> <ref name=Bilezikjian1993><pubmed>8243276</pubmed></ref>。FSHβ鎖サブユニットのmRNA発現を安定化させFSH分泌を促す作用を持つ <ref name=Justice2011><pubmed>21700720</pubmed></ref>。パラクリン作用で下垂体内の他のホルモン分泌にも寄与する可能性がある。アクチビンの存在する組織にはフォリスタチンが存在し作用を調節している。アクチビンのシグナルでフォリスタチンの発現は上昇する。アクチビンの生理作用として、生殖腺顆粒膜細胞や膵内分泌細胞の分化促進,赤芽球分化促進,肝細胞や免疫B細胞のアポトーシス誘導,神経細胞の保護作用を列挙することができる。神経細胞の生存因子としても精製されている <ref name=Schubert1990><pubmed>2330043</pubmed></ref>。 | |||
[[ファイル:Tsuchida Activin Fig6.png|サムネイル|'''図6. 脳におけるアクチビンの機能''']] | [[ファイル:Tsuchida Activin Fig6.png|サムネイル|'''図6. 脳におけるアクチビンの機能''']] | ||
[[ファイル:Tsuchida Activin Fig7.png|サムネイル|'''図7. シナプスでのアクチビンのシグナル''']] | [[ファイル:Tsuchida Activin Fig7.png|サムネイル|'''図7. シナプスでのアクチビンのシグナル''']] | ||
=== 神経系での機能 === | |||
海馬などに見られる興奮性シナプスには、神経伝達物質の受け取り側のポストシナプスに樹状突起の棘(スパイン)と呼ばれる構造が存在し、記憶素子として重要である。アクチビンには、スパインのネック(首部分)を伸長させる効果と各スパインに接触するプレシナプス数を増加させる作用がある <ref name=Shoji-Kasai2007><pubmed>17940062</pubmed></ref>。この効果は、Erk1/2のリン酸化を介している。 | |||
興奮性シナプス入力によりアクチビンβAのmRNAが急速かつ一過性に誘導される <ref name=Andreasson1995><pubmed>8596648</pubmed></ref> <ref name=Inokuchi1996><pubmed>8612762</pubmed></ref>。長期増強をもたらす高周波シナプス刺激によって海馬の顆粒細胞ニューロンで誘導され、それはNMDA受容体依存性である。カイニン酸刺激によるてんかん誘導や海馬損傷でも強く誘導される <ref name=Inokuchi1996><pubmed>8612762</pubmed></ref><ref name=Tretter1996><pubmed>8905672</pubmed></ref>。塩基性繊維芽細胞増殖因子(basic fibroblast growth factor, bFGF)には神経保護作用があるがアクチビンが仲介している <ref name=Tretter2000><pubmed>10888932</pubmed></ref>。bFGFと協調して線状体ニューロンでチロシンヒドロキシラーゼを誘導する <ref name=Bao2005><pubmed>15749808</pubmed></ref>。また、アクチビンAにはパーキンソン病のモデル動物の中脳ニューロンの保護作用と抗炎症作用を持つことが報告されている <ref name=Stayte2015><pubmed>25902062</pubmed></ref> <ref name=Stayte2017><pubmed>28121982</pubmed></ref>。脳虚血時に誘導され、p38やJNKを介して神経保護作用・神経細胞生存作用を持つ <ref name=Tretter2000><pubmed>10888932</pubmed></ref>。 | |||
興奮性シナプス入力によりアクチビンβAのmRNAが急速かつ一過性に誘導される<ref name=Andreasson1995><pubmed>8596648</pubmed></ref><ref name=Inokuchi1996><pubmed>8612762</pubmed></ref> | |||
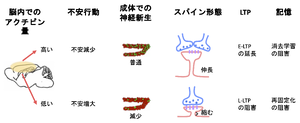
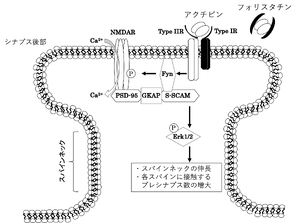
一方、神経新生においては、海馬などの神経系でのアクチビンの発現レベルが、神経形成に関与する。フォリスタチンによってアクチビン活性が抑制されると、神経新生が低下し、その結果、不安行動が増強される <ref name=Ageta2008><pubmed>18382659</pubmed></ref>。さらに、アクチビンは、海馬CA1での前期LTP (early-LTP, E-LTP)の持続期間を長くし、後期LTP(late-LTP, L-LTP)の維持に関与する。脳内のアクチビンのレベルに依存して、記憶の強化あるいは記憶の再固定化や記憶消去に関与する <ref name=Ageta2010><pubmed>20332189</pubmed></ref>'''(図6)'''。シナプス後ニューロンにNMDA受容体を介してカルシウムが流入すると、LTP誘導が惹起される。アクチビンは海馬ニューロンにおいて、持続的なNMDA受容体のリン酸化を引き起こすことでカルシウムを流入させる。アクチビンII型受容体は、カルボキシル末端で後シナプスの裏打ちタンパク質であるS-SCAM (ARIP1)やPSD95と結合する。アクチビン受容体、NMDA受容体、PSD95、S-SCAMが複合体を形成し、Fynを含むSrcファミリーのチロシンキナーゼを活性化することが持続的なNMDA受容体の活性化につながると想定されている <ref name=Kurisaki2008><pubmed>18201830</pubmed></ref>(図7)。 | |||
ACVR1C(ALK7)は、アクチビン特に、アクチビンB, ABのシグナルを仲介する受容体である。ACVR1Cは海馬を含めた中枢神経での発現が高い。運動負荷を与えると、CA1領域を含めた背側海馬での発現が上昇し、記憶に関与する分子として作用するとの報告がある <ref name=Keiser2024><pubmed>38714691</pubmed></ref> <ref name=LaTour2024><pubmed>39137861</pubmed></ref>。主に記憶の固定化における空間的記憶と認知機能を評価する試験として、物体位置記憶(OLM, object location memory)がある。物体の位置を記憶させ、後で再認識する能力の評価法である。主に記憶の固定化における空間的記憶と認知機能を評価する試験である。増加したACVR1Cは、記憶の固定化、LTPに寄与すること、阻害剤でそれが抑制されることから記憶に深く関わる分子と考えられている。こうしたACVR1Cの発現挙動はBDNF(brain-derived neurotrophic factor)と類似している。自発的運動と長期増強やシナプス可塑性をつなぐ数少ない遺伝子である。アルツハイマーモデル動物や老化モデルの海馬ではACVR1Cが低下しており、強制発現させると記憶機能の回復が見られた <ref name=Keiser2024><pubmed>38714691</pubmed></ref>。 | |||
シナプスタッギングは、特定のシナプスが可塑的変化を維持するために「タグ(標識)」を形成し、その後のタンパク質合成依存的なL-LTPを形成する過程である(シナプスタグ仮説は関連項目を参照。)。アクチビン受容体の一つであるACVR1Cが、シナプスタッギングによる可塑性と長期増強の両者に関与する機構が想定されている <ref name=Keiser2024><pubmed>38714691</pubmed></ref><ref name=Park2017><pubmed>28927503</pubmed></ref>。 | |||
=== 発生=== | === 発生=== | ||
アクチビンのツメガエル胚のアニマルキャップ刺激による強力な中胚葉誘導作用は関連研究を大きく進展させた。アクチビンの濃度依存的に様々な臓器形成を誘導することが可能なことが明らかになっており、再生医療の発端であったと言える <ref name=Asashima2024><pubmed>38295873</pubmed></ref>。 | |||
多能性幹細胞であるES細胞(embryonic stem cell)の培養系やEB(embryoid body)において多分化能の維持や分化には多くの因子が働いている。アクチビンは、幹細胞の神経誘導に関与する。また、胚性幹細胞由来の終脳神経前駆細胞における皮質介在ニューロン分化を制御している <ref name=Cambray2012><pubmed>22588303</pubmed></ref>。ES, iPS細胞を用いた研究から、アクチビンは線状体投射ニューロンへの細胞分化の決定に関与するものと考えられる <ref name=Arber2015><pubmed>25804741</pubmed></ref>。近年の再生医療研究に欠かせない因子となっている。 | |||
=== | === 骨格筋への作用 === | ||
アクチビンと構造上類似したマイオスタチンは骨格筋により産生され全身の骨格筋に作用し筋肉量を負に調節していることが、マウス、家畜牛、羊、魚類で確認されている <ref name=Kresak2023><pubmed>36642816</pubmed></ref><ref name=Lee1999><pubmed>10508689</pubmed></ref>。マイオカインの1種である。アクチビンも筋量を調節しており、特にヒトを含めた霊長類ではマイオスタチンと共にアクチビンが筋量を調節している可能性が高い <ref name=Latres2017><pubmed>28452368</pubmed></ref><ref name=Lee2007><pubmed>17726519</pubmed></ref><ref name=Lee2010><pubmed>20810712</pubmed></ref>。 | |||
加齢にともなう筋萎縮であるサルコペニア誘導やがん悪液質では、アクチビンシグナルが過剰に働いており、その阻害によって病態改善効果が期待されている <ref name=Chen2014><pubmed>24378873</pubmed></ref><ref name=Lee2011><pubmed>21798080</pubmed></ref><ref name=Zhou2010><pubmed>20723755</pubmed></ref>。 | |||
=== ノックアウト動物 === | === ノックアウト動物 === | ||
アクチビンと関連する受容体については、遺伝子破壊ノックアウト(KO)マウスが作製され解析されている。 | |||
アクチビンA(アクチビンβA遺伝子)のKOマウスは、生後24時間以内に死亡する。マウスの解析から,アクチビンAは口蓋,頬鬚,下顎切歯形成、頭蓋顔面形成に関与する <ref name=Matzuk1995><pubmed>7885474</pubmed></ref>。 | |||
アクチビンB(アクチビンβB遺伝子)のKOマウスは、胎生後期に眼瞼融合障害が見られる。胎児の発育不全を主とした生殖異常が見られる <ref name=Vassalli1994><pubmed>8125256</pubmed></ref>。 | |||
ActRIIAのKOマウスでは、血中のFSH値が低下し、生殖能低下も見られる。FSHレベルの調節に必須の受容体である<ref name=Matzuk1995><pubmed>7885474</pubmed></ref>。歯形成異常はアクチビンAのKOと同様である。しかし一致しない表現型もあるため、生体内ではアクチビン以外のリガンドの受容体として働くことが示唆された。 | ActRIIAのKOマウスでは、血中のFSH値が低下し、生殖能低下も見られる。FSHレベルの調節に必須の受容体である <ref name=Matzuk1995><pubmed>7885474</pubmed></ref>。歯形成異常はアクチビンAのKOと同様である。しかし一致しない表現型もあるため、生体内ではアクチビン以外のリガンドの受容体として働くことが示唆された。 | ||
ActRIIBのKOマウスでは、左右軸発生異常、心房および心室中隔欠損、肺や脾臓の低形成が見られる <ref name=Oh1997><pubmed>9242489</pubmed></ref>。 | |||
ActRIB(ALK4) | ActRIB(ALK4)のKOマウスでは、原始線条形成異常が見られ、胎生致死である <ref name=Gu1998><pubmed>9512518</pubmed></ref>。ACVR1B遺伝子の細胞内領域のフレームシフトや欠損による早期翻訳停止等の体性変異が、膵がん,胃がん、肝がんで見られる <ref name=Reissmann2001><pubmed>11485994</pubmed></ref>。 | ||
ActRIC(ALK7) | ActRIC(ALK7)は、神経系、分化脂肪細胞等に高発現する。ActRICのKOマウスは、生存や繁殖には問題がないが、脂肪沈着の低下と摂食性肥満に対して部分的な抵抗性を示す <ref name=Andersson2008><pubmed>18480259</pubmed></ref>。この表現型はGdf3-/-と類似している <ref name=Bertolino2008><pubmed>18480258</pubmed></ref><ref name=Shen2009><pubmed>19008465</pubmed></ref>。また、加齢に伴う高インスリン血症と肝硬変が観察される。これはアクチビンβBのKOマウスの表現型と類似している <ref name=Tsuchida2004><pubmed>15196700</pubmed></ref> <ref name=Bertolino2008><pubmed>18480258</pubmed></ref>。GDF-3とアクチビンBの生体内でのI型受容体がActRIC(ALK7)であることを示している。さらに、ACVR1C(ALK7)はNodalの受容体としても作用する <ref name=Nadeem2011><pubmed>21356369</pubmed></ref>。 | ||
== 疾患との関わり == | == 疾患との関わり == | ||
神経筋変性疾患に関して、機能の項で示したように、神経系でアクチビンは神経保護作用があり、パーキンソン病などの神経変性疾患に関与する可能性がある。また、記憶の増強やシナプス増強に関与するため老化やアルツハイマー病の新たな治療標的となる可能性がある。 | |||
サルコペニアや悪液質による筋萎縮、貧血や骨髄疾患、肺動脈性肺高血圧症 (PAH) への応用展開が行われている。マイオスタチンとアクチビンは筋肉量を負に制御するため、その阻害による筋萎縮性疾患への治療が期待されている<ref name=Lee2021><pubmed>33938454</pubmed></ref>。 | |||
ACVR2A(ActRIIA)やACVR2B(ActRIIB) | ACVR2A(ActRIIA)やACVR2B(ActRIIB)の細胞外ドメインタンパク質によるリガンドトラップ法や抗体医薬は、貧血性骨髄疾患、筋萎縮性疾患,癌悪液質の治療薬候補として期待されている。実際に、ラスパテルセプトは、ヒトACVR2Bの細胞外領域とヒト免疫グロブリンIgGのFc領域の融合分子であり、GDF11を阻害する。人工的に点変異を導入しており、アクチビン阻害は弱いとされる。エリスロポイエチンとは異なった機序で増血効果があり、最近、サラセミアや骨髄異形成症の治療薬となった <ref name=Fenaux2019><pubmed>30602619</pubmed></ref><ref name=Molica2024><pubmed>38555469</pubmed></ref>。また、ソタセルセプトは、ヒトACVR2Aの細胞外領域とヒト免疫グロブリンIgGのFc領域の融合分子であり、肺動脈性肺高血圧症 (PAH) の新たな治療薬として承認された <ref name=Hoeper2023><pubmed>36877098</pubmed></ref><ref name=Madonna2024><pubmed>39571875</pubmed></ref>。この分子は、GDF11、マイオスタチン、アクチビンを阻害する。 | ||
FOP(fibrodysplasia ossicans progressive、進行性骨化性線維異形成症)は、骨格筋・腱・結合組織に進行性の異所性の骨化をきたす希少疾患である。通常、ACVR1A(ALK2)は、アクチビンの受容体ではなくBMPファミリーの受容体として作用する。ところが、FOPで見られるACVR1A(ALK2)機能獲得型遺伝子変異体 (GS領域のR206Hが典型例)では、アクチビンが変異受容体に過剰に反応することで、異所性に骨形成を誘導させる <ref name=Kaplan2009><pubmed>19085907</pubmed></ref> <ref name=Hino2015><pubmed>26621707</pubmed></ref><ref name=Srinivasan2024><pubmed>38254701</pubmed></ref> <ref name=Kaplan2025><pubmed>39299836</pubmed></ref>。そのため、アクチビンの阻害抗体やACVR2B-Fcタンパク質で阻害する方法論がFOPの治療薬候補となっている <ref name=Srinivasan2024><pubmed>38254701</pubmed></ref> <ref name=Gao2024><pubmed>38500216</pubmed></ref>。興味深いことに、同じALK2変異が、希少小児がんであるdiffuse intrinsic pontine glioma (DIPG)の原因遺伝子と報告されている <ref name=Taylor2014><pubmed>24705252</pubmed></ref> <ref name=Kresak2023><pubmed>36642816</pubmed></ref>。 | |||
== 関連語 == | == 関連語 == | ||
| 156行目: | 126行目: | ||
* [[PSD-95]] | * [[PSD-95]] | ||
* [[シナプスタグ]] | * [[シナプスタグ]] | ||
2025年4月5日 (土) 21:25時点における版
上田 洋司、土田 邦博
藤田医科大学 医科学研究センター 難病治療学部門
DOI:10.14931/bsd.10935 原稿受付日:2025年3月25日 原稿完成日:2025年4月4日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英:activin
アクチビンは、下垂体前葉細胞から卵胞刺激ホルモン(FSH)の分泌を促進する分子として発見されたTGF-βファミリーに属するポリペプチドである。アクチビンは、アクチビンβ鎖のホモ二量体またはヘテロ二量体として存在し、共通したβ鎖サブユニットを持つインヒビンとは異なる生理作用を示す。主要なサブファミリーにはアクチビンA、B、ABがあり、肝臓特異的なアクチビンC、Eも知られている。アクチビンは、神経内分泌系や細胞の分化誘導に関与するペプチドホルモンであり、細胞分化、アポトーシス、初期発生、細胞周期調節、創傷治癒、免疫調節など多様な生理作用を持つ。特に神経系においては記憶調節や神経栄養因子様の作用があり、疾患との関連も注目されている。
アクチビンとは
アクチビンは、下垂体前葉細胞からの卵胞刺激ホルモン(FSH)分泌を抑制するインビビンをブタ卵胞液から精製する過程で、インヒビンとは逆にFSHの分泌を促進する分子として偶然に発見された [1][2]。
内分泌の要である視床下部―下垂体―生殖腺系では、視床下部由来のGnRH(gonadotropin-releasing hormone)が下垂体前葉からのゴナドトロピン(FSH, LH(黄体形成ホルモン))の分泌を促進し、生殖腺でのステロイド産生と成熟を促す。生殖腺ではエストロゲンなどのステロイドホルモンやFSH, LHが視床下部へのネガティブ・フィードバック機構でGnRH産生を抑制している。生殖腺由来の非ステロイド性の分子が下垂体前葉からのFSHの産生や分泌を特異的に抑制する機構が提唱されていた。これが1932年に提唱されたインヒビン仮説である[3]。1985年になるとインヒビンがブタ卵胞液からタンパク質として精製され、その存在が証明された [4]。インヒビンは18kDaのインヒビンα鎖と13kDaのアクチビンβ鎖(βAあるいはβB)のペプチドがS-S結合を介してヘテロ二量体の構造を有する。インヒビンA(αβA)とインヒビンB(αβB)である(図1)。このインヒビン精製の過程で、逆にFSHの分泌を促進するペプチドも発見されアクチビンと命名された。その際、精製されたのは、アクチビンA(βAβA:アクチビンβA鎖のホモ二量体)とアクチビンAB(βAβB:アクチビンはβA鎖とアクチビンβB鎖のヘテロ二量体)である。その後、卵巣、卵胞液、フォリスタチン/アクチビンを複合体として精製することで、アクチビンB(βBβB:アクチビンβB鎖のホモ二量体)も生体内で存在することが証明されている。なお、フォリスタチンは、細胞外でアクチビンに結合しその生理活性を強く阻害する。
構造的には、アクチビンはTGF-βファミリーに属するポリペプチドであり、アクチビンβ鎖(インヒビンβ鎖とも称されるが、本稿ではアクチビンβ鎖と呼ぶ。)のホモ二量体またはヘテロ二量体として存在する。インヒビンはインヒビンα鎖とアクチビンβ鎖のヘテロ二量体であり、インヒビンとアクチビンは共通のβ鎖を持つことから部分的に類似した構造を有する。しかしながら、生理学的作用は正反対である。インヒビンのサブユニットのインヒビンα鎖は1種類のみであり、アクチビンβ鎖の違いによりインヒビンAとインヒビンBが存在する。アクチビンを構成するβ鎖サブユニットにはβA鎖とβB鎖が知られている。主要なサブファミリーとしては、アクチビンA(βAβA), B(βBβB), AB(βAβB)が生体に存在する(図1)。なお、肝臓特異的に発現するアクチビンC(βCβC)とアクチビンE(βEβE)も知られている。アクチビンは、神経内分泌系や細胞の分化誘導に関わるペプチドホルモンであるが、それ以外にも様々な生理作用を有する重要なシグナル分子である。生殖器系への作用が主に解析されてきたがその機能は極めて多彩で、細胞分化、アポトーシス、初期発生、細胞周期調節、創傷治癒、免疫調節など多岐に渡る。神経系でも興味深い作用を発揮する。
アクチビン/インヒビン/フォリスタチン系は神経内分泌系、下垂体制御系で重要な生理作用を持つ。生殖腺由来のインヒビンはフィードバック調節による下垂体での作用が主要であり低濃度でFSH産生を抑制する。これはFSHの基礎分泌がアクチビンにより維持されており、それをインヒビンがアンタゴニストとして作用し、それを阻害するためと考えられている。アクチビンの作用は産生組織周辺のオートクライン作用あるいはパラクリン作用が主体である。例えば、下垂体内ではオートクライン作用でFSHの転写や分泌を調節している。卵巣顆粒膜細胞では、アクチビンはプロゲステロン産生やLH受容体を増加させ黄体化を促進する。この作用は主としてパラクライン作用と考えられている。アクチビンは多くの組織で産生され、視床下部―下垂体―生殖腺以外の組織でも多彩な機能を発揮する。神経系でもアクチビンは極めてユニークな作用を発揮する。
構造
アクチビンは,アクチビンβA鎖あるいはアクチビンβB鎖のホモ二量体あるいはヘテロ二量体である。前駆体ペプチドがS-S結合で二量体を形成した後にプロセシングを受けて約26 kDaの二量体の成熟型が生成される。アクチビンはTGF-β(transforming growth factor-β)ファミリーに属する細胞増殖因子である(下記サブファミリーの項目を参照)。主要な二量体のアクチビンはアクチビンA,B,ABである(図1)。立体構造も解明されており、各サブユニットは、複数のβシート構造とαヘリックス構造からなり、全体として、二量体はバタフライ様の構造を取る(図2)。いわば両手を組合わせたような構造であり、リスト部分のα-ヘリックス構造、4本の指に相当する4つのβ-シート部分が逆並行に配置され、先端はシステイン・ノットと称される結び目構造を取る。アクチビンは他のTGF-βファミリーに比べて、受容体に結合していない状態では、比較的柔軟な構造を取りうる[5][6] [7]。バタフライ構造がより引き寄せられた構造やより開いた構造も取る。アクチビン・I型受容体・II型受容体複合体は、1:2:2の比率で複合体を形成する。I型受容体はアクチビン二量体のくぼみの部分に、II型受容体にはナックル領域に結合する [5][6]。フォリスタチンとの結合はフォリスタチンの項を参照されたい。
インヒビンは,2種の異なった遺伝子由来のα鎖サブユニットとβ鎖サブユニットの前駆体が二量体を形成し,プロセシングを受けて,カルボキシル末端の成熟型の二量体として成熟体インヒビンが産生される.インヒビンAとインヒビンBが存在する(図1)。インヒビンもTGF-βファミリーに属する細胞増殖分化因子である。インヒビンAはアクチビンII型受容体に結合し、βグリカンを共受容体とすることでアクチビンのII型受容体への結合を抑制しアクチビンに拮抗する。インヒビンBのアクチビンII型受容体への結合は下垂体前葉の性線刺激ホルモン産生細胞(ゴナドトロフ)に特異的に発現するTGFBR3L(transforming growth factor beta receptor 3 like)を共受容体とすることで高まりアクチビンと拮抗する [8][9](表1)。
| リガンド | タイプII受容体 | タイプI受容体 | コ・レセプター | Smad |
|---|---|---|---|---|
| アクチビン A | ACVR2A, ACVR2B | ACVR1B, (ACVR1C) | Smad 2,3 with Smad4 | |
| アクチビン B | ACVR2A, ACVR2B | ACVR1C, ACVR1B | - | |
| アクチビン AB | ACVR2A, ACVR2B | ACVR1B, (ACVR1C) | - | |
| インヒビン A | ACVR2A, ACVR2B | - | Betaglycan | |
| インヒビン B | ACVR2A, ACVR2B | - | TGFBR3L |
立体構造は、データベースで確認することができる(表2)。
| 構造 | PDB | 参考文献 |
|---|---|---|
| アクチビンA | 2ARV, 915W | [10] |
| アクチビンAとアクチビンII型受容体 (ACVR2A, ActRIIA) 複合体 | 7U5P | [11] |
| アクチビンAとアクチビンII型受容体 (ACVR2B, ActRIIB) 複合体(図3) | 1NYU 1NYS | [6] |
| アクチビンAとフォリスタチン複合体 | 2B0U | [12][7] |
| アクチビンAとFSTL3(FLRG)複合体 | 3B4V | [13] |
サブファミリー
一般的に単にアクチビンと表記される場合は、アクチビンAを示すことが多い。主要な二量体のアクチビンはアクチビンA,B,ABである。TGF-βスーパーファミリーに属する細胞増殖分化因子である。TGF-βスーパーファミリーには、多くのリガンドが知られており、TGF-βサブグループ、BMP(骨形成因子)サブグループ、アクチビン/nodalサブグループに大別される。構造上、アクチビンは、マイオスタチン、GDF11に類似している。アクチビンを構成するアクチビンβ鎖はそれぞれ9個のシステインを持つが、多くのTGF-βファミリーに属する分子で保存されている。そのうちの1つのシステインがアクチビンβ鎖の二量体形成に寄与し、他のシステインはサブユニット内のジスルフィド結合に関与し二量体の安定化を支持している。サブファミリーとして、アクチビンには、アクチビンβ鎖を共有した阻害因子のインヒビンが存在することがTGF-βスーパーファミリーの中でユニークである。肝臓特異的な発現をするアクチビンCとアクチビンEは代謝調節に関与している。すべてTGF-βスーパーファミリーに属するポリペプチド型の細胞増殖分化制御因子である。
アクチビン受容体
アクチビンを含めたTGF-βファミリーの受容体は、1回膜貫通型で細胞内にセリン/スレオニンキナーゼの構造を有する(図4)。I型受容体とII型受容体が存在する。アクチビンは、II型受容体の細胞外領域に結合する。II型受容体は恒常的にリン酸化されている。I型受容体は単独ではアクチビンへの結合は示さないが、アクチビン/II型受容体の複合体に会合する。アクチビンが結合すると、受容体各々の二量体が会合したヘテロ四量体として機能している。II型受容体としては、ActRIIA(ACVR2A)が発現クローニングの手法でTGF-βファミリーの受容体として最初に同定された。その後、ActRIIB(ACVR2B)が発見された [14] [15][16]。ACVR2AとACVR2Bの両者はアクチビンのII型受容体として働く。I型受容体は、ALK(activin-receptor like kinase)と総称され、ALK1~7まで存在する。アクチビンのI型受容体は、主にALK4(ActRIB, ACVRIB)であり、アクチビンA, ABのシグナルを伝達する。アクチビンBに関しては、その生理活性がアクチビンAより弱いことが知られていたが、II型受容体への結合が弱いためと考えられている。そして、I型受容体として主としてALK7(ACVR1C、ActRIC)を活性化する [17][18](Table 1)。ALK7(ACVR1C)は神経系と脂肪組織での発現が高く、アクチビンB以外に、GDF3 (growth differentiation factor 3), GDF1, nodalの受容体としても働く [19] [20]。GDF3, GDF1, Nodalの場合はEGF-CFCファミリーに属するcriptoまたはcrypticが補助因子として受容体の活性化に寄与する。
アクチビンがII型受容体の細胞外領域と結合しI型受容体と複合体を形成すると、I型受容体の細胞内領域にあるグリシン/セリンに富んだGS領域がII型受容体によりリン酸化を受ける。アクチビンの細胞内シグナルは、受容体の下流ではTGF-β型のSmadであるSmad2/3をリン酸化し、Smad4と共に核移行し様々な転写活性因子と相互作用し転写を調節している(図5)。フィードバックにより、抑制型SmadであるSmad6/7で阻害される。アクチビンのI型受容体(ACVR1BとACVR1C)はTGF-βのI型受容体であるALK5と構造及び機能面で類似しており、細胞内シグナルもTGF-βと共通点が多い [16]。
アクチビン受容体にはスプライシングの違いによるアイソフォームが存在する。ActRIIA(ACVR2A)には、神経系特異的なActRIIA-Nが知られている [21]。ActRIIB(ACVR2B)にも4種のスプライシングバリアントが報告されている [15]。ActRIB (ACVRIB)には下垂体腺腫特異的バリアントが存在する。カルボキシル末端欠損型が見られ、優性阻害体として作用する [22]。ActRIC(ACVR1C)にもバリアントが知られている [23]。 細胞外では、アクチビンの結合タンパク質としてフォリスタチンが知られている。フォリスタチンは、細胞外でアクチビンと2:1(フォリスタチン2分子にアクチビン1分子)で結合しその機能を阻害する。
発現
アクチビンAのmRNAやタンパク質は多くの組織で発現が確認される。神経系では、内在性アクチビンAは、海馬ではCA1, CA3, DGでの発現が確認されている。長期増強(LTP, long-term potentiation)誘導刺激で、海馬での発現が顕著に上昇する [24] [25] [26]。神経系では、アクチビンBのmRNAやタンパク質は、皮質、海馬、嗅球、延髄、小脳、視床で発現する。ACVR2Aの神経系での発現は、皮質サブプレート、海馬、嗅球で多く見られる。ACVR1Bは、神経系で大脳皮質、海馬、嗅球、線状体など多くの組織で発現する。ACVR1Cは、前脳、海馬CA3、基底核、視床、小脳での発現が見られる [27]。ACVR1Cの神経系における機能は最近報告されている。
機能
アクチビンは、多くの細胞・臓器に発現しその作用も多彩である。
ラット下垂体前葉細胞では主にオートクリンの機構で作用する。阻害抗体でFSH分泌が抑制されることから下垂体ではアクチビンBが自己分泌機能により基礎的なFSH分泌・産生を主に調節している [28] [29]。FSHβ鎖サブユニットのmRNA発現を安定化させFSH分泌を促す作用を持つ [30]。パラクリン作用で下垂体内の他のホルモン分泌にも寄与する可能性がある。アクチビンの存在する組織にはフォリスタチンが存在し作用を調節している。アクチビンのシグナルでフォリスタチンの発現は上昇する。アクチビンの生理作用として、生殖腺顆粒膜細胞や膵内分泌細胞の分化促進,赤芽球分化促進,肝細胞や免疫B細胞のアポトーシス誘導,神経細胞の保護作用を列挙することができる。神経細胞の生存因子としても精製されている [31]。
神経系での機能
海馬などに見られる興奮性シナプスには、神経伝達物質の受け取り側のポストシナプスに樹状突起の棘(スパイン)と呼ばれる構造が存在し、記憶素子として重要である。アクチビンには、スパインのネック(首部分)を伸長させる効果と各スパインに接触するプレシナプス数を増加させる作用がある [32]。この効果は、Erk1/2のリン酸化を介している。
興奮性シナプス入力によりアクチビンβAのmRNAが急速かつ一過性に誘導される [24] [25]。長期増強をもたらす高周波シナプス刺激によって海馬の顆粒細胞ニューロンで誘導され、それはNMDA受容体依存性である。カイニン酸刺激によるてんかん誘導や海馬損傷でも強く誘導される [25][26]。塩基性繊維芽細胞増殖因子(basic fibroblast growth factor, bFGF)には神経保護作用があるがアクチビンが仲介している [33]。bFGFと協調して線状体ニューロンでチロシンヒドロキシラーゼを誘導する [34]。また、アクチビンAにはパーキンソン病のモデル動物の中脳ニューロンの保護作用と抗炎症作用を持つことが報告されている [35] [36]。脳虚血時に誘導され、p38やJNKを介して神経保護作用・神経細胞生存作用を持つ [33]。
一方、神経新生においては、海馬などの神経系でのアクチビンの発現レベルが、神経形成に関与する。フォリスタチンによってアクチビン活性が抑制されると、神経新生が低下し、その結果、不安行動が増強される [37]。さらに、アクチビンは、海馬CA1での前期LTP (early-LTP, E-LTP)の持続期間を長くし、後期LTP(late-LTP, L-LTP)の維持に関与する。脳内のアクチビンのレベルに依存して、記憶の強化あるいは記憶の再固定化や記憶消去に関与する [38](図6)。シナプス後ニューロンにNMDA受容体を介してカルシウムが流入すると、LTP誘導が惹起される。アクチビンは海馬ニューロンにおいて、持続的なNMDA受容体のリン酸化を引き起こすことでカルシウムを流入させる。アクチビンII型受容体は、カルボキシル末端で後シナプスの裏打ちタンパク質であるS-SCAM (ARIP1)やPSD95と結合する。アクチビン受容体、NMDA受容体、PSD95、S-SCAMが複合体を形成し、Fynを含むSrcファミリーのチロシンキナーゼを活性化することが持続的なNMDA受容体の活性化につながると想定されている [39](図7)。 ACVR1C(ALK7)は、アクチビン特に、アクチビンB, ABのシグナルを仲介する受容体である。ACVR1Cは海馬を含めた中枢神経での発現が高い。運動負荷を与えると、CA1領域を含めた背側海馬での発現が上昇し、記憶に関与する分子として作用するとの報告がある [40] [41]。主に記憶の固定化における空間的記憶と認知機能を評価する試験として、物体位置記憶(OLM, object location memory)がある。物体の位置を記憶させ、後で再認識する能力の評価法である。主に記憶の固定化における空間的記憶と認知機能を評価する試験である。増加したACVR1Cは、記憶の固定化、LTPに寄与すること、阻害剤でそれが抑制されることから記憶に深く関わる分子と考えられている。こうしたACVR1Cの発現挙動はBDNF(brain-derived neurotrophic factor)と類似している。自発的運動と長期増強やシナプス可塑性をつなぐ数少ない遺伝子である。アルツハイマーモデル動物や老化モデルの海馬ではACVR1Cが低下しており、強制発現させると記憶機能の回復が見られた [40]。
シナプスタッギングは、特定のシナプスが可塑的変化を維持するために「タグ(標識)」を形成し、その後のタンパク質合成依存的なL-LTPを形成する過程である(シナプスタグ仮説は関連項目を参照。)。アクチビン受容体の一つであるACVR1Cが、シナプスタッギングによる可塑性と長期増強の両者に関与する機構が想定されている [40][42]。
発生
アクチビンのツメガエル胚のアニマルキャップ刺激による強力な中胚葉誘導作用は関連研究を大きく進展させた。アクチビンの濃度依存的に様々な臓器形成を誘導することが可能なことが明らかになっており、再生医療の発端であったと言える [43]。
多能性幹細胞であるES細胞(embryonic stem cell)の培養系やEB(embryoid body)において多分化能の維持や分化には多くの因子が働いている。アクチビンは、幹細胞の神経誘導に関与する。また、胚性幹細胞由来の終脳神経前駆細胞における皮質介在ニューロン分化を制御している [44]。ES, iPS細胞を用いた研究から、アクチビンは線状体投射ニューロンへの細胞分化の決定に関与するものと考えられる [45]。近年の再生医療研究に欠かせない因子となっている。
骨格筋への作用
アクチビンと構造上類似したマイオスタチンは骨格筋により産生され全身の骨格筋に作用し筋肉量を負に調節していることが、マウス、家畜牛、羊、魚類で確認されている [46][47]。マイオカインの1種である。アクチビンも筋量を調節しており、特にヒトを含めた霊長類ではマイオスタチンと共にアクチビンが筋量を調節している可能性が高い [48][49][50]。
加齢にともなう筋萎縮であるサルコペニア誘導やがん悪液質では、アクチビンシグナルが過剰に働いており、その阻害によって病態改善効果が期待されている [51][52][53]。
ノックアウト動物
アクチビンと関連する受容体については、遺伝子破壊ノックアウト(KO)マウスが作製され解析されている。
アクチビンA(アクチビンβA遺伝子)のKOマウスは、生後24時間以内に死亡する。マウスの解析から,アクチビンAは口蓋,頬鬚,下顎切歯形成、頭蓋顔面形成に関与する [54]。
アクチビンB(アクチビンβB遺伝子)のKOマウスは、胎生後期に眼瞼融合障害が見られる。胎児の発育不全を主とした生殖異常が見られる [55]。
ActRIIAのKOマウスでは、血中のFSH値が低下し、生殖能低下も見られる。FSHレベルの調節に必須の受容体である [54]。歯形成異常はアクチビンAのKOと同様である。しかし一致しない表現型もあるため、生体内ではアクチビン以外のリガンドの受容体として働くことが示唆された。
ActRIIBのKOマウスでは、左右軸発生異常、心房および心室中隔欠損、肺や脾臓の低形成が見られる [56]。
ActRIB(ALK4)のKOマウスでは、原始線条形成異常が見られ、胎生致死である [57]。ACVR1B遺伝子の細胞内領域のフレームシフトや欠損による早期翻訳停止等の体性変異が、膵がん,胃がん、肝がんで見られる [19]。
ActRIC(ALK7)は、神経系、分化脂肪細胞等に高発現する。ActRICのKOマウスは、生存や繁殖には問題がないが、脂肪沈着の低下と摂食性肥満に対して部分的な抵抗性を示す [58]。この表現型はGdf3-/-と類似している [20][59]。また、加齢に伴う高インスリン血症と肝硬変が観察される。これはアクチビンβBのKOマウスの表現型と類似している [18] [20]。GDF-3とアクチビンBの生体内でのI型受容体がActRIC(ALK7)であることを示している。さらに、ACVR1C(ALK7)はNodalの受容体としても作用する [60]。
疾患との関わり
神経筋変性疾患に関して、機能の項で示したように、神経系でアクチビンは神経保護作用があり、パーキンソン病などの神経変性疾患に関与する可能性がある。また、記憶の増強やシナプス増強に関与するため老化やアルツハイマー病の新たな治療標的となる可能性がある。
サルコペニアや悪液質による筋萎縮、貧血や骨髄疾患、肺動脈性肺高血圧症 (PAH) への応用展開が行われている。マイオスタチンとアクチビンは筋肉量を負に制御するため、その阻害による筋萎縮性疾患への治療が期待されている[61]。
ACVR2A(ActRIIA)やACVR2B(ActRIIB)の細胞外ドメインタンパク質によるリガンドトラップ法や抗体医薬は、貧血性骨髄疾患、筋萎縮性疾患,癌悪液質の治療薬候補として期待されている。実際に、ラスパテルセプトは、ヒトACVR2Bの細胞外領域とヒト免疫グロブリンIgGのFc領域の融合分子であり、GDF11を阻害する。人工的に点変異を導入しており、アクチビン阻害は弱いとされる。エリスロポイエチンとは異なった機序で増血効果があり、最近、サラセミアや骨髄異形成症の治療薬となった [62][63]。また、ソタセルセプトは、ヒトACVR2Aの細胞外領域とヒト免疫グロブリンIgGのFc領域の融合分子であり、肺動脈性肺高血圧症 (PAH) の新たな治療薬として承認された [64][65]。この分子は、GDF11、マイオスタチン、アクチビンを阻害する。
FOP(fibrodysplasia ossicans progressive、進行性骨化性線維異形成症)は、骨格筋・腱・結合組織に進行性の異所性の骨化をきたす希少疾患である。通常、ACVR1A(ALK2)は、アクチビンの受容体ではなくBMPファミリーの受容体として作用する。ところが、FOPで見られるACVR1A(ALK2)機能獲得型遺伝子変異体 (GS領域のR206Hが典型例)では、アクチビンが変異受容体に過剰に反応することで、異所性に骨形成を誘導させる [66] [67][68] [69]。そのため、アクチビンの阻害抗体やACVR2B-Fcタンパク質で阻害する方法論がFOPの治療薬候補となっている [68] [70]。興味深いことに、同じALK2変異が、希少小児がんであるdiffuse intrinsic pontine glioma (DIPG)の原因遺伝子と報告されている [71] [46]。
関連語
- ↑
Ling, N., Ying, S.Y., Ueno, N., Shimasaki, S., Esch, F., Hotta, M., & Guillemin, R. (1986).
Pituitary FSH is released by a heterodimer of the beta-subunits from the two forms of inhibin. Nature, 321(6072), 779-82. [PubMed:3086749] [WorldCat] [DOI] - ↑
Vale, W., Rivier, J., Vaughan, J., McClintock, R., Corrigan, A., Woo, W., ..., & Spiess, J. (1986).
Purification and characterization of an FSH releasing protein from porcine ovarian follicular fluid. Nature, 321(6072), 776-9. [PubMed:3012369] [WorldCat] [DOI] - ↑
McCullagh, D.R. (1932).
DUAL ENDOCRINE ACTIVITY OF THE TESTES. Science (New York, N.Y.), 76(1957), 19-20. [PubMed:17815236] [WorldCat] [DOI] - ↑
Makanji, Y., Zhu, J., Mishra, R., Holmquist, C., Wong, W.P., Schwartz, N.B., ..., & Woodruff, T.K. (2014).
Inhibin at 90: from discovery to clinical application, a historical review. Endocrine reviews, 35(5), 747-94. [PubMed:25051334] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Greenwald, J., Vega, M.E., Allendorph, G.P., Fischer, W.H., Vale, W., & Choe, S. (2004).
A flexible activin explains the membrane-dependent cooperative assembly of TGF-beta family receptors. Molecular cell, 15(3), 485-9. [PubMed:15304227] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Thompson, T.B., Woodruff, T.K., & Jardetzky, T.S. (2003).
Structures of an ActRIIB:activin A complex reveal a novel binding mode for TGF-beta ligand:receptor interactions. The EMBO journal, 22(7), 1555-66. [PubMed:12660162] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Thompson, T.B., Lerch, T.F., Cook, R.W., Woodruff, T.K., & Jardetzky, T.S. (2005).
The structure of the follistatin:activin complex reveals antagonism of both type I and type II receptor binding. Developmental cell, 9(4), 535-43. [PubMed:16198295] [WorldCat] [DOI] - ↑
Brûlé, E., Wang, Y., Li, Y., Lin, Y.F., Zhou, X., Ongaro, L., ..., & Bernard, D.J. (2021).
TGFBR3L is an inhibin B co-receptor that regulates female fertility. Science advances, 7(51), eabl4391. [PubMed:34910520] [PMC] [WorldCat] [DOI] - ↑
Lewis, K.A., Gray, P.C., Blount, A.L., MacConell, L.A., Wiater, E., Bilezikjian, L.M., & Vale, W. (2000).
Betaglycan binds inhibin and can mediate functional antagonism of activin signalling. Nature, 404(6776), 411-4. [PubMed:10746731] [WorldCat] [DOI] - ↑
Harrington, A.E., Morris-Triggs, S.A., Ruotolo, B.T., Robinson, C.V., Ohnuma, S., & Hyvönen, M. (2006).
Structural basis for the inhibition of activin signalling by follistatin. The EMBO journal, 25(5), 1035-45. [PubMed:16482217] [PMC] [WorldCat] [DOI] - ↑
Chu, K.Y., Malik, A., Thamilselvan, V., & Martinez-Hackert, E. (2022).
Type II BMP and activin receptors BMPR2 and ACVR2A share a conserved mode of growth factor recognition. The Journal of biological chemistry, 298(7), 102076. [PubMed:35643319] [PMC] [WorldCat] [DOI] - ↑
Cash, J.N., Rejon, C.A., McPherron, A.C., Bernard, D.J., & Thompson, T.B. (2009).
The structure of myostatin:follistatin 288: insights into receptor utilization and heparin binding. The EMBO journal, 28(17), 2662-76. [PubMed:19644449] [PMC] [WorldCat] [DOI] - ↑
Stamler, R., Keutmann, H.T., Sidis, Y., Kattamuri, C., Schneyer, A., & Thompson, T.B. (2008).
The structure of FSTL3.activin A complex. Differential binding of N-terminal domains influences follistatin-type antagonist specificity. The Journal of biological chemistry, 283(47), 32831-8. [PubMed:18768470] [PMC] [WorldCat] [DOI] - ↑
Mathews, L.S., & Vale, W.W. (1991).
Expression cloning of an activin receptor, a predicted transmembrane serine kinase. Cell, 65(6), 973-82. [PubMed:1646080] [WorldCat] [DOI] - ↑ 15.0 15.1
Attisano, L., Wrana, J.L., Cheifetz, S., & Massagué, J. (1992).
Novel activin receptors: distinct genes and alternative mRNA splicing generate a repertoire of serine/threonine kinase receptors. Cell, 68(1), 97-108. [PubMed:1310075] [WorldCat] [DOI] - ↑ 16.0 16.1
Tsuchida, K., Nakatani, M., Uezumi, A., Murakami, T., & Cui, X. (2008).
Signal transduction pathway through activin receptors as a therapeutic target of musculoskeletal diseases and cancer. Endocrine journal, 55(1), 11-21. [PubMed:17878607] [WorldCat] [DOI] - ↑
Bernard, D.J., Lee, K.B., & Santos, M.M. (2006).
Activin B can signal through both ALK4 and ALK7 in gonadotrope cells. Reproductive biology and endocrinology : RB&E, 4, 52. [PubMed:17040568] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Tsuchida, K., Nakatani, M., Yamakawa, N., Hashimoto, O., Hasegawa, Y., & Sugino, H. (2004).
Activin isoforms signal through type I receptor serine/threonine kinase ALK7. Molecular and cellular endocrinology, 220(1-2), 59-65. [PubMed:15196700] [WorldCat] [DOI] - ↑ 19.0 19.1
Reissmann, E., Jörnvall, H., Blokzijl, A., Andersson, O., Chang, C., Minchiotti, G., ..., & Brivanlou, A.H. (2001).
The orphan receptor ALK7 and the Activin receptor ALK4 mediate signaling by Nodal proteins during vertebrate development. Genes & development, 15(15), 2010-22. [PubMed:11485994] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Bertolino, P., Holmberg, R., Reissmann, E., Andersson, O., Berggren, P.O., & Ibáñez, C.F. (2008).
Activin B receptor ALK7 is a negative regulator of pancreatic beta-cell function. Proceedings of the National Academy of Sciences of the United States of America, 105(20), 7246-51. [PubMed:18480258] [PMC] [WorldCat] [DOI] - ↑
Shoji, H., Nakamura, T., van den Eijnden-van Raaij, A.J., & Sugino, H. (1998).
Identification of a novel type II activin receptor, type IIA-N, induced during the neural differentiation of murine P19 embryonal carcinoma cells. Biochemical and biophysical research communications, 246(2), 320-4. [PubMed:9610356] [WorldCat] [DOI] - ↑
Alexander, J.M., Bikkal, H.A., Zervas, N.T., Laws, E.R., & Klibanski, A. (1996).
Tumor-specific expression and alternate splicing of messenger ribonucleic acid encoding activin/transforming growth factor-beta receptors in human pituitary adenomas. The Journal of clinical endocrinology and metabolism, 81(2), 783-90. [PubMed:8636304] [WorldCat] [DOI] - ↑
Roberts, H.J., Hu, S., Qiu, Q., Leung, P.C., Caniggia, I., Gruslin, A., ..., & Peng, C. (2003).
Identification of novel isoforms of activin receptor-like kinase 7 (ALK7) generated by alternative splicing and expression of ALK7 and its ligand, Nodal, in human placenta. Biology of reproduction, 68(5), 1719-26. [PubMed:12606401] [WorldCat] [DOI] - ↑ 24.0 24.1
Andreasson, K., & Worley, P.F. (1995).
Induction of beta-A activin expression by synaptic activity and during neocortical development. Neuroscience, 69(3), 781-96. [PubMed:8596648] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2
Inokuchi, K., Kato, A., Hiraia, K., Hishinuma, F., Inoue, M., & Ozawa, F. (1996).
Increase in activin beta A mRNA in rat hippocampus during long-term potentiation. FEBS letters, 382(1-2), 48-52. [PubMed:8612762] [WorldCat] [DOI] - ↑ 26.0 26.1
Tretter, Y.P., Munz, B., Hübner, G., ten Bruggencate, G., Werner, S., & Alzheimer, C. (1996).
Strong induction of activin expression after hippocampal lesion. Neuroreport, 7(11), 1819-23. [PubMed:8905672] [WorldCat] [DOI] - ↑
Tsuchida, K., Sawchenko, P.E., Nishikawa, S., & Vale, W.W. (1996).
Molecular cloning of a novel type I receptor serine/threonine kinase for the TGF beta superfamily from rat brain. Molecular and cellular neurosciences, 7(6), 467-78. [PubMed:8875430] [WorldCat] [DOI] - ↑
Corrigan, A.Z., Bilezikjian, L.M., Carroll, R.S., Bald, L.N., Schmelzer, C.H., Fendly, B.M., ..., & Vale, W. (1991).
Evidence for an autocrine role of activin B within rat anterior pituitary cultures. Endocrinology, 128(3), 1682-4. [PubMed:1900235] [WorldCat] [DOI] - ↑
Bilezikjian, L.M., Vaughan, J.M., & Vale, W.W. (1993).
Characterization and the regulation of inhibin/activin subunit proteins of cultured rat anterior pituitary cells. Endocrinology, 133(6), 2545-53. [PubMed:8243276] [WorldCat] [DOI] - ↑
Justice, N.J., Blount, A.L., Pelosi, E., Schlessinger, D., Vale, W., & Bilezikjian, L.M. (2011).
Impaired FSHbeta expression in the pituitaries of Foxl2 mutant animals. Molecular endocrinology (Baltimore, Md.), 25(8), 1404-15. [PubMed:21700720] [PMC] [WorldCat] [DOI] - ↑
Schubert, D., Kimura, H., LaCorbiere, M., Vaughan, J., Karr, D., & Fischer, W.H. (1990).
Activin is a nerve cell survival molecule. Nature, 344(6269), 868-70. [PubMed:2330043] [WorldCat] [DOI] - ↑
Shoji-Kasai, Y., Ageta, H., Hasegawa, Y., Tsuchida, K., Sugino, H., & Inokuchi, K. (2007).
Activin increases the number of synaptic contacts and the length of dendritic spine necks by modulating spinal actin dynamics. Journal of cell science, 120(Pt 21), 3830-7. [PubMed:17940062] [WorldCat] [DOI] - ↑ 33.0 33.1
Tretter, Y.P., Hertel, M., Munz, B., ten Bruggencate, G., Werner, S., & Alzheimer, C. (2000).
Induction of activin A is essential for the neuroprotective action of basic fibroblast growth factor in vivo. Nature medicine, 6(7), 812-5. [PubMed:10888932] [WorldCat] [DOI] - ↑
Bao, Y.L., Tsuchida, K., Liu, B., Kurisaki, A., Matsuzaki, T., & Sugino, H. (2005).
Synergistic activity of activin A and basic fibroblast growth factor on tyrosine hydroxylase expression through Smad3 and ERK1/ERK2 MAPK signaling pathways. The Journal of endocrinology, 184(3), 493-504. [PubMed:15749808] [WorldCat] [DOI] - ↑
Stayte, S., Rentsch, P., Li, K.M., & Vissel, B. (2015).
Activin A protects midbrain neurons in the 6-hydroxydopamine mouse model of Parkinson's disease. PloS one, 10(4), e0124325. [PubMed:25902062] [PMC] [WorldCat] [DOI] - ↑
Stayte, S., Rentsch, P., Tröscher, A.R., Bamberger, M., Li, K.M., & Vissel, B. (2017).
Activin A Inhibits MPTP and LPS-Induced Increases in Inflammatory Cell Populations and Loss of Dopamine Neurons in the Mouse Midbrain In Vivo. PloS one, 12(1), e0167211. [PubMed:28121982] [PMC] [WorldCat] [DOI] - ↑
Ageta, H., Murayama, A., Migishima, R., Kida, S., Tsuchida, K., Yokoyama, M., & Inokuchi, K. (2008).
Activin in the brain modulates anxiety-related behavior and adult neurogenesis. PloS one, 3(4), e1869. [PubMed:18382659] [PMC] [WorldCat] [DOI] - ↑
Ageta, H., Ikegami, S., Miura, M., Masuda, M., Migishima, R., Hino, T., ..., & Inokuchi, K. (2010).
Activin plays a key role in the maintenance of long-term memory and late-LTP. Learning & memory (Cold Spring Harbor, N.Y.), 17(4), 176-85. [PubMed:20332189] [WorldCat] [DOI] - ↑
Kurisaki, A., Inoue, I., Kurisaki, K., Yamakawa, N., Tsuchida, K., & Sugino, H. (2008).
Activin induces long-lasting N-methyl-D-aspartate receptor activation via scaffolding PDZ protein activin receptor interacting protein 1. Neuroscience, 151(4), 1225-35. [PubMed:18201830] [WorldCat] [DOI] - ↑ 40.0 40.1 40.2
Keiser, A.A., Dong, T.N., Kramár, E.A., Butler, C.W., Chen, S., Matheos, D.P., ..., & Wood, M.A. (2024).
Specific exercise patterns generate an epigenetic molecular memory window that drives long-term memory formation and identifies ACVR1C as a bidirectional regulator of memory in mice. Nature communications, 15(1), 3836. [PubMed:38714691] [PMC] [WorldCat] [DOI] - ↑
La Tour, S., Shaikh, H., Beardwood, J.H., Augustynski, A.S., Wood, M.A., & Keiser, A.A. (2024).
The weekend warrior effect: Consistent intermittent exercise induces persistent cognitive benefits. Neurobiology of learning and memory, 214, 107971. [PubMed:39137861] [PMC] [WorldCat] [DOI] - ↑
Park, A.J., Havekes, R., Fu, X., Hansen, R., Tudor, J.C., Peixoto, L., ..., & Abel, T. (2017).
Learning induces the translin/trax RNase complex to express activin receptors for persistent memory. eLife, 6. [PubMed:28927503] [PMC] [WorldCat] [DOI] - ↑
Asashima, M., & Satou-Kobayashi, Y. (2024).
Spemann-Mangold organizer and mesoderm induction. Cells & development, 178, 203903. [PubMed:38295873] [WorldCat] [DOI] - ↑
Cambray, S., Arber, C., Little, G., Dougalis, A.G., de Paola, V., Ungless, M.A., ..., & Rodríguez, T.A. (2012).
Activin induces cortical interneuron identity and differentiation in embryonic stem cell-derived telencephalic neural precursors. Nature communications, 3, 841. [PubMed:22588303] [WorldCat] [DOI] - ↑
Arber, C., Precious, S.V., Cambray, S., Risner-Janiczek, J.R., Kelly, C., Noakes, Z., ..., & Li, M. (2015).
Activin A directs striatal projection neuron differentiation of human pluripotent stem cells. Development (Cambridge, England), 142(7), 1375-86. [PubMed:25804741] [PMC] [WorldCat] [DOI] - ↑ 46.0 46.1
Kresak, J.L., Walsh, M., Tuzzolo, A., Ordulu, Z., & Gregory, J. (2023).
Midline brain hamartomatous lesions in fibrodysplasia ossificans progressiva with ACVR1 mutations. Neuropathology : official journal of the Japanese Society of Neuropathology, 43(4), 333-339. [PubMed:36642816] [WorldCat] [DOI] - ↑
Lee, S.J., & McPherron, A.C. (1999).
Myostatin and the control of skeletal muscle mass. Current opinion in genetics & development, 9(5), 604-7. [PubMed:10508689] [WorldCat] [DOI] - ↑
Latres, E., Mastaitis, J., Fury, W., Miloscio, L., Trejos, J., Pangilinan, J., ..., & Gromada, J. (2017).
Activin A more prominently regulates muscle mass in primates than does GDF8. Nature communications, 8, 15153. [PubMed:28452368] [PMC] [WorldCat] [DOI] - ↑
Lee, S.J. (2007).
Quadrupling muscle mass in mice by targeting TGF-beta signaling pathways. PloS one, 2(8), e789. [PubMed:17726519] [PMC] [WorldCat] [DOI] - ↑
Lee, S.J., Lee, Y.S., Zimmers, T.A., Soleimani, A., Matzuk, M.M., Tsuchida, K., ..., & Barton, E.R. (2010).
Regulation of muscle mass by follistatin and activins. Molecular endocrinology (Baltimore, Md.), 24(10), 1998-2008. [PubMed:20810712] [PMC] [WorldCat] [DOI] - ↑
Chen, J.L., Walton, K.L., Winbanks, C.E., Murphy, K.T., Thomson, R.E., Makanji, Y., ..., & Gregorevic, P. (2014).
Elevated expression of activins promotes muscle wasting and cachexia. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 28(4), 1711-23. [PubMed:24378873] [WorldCat] [DOI] - ↑
Lee, S.J., & Glass, D.J. (2011).
Treating cancer cachexia to treat cancer. Skeletal muscle, 1(1), 2. [PubMed:21798080] [PMC] [WorldCat] [DOI] - ↑
Zhou, X., Wang, J.L., Lu, J., Song, Y., Kwak, K.S., Jiao, Q., ..., & Han, H.Q. (2010).
Reversal of cancer cachexia and muscle wasting by ActRIIB antagonism leads to prolonged survival. Cell, 142(4), 531-43. [PubMed:20723755] [WorldCat] [DOI] - ↑ 54.0 54.1
Matzuk, M.M., Kumar, T.R., & Bradley, A. (1995).
Different phenotypes for mice deficient in either activins or activin receptor type II. Nature, 374(6520), 356-60. [PubMed:7885474] [WorldCat] [DOI] - ↑
Vassalli, A., Matzuk, M.M., Gardner, H.A., Lee, K.F., & Jaenisch, R. (1994).
Activin/inhibin beta B subunit gene disruption leads to defects in eyelid development and female reproduction. Genes & development, 8(4), 414-27. [PubMed:8125256] [WorldCat] [DOI] - ↑
Oh, S.P., & Li, E. (1997).
The signaling pathway mediated by the type IIB activin receptor controls axial patterning and lateral asymmetry in the mouse. Genes & development, 11(14), 1812-26. [PubMed:9242489] [WorldCat] [DOI] - ↑
Gu, Z., Nomura, M., Simpson, B.B., Lei, H., Feijen, A., van den Eijnden-van Raaij, J., ..., & Li, E. (1998).
The type I activin receptor ActRIB is required for egg cylinder organization and gastrulation in the mouse. Genes & development, 12(6), 844-57. [PubMed:9512518] [PMC] [WorldCat] [DOI] - ↑
Andersson, O., Korach-Andre, M., Reissmann, E., Ibáñez, C.F., & Bertolino, P. (2008).
Growth/differentiation factor 3 signals through ALK7 and regulates accumulation of adipose tissue and diet-induced obesity. Proceedings of the National Academy of Sciences of the United States of America, 105(20), 7252-6. [PubMed:18480259] [PMC] [WorldCat] [DOI] - ↑
Shen, J.J., Huang, L., Li, L., Jorgez, C., Matzuk, M.M., & Brown, C.W. (2009).
Deficiency of growth differentiation factor 3 protects against diet-induced obesity by selectively acting on white adipose. Molecular endocrinology (Baltimore, Md.), 23(1), 113-23. [PubMed:19008465] [PMC] [WorldCat] [DOI] - ↑
Nadeem, L., Munir, S., Fu, G., Dunk, C., Baczyk, D., Caniggia, I., ..., & Peng, C. (2011).
Nodal signals through activin receptor-like kinase 7 to inhibit trophoblast migration and invasion: implication in the pathogenesis of preeclampsia. The American journal of pathology, 178(3), 1177-89. [PubMed:21356369] [PMC] [WorldCat] [DOI] - ↑
Lee, S.J. (2021).
Targeting the myostatin signaling pathway to treat muscle loss and metabolic dysfunction. The Journal of clinical investigation, 131(9). [PubMed:33938454] [PMC] [WorldCat] [DOI] - ↑
Fenaux, P., Kiladjian, J.J., & Platzbecker, U. (2019).
Luspatercept for the treatment of anemia in myelodysplastic syndromes and primary myelofibrosis. Blood, 133(8), 790-794. [PubMed:30602619] [WorldCat] [DOI] - ↑
Molica, M., & Rossi, M. (2024).
Luspatercept in low-risk myelodysplastic syndromes: a paradigm shift in treatment strategies. Expert opinion on biological therapy, 24(4), 233-241. [PubMed:38555469] [WorldCat] [DOI] - ↑
Hoeper, M.M., Badesch, D.B., Ghofrani, H.A., Gibbs, J.S.R., Gomberg-Maitland, M., McLaughlin, V.V., ..., & STELLAR Trial Investigators (2023).
Phase 3 Trial of Sotatercept for Treatment of Pulmonary Arterial Hypertension. The New England journal of medicine, 388(16), 1478-1490. [PubMed:36877098] [WorldCat] [DOI] - ↑
Madonna, R., & Biondi, F. (2024).
Sotatercept: New drug on the horizon of pulmonary hypertension. Vascular pharmacology, 157, 107442. [PubMed:39571875] [WorldCat] [DOI] - ↑
Kaplan, F.S., Xu, M., Seemann, P., Connor, J.M., Glaser, D.L., Carroll, L., ..., & Shore, E.M. (2009).
Classic and atypical fibrodysplasia ossificans progressiva (FOP) phenotypes are caused by mutations in the bone morphogenetic protein (BMP) type I receptor ACVR1. Human mutation, 30(3), 379-90. [PubMed:19085907] [PMC] [WorldCat] [DOI] - ↑
Hino, K., Ikeya, M., Horigome, K., Matsumoto, Y., Ebise, H., Nishio, M., ..., & Toguchida, J. (2015).
Neofunction of ACVR1 in fibrodysplasia ossificans progressiva. Proceedings of the National Academy of Sciences of the United States of America, 112(50), 15438-43. [PubMed:26621707] [PMC] [WorldCat] [DOI] - ↑ 68.0 68.1
Srinivasan, D., Arostegui, M., Goebel, E.J., Hart, K.N., Aykul, S., Lees-Shepard, J.B., ..., & Economides, A.N. (2024).
How Activin A Became a Therapeutic Target in Fibrodysplasia Ossificans Progressiva. Biomolecules, 14(1). [PubMed:38254701] [PMC] [WorldCat] [DOI] - ↑
Kaplan, F.S., Shore, E.M., & Pignolo, R.J. (2025).
Fibrodysplasia ossificans progressiva emerges from obscurity. Trends in molecular medicine, 31(2), 106-116. [PubMed:39299836] [WorldCat] [DOI] - ↑
Gao, P., Inada, Y., Hotta, A., Sakurai, H., & Ikeya, M. (2024).
iMSC-mediated delivery of ACVR2B-Fc fusion protein reduces heterotopic ossification in a mouse model of fibrodysplasia ossificans progressiva. Stem cell research & therapy, 15(1), 83. [PubMed:38500216] [PMC] [WorldCat] [DOI] - ↑
Taylor, K.R., Mackay, A., Truffaux, N., Butterfield, Y., Morozova, O., Philippe, C., ..., & Grill, J. (2014).
Recurrent activating ACVR1 mutations in diffuse intrinsic pontine glioma. Nature genetics, 46(5), 457-461. [PubMed:24705252] [PMC] [WorldCat] [DOI]