「グレリン」の版間の差分
細 →発現 |
細 →構造 |
||
| (同じ利用者による、間の18版が非表示) | |||
| 8行目: | 8行目: | ||
英語名:ghrelin<br>略語:Ghrl | 英語名:ghrelin<br>略語:Ghrl | ||
{{box|text= | {{box|text= グレリン(ghrelin)は、成長ホルモン分泌促進因子受容体(growth hormone secretagogue receptor, GHS-R)の内因性リガンドとして胃から発見されたペプチドホルモンである<ref name=Kojima1999><pubmed>10604470</pubmed></ref>(1)。N末端から3番目のセリン残基の側鎖は、中鎖脂肪酸であるn-オクタン酸によって修飾されている。この修飾は、生理活性の発現に不可欠である。グレリンのペプチド部分に脂肪酸を付加する特異的な酵素として、グレリン-O-アシルトランスフェラーゼ(ghrelin O-acyltransferase, GOAT)が同定されている<ref name=Yang2008><pubmed>18267071</pubmed></ref>(2)。グレリンは主に胃粘膜のX/A-like細胞から分泌され、成長ホルモン(growth hormone , GH)の分泌促進や摂食行動の亢進といった生理作用を持つ<ref name=Date2000><pubmed>11089560</pubmed></ref>(3)。この特性を活用し、グレリン様化合物ががん悪液質に伴う食欲不振および体重減少の改善を目的とした治療薬として開発されている。}} | ||
== 発見 == | == 発見 == | ||
グレリンはGHS-Rの内因性リガンドとして同定されたペプチドホルモンである<ref name=Kojima1999><pubmed>10604470</pubmed></ref>(1)。その発見は、GH分泌を促進する因子の探索研究から始まり、GHS-Rのクローニングとともに進展した。本章では、グレリンの発見に至る経緯と、その同定の過程を概説する。 | |||
=== | === 背景と成長ホルモン分泌促進因子(GHS)の発展 === | ||
GHは、成長、代謝、エネルギー恒常性の維持に重要な役割を果たすホルモンであり、その分泌は視床下部から分泌される成長ホルモン放出ホルモン(growth hormone-releasing hormone, GHRH)とソマトスタチン(somatostatin, SST)によって制御される。1970年代後半になって、成長ホルモン分泌促進活性を持つ化合物として、さまざまな成長ホルモン分泌促進因子(growth hormone secretagogue, GHS)が開発された<ref name=Bowers1980><pubmed>7353536</pubmed></ref>(4)。この探索の契機となったのは、1975年にHughesらによって発見されたオピオイドペプチドの研究である。Bowersらは、メチオニンエンケファリンおよびロイシンエンケファリンの構造を基に、オピオイド誘導体(Tyr-D-Trp-Gly-Phe-Met-NH₂)を合成し、これがGH分泌を弱く促進することを示した<ref name=Bowers1980><pubmed>7353536</pubmed></ref>(4)。その後、さらなる改良が重ねられ、より強力な作用を持つ成長ホルモン放出ペプチド(growth hormone-releasing peptide 6, GHRP-6)(His-D-Trp-Ala-D-Trp-Phe-Lys-NH₂)が開発された。 | |||
=== | === GHS-Rのクローニングと内因性リガンドの探索 === | ||
1993年、メルク社のSmithらは、経口投与可能な非ペプチド性低分子GHS(L-692,429)を開発し、GHSが特定の受容体を介してGH分泌を促進することを示した<ref name=Smith1993><pubmed>8503009</pubmed></ref>(5)。この研究を契機に、GHSが作用する受容体の同定が進められた。1996年、メルク社の研究チームは発現クローニング法を用いて、GHSが特異的に結合するGタンパク質共役受容体(G protein-coupled receptor,GPCR)を単離し、これをGHS-Rと命名した<ref name=Howard1996><pubmed>8688086</pubmed></ref>(6)。GHS-Rは視床下部、下垂体、海馬などに分布しており、GHSが典型的なGPCRシグナル伝達を介して作用することが確認された。この受容体の発見により生体内にはGHS-Rに結合する内因性リガンドが存在すると考えられ、その同定を目指した研究が本格化した。 | |||
=== グレリンの同定と命名の由来 === | === グレリンの同定と命名の由来 === | ||
児島将康、細田洋司、伊達紫、中里雅光、松尾壽之、寒川賢治の研究グループは、GHS-R発現細胞株を樹立し、細胞内カルシウムイオン濃度の上昇活性を指標としてリガンド探索を行った。その結果、ラットの胃粘膜から28アミノ酸残基を有するペプチドが単離され、これがGHS-Rの内因性リガンドであることが確認された。この新規ペプチドは、1999年に「グレリン(ghrelin)」と命名された<ref name=Kojima1999><pubmed>10604470</pubmed></ref>(1)。この名称は、インド・ヨーロッパ基語の ghre-(成長を意味する語)に由来し、さらにこのペプチドがGHの分泌を促進することから"GH release" という意味も込められている。 | |||
グレリンの発見により、成長ホルモンの分泌調節機構に新たな経路が加わることとなった。さらに、グレリンは摂食調節や代謝制御にも深く関与することが明らかとなり、その研究は多岐にわたる展開を見せている。 | |||
[[ファイル:Kojima Ghrelin Fig1.png|サムネイル|'''図1. ヒトグレリンの構造'''<br>ヒトのグレリンはアミノ酸28残基からなるペプチドで、3番目のセリンが脂肪酸のn-オクタン酸によって修飾を受けており、この修飾基は活性発現に必要である。この図では修飾基のオクタン酸は非常に大きな分子のように見えるが、例えばロイシンやイソロイシンには炭素原子が6個あることを考えるとオクタン酸はほぼアミノ酸1個程度の大きさである。<ref name=Kojima2005><pubmed>15788704</pubmed></ref>より改変。]] | [[ファイル:Kojima Ghrelin Fig1.png|サムネイル|'''図1. ヒトグレリンの構造'''<br>ヒトのグレリンはアミノ酸28残基からなるペプチドで、3番目のセリンが脂肪酸のn-オクタン酸によって修飾を受けており、この修飾基は活性発現に必要である。この図では修飾基のオクタン酸は非常に大きな分子のように見えるが、例えばロイシンやイソロイシンには炭素原子が6個あることを考えるとオクタン酸はほぼアミノ酸1個程度の大きさである。<ref name=Kojima2005><pubmed>15788704</pubmed></ref>より改変。]] | ||
[[ファイル:Kojima Ghrelin Fig2.png|サムネイル|'''図2. 哺乳類グレリン前駆体のアミノ酸配列'''<br> | [[ファイル:Kojima Ghrelin Fig2.png|サムネイル|'''図2. 哺乳類グレリン前駆体のアミノ酸配列'''<br>哺乳類グレリン前駆体間の配列比較を示す。同一アミノ酸は色分けされている。アスタリスクはアシル修飾されるSer3の位置を示す。哺乳類のグレリン前駆体のアミノ酸配列はよく保存されており、特に、アシル修飾されるセリンを含む活性グレリンペプチドのNH2末端の10アミノ酸はすべて同一である。<ref name=Kojima2005><pubmed>15788704</pubmed></ref>より改変。]] | ||
[[ファイル:Kojima Ghrelin Fig3.png|サムネイル|'''図3. 脊椎動物グレリンのアミノ酸配列比較'''<br> | [[ファイル:Kojima Ghrelin Fig3.png|サムネイル|'''図3. 脊椎動物グレリンのアミノ酸配列比較'''<br>グレリンは脊椎動物一般に存在して、N 末端の活性に必要な部分のアミノ酸配列が非常によく保存されている。特に3番目のアミノ酸は両生類を除いてセリン残基であり、この部位が脂肪酸(主としてn-オクタン酸)によって修飾されている。両生類のグレリンは現在2種明らかになっており、3番目のアミノ酸はどちらもトレオニンである。セリンとトレオニンはともに側鎖にOH 基を持つ同族のアミノ酸で、両生類グレリンのトレオニンも脂肪酸によって修飾されている。魚類のグレリンはC 末端がアミド構造になっている。<ref name=Kojima2005><pubmed>15788704</pubmed></ref>より改変。]] | ||
== 構造 == | |||
グレリンは、主に胃粘膜で合成・分泌される。その構造的特徴は、特定の脂肪酸修飾(アシル化)を受けることにある。 | |||
===前駆体=== | ===前駆体=== | ||
グレリンはmRNAから、まずプレプログレリン(preproghrelin) と呼ばれる117アミノ酸残基(ヒトの場合)からなる前駆体タンパク質として合成される。そのN末端にはシグナルペプチドが存在する。このシグナルペプチドは、シグナルペプチダーゼにより切断されることで プログレリン(proghrelin, 94残基) が生成される。プログレリンはさらに酵素的切断を受け、グレリンとなる。 | |||
=== 一次構造と脂肪酸修飾 === | |||
グレリンは28アミノ酸残基からなる単鎖ペプチドであり、その最大の特徴はN末端から3番目のセリン(Ser3)残基の水酸基にオクタノイル基(C8:0)が共有結合している点である | |||
<ref name=Kojima1999><pubmed>10604470</pubmed></ref>(1)('''図1''')。この脂肪酸修飾(アシル化)はGHS-Rとの結合および生理活性の発現に必須であり、グレリンの特異的な生理機能を決定する重要な要素である。通常、ペプチドホルモンの活性はアミノ酸配列によって決定されるが、グレリンは受容体への結合と活性発現に脂肪酸修飾が不可欠である。 | |||
このアシル化修飾はGOATによって触媒される<ref name=Yang2008><pubmed>18267071</pubmed></ref>(2)。 | |||
=== アシルグレリンとデスアシルグレリン === | |||
グレリンには、アシルグレリン(acylated ghrelin)とデスアシルグレリン(desacyl-ghrelin)の2つの主要な分子形態が存在する。アシルグレリンはSer3にオクタノイル基が付加された活性型のグレリンであり、GHS-Rを介して成長ホルモン分泌促進などの生理作用を発揮する。一方、デスアシルグレリンはアシル化を受けていないグレリンであり、GHS-Rに対する親和性を持たないが、血中ではアシルグレリンよりも高濃度で循環している<ref name=Hosoda2000><pubmed>11162448</pubmed></ref>(7)。その生理的役割は未だ完全には解明されていないが、デスアシルグレリンが骨格筋由来のC2C12細胞の増殖を抑制しつつ分化を促進して多核の筋管細胞に変化させることや<ref name=Filigheddu2007><pubmed>17202410</pubmed></ref>(8)、膵臓や皮膚、副腎などの細胞株において細胞増殖の促進やアポトーシスの抑制作用を示すことが報告されている<ref name=Granata2007><pubmed>17068144</pubmed></ref>(9)。以下,特に記載のない場合、“グレリン”はオクタン酸で修飾されたグレリンを指す。 | |||
=== 種間比較と分子多様性 === | |||
グレリンの一次構造は、哺乳類間で高度に保存されており、特にN末端側の10アミノ酸はすべての哺乳類で完全に一致している('''図2''')。これは、グレリンの生理機能におけるこの領域の重要性を示すものである。哺乳類以外の脊椎動物においても、グレリンの存在が確認されており、鳥類、魚類、両生類、爬虫類などでもグレリン遺伝子が同定されている<ref name=Kaiya2002><pubmed>12193558</pubmed></ref><ref name=Kaiya2003a><pubmed>12970156</pubmed></ref><ref name=Kaiya2003b><pubmed>12630926</pubmed></ref><ref name=Kaiya2001><pubmed>11546772</pubmed></ref><ref name=Kaiya2004><pubmed>15242751</pubmed></ref><ref name=Kaiya2006a><pubmed>16630619</pubmed></ref><ref name=Kaiya2006b><pubmed>16762351</pubmed></ref><ref name=Suda2012><pubmed>22569173</pubmed></ref>(10–17)。これらの比較解析から、グレリンが種を超えて基本的な構造的特徴を共有するペプチドであることが明らかとなっている('''図3''')。 | |||
活性型グレリンの生理作用には、脂肪酸によるアシル化が必須であり、最も一般的に付加される脂肪酸はn-オクタン酸(C8:0)である。加えて、ヘキサン酸(C6:0)やデカン酸(C10:0)などが付加されたグレリンも報告されている。摂取された中鎖脂肪酸(MCFA)や中鎖トリグリセリド(MCT)が、これらのアシル基として直接利用されることも示されており、食餌成分がグレリンの修飾に影響を与えることが示唆されている<ref name=Nishi2005a><pubmed>15677766</pubmed></ref>(18)。発達段階によるアシル化パターンの変化も報告されている。マウスを用いた研究では、胃内のn-オクタノイルグレリン量が授乳期にかけて徐々に増加し、離乳開始後に急激に減少することが観察されている。さらに、早期に離乳させたマウスでは、胃内のn-オクタノイルグレリンおよびn-デカノイルグレリンの量が有意に低下しており、発達段階がアシル化修飾に影響を及ぼす可能性がある<ref name=Nishi2005b><pubmed>15746259</pubmed></ref>(19)。このペプチドもオクタン酸修飾を受け、生理活性を持つことが示唆されており、グレリン遺伝子の選択的スプライシングによって産生される。 | |||
ラット胃におけるグレリンに対するdes-Gln14-グレリンの比率は約1/4とされている。 | |||
=== オベスタチン === | === オベスタチン === | ||
オベスタチンは、2005年にHsuehらにより報告されたペプチドで、グレリン前駆体から切り出され、グレリンとは逆に摂食抑制作用を示すとされた<ref name=Zhang2005><pubmed>16284174</pubmed></ref>(20)。オーファン受容体GPR39の内因性リガンドとも提唱され、同一前駆体に由来する対照的な作用を持つペプチドとして注目された。一方で、脊椎動物全体ではアミノ酸配列の保存性が低く、またC末端のアミド構造やプロセシング部位の不確かさ、グレリンとは異なる分泌動態などが報告されている<ref name=Chartrel2007><pubmed>17289961</pubmed></ref>(21)。さらに、GPR39との結合や摂食抑制作用については他の研究で再現が難しく<ref name=Zizzari2011><pubmed>21530598</pubmed></ref><ref name=Holst2007><pubmed>16959833</pubmed></ref><ref name=Zizzari2007><pubmed>17204551</pubmed></ref><ref name=Nogueiras2007><pubmed>17008393</pubmed></ref>(22–25)、現時点ではその内因性生理活性ペプチドとしての位置づけには慎重な見解が多く示されている。 | |||
== 遺伝子と発現調節 == | == 遺伝子と発現調節 == | ||
=== 遺伝子構造 === | === 遺伝子構造 === | ||
ヒトのグレリン遺伝子は第3染色体(3p25–26)に位置し、5つのエキソンから構成される<ref name=Smith1997><pubmed>9331545</pubmed></ref><ref name=Tanaka2001><pubmed>11459820</pubmed></ref><ref name=Kanamoto2004><pubmed>15142980</pubmed></ref>(26–28)。グレリン遺伝子には2種類の転写開始部位があり、それぞれ開始コドン(ATG)の上流-80および-555の位置に存在する。これにより、異なる転写産物が生成される。-80の転写開始部位から産生されるmRNAは、第2エキソン以下の4つのエキソンから構成され、28アミノ酸残基からなるグレリンをコードする主要なmRNAである。一方、-555の転写開始部位から産生されるmRNAは、第1エキソンを含む5つのエキソンから構成される。ラットおよびマウスのグレリン遺伝子では、第14アミノ酸であるグルタミン(Gln)のコドンCAGが選択的スプライシングのシグナルとして機能し、2種類の成熟mRNAが生成される<ref name=Hosoda2000b><pubmed>10801861</pubmed></ref>(29)。一方は28アミノ酸のグレリンであり、もう一方は14番目のGlnが欠失した27アミノ酸型のdes-Gln14-グレリンである。 | |||
=== 発現調節 === | === 発現調節 === | ||
グレリンの発現は栄養状態やホルモン環境に応じて調節される。特に、空腹時に転写が促進され、食後には抑制されるという特徴がある<ref name=Asakawa2001><pubmed>11159873</pubmed></ref>(30)。一方、レプチン投与が血漿中の胃グレリン濃度を迅速に低下させることから<ref name=Ueno2004><pubmed>15155574</pubmed></ref>(31)、グレリンとレプチンの拮抗作用によってエネルギーバランスは維持されている。 | |||
さらに、グレリンの発現は消化管ホルモンや神経伝達物質によっても調節される。 | |||
例えば、グルカゴン様ペプチド-1(GLP-1)やコレシストキニン(CCK)はグレリンの分泌を抑制する作用を持つ | |||
<ref name=Steinert2017><pubmed>28003328</pubmed></ref>(32)。 | |||
また、交感神経系の活性化に伴い、ノルアドレナリンがグレリン分泌を増加させることも報告されている | |||
<ref name=Mundinger2006><pubmed>16527847</pubmed></ref>(33)。 | |||
[[ファイル:Kojima Ghrelin Fig4.png|サムネイル|'''図4. (A) グレリン受容体 (B) リガンド結合ポケット'''<br> | [[ファイル:Kojima Ghrelin Fig4.png|サムネイル|'''図4. (A) グレリン受容体 (B) リガンド結合ポケット'''<br>グレリン受容体とアンタゴニスト化合物21との複合体の切断面を見ると、リガンド結合ポケットが分岐していることがわかる<ref name=Shiimura2020><pubmed>32814772</pubmed></ref>(34)。]] | ||
== | == 受容体とシグナル伝達 == | ||
=== | === GHS-Rの構造とアイソフォーム === | ||
GHS-RはGPCRに分類される膜貫通型受容体であり、成長ホルモン分泌を調節する主要な因子の一つである。GHS-Rをコードする遺伝子は第3染色体(3q26–27)に位置し、2つのエキソンから構成される | |||
<ref name=Howard1996><pubmed>8688086</pubmed></ref>(6)。 | |||
GHS-Rには選択的スプライシングによって生成される2つの主要なアイソフォームが存在する。機能的な7回膜貫通型受容体であるGHS-R1aはグレリンと結合し、シグナル伝達を担う。一方、GHS-R1bは5回膜貫通型であり、リガンド結合能やシグナル伝達機能を持たないが、GHS-R1aとのヘテロ二量体形成によって受容体機能を調節する可能性が示唆されている。 | |||
=== | === GHS-Rのシグナル伝達機構 === | ||
GHS-R1aは主にGq/11タンパク質を介してホスホリパーゼC(phospholipase C,PLC)経路を活性化する。これによりイノシトール三リン酸(inositol 1,4,5-trisphosphate,IP3)とジアシルグリセロール(diacylglycerol,DAG)が生成され、細胞内Ca²⁺濃度が上昇し、成長ホルモン分泌が促進される。また、GHS-Rは細胞外シグナル調節キナーゼ(extracellular signal-regulated kinase,ERK)経路やAMP活性化プロテインキナーゼ(5' adenosine monophosphate-activated protein kinase,AMPK)経路も活性化し、代謝調節や細胞の生存維持に関与する。 | |||
=== 立体構造と受容体結合様式 === | === 立体構造と受容体結合様式 === | ||
近年の研究により、グレリン受容体の立体構造が明らかになった。 | |||
2020年には、アンタゴニストCompound 21が結合した不活性型GHS-RのX線結晶構造が解明され、受容体のリガンド結合ポケットがE124³·³³とR283⁶·⁵⁵ (上付の数字はBallesteros-Weinstein numberingによる) のイオン結合により二股構造(Cavity IとCavity II)を形成していることが示された('''図4''') | |||
<ref name=Shiimura2020><pubmed>32814772</pubmed></ref>(34)。 | |||
2021年には、グレリンが結合した活性型GHS-Rの構造がクライオ電子顕微鏡解析により解明された | |||
<ref name=Liu2021><pubmed>34737341</pubmed></ref><ref name=Qin2022><pubmed>35027551</pubmed></ref><ref name=Wang2021><pubmed>34417468</pubmed></ref>(35–37)。 | |||
グレリンのN末端から7番目のプロリンまでの領域がリガンド結合部位を占め、8番目のグルタミン酸以降の部分がαヘリックスを形成する。 | |||
グレリン受容体の二股構造は、グレリン結合に重要な役割を果たしており、グレリンのペプチド鎖とオクタン酸は、E124³·³³とR283⁶·⁵⁵のイオン結合を跨ぐようにして、それぞれCavity IとIIに収納されている。特に、Ser3に結合したオクタノイル基は、I178⁴·⁶⁰およびL181⁴·⁶³と疎水結合を形成し、受容体の活性化に寄与することが示された。 | |||
さらに、異なるリガンドやGタンパク質が結合したGHS-R構造が複数決定され、これらの比較解析が可能になったことで、リガンドに応じた受容体の構造変化がシグナル伝達の多様性に影響を与えることが明らかとなった | |||
<ref name=Shiimura2025><pubmed>39833471</pubmed></ref>(38)。 | |||
これらの知見は、GHS-Rを標的とする新規作動薬や拮抗薬の開発を加速させ、個別化医療への応用を可能にする重要な基盤となっている。 | |||
== 発現 == | |||
<ref name= | === 組織分布 === | ||
グレリンは、主に胃底腺のX/A-like細胞で合成・分泌されるが | |||
<ref name=Date2000><pubmed>11089560</pubmed></ref>(3)、 | |||
その他の組織にも広く発現が認められる。消化管では、十二指腸や小腸、大腸においても発現が確認されているが、その発現量は胃と比較して非常に低い | |||
<ref name=Date2000><pubmed>11089560</pubmed></ref>, | |||
<ref name=Hosoda2000><pubmed>11162448</pubmed></ref>(3,7)。 | |||
消化管以外の組織では、膵臓、視床下部、下垂体、腎臓などにおいても発現しており | |||
<ref name=Sato2005><pubmed>15774556</pubmed></ref> | |||
<ref name=Date2002><pubmed>11756331</pubmed></ref> | |||
<ref name=Ghizzoni2004><pubmed>15531502</pubmed></ref> | |||
<ref name=Korbonits2001><pubmed>11322490</pubmed></ref> | |||
<ref name=Mori2000><pubmed>11119706</pubmed></ref>(39–43)、 | |||
それぞれ異なる機能を担うと考えられている。膵臓ではランゲルハンス島のα細胞やε細胞にグレリンが局在しており、インスリン分泌を調節する | |||
<ref name=Date2002><pubmed>11756331</pubmed></ref>, | |||
<ref name=Prado2004><pubmed>14970313</pubmed></ref>(40,44)。 | |||
インスリンの血中濃度と同様に、グレリンの血中濃度も膵動脈よりも膵静脈で高い | |||
<ref name=Dezaki2006><pubmed>17130496</pubmed></ref>(45)。 | |||
=== 細胞内分布と分泌機構 === | |||
グレリンは、主に胃底腺領域のX/A様細胞(ヒトではP/D1細胞)で合成されており、その合成経路は一般的な分泌タンパク質とよく似ている | |||
<ref name=Date2000><pubmed>11089560</pubmed></ref>, | |||
<ref name=Rindi2002><pubmed>12107501</pubmed></ref>(3,46)。 | |||
グレリン遺伝子は転写後、スプライシングを経て117アミノ酸からなる前駆体タンパク質、プロプレグレリン(preproghrelin)として翻訳される。その後、プロテアーゼによる切断と、GOATによるアシル化修飾を受けて、最終的に生理活性を持つアシルグレリンが生成される。このアシル化は、小胞体およびゴルジ体膜に局在するGOATによって触媒される | |||
<ref name=Yang2008><pubmed>18267071</pubmed></ref>(2)。 | |||
アシル化されたグレリンは、内分泌経路を通じて血中に分泌され、全身に作用する。一方で、アシル化を受けていないデスアシルグレリンも分泌されており、これにも独自の機能がある可能性が指摘されている。免疫染色および電子顕微鏡による解析から、グレリンが分泌顆粒内に濃縮されて存在していることが明らかとなっている | |||
<ref name=Date2000><pubmed>11089560</pubmed></ref>。 | |||
また、GOATとグレリンは細胞内で共局在しており、アシル化修飾が厳密に制御されていることが示唆されている | |||
<ref name=Yang2008><pubmed>18267071</pubmed></ref>(2)。 | |||
== | == 生理機能 == | ||
グレリンは多様な生理機能を担うペプチドホルモンであり、主に摂食調節、成長ホルモン分泌、代謝制御、循環機能の調節に関与する。その作用はGHS-Rを介したシグナル伝達によって発現し、神経系、内分泌系、代謝系などに広範な影響を及ぼす。 | |||
=== 摂食調節 === | === 摂食調節 === | ||
グレリンは、末梢で産生され視床下部の摂食中枢に作用する唯一の液性空腹シグナルであり、摂食行動の強力な調節因子として機能する<ref name=Tschop2000><pubmed>11057670</pubmed></ref><ref name=Nakazato2001><pubmed>11196643</pubmed></ref><ref name=Wren2000><pubmed>11089570</pubmed></ref><ref name=Wren2001><pubmed>11679432</pubmed></ref>(47–50)。 | |||
特に、視床下部の弓状核(arcuate nucleus, ARC)に存在する神経ペプチドY(neuropeptide Y, NPY)およびアグーチ関連ペプチド(agouti-related peptide, AgRP)ニューロンを活性化し、これらを介して摂食行動を促進する<ref name=Nakazato2001><pubmed>11196643</pubmed></ref><ref name=Kamegai2001><pubmed>11679419</pubmed></ref><ref name=Shintani2001><pubmed>11272130</pubmed></ref><ref name=Cowley2003><pubmed>12597862</pubmed></ref>(48,51–53)。 | |||
NPYは室傍核(paraventricular nucleus, PVN)のメラノコルチン系を抑制し、食欲を増進させる。一方、AgRPはメラノコルチン-4受容体(melanocortin-4 receptor, MC4R)を拮抗的に阻害し、摂食行動をさらに促進する | |||
<ref name=Ollmann1997><pubmed>9311920</pubmed></ref>(54)。 | |||
また、グレリンは腹内側核(Ventromedial hyptothalamus, VMH)において食欲抑制シグナルを抑制することで、摂食行動をさらに増強する | |||
<ref name=Lopez2008><pubmed>18460330</pubmed></ref>(55)。 | |||
さらに、迷走神経を介した中枢シグナル伝達にも関与し、消化管からのグレリン分泌が脳幹の延髄孤束核(nucleus tractus solitarius, NTS)へ伝達されることで摂食調節に影響を及ぼすことが示されている。グレリンの摂食促進作用は、レプチンと拮抗的に働く。レプチンは脂肪組織由来のホルモンであり、視床下部のNPY/AgRPニューロンを抑制するとともに、プロオピオメラノコルチン(pro-opiomelanocortin, POMC)ニューロンを活性化し摂食抑制を引き起こす。この拮抗作用によりエネルギーバランスが調整される。 | |||
=== 成長ホルモン分泌 === | === 成長ホルモン分泌 === | ||
グレリンは主に下垂体前葉に作用し、成長ホルモン(GH)の分泌を強力に促進する内因性ペプチドである | |||
<ref name=Kojima1999><pubmed>10604470</pubmed></ref>(1)。 | |||
GHS-R1aに結合すると、Gqタンパク質を介してホスホリパーゼC(PLC)経路が活性化され、イノシトール三リン酸(IP₃)を介して細胞内Ca²⁺濃度が上昇する。これによりGH分泌細胞が脱分極し、GHが分泌される。また、グレリンは脳室内に投与することで、血中投与よりもはるかに少ない10 pmolという量からGH分泌促進作用を示す | |||
<ref name=Date2000b><pubmed>10964690</pubmed></ref>(56)。 | |||
さらに、その作用は成長ホルモン放出ホルモン(GHRH)よりも強力であり | |||
<ref name=Takaya2000><pubmed>11134161</pubmed></ref>(57)、 | |||
グレリンとGHRHを同時に投与すると、GH分泌に対して相乗的な効果が認められる | |||
<ref name=Hataya2001><pubmed>11549707</pubmed></ref>(58)。 | |||
=== 代謝調節 === | === 代謝調節 === | ||
グレリンは糖代謝および脂質代謝に対して多面的な調節作用を有している。ヒトにおける研究では、グレリンの急性静脈内投与によってインスリン分泌が抑制され、血糖値が上昇することが示されており、抗インスリン作用を持つことが明らかとなっている | |||
<ref name=Broglio2001><pubmed>11600590</pubmed></ref>(59)。 | |||
さらに、グレリンの持続投与によりインスリン感受性が低下し、脂肪分解が促進されることが報告されており、これらの作用は成長ホルモンとは独立して生じるとされる | |||
<ref name=Vestergaard2008><pubmed>18776138</pubmed></ref>(60)。 | |||
脂質代謝においては、グレリンが骨格筋および肝臓における脂質関連遺伝子の発現を調節し、ミトコンドリア機能や脂肪蓄積に影響を及ぼすことが報告されている | |||
<ref name=Barazzoni2005><pubmed>15328073</pubmed></ref>(61)。 | |||
これらの調節には脂肪酸酸化やエネルギー利用の経路が関与しており、組織脂肪の分布にも変化が生じるとされる。加えて、高脂肪食とアシルグレリンの併用投与を行ったラットの研究では、体重増加が認められたにもかかわらず、骨格筋における炎症は低下し、酸化的代謝機能が維持されていた | |||
<ref name=Barazzoni2011><pubmed>22039445</pubmed></ref>(62)。 | |||
また、グレリンは視床下部や報酬系を介して摂食行動を促進するとともに、ストレスや情動の調節にも関与することが知られており | |||
<ref name=Chuang2010><pubmed>20721341</pubmed></ref>(63)、 | |||
糖・脂質代謝の変化が中枢神経系を介した行動・内分泌応答と密接に関連していることが示唆されている。 | |||
=== 体温調節 === | === 体温調節 === | ||
グレリンは体温調節にも関与するとされ、とくにエネルギー不足時の体温低下との関連が報告されている。マウスにグレリンを中枢または末梢に投与すると、摂食が促進されるとともに一過性の体温低下が観察される場合がある。この作用は、トーパー(torpor)と呼ばれる可逆的な低代謝・低体温状態と関係しており、エネルギー節約の手段とされる。絶食時に血中グレリンが上昇し体温が低下する一方、グレリン欠損マウスではトーパーが誘導されず、グレリンがその成立に必要な因子であることが示されている | |||
<ref name=Sato2021><pubmed>34518616</pubmed></ref>。 | <ref name=Sato2021><pubmed>34518616</pubmed></ref>(64)。 | ||
この背景には、グレリンで活性化された視床下部のNPYニューロンが、延髄のGABA作動性ニューロンを介して交感神経出力を抑制し、褐色脂肪組織での熱産生を低下させる経路がある。また、この回路は三叉神経運動核にも投射し、摂食行動にも関与することが知られている | |||
<ref name=Nakamura2017><pubmed>28065829</pubmed></ref>(65)。 | |||
グレリンは、体温と摂食を統合的に制御する内因性因子として機能すると考えられるが、その詳細な作用機構については今後の研究が必要である。 | |||
=== 循環機能の調節 === | === 循環機能の調節 === | ||
グレリンは血管内皮に作用し、一酸化窒素(NO)の産生を促進することで血管拡張を引き起こし、一過性の血圧低下をもたらす | |||
<ref name=Tesauro2005><pubmed>16260640</pubmed></ref> | <ref name=Tesauro2005><pubmed>16260640</pubmed></ref>(66)。 | ||
<ref name=Nagaya2001><pubmed>11560861</pubmed></ref> | この血圧低下は心拍数の変化を伴わず、比較的長時間持続することが知られている。交感神経活動の抑制と副交感神経系の活性化を介した自律神経系による循環調節も認められ | ||
<ref name=Nagaya2004><pubmed>15569841</pubmed></ref>(67)、 | |||
また延髄孤束核を介する中枢性経路の関与も報告されている。孤束核へのグレリン注入によって平均血圧および心拍数の低下が誘導されることが示されている。心臓や大動脈においてはグレリンおよびその受容体のmRNAが発現しており、心筋への直接作用も示唆されている。心不全モデル動物では、グレリン投与により心拍出量、一回拍出量、左心室の最大圧変化率(dP/dt[max])の増加が認められ | |||
<ref name=Nagaya2001><pubmed>11560861</pubmed></ref>(68)、 | |||
さらに非梗塞領域の心筋後壁の拡張期厚の増加、左室リモデリングの抑制、左室短縮率の改善も報告されている。また、グレリンは心筋細胞および血管内皮細胞に対してアポトーシス抑制作用を示す | |||
<ref name=Baldanzi2002><pubmed>12486113</pubmed></ref><ref name=Pettersson2002><pubmed>12379504</pubmed></ref>(69,70)。 | |||
ヒトにおいても、慢性心不全患者へのグレリン投与により左室機能や筋肉量の改善が報告されており | |||
<ref name=Nagaya2001><pubmed>11560861</pubmed></ref>(68)、 | |||
炎症性サイトカインや酸化ストレスの軽減効果と併せて心筋保護作用が期待されている。これらの知見に基づき、グレリンは心不全やカヘキシアの新たな治療標的として注目されている。 | |||
=== その他 === | === その他 === | ||
グレリンは中脳腹側被蓋野(VTA)に存在するドーパミン作動性ニューロンを活性化し、側坐核(Nucleus accumbens, NAcc)へのドーパミン放出を促進する。この作用は快感や報酬行動と密接に関係し、摂食行動の動機づけに関与する。空腹時に食物をより魅力的に感じるのは、こうした神経機構に基づくと考えられている | |||
<ref name=Abizaid2006><pubmed>17060947</pubmed></ref>(71)。 | |||
また、グレリンはエネルギー摂取の生理的必要性と報酬系の活動を結びつけ、高カロリー食や甘味への嗜好、過食傾向の形成にも関与する可能性がある | |||
<ref name=Dickson2011><pubmed>21354264</pubmed></ref>(72)。 | |||
さらに、ドーパミン系を介した報酬処理への関与から、グレリンはアルコールや薬物など依存性物質に対する報酬反応にも影響を及ぼすとされる。動物実験では、グレリン受容体の遮断によりアルコールや薬物への応答が減弱することが報告されている。加えて、ドーパミン系が快楽やストレス応答に関与することから、グレリンは気分調節や抗ストレス作用にも寄与する可能性がある。加えて、グレリンは海馬において学習や記憶にも影響を与えるとされる | |||
<ref name=Diano2006><pubmed>16491079</pubmed></ref>, | |||
<ref name=Carlini2002><pubmed>12470640</pubmed></ref>(73,74)。 | |||
血中のグレリンが海馬に作用し、シナプス形成や長期増強(LTP)を促進することで、空間学習記憶の向上に寄与する可能性があると報告されている。グレリン欠損マウスではCA1領域のシナプス数減少と記憶障害が見られ、グレリン投与によりこれらの障害が回復することが示されている。一方で、血中グレリンが海馬に直接到達するかどうかには疑問もあり、迷走神経を介した間接的経路の関与も示唆されている。 | |||
== 疾患との関わり == | == 疾患との関わり == | ||
神経性食欲不振症(anorexia nervosa , AN)は、やせ、異常な食行動、体型認識のゆがみ、無月経などを特徴とする疾患である。AN患者ではやせの重症度と血中グレリン濃度が相関し、症状の改善に伴いグレリン濃度も正常化することから、グレリンとANの病態との深い関連が示唆される | |||
<ref name=Ariyasu2001><pubmed>11600536</pubmed></ref> | |||
<ref name=Blom2005><pubmed>15699223</pubmed></ref> | |||
<ref name=Otto2001><pubmed>11720888</pubmed></ref>(75–77)。 | |||
また、高グレリン濃度が成長ホルモンやACTH、プロラクチン、コルチゾールの上昇を介して無月経や行動変化を引き起こしている可能性もある。一方、グレリンは食欲亢進作用を持つため、食欲不振を伴う疾患(AN、慢性疾患、高齢者の食欲低下、抗がん剤治療に伴う食欲不振など)の治療への応用が期待されている | |||
<ref name=Tschop2000><pubmed>11057670</pubmed></ref> | |||
<ref name=Nakazato2001><pubmed>11196643</pubmed></ref>(47,48)。 | |||
しかし、ANに対するグレリンの臨床試験では十分な治療効果が得られず、摂食量が逆に減少する例もみられ、この疾患の治療の難しさが浮き彫りとなった。一方で、がん悪液質への応用研究は進展した。がん悪液質はがん、後天性免疫不全症候群(Acquired Immunodeficiency Syndrome , AIDS)、慢性心不全、慢性閉塞性肺疾患(chronic obstructive pulmonary disease, COPD)などに伴い発症し、特にがん患者の約90%が悪液質を呈する。従来、有効な治療薬がなかったが、GHSとしてアナモレリンが開発され、経口投与可能な治療薬として日本で2021年、「エドルミズ」の名称で正式に承認された | |||
<ref name=Garcia2013><pubmed>22699302</pubmed></ref>(78)。 | |||
グレリンの発見から22年を経て、がん悪液質の治療薬として実用化に至ったことは重要な進展であり、今後、他疾患への応用にも期待が寄せられている。 | |||
== 関連用語 == | == 関連用語 == | ||
* [[レプチン]] | * [[レプチン]] | ||
==参考文献== | ==参考文献== | ||
2025年10月4日 (土) 14:58時点における版
佐藤 貴弘、椎村 祐樹、児島 将康
久留米大学 分子生命科学研究所
DOI:10.14931/bsd.11396 原稿受付日:2025年3月31日 原稿完成日:2025年10月1日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英語名:ghrelin
略語:Ghrl
グレリン(ghrelin)は、成長ホルモン分泌促進因子受容体(growth hormone secretagogue receptor, GHS-R)の内因性リガンドとして胃から発見されたペプチドホルモンである[1](1)。N末端から3番目のセリン残基の側鎖は、中鎖脂肪酸であるn-オクタン酸によって修飾されている。この修飾は、生理活性の発現に不可欠である。グレリンのペプチド部分に脂肪酸を付加する特異的な酵素として、グレリン-O-アシルトランスフェラーゼ(ghrelin O-acyltransferase, GOAT)が同定されている[2](2)。グレリンは主に胃粘膜のX/A-like細胞から分泌され、成長ホルモン(growth hormone , GH)の分泌促進や摂食行動の亢進といった生理作用を持つ[3](3)。この特性を活用し、グレリン様化合物ががん悪液質に伴う食欲不振および体重減少の改善を目的とした治療薬として開発されている。
発見
グレリンはGHS-Rの内因性リガンドとして同定されたペプチドホルモンである[1](1)。その発見は、GH分泌を促進する因子の探索研究から始まり、GHS-Rのクローニングとともに進展した。本章では、グレリンの発見に至る経緯と、その同定の過程を概説する。
背景と成長ホルモン分泌促進因子(GHS)の発展
GHは、成長、代謝、エネルギー恒常性の維持に重要な役割を果たすホルモンであり、その分泌は視床下部から分泌される成長ホルモン放出ホルモン(growth hormone-releasing hormone, GHRH)とソマトスタチン(somatostatin, SST)によって制御される。1970年代後半になって、成長ホルモン分泌促進活性を持つ化合物として、さまざまな成長ホルモン分泌促進因子(growth hormone secretagogue, GHS)が開発された[4](4)。この探索の契機となったのは、1975年にHughesらによって発見されたオピオイドペプチドの研究である。Bowersらは、メチオニンエンケファリンおよびロイシンエンケファリンの構造を基に、オピオイド誘導体(Tyr-D-Trp-Gly-Phe-Met-NH₂)を合成し、これがGH分泌を弱く促進することを示した[4](4)。その後、さらなる改良が重ねられ、より強力な作用を持つ成長ホルモン放出ペプチド(growth hormone-releasing peptide 6, GHRP-6)(His-D-Trp-Ala-D-Trp-Phe-Lys-NH₂)が開発された。
GHS-Rのクローニングと内因性リガンドの探索
1993年、メルク社のSmithらは、経口投与可能な非ペプチド性低分子GHS(L-692,429)を開発し、GHSが特定の受容体を介してGH分泌を促進することを示した[5](5)。この研究を契機に、GHSが作用する受容体の同定が進められた。1996年、メルク社の研究チームは発現クローニング法を用いて、GHSが特異的に結合するGタンパク質共役受容体(G protein-coupled receptor,GPCR)を単離し、これをGHS-Rと命名した[6](6)。GHS-Rは視床下部、下垂体、海馬などに分布しており、GHSが典型的なGPCRシグナル伝達を介して作用することが確認された。この受容体の発見により生体内にはGHS-Rに結合する内因性リガンドが存在すると考えられ、その同定を目指した研究が本格化した。
グレリンの同定と命名の由来
児島将康、細田洋司、伊達紫、中里雅光、松尾壽之、寒川賢治の研究グループは、GHS-R発現細胞株を樹立し、細胞内カルシウムイオン濃度の上昇活性を指標としてリガンド探索を行った。その結果、ラットの胃粘膜から28アミノ酸残基を有するペプチドが単離され、これがGHS-Rの内因性リガンドであることが確認された。この新規ペプチドは、1999年に「グレリン(ghrelin)」と命名された[1](1)。この名称は、インド・ヨーロッパ基語の ghre-(成長を意味する語)に由来し、さらにこのペプチドがGHの分泌を促進することから"GH release" という意味も込められている。
グレリンの発見により、成長ホルモンの分泌調節機構に新たな経路が加わることとなった。さらに、グレリンは摂食調節や代謝制御にも深く関与することが明らかとなり、その研究は多岐にわたる展開を見せている。
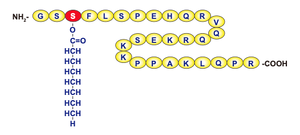
ヒトのグレリンはアミノ酸28残基からなるペプチドで、3番目のセリンが脂肪酸のn-オクタン酸によって修飾を受けており、この修飾基は活性発現に必要である。この図では修飾基のオクタン酸は非常に大きな分子のように見えるが、例えばロイシンやイソロイシンには炭素原子が6個あることを考えるとオクタン酸はほぼアミノ酸1個程度の大きさである。[7]より改変。

哺乳類グレリン前駆体間の配列比較を示す。同一アミノ酸は色分けされている。アスタリスクはアシル修飾されるSer3の位置を示す。哺乳類のグレリン前駆体のアミノ酸配列はよく保存されており、特に、アシル修飾されるセリンを含む活性グレリンペプチドのNH2末端の10アミノ酸はすべて同一である。[7]より改変。

グレリンは脊椎動物一般に存在して、N 末端の活性に必要な部分のアミノ酸配列が非常によく保存されている。特に3番目のアミノ酸は両生類を除いてセリン残基であり、この部位が脂肪酸(主としてn-オクタン酸)によって修飾されている。両生類のグレリンは現在2種明らかになっており、3番目のアミノ酸はどちらもトレオニンである。セリンとトレオニンはともに側鎖にOH 基を持つ同族のアミノ酸で、両生類グレリンのトレオニンも脂肪酸によって修飾されている。魚類のグレリンはC 末端がアミド構造になっている。[7]より改変。
構造
グレリンは、主に胃粘膜で合成・分泌される。その構造的特徴は、特定の脂肪酸修飾(アシル化)を受けることにある。
前駆体
グレリンはmRNAから、まずプレプログレリン(preproghrelin) と呼ばれる117アミノ酸残基(ヒトの場合)からなる前駆体タンパク質として合成される。そのN末端にはシグナルペプチドが存在する。このシグナルペプチドは、シグナルペプチダーゼにより切断されることで プログレリン(proghrelin, 94残基) が生成される。プログレリンはさらに酵素的切断を受け、グレリンとなる。
一次構造と脂肪酸修飾
グレリンは28アミノ酸残基からなる単鎖ペプチドであり、その最大の特徴はN末端から3番目のセリン(Ser3)残基の水酸基にオクタノイル基(C8:0)が共有結合している点である [1](1)(図1)。この脂肪酸修飾(アシル化)はGHS-Rとの結合および生理活性の発現に必須であり、グレリンの特異的な生理機能を決定する重要な要素である。通常、ペプチドホルモンの活性はアミノ酸配列によって決定されるが、グレリンは受容体への結合と活性発現に脂肪酸修飾が不可欠である。 このアシル化修飾はGOATによって触媒される[2](2)。
アシルグレリンとデスアシルグレリン
グレリンには、アシルグレリン(acylated ghrelin)とデスアシルグレリン(desacyl-ghrelin)の2つの主要な分子形態が存在する。アシルグレリンはSer3にオクタノイル基が付加された活性型のグレリンであり、GHS-Rを介して成長ホルモン分泌促進などの生理作用を発揮する。一方、デスアシルグレリンはアシル化を受けていないグレリンであり、GHS-Rに対する親和性を持たないが、血中ではアシルグレリンよりも高濃度で循環している[8](7)。その生理的役割は未だ完全には解明されていないが、デスアシルグレリンが骨格筋由来のC2C12細胞の増殖を抑制しつつ分化を促進して多核の筋管細胞に変化させることや[9](8)、膵臓や皮膚、副腎などの細胞株において細胞増殖の促進やアポトーシスの抑制作用を示すことが報告されている[10](9)。以下,特に記載のない場合、“グレリン”はオクタン酸で修飾されたグレリンを指す。
種間比較と分子多様性
グレリンの一次構造は、哺乳類間で高度に保存されており、特にN末端側の10アミノ酸はすべての哺乳類で完全に一致している(図2)。これは、グレリンの生理機能におけるこの領域の重要性を示すものである。哺乳類以外の脊椎動物においても、グレリンの存在が確認されており、鳥類、魚類、両生類、爬虫類などでもグレリン遺伝子が同定されている[11][12][13][14][15][16][17][18](10–17)。これらの比較解析から、グレリンが種を超えて基本的な構造的特徴を共有するペプチドであることが明らかとなっている(図3)。
活性型グレリンの生理作用には、脂肪酸によるアシル化が必須であり、最も一般的に付加される脂肪酸はn-オクタン酸(C8:0)である。加えて、ヘキサン酸(C6:0)やデカン酸(C10:0)などが付加されたグレリンも報告されている。摂取された中鎖脂肪酸(MCFA)や中鎖トリグリセリド(MCT)が、これらのアシル基として直接利用されることも示されており、食餌成分がグレリンの修飾に影響を与えることが示唆されている[19](18)。発達段階によるアシル化パターンの変化も報告されている。マウスを用いた研究では、胃内のn-オクタノイルグレリン量が授乳期にかけて徐々に増加し、離乳開始後に急激に減少することが観察されている。さらに、早期に離乳させたマウスでは、胃内のn-オクタノイルグレリンおよびn-デカノイルグレリンの量が有意に低下しており、発達段階がアシル化修飾に影響を及ぼす可能性がある[20](19)。このペプチドもオクタン酸修飾を受け、生理活性を持つことが示唆されており、グレリン遺伝子の選択的スプライシングによって産生される。 ラット胃におけるグレリンに対するdes-Gln14-グレリンの比率は約1/4とされている。
オベスタチン
オベスタチンは、2005年にHsuehらにより報告されたペプチドで、グレリン前駆体から切り出され、グレリンとは逆に摂食抑制作用を示すとされた[21](20)。オーファン受容体GPR39の内因性リガンドとも提唱され、同一前駆体に由来する対照的な作用を持つペプチドとして注目された。一方で、脊椎動物全体ではアミノ酸配列の保存性が低く、またC末端のアミド構造やプロセシング部位の不確かさ、グレリンとは異なる分泌動態などが報告されている[22](21)。さらに、GPR39との結合や摂食抑制作用については他の研究で再現が難しく[23][24][25][26](22–25)、現時点ではその内因性生理活性ペプチドとしての位置づけには慎重な見解が多く示されている。
遺伝子と発現調節
遺伝子構造
ヒトのグレリン遺伝子は第3染色体(3p25–26)に位置し、5つのエキソンから構成される[27][28][29](26–28)。グレリン遺伝子には2種類の転写開始部位があり、それぞれ開始コドン(ATG)の上流-80および-555の位置に存在する。これにより、異なる転写産物が生成される。-80の転写開始部位から産生されるmRNAは、第2エキソン以下の4つのエキソンから構成され、28アミノ酸残基からなるグレリンをコードする主要なmRNAである。一方、-555の転写開始部位から産生されるmRNAは、第1エキソンを含む5つのエキソンから構成される。ラットおよびマウスのグレリン遺伝子では、第14アミノ酸であるグルタミン(Gln)のコドンCAGが選択的スプライシングのシグナルとして機能し、2種類の成熟mRNAが生成される[30](29)。一方は28アミノ酸のグレリンであり、もう一方は14番目のGlnが欠失した27アミノ酸型のdes-Gln14-グレリンである。
発現調節
グレリンの発現は栄養状態やホルモン環境に応じて調節される。特に、空腹時に転写が促進され、食後には抑制されるという特徴がある[31](30)。一方、レプチン投与が血漿中の胃グレリン濃度を迅速に低下させることから[32](31)、グレリンとレプチンの拮抗作用によってエネルギーバランスは維持されている。 さらに、グレリンの発現は消化管ホルモンや神経伝達物質によっても調節される。 例えば、グルカゴン様ペプチド-1(GLP-1)やコレシストキニン(CCK)はグレリンの分泌を抑制する作用を持つ [33](32)。 また、交感神経系の活性化に伴い、ノルアドレナリンがグレリン分泌を増加させることも報告されている [34](33)。
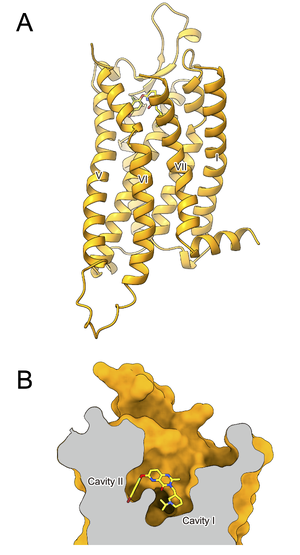
グレリン受容体とアンタゴニスト化合物21との複合体の切断面を見ると、リガンド結合ポケットが分岐していることがわかる[35](34)。
受容体とシグナル伝達
GHS-Rの構造とアイソフォーム
GHS-RはGPCRに分類される膜貫通型受容体であり、成長ホルモン分泌を調節する主要な因子の一つである。GHS-Rをコードする遺伝子は第3染色体(3q26–27)に位置し、2つのエキソンから構成される [6](6)。 GHS-Rには選択的スプライシングによって生成される2つの主要なアイソフォームが存在する。機能的な7回膜貫通型受容体であるGHS-R1aはグレリンと結合し、シグナル伝達を担う。一方、GHS-R1bは5回膜貫通型であり、リガンド結合能やシグナル伝達機能を持たないが、GHS-R1aとのヘテロ二量体形成によって受容体機能を調節する可能性が示唆されている。
GHS-Rのシグナル伝達機構
GHS-R1aは主にGq/11タンパク質を介してホスホリパーゼC(phospholipase C,PLC)経路を活性化する。これによりイノシトール三リン酸(inositol 1,4,5-trisphosphate,IP3)とジアシルグリセロール(diacylglycerol,DAG)が生成され、細胞内Ca²⁺濃度が上昇し、成長ホルモン分泌が促進される。また、GHS-Rは細胞外シグナル調節キナーゼ(extracellular signal-regulated kinase,ERK)経路やAMP活性化プロテインキナーゼ(5' adenosine monophosphate-activated protein kinase,AMPK)経路も活性化し、代謝調節や細胞の生存維持に関与する。
立体構造と受容体結合様式
近年の研究により、グレリン受容体の立体構造が明らかになった。 2020年には、アンタゴニストCompound 21が結合した不活性型GHS-RのX線結晶構造が解明され、受容体のリガンド結合ポケットがE124³·³³とR283⁶·⁵⁵ (上付の数字はBallesteros-Weinstein numberingによる) のイオン結合により二股構造(Cavity IとCavity II)を形成していることが示された(図4) [35](34)。 2021年には、グレリンが結合した活性型GHS-Rの構造がクライオ電子顕微鏡解析により解明された [36][37][38](35–37)。 グレリンのN末端から7番目のプロリンまでの領域がリガンド結合部位を占め、8番目のグルタミン酸以降の部分がαヘリックスを形成する。 グレリン受容体の二股構造は、グレリン結合に重要な役割を果たしており、グレリンのペプチド鎖とオクタン酸は、E124³·³³とR283⁶·⁵⁵のイオン結合を跨ぐようにして、それぞれCavity IとIIに収納されている。特に、Ser3に結合したオクタノイル基は、I178⁴·⁶⁰およびL181⁴·⁶³と疎水結合を形成し、受容体の活性化に寄与することが示された。 さらに、異なるリガンドやGタンパク質が結合したGHS-R構造が複数決定され、これらの比較解析が可能になったことで、リガンドに応じた受容体の構造変化がシグナル伝達の多様性に影響を与えることが明らかとなった [39](38)。 これらの知見は、GHS-Rを標的とする新規作動薬や拮抗薬の開発を加速させ、個別化医療への応用を可能にする重要な基盤となっている。
発現
組織分布
グレリンは、主に胃底腺のX/A-like細胞で合成・分泌されるが [3](3)、 その他の組織にも広く発現が認められる。消化管では、十二指腸や小腸、大腸においても発現が確認されているが、その発現量は胃と比較して非常に低い [3], [8](3,7)。 消化管以外の組織では、膵臓、視床下部、下垂体、腎臓などにおいても発現しており [40] [41] [42] [43] [44](39–43)、 それぞれ異なる機能を担うと考えられている。膵臓ではランゲルハンス島のα細胞やε細胞にグレリンが局在しており、インスリン分泌を調節する [41], [45](40,44)。 インスリンの血中濃度と同様に、グレリンの血中濃度も膵動脈よりも膵静脈で高い [46](45)。
細胞内分布と分泌機構
グレリンは、主に胃底腺領域のX/A様細胞(ヒトではP/D1細胞)で合成されており、その合成経路は一般的な分泌タンパク質とよく似ている [3], [47](3,46)。 グレリン遺伝子は転写後、スプライシングを経て117アミノ酸からなる前駆体タンパク質、プロプレグレリン(preproghrelin)として翻訳される。その後、プロテアーゼによる切断と、GOATによるアシル化修飾を受けて、最終的に生理活性を持つアシルグレリンが生成される。このアシル化は、小胞体およびゴルジ体膜に局在するGOATによって触媒される [2](2)。 アシル化されたグレリンは、内分泌経路を通じて血中に分泌され、全身に作用する。一方で、アシル化を受けていないデスアシルグレリンも分泌されており、これにも独自の機能がある可能性が指摘されている。免疫染色および電子顕微鏡による解析から、グレリンが分泌顆粒内に濃縮されて存在していることが明らかとなっている [3]。 また、GOATとグレリンは細胞内で共局在しており、アシル化修飾が厳密に制御されていることが示唆されている [2](2)。
生理機能
グレリンは多様な生理機能を担うペプチドホルモンであり、主に摂食調節、成長ホルモン分泌、代謝制御、循環機能の調節に関与する。その作用はGHS-Rを介したシグナル伝達によって発現し、神経系、内分泌系、代謝系などに広範な影響を及ぼす。
摂食調節
グレリンは、末梢で産生され視床下部の摂食中枢に作用する唯一の液性空腹シグナルであり、摂食行動の強力な調節因子として機能する[48][49][50][51](47–50)。 特に、視床下部の弓状核(arcuate nucleus, ARC)に存在する神経ペプチドY(neuropeptide Y, NPY)およびアグーチ関連ペプチド(agouti-related peptide, AgRP)ニューロンを活性化し、これらを介して摂食行動を促進する[49][52][53][54](48,51–53)。 NPYは室傍核(paraventricular nucleus, PVN)のメラノコルチン系を抑制し、食欲を増進させる。一方、AgRPはメラノコルチン-4受容体(melanocortin-4 receptor, MC4R)を拮抗的に阻害し、摂食行動をさらに促進する [55](54)。 また、グレリンは腹内側核(Ventromedial hyptothalamus, VMH)において食欲抑制シグナルを抑制することで、摂食行動をさらに増強する [56](55)。 さらに、迷走神経を介した中枢シグナル伝達にも関与し、消化管からのグレリン分泌が脳幹の延髄孤束核(nucleus tractus solitarius, NTS)へ伝達されることで摂食調節に影響を及ぼすことが示されている。グレリンの摂食促進作用は、レプチンと拮抗的に働く。レプチンは脂肪組織由来のホルモンであり、視床下部のNPY/AgRPニューロンを抑制するとともに、プロオピオメラノコルチン(pro-opiomelanocortin, POMC)ニューロンを活性化し摂食抑制を引き起こす。この拮抗作用によりエネルギーバランスが調整される。
成長ホルモン分泌
グレリンは主に下垂体前葉に作用し、成長ホルモン(GH)の分泌を強力に促進する内因性ペプチドである [1](1)。 GHS-R1aに結合すると、Gqタンパク質を介してホスホリパーゼC(PLC)経路が活性化され、イノシトール三リン酸(IP₃)を介して細胞内Ca²⁺濃度が上昇する。これによりGH分泌細胞が脱分極し、GHが分泌される。また、グレリンは脳室内に投与することで、血中投与よりもはるかに少ない10 pmolという量からGH分泌促進作用を示す [57](56)。 さらに、その作用は成長ホルモン放出ホルモン(GHRH)よりも強力であり [58](57)、 グレリンとGHRHを同時に投与すると、GH分泌に対して相乗的な効果が認められる [59](58)。
代謝調節
グレリンは糖代謝および脂質代謝に対して多面的な調節作用を有している。ヒトにおける研究では、グレリンの急性静脈内投与によってインスリン分泌が抑制され、血糖値が上昇することが示されており、抗インスリン作用を持つことが明らかとなっている [60](59)。 さらに、グレリンの持続投与によりインスリン感受性が低下し、脂肪分解が促進されることが報告されており、これらの作用は成長ホルモンとは独立して生じるとされる [61](60)。 脂質代謝においては、グレリンが骨格筋および肝臓における脂質関連遺伝子の発現を調節し、ミトコンドリア機能や脂肪蓄積に影響を及ぼすことが報告されている [62](61)。 これらの調節には脂肪酸酸化やエネルギー利用の経路が関与しており、組織脂肪の分布にも変化が生じるとされる。加えて、高脂肪食とアシルグレリンの併用投与を行ったラットの研究では、体重増加が認められたにもかかわらず、骨格筋における炎症は低下し、酸化的代謝機能が維持されていた [63](62)。 また、グレリンは視床下部や報酬系を介して摂食行動を促進するとともに、ストレスや情動の調節にも関与することが知られており [64](63)、 糖・脂質代謝の変化が中枢神経系を介した行動・内分泌応答と密接に関連していることが示唆されている。
体温調節
グレリンは体温調節にも関与するとされ、とくにエネルギー不足時の体温低下との関連が報告されている。マウスにグレリンを中枢または末梢に投与すると、摂食が促進されるとともに一過性の体温低下が観察される場合がある。この作用は、トーパー(torpor)と呼ばれる可逆的な低代謝・低体温状態と関係しており、エネルギー節約の手段とされる。絶食時に血中グレリンが上昇し体温が低下する一方、グレリン欠損マウスではトーパーが誘導されず、グレリンがその成立に必要な因子であることが示されている [65](64)。 この背景には、グレリンで活性化された視床下部のNPYニューロンが、延髄のGABA作動性ニューロンを介して交感神経出力を抑制し、褐色脂肪組織での熱産生を低下させる経路がある。また、この回路は三叉神経運動核にも投射し、摂食行動にも関与することが知られている [66](65)。 グレリンは、体温と摂食を統合的に制御する内因性因子として機能すると考えられるが、その詳細な作用機構については今後の研究が必要である。
循環機能の調節
グレリンは血管内皮に作用し、一酸化窒素(NO)の産生を促進することで血管拡張を引き起こし、一過性の血圧低下をもたらす [67](66)。 この血圧低下は心拍数の変化を伴わず、比較的長時間持続することが知られている。交感神経活動の抑制と副交感神経系の活性化を介した自律神経系による循環調節も認められ [68](67)、 また延髄孤束核を介する中枢性経路の関与も報告されている。孤束核へのグレリン注入によって平均血圧および心拍数の低下が誘導されることが示されている。心臓や大動脈においてはグレリンおよびその受容体のmRNAが発現しており、心筋への直接作用も示唆されている。心不全モデル動物では、グレリン投与により心拍出量、一回拍出量、左心室の最大圧変化率(dP/dt[max])の増加が認められ [69](68)、 さらに非梗塞領域の心筋後壁の拡張期厚の増加、左室リモデリングの抑制、左室短縮率の改善も報告されている。また、グレリンは心筋細胞および血管内皮細胞に対してアポトーシス抑制作用を示す [70][71](69,70)。 ヒトにおいても、慢性心不全患者へのグレリン投与により左室機能や筋肉量の改善が報告されており [69](68)、 炎症性サイトカインや酸化ストレスの軽減効果と併せて心筋保護作用が期待されている。これらの知見に基づき、グレリンは心不全やカヘキシアの新たな治療標的として注目されている。
その他
グレリンは中脳腹側被蓋野(VTA)に存在するドーパミン作動性ニューロンを活性化し、側坐核(Nucleus accumbens, NAcc)へのドーパミン放出を促進する。この作用は快感や報酬行動と密接に関係し、摂食行動の動機づけに関与する。空腹時に食物をより魅力的に感じるのは、こうした神経機構に基づくと考えられている [72](71)。 また、グレリンはエネルギー摂取の生理的必要性と報酬系の活動を結びつけ、高カロリー食や甘味への嗜好、過食傾向の形成にも関与する可能性がある [73](72)。 さらに、ドーパミン系を介した報酬処理への関与から、グレリンはアルコールや薬物など依存性物質に対する報酬反応にも影響を及ぼすとされる。動物実験では、グレリン受容体の遮断によりアルコールや薬物への応答が減弱することが報告されている。加えて、ドーパミン系が快楽やストレス応答に関与することから、グレリンは気分調節や抗ストレス作用にも寄与する可能性がある。加えて、グレリンは海馬において学習や記憶にも影響を与えるとされる [74], [75](73,74)。 血中のグレリンが海馬に作用し、シナプス形成や長期増強(LTP)を促進することで、空間学習記憶の向上に寄与する可能性があると報告されている。グレリン欠損マウスではCA1領域のシナプス数減少と記憶障害が見られ、グレリン投与によりこれらの障害が回復することが示されている。一方で、血中グレリンが海馬に直接到達するかどうかには疑問もあり、迷走神経を介した間接的経路の関与も示唆されている。
疾患との関わり
神経性食欲不振症(anorexia nervosa , AN)は、やせ、異常な食行動、体型認識のゆがみ、無月経などを特徴とする疾患である。AN患者ではやせの重症度と血中グレリン濃度が相関し、症状の改善に伴いグレリン濃度も正常化することから、グレリンとANの病態との深い関連が示唆される [76] [77] [78](75–77)。 また、高グレリン濃度が成長ホルモンやACTH、プロラクチン、コルチゾールの上昇を介して無月経や行動変化を引き起こしている可能性もある。一方、グレリンは食欲亢進作用を持つため、食欲不振を伴う疾患(AN、慢性疾患、高齢者の食欲低下、抗がん剤治療に伴う食欲不振など)の治療への応用が期待されている [48] [49](47,48)。 しかし、ANに対するグレリンの臨床試験では十分な治療効果が得られず、摂食量が逆に減少する例もみられ、この疾患の治療の難しさが浮き彫りとなった。一方で、がん悪液質への応用研究は進展した。がん悪液質はがん、後天性免疫不全症候群(Acquired Immunodeficiency Syndrome , AIDS)、慢性心不全、慢性閉塞性肺疾患(chronic obstructive pulmonary disease, COPD)などに伴い発症し、特にがん患者の約90%が悪液質を呈する。従来、有効な治療薬がなかったが、GHSとしてアナモレリンが開発され、経口投与可能な治療薬として日本で2021年、「エドルミズ」の名称で正式に承認された [79](78)。 グレリンの発見から22年を経て、がん悪液質の治療薬として実用化に至ったことは重要な進展であり、今後、他疾患への応用にも期待が寄せられている。
関連用語
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4
Kojima, M., Hosoda, H., Date, Y., Nakazato, M., Matsuo, H., & Kangawa, K. (1999).
Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature, 402(6762), 656-60. [PubMed:10604470] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Yang, J., Brown, M.S., Liang, G., Grishin, N.V., & Goldstein, J.L. (2008).
Identification of the acyltransferase that octanoylates ghrelin, an appetite-stimulating peptide hormone. Cell, 132(3), 387-96. [PubMed:18267071] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4
Date, Y., Kojima, M., Hosoda, H., Sawaguchi, A., Mondal, M.S., Suganuma, T., ..., & Nakazato, M. (2000).
Ghrelin, a novel growth hormone-releasing acylated peptide, is synthesized in a distinct endocrine cell type in the gastrointestinal tracts of rats and humans. Endocrinology, 141(11), 4255-61. [PubMed:11089560] [WorldCat] [DOI] - ↑ 4.0 4.1
Bowers, C.Y., Momany, F., Reynolds, G.A., Chang, D., Hong, A., & Chang, K. (1980).
Structure-activity relationships of a synthetic pentapeptide that specifically releases growth hormone in vitro. Endocrinology, 106(3), 663-7. [PubMed:7353536] [WorldCat] [DOI] - ↑
Smith, R.G., Cheng, K., Schoen, W.R., Pong, S.S., Hickey, G., Jacks, T., ..., & Judith, F. (1993).
A nonpeptidyl growth hormone secretagogue. Science (New York, N.Y.), 260(5114), 1640-3. [PubMed:8503009] [WorldCat] [DOI] - ↑ 6.0 6.1
Howard, A.D., Feighner, S.D., Cully, D.F., Arena, J.P., Liberator, P.A., Rosenblum, C.I., ..., & Van der Ploeg, L.H. (1996).
A receptor in pituitary and hypothalamus that functions in growth hormone release. Science (New York, N.Y.), 273(5277), 974-7. [PubMed:8688086] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Kojima, M., & Kangawa, K. (2005).
Ghrelin: structure and function. Physiological reviews, 85(2), 495-522. [PubMed:15788704] [WorldCat] [DOI] - ↑ 8.0 8.1
Hosoda, H., Kojima, M., Matsuo, H., & Kangawa, K. (2000).
Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochemical and biophysical research communications, 279(3), 909-13. [PubMed:11162448] [WorldCat] [DOI] - ↑
Filigheddu, N., Gnocchi, V.F., Coscia, M., Cappelli, M., Porporato, P.E., Taulli, R., ..., & Graziani, A. (2007).
Ghrelin and des-acyl ghrelin promote differentiation and fusion of C2C12 skeletal muscle cells. Molecular biology of the cell, 18(3), 986-94. [PubMed:17202410] [PMC] [WorldCat] [DOI] - ↑
Granata, R., Settanni, F., Biancone, L., Trovato, L., Nano, R., Bertuzzi, F., ..., & Muccioli, G. (2007).
Acylated and unacylated ghrelin promote proliferation and inhibit apoptosis of pancreatic beta-cells and human islets: involvement of 3',5'-cyclic adenosine monophosphate/protein kinase A, extracellular signal-regulated kinase 1/2, and phosphatidyl inositol 3-Kinase/Akt signaling. Endocrinology, 148(2), 512-29. [PubMed:17068144] [WorldCat] [DOI] - ↑
Kaiya, H., Van Der Geyten, S., Kojima, M., Hosoda, H., Kitajima, Y., Matsumoto, M., ..., & Kangawa, K. (2002).
Chicken ghrelin: purification, cDNA cloning, and biological activity. Endocrinology, 143(9), 3454-63. [PubMed:12193558] [WorldCat] [DOI] - ↑
Kaiya, H., Kojima, M., Hosoda, H., Moriyama, S., Takahashi, A., Kawauchi, H., & Kangawa, K. (2003).
Peptide purification, complementary deoxyribonucleic acid (DNA) and genomic DNA cloning, and functional characterization of ghrelin in rainbow trout. Endocrinology, 144(12), 5215-26. [PubMed:12970156] [WorldCat] [DOI] - ↑
Kaiya, H., Kojima, M., Hosoda, H., Riley, L.G., Hirano, T., Grau, E.G., & Kangawa, K. (2003).
Amidated fish ghrelin: purification, cDNA cloning in the Japanese eel and its biological activity. The Journal of endocrinology, 176(3), 415-23. [PubMed:12630926] [WorldCat] [DOI] - ↑
Kaiya, H., Kojima, M., Hosoda, H., Koda, A., Yamamoto, K., Kitajima, Y., ..., & Kangawa, K. (2001).
Bullfrog ghrelin is modified by n-octanoic acid at its third threonine residue. The Journal of biological chemistry, 276(44), 40441-8. [PubMed:11546772] [WorldCat] [DOI] - ↑
Kaiya, H., Sakata, I., Kojima, M., Hosoda, H., Sakai, T., & Kangawa, K. (2004).
Structural determination and histochemical localization of ghrelin in the red-eared slider turtle, Trachemys scripta elegans. General and comparative endocrinology, 138(1), 50-7. [PubMed:15242751] [WorldCat] [DOI] - ↑
Kaiya, H., Sakata, I., Yamamoto, K., Koda, A., Sakai, T., Kangawa, K., & Kikuyama, S. (2006).
Identification of immunoreactive plasma and stomach ghrelin, and expression of stomach ghrelin mRNA in the bullfrog, Rana catesbeiana. General and comparative endocrinology, 148(2), 236-44. [PubMed:16630619] [WorldCat] [DOI] - ↑
Kaiya, H., Tsukada, T., Yuge, S., Mondo, H., Kangawa, K., & Takei, Y. (2006).
Identification of eel ghrelin in plasma and stomach by radioimmunoassay and histochemistry. General and comparative endocrinology, 148(3), 375-82. [PubMed:16762351] [WorldCat] [DOI] - ↑
Suda, A., Kaiya, H., Nikaido, H., Shiozawa, S., Mishiro, K., & Ando, H. (2012).
Identification and gene expression analyses of ghrelin in the stomach of Pacific bluefin tuna (Thunnus orientalis). General and comparative endocrinology, 178(1), 89-97. [PubMed:22569173] [WorldCat] [DOI] - ↑
Nishi, Y., Hiejima, H., Hosoda, H., Kaiya, H., Mori, K., Fukue, Y., ..., & Kojima, M. (2005).
Ingested medium-chain fatty acids are directly utilized for the acyl modification of ghrelin. Endocrinology, 146(5), 2255-64. [PubMed:15677766] [WorldCat] [DOI] - ↑
Nishi, Y., Hiejima, H., Mifune, H., Sato, T., Kangawa, K., & Kojima, M. (2005).
Developmental changes in the pattern of ghrelin's acyl modification and the levels of acyl-modified ghrelins in murine stomach. Endocrinology, 146(6), 2709-15. [PubMed:15746259] [WorldCat] [DOI] - ↑
Zhang, J.V., Ren, P.G., Avsian-Kretchmer, O., Luo, C.W., Rauch, R., Klein, C., & Hsueh, A.J. (2005).
Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin's effects on food intake. Science (New York, N.Y.), 310(5750), 996-9. [PubMed:16284174] [WorldCat] [DOI] - ↑
Chartrel, N., Alvear-Perez, R., Leprince, J., Iturrioz, X., Reaux-Le Goazigo, A., Audinot, V., ..., & Llorens-Cortes, C. (2007).
Comment on "Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin's effects on food intake". Science (New York, N.Y.), 315(5813), 766; author reply 766. [PubMed:17289961] [WorldCat] [DOI] - ↑
Zizzari, P., Hassouna, R., Grouselle, D., Epelbaum, J., & Tolle, V. (2011).
Physiological roles of preproghrelin-derived peptides in GH secretion and feeding. Peptides, 32(11), 2274-82. [PubMed:21530598] [WorldCat] [DOI] - ↑
Holst, B., Egerod, K.L., Schild, E., Vickers, S.P., Cheetham, S., Gerlach, L.O., ..., & Schwartz, T.W. (2007).
GPR39 signaling is stimulated by zinc ions but not by obestatin. Endocrinology, 148(1), 13-20. [PubMed:16959833] [WorldCat] [DOI] - ↑
Zizzari, P., Longchamps, R., Epelbaum, J., & Bluet-Pajot, M.T. (2007).
Obestatin partially affects ghrelin stimulation of food intake and growth hormone secretion in rodents. Endocrinology, 148(4), 1648-53. [PubMed:17204551] [PMC] [WorldCat] [DOI] - ↑
Nogueiras, R., Pfluger, P., Tovar, S., Arnold, M., Mitchell, S., Morris, A., ..., & Diéguez, C. (2007).
Effects of obestatin on energy balance and growth hormone secretion in rodents. Endocrinology, 148(1), 21-6. [PubMed:17008393] [WorldCat] [DOI] - ↑
Smith, R.G., Van der Ploeg, L.H., Howard, A.D., Feighner, S.D., Cheng, K., Hickey, G.J., ..., & Patchett, A.A. (1997).
Peptidomimetic regulation of growth hormone secretion. Endocrine reviews, 18(5), 621-45. [PubMed:9331545] [WorldCat] [DOI] - ↑
Tanaka, M., Hayashida, Y., Iguchi, T., Nakao, N., Nakai, N., & Nakashima, K. (2001).
Organization of the mouse ghrelin gene and promoter: occurrence of a short noncoding first exon. Endocrinology, 142(8), 3697-700. [PubMed:11459820] [WorldCat] [DOI] - ↑
Kanamoto, N., Akamizu, T., Tagami, T., Hataya, Y., Moriyama, K., Takaya, K., ..., & Nakao, K. (2004).
Genomic structure and characterization of the 5'-flanking region of the human ghrelin gene. Endocrinology, 145(9), 4144-53. [PubMed:15142980] [WorldCat] [DOI] - ↑
Hosoda, H., Kojima, M., Matsuo, H., & Kangawa, K. (2000).
Purification and characterization of rat des-Gln14-Ghrelin, a second endogenous ligand for the growth hormone secretagogue receptor. The Journal of biological chemistry, 275(29), 21995-2000. [PubMed:10801861] [WorldCat] [DOI] - ↑
Asakawa, A., Inui, A., Kaga, T., Yuzuriha, H., Nagata, T., Ueno, N., ..., & Kasuga, M. (2001).
Ghrelin is an appetite-stimulatory signal from stomach with structural resemblance to motilin. Gastroenterology, 120(2), 337-45. [PubMed:11159873] [WorldCat] [DOI] - ↑
Ueno, N., Dube, M.G., Inui, A., Kalra, P.S., & Kalra, S.P. (2004).
Leptin modulates orexigenic effects of ghrelin and attenuates adiponectin and insulin levels and selectively the dark-phase feeding as revealed by central leptin gene therapy. Endocrinology, 145(9), 4176-84. [PubMed:15155574] [WorldCat] [DOI] - ↑
Steinert, R.E., Feinle-Bisset, C., Asarian, L., Horowitz, M., Beglinger, C., & Geary, N. (2017).
Ghrelin, CCK, GLP-1, and PYY(3-36): Secretory Controls and Physiological Roles in Eating and Glycemia in Health, Obesity, and After RYGB. Physiological reviews, 97(1), 411-463. [PubMed:28003328] [PMC] [WorldCat] [DOI] - ↑
Mundinger, T.O., Cummings, D.E., & Taborsky, G.J. (2006).
Direct stimulation of ghrelin secretion by sympathetic nerves. Endocrinology, 147(6), 2893-901. [PubMed:16527847] [WorldCat] [DOI] - ↑ 35.0 35.1
Shiimura, Y., Horita, S., Hamamoto, A., Asada, H., Hirata, K., Tanaka, M., ..., & Kojima, M. (2020).
Structure of an antagonist-bound ghrelin receptor reveals possible ghrelin recognition mode. Nature communications, 11(1), 4160. [PubMed:32814772] [PMC] [WorldCat] [DOI] - ↑
Liu, H., Sun, D., Myasnikov, A., Damian, M., Baneres, J.L., Sun, J., & Zhang, C. (2021).
Structural basis of human ghrelin receptor signaling by ghrelin and the synthetic agonist ibutamoren. Nature communications, 12(1), 6410. [PubMed:34737341] [PMC] [WorldCat] [DOI] - ↑
Qin, J., Cai, Y., Xu, Z., Ming, Q., Ji, S.Y., Wu, C., ..., & Shao, Z. (2022).
Molecular mechanism of agonism and inverse agonism in ghrelin receptor. Nature communications, 13(1), 300. [PubMed:35027551] [PMC] [WorldCat] [DOI] - ↑
Wang, Y., Guo, S., Zhuang, Y., Yun, Y., Xu, P., He, X., ..., & Jiang, Y. (2021).
Molecular recognition of an acyl-peptide hormone and activation of ghrelin receptor. Nature communications, 12(1), 5064. [PubMed:34417468] [PMC] [WorldCat] [DOI] - ↑
Shiimura, Y., Im, D., Tany, R., Asada, H., Kise, R., Kurumiya, E., ..., & Masuho, I. (2025).
The structure and function of the ghrelin receptor coding for drug actions. Nature structural & molecular biology, 32(3), 531-542. [PubMed:39833471] [WorldCat] [DOI] - ↑
Sato, T., Fukue, Y., Teranishi, H., Yoshida, Y., & Kojima, M. (2005).
Molecular forms of hypothalamic ghrelin and its regulation by fasting and 2-deoxy-d-glucose administration. Endocrinology, 146(6), 2510-6. [PubMed:15774556] [WorldCat] [DOI] - ↑ 41.0 41.1
Date, Y., Nakazato, M., Hashiguchi, S., Dezaki, K., Mondal, M.S., Hosoda, H., ..., & Matsukura, S. (2002).
Ghrelin is present in pancreatic alpha-cells of humans and rats and stimulates insulin secretion. Diabetes, 51(1), 124-9. [PubMed:11756331] [WorldCat] [DOI] - ↑
Ghizzoni, L., Mastorakos, G., Vottero, A., Ziveri, M., Ilias, I., & Bernasconi, S. (2004).
Spontaneous growth hormone (GH) secretion is not directly affected by ghrelin in either short normal prepubertal children or children with GH neurosecretory dysfunction. The Journal of clinical endocrinology and metabolism, 89(11), 5488-95. [PubMed:15531502] [WorldCat] [DOI] - ↑
Korbonits, M., Kojima, M., Kangawa, K., & Grossman, A.B. (2001).
Presence of ghrelin in normal and adenomatous human pituitary. Endocrine, 14(1), 101-4. [PubMed:11322490] [WorldCat] [DOI] - ↑
Mori, K., Yoshimoto, A., Takaya, K., Hosoda, K., Ariyasu, H., Yahata, K., ..., & Nakao, K. (2000).
Kidney produces a novel acylated peptide, ghrelin. FEBS letters, 486(3), 213-6. [PubMed:11119706] [WorldCat] [DOI] - ↑
Prado, C.L., Pugh-Bernard, A.E., Elghazi, L., Sosa-Pineda, B., & Sussel, L. (2004).
Ghrelin cells replace insulin-producing beta cells in two mouse models of pancreas development. Proceedings of the National Academy of Sciences of the United States of America, 101(9), 2924-9. [PubMed:14970313] [PMC] [WorldCat] [DOI] - ↑
Dezaki, K., Sone, H., Koizumi, M., Nakata, M., Kakei, M., Nagai, H., ..., & Yada, T. (2006).
Blockade of pancreatic islet-derived ghrelin enhances insulin secretion to prevent high-fat diet-induced glucose intolerance. Diabetes, 55(12), 3486-93. [PubMed:17130496] [WorldCat] [DOI] - ↑
Rindi, G., Necchi, V., Savio, A., Torsello, A., Zoli, M., Locatelli, V., ..., & Solcia, E. (2002).
Characterisation of gastric ghrelin cells in man and other mammals: studies in adult and fetal tissues. Histochemistry and cell biology, 117(6), 511-9. [PubMed:12107501] [WorldCat] [DOI] - ↑ 48.0 48.1
Tschöp, M., Smiley, D.L., & Heiman, M.L. (2000).
Ghrelin induces adiposity in rodents. Nature, 407(6806), 908-13. [PubMed:11057670] [WorldCat] [DOI] - ↑ 49.0 49.1 49.2
Nakazato, M., Murakami, N., Date, Y., Kojima, M., Matsuo, H., Kangawa, K., & Matsukura, S. (2001).
A role for ghrelin in the central regulation of feeding. Nature, 409(6817), 194-8. [PubMed:11196643] [WorldCat] [DOI] - ↑
Wren, A.M., Small, C.J., Ward, H.L., Murphy, K.G., Dakin, C.L., Taheri, S., ..., & Bloom, S.R. (2000).
The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion. Endocrinology, 141(11), 4325-8. [PubMed:11089570] [WorldCat] [DOI] - ↑
Wren, A.M., Small, C.J., Abbott, C.R., Dhillo, W.S., Seal, L.J., Cohen, M.A., ..., & Bloom, S.R. (2001).
Ghrelin causes hyperphagia and obesity in rats. Diabetes, 50(11), 2540-7. [PubMed:11679432] [WorldCat] [DOI] - ↑
Kamegai, J., Tamura, H., Shimizu, T., Ishii, S., Sugihara, H., & Wakabayashi, I. (2001).
Chronic central infusion of ghrelin increases hypothalamic neuropeptide Y and Agouti-related protein mRNA levels and body weight in rats. Diabetes, 50(11), 2438-43. [PubMed:11679419] [WorldCat] [DOI] - ↑
Shintani, M., Ogawa, Y., Ebihara, K., Aizawa-Abe, M., Miyanaga, F., Takaya, K., ..., & Nakao, K. (2001).
Ghrelin, an endogenous growth hormone secretagogue, is a novel orexigenic peptide that antagonizes leptin action through the activation of hypothalamic neuropeptide Y/Y1 receptor pathway. Diabetes, 50(2), 227-32. [PubMed:11272130] [WorldCat] [DOI] - ↑
Cowley, M.A., Smith, R.G., Diano, S., Tschöp, M., Pronchuk, N., Grove, K.L., ..., & Horvath, T.L. (2003).
The distribution and mechanism of action of ghrelin in the CNS demonstrates a novel hypothalamic circuit regulating energy homeostasis. Neuron, 37(4), 649-61. [PubMed:12597862] [WorldCat] [DOI] - ↑
Ollmann, M.M., Wilson, B.D., Yang, Y.K., Kerns, J.A., Chen, Y., Gantz, I., & Barsh, G.S. (1997).
Antagonism of central melanocortin receptors in vitro and in vivo by agouti-related protein. Science (New York, N.Y.), 278(5335), 135-8. [PubMed:9311920] [WorldCat] [DOI] - ↑
López, M., Lage, R., Saha, A.K., Pérez-Tilve, D., Vázquez, M.J., Varela, L., ..., & Vidal-Puig, A. (2008).
Hypothalamic fatty acid metabolism mediates the orexigenic action of ghrelin. Cell metabolism, 7(5), 389-99. [PubMed:18460330] [WorldCat] [DOI] - ↑
Date, Y., Murakami, N., Kojima, M., Kuroiwa, T., Matsukura, S., Kangawa, K., & Nakazato, M. (2000).
Central effects of a novel acylated peptide, ghrelin, on growth hormone release in rats. Biochemical and biophysical research communications, 275(2), 477-80. [PubMed:10964690] [WorldCat] [DOI] - ↑
Takaya, K., Ariyasu, H., Kanamoto, N., Iwakura, H., Yoshimoto, A., Harada, M., ..., & Nakao, K. (2000).
Ghrelin strongly stimulates growth hormone release in humans. The Journal of clinical endocrinology and metabolism, 85(12), 4908-11. [PubMed:11134161] [WorldCat] [DOI] - ↑
Hataya, Y., Akamizu, T., Takaya, K., Kanamoto, N., Ariyasu, H., Saijo, M., ..., & Nakao, K. (2001).
A low dose of ghrelin stimulates growth hormone (GH) release synergistically with GH-releasing hormone in humans. The Journal of clinical endocrinology and metabolism, 86(9), 4552. [PubMed:11549707] [WorldCat] [DOI] - ↑
Broglio, F., Arvat, E., Benso, A., Gottero, C., Muccioli, G., Papotti, M., ..., & Ghigo, E. (2001).
Ghrelin, a natural GH secretagogue produced by the stomach, induces hyperglycemia and reduces insulin secretion in humans. The Journal of clinical endocrinology and metabolism, 86(10), 5083-6. [PubMed:11600590] [WorldCat] [DOI] - ↑
Vestergaard, E.T., Gormsen, L.C., Jessen, N., Lund, S., Hansen, T.K., Moller, N., & Jorgensen, J.O. (2008).
Ghrelin infusion in humans induces acute insulin resistance and lipolysis independent of growth hormone signaling. Diabetes, 57(12), 3205-10. [PubMed:18776138] [PMC] [WorldCat] [DOI] - ↑
Barazzoni, R., Bosutti, A., Stebel, M., Cattin, M.R., Roder, E., Visintin, L., ..., & Guarnieri, G. (2005).
Ghrelin regulates mitochondrial-lipid metabolism gene expression and tissue fat distribution in liver and skeletal muscle. American journal of physiology. Endocrinology and metabolism, 288(1), E228-35. [PubMed:15328073] [WorldCat] [DOI] - ↑
Barazzoni, R., Zanetti, M., Semolic, A., Cattin, M.R., Pirulli, A., Cattin, L., & Guarnieri, G. (2011).
High-fat diet with acyl-ghrelin treatment leads to weight gain with low inflammation, high oxidative capacity and normal triglycerides in rat muscle. PloS one, 6(10), e26224. [PubMed:22039445] [PMC] [WorldCat] [DOI] - ↑
Chuang, J.C., & Zigman, J.M. (2010).
Ghrelin's Roles in Stress, Mood, and Anxiety Regulation. International journal of peptides, 2010. [PubMed:20721341] [PMC] [WorldCat] [DOI] - ↑
Sato, T., Oishi, K., Koga, D., Ida, T., Sakai, Y., Kangawa, K., & Kojima, M. (2021).
Thermoregulatory role of ghrelin in the induction of torpor under a restricted feeding condition. Scientific reports, 11(1), 17954. [PubMed:34518616] [PMC] [WorldCat] [DOI] - ↑
Nakamura, Y., Yanagawa, Y., Morrison, S.F., & Nakamura, K. (2017).
Medullary Reticular Neurons Mediate Neuropeptide Y-Induced Metabolic Inhibition and Mastication. Cell metabolism, 25(2), 322-334. [PubMed:28065829] [PMC] [WorldCat] [DOI] - ↑
Tesauro, M., Schinzari, F., Iantorno, M., Rizza, S., Melina, D., Lauro, D., & Cardillo, C. (2005).
Ghrelin improves endothelial function in patients with metabolic syndrome. Circulation, 112(19), 2986-92. [PubMed:16260640] [WorldCat] [DOI] - ↑
Nagaya, N., Moriya, J., Yasumura, Y., Uematsu, M., Ono, F., Shimizu, W., ..., & Kangawa, K. (2004).
Effects of ghrelin administration on left ventricular function, exercise capacity, and muscle wasting in patients with chronic heart failure. Circulation, 110(24), 3674-9. [PubMed:15569841] [WorldCat] [DOI] - ↑ 69.0 69.1
Nagaya, N., Uematsu, M., Kojima, M., Ikeda, Y., Yoshihara, F., Shimizu, W., ..., & Kangawa, K. (2001).
Chronic administration of ghrelin improves left ventricular dysfunction and attenuates development of cardiac cachexia in rats with heart failure. Circulation, 104(12), 1430-5. [PubMed:11560861] [WorldCat] [DOI] - ↑
Baldanzi, G., Filigheddu, N., Cutrupi, S., Catapano, F., Bonissoni, S., Fubini, A., ..., & Graziani, A. (2002).
Ghrelin and des-acyl ghrelin inhibit cell death in cardiomyocytes and endothelial cells through ERK1/2 and PI 3-kinase/AKT. The Journal of cell biology, 159(6), 1029-37. [PubMed:12486113] [PMC] [WorldCat] [DOI] - ↑
Pettersson, I., Muccioli, G., Granata, R., Deghenghi, R., Ghigo, E., Ohlsson, C., & Isgaard, J. (2002).
Natural (ghrelin) and synthetic (hexarelin) GH secretagogues stimulate H9c2 cardiomyocyte cell proliferation. The Journal of endocrinology, 175(1), 201-9. [PubMed:12379504] [WorldCat] [DOI] - ↑
Abizaid, A., Liu, Z.W., Andrews, Z.B., Shanabrough, M., Borok, E., Elsworth, J.D., ..., & Horvath, T.L. (2006).
Ghrelin modulates the activity and synaptic input organization of midbrain dopamine neurons while promoting appetite. The Journal of clinical investigation, 116(12), 3229-39. [PubMed:17060947] [PMC] [WorldCat] [DOI] - ↑
Dickson, S.L., Egecioglu, E., Landgren, S., Skibicka, K.P., Engel, J.A., & Jerlhag, E. (2011).
The role of the central ghrelin system in reward from food and chemical drugs. Molecular and cellular endocrinology, 340(1), 80-7. [PubMed:21354264] [WorldCat] [DOI] - ↑
Diano, S., Farr, S.A., Benoit, S.C., McNay, E.C., da Silva, I., Horvath, B., ..., & Horvath, T.L. (2006).
Ghrelin controls hippocampal spine synapse density and memory performance. Nature neuroscience, 9(3), 381-8. [PubMed:16491079] [WorldCat] [DOI] - ↑
Carlini, V.P., Monzón, M.E., Varas, M.M., Cragnolini, A.B., Schiöth, H.B., Scimonelli, T.N., & de Barioglio, S.R. (2002).
Ghrelin increases anxiety-like behavior and memory retention in rats. Biochemical and biophysical research communications, 299(5), 739-43. [PubMed:12470640] [WorldCat] [DOI] - ↑
Ariyasu, H., Takaya, K., Tagami, T., Ogawa, Y., Hosoda, K., Akamizu, T., ..., & Nakao, K. (2001).
Stomach is a major source of circulating ghrelin, and feeding state determines plasma ghrelin-like immunoreactivity levels in humans. The Journal of clinical endocrinology and metabolism, 86(10), 4753-8. [PubMed:11600536] [WorldCat] [DOI] - ↑
Blom, W.A., Stafleu, A., de Graaf, C., Kok, F.J., Schaafsma, G., & Hendriks, H.F. (2005).
Ghrelin response to carbohydrate-enriched breakfast is related to insulin. The American journal of clinical nutrition, 81(2), 367-75. [PubMed:15699223] [WorldCat] [DOI] - ↑
Otto, B., Cuntz, U., Fruehauf, E., Wawarta, R., Folwaczny, C., Riepl, R.L., ..., & Tschöp, M. (2001).
Weight gain decreases elevated plasma ghrelin concentrations of patients with anorexia nervosa. European journal of endocrinology, 145(5), 669-73. [PubMed:11720888] [WorldCat] - ↑
Garcia, J.M., Friend, J., & Allen, S. (2013).
Therapeutic potential of anamorelin, a novel, oral ghrelin mimetic, in patients with cancer-related cachexia: a multicenter, randomized, double-blind, crossover, pilot study. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer, 21(1), 129-37. [PubMed:22699302] [WorldCat] [DOI]