「シナプトタグミン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の41版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:synaptotagmin | |||
シナプトタグミンはシナプス小胞上に豊富に存在するカルシウム・リン脂質結合分子として1990年に同定された膜タンパク質である<ref name=ref1><pubmed>2333096</pubmed></ref>。シナプトタグミンは植物・動物を含め様々な生物種に存在することが現在では知られており、ヒトやマウスでは17種類のアイソフォームの存在が報告されている<ref name=ref2><pubmed>12801916</pubmed></ref> <ref name=ref3><pubmed>20078875</pubmed></ref>。シナプトタグミンファミリーはN末端側に膜貫通領域を1カ所持ち、C末端側の細胞質領域に存在する二つのC2領域でカルシウムイオンやリン脂質を結合することが知られている<ref name=ref4><pubmed>15217342</pubmed></ref> <ref name=ref5>'''Fukuda, M.'''<br>Molecular mechanism of Exocytosis.<br>Landes Bioscience, Austin, TX, (2006) 42-61</ref> <ref name=ref6><pubmed>16698267</pubmed></ref> <ref name=ref7><pubmed>18275379</pubmed></ref>。このカルシウムイオンの結合能を利用して、シナプトタグミンファミリーはシナプス小胞からの神経伝達物質放出をはじめ、開口放出(エクソサイトーシス:exocytosis)の際の主要な「カルシウムセンサー」として機能するものと考えられている。 | |||
== 神経伝達物質放出を司るカルシウムセンサー == | |||
[[image:シナプトタグミン図1.jpg|thumb|300px|'''図1''']] | |||
神経細胞間の情報伝達は、主にシナプス部における神経伝達物質のやり取りによって行われている。神経伝達物質はプレシナプスに存在するシナプス小胞に貯蔵されており、開口放出によってシナプス間隙へと放出される。この開口放出機構は、小胞のプレシナプス膜付近への移動(トランスロケーション:translocation)、細胞膜との繋留/接着(テザリング/ドッキング:tethering/docking)、プライミングと呼ばれる融合可能な状態への準備(priming)を経て、小胞膜と細胞膜の融合(fusion)に至る一連の過程から構成されている(図1)。開口放出によって細胞膜に移行した小胞のタンパク質は、その後エンドサイトーシスによって選択的に回収(リサイクリング:recycling)される。これらの過程の中で、特にシナプス小胞と細胞膜の融合は細胞外からのカルシウムイオン流入によって厳密に制御されていることから、シナプス小胞上にはカルシウムイオン上昇を感知するカルシウムセンサー(カルシウムイオンを結合し膜融合を促進する分子で、膜融合の装置そのものではない)の存在が提唱されてきた<ref name=ref8><pubmed>11399430</pubmed></ref>。遺伝学、生化学などを駆使した近年の目覚ましい研究成果により、現在ではシナプス小胞上に存在するシナプトタグミン1分子が主要なカルシウムセンサー(唯一ではなく、主に低親和性カルシウムセンサーとして機能)であると考えられている<ref name=ref4><pubmed>15217342</pubmed></ref> <ref name=ref5>'''Fukuda, M.'''<br>Molecular mechanism of Exocytosis.<br>Landes Bioscience, Austin, TX, (2006) 42-61</ref> <ref name=ref6><pubmed>16698267</pubmed></ref> <ref name=ref7><pubmed>18275379</pubmed></ref>。また、シナプス小胞以外のカルシウム依存的な小胞輸送過程に他のシナプトタグミンアイソフォームの関与も相次いで報告され、シナプトタグミンファミリーがかなり普遍的なカルシウムセンサーではないかという概念が定着しつつある。 | |||
== シナプトタグミンファミリーの構造 == | |||
[[image:シナプトタグミン図2.jpg|thumb|300px|'''図2''']] | |||
シナプトタグミンはN末端側に膜貫通領域を持つ1回膜貫通型の膜タンパク質で、C末端側の細胞質領域にはC2領域と呼ばれるプロテインキナーゼCのC2調節領域に由来するタンパク質モチーフを2つ持っている(N末端側から、内腔領域、膜貫通領域、スペーサー領域、C2A領域、C2B領域と命名)(図2)。ほ乳類には少なくとも17種類のアイソフォームが存在し、このうちシナプトタグミン1, 4, 7, 12, 14はショウジョウバエからほ乳類に至るまで進化的に保存されている<ref name=ref2><pubmed>12801916</pubmed></ref> <ref name=ref3><pubmed>20078875</pubmed></ref>。なお、シナプトタグミン16(元々の名称はStrep14)およびシナプトタグミン17(元々の名称はB/K)は膜貫通領域が欠損しているため、厳密にはシナプトタグミンファミリーの範疇には属さない<ref name=ref2><pubmed>12801916</pubmed></ref>。シナプトタグミンファミリー間で機能領域と考えられているC2A領域およびC2B領域は高度に保存されているが、他の領域(内腔領域、膜貫通領域およびスペーサー領域)ではほとんど相同性を示さない。シナプトタグミン1, 2では、細胞外に位置する内腔領域でN結合型糖鎖およびO結合型糖鎖の修飾を受けている。また、多くのアイソフォームで膜貫通領域の近傍でアシル化による修飾(システイン残基への脂肪酸の付加)を受け、オリゴマー形成が促進される<ref name=ref9><pubmed> 11514560</pubmed></ref>。二つのC2領域はアミノ酸レベルで40%以上の相同性を示すため、基本的には同様な立体構造を取り(8本のβストランドと3本のカルシウム結合ループにより構成)共にカルシウム結合能を示すが<ref name=ref10><pubmed>7697723</pubmed></ref> <ref name=ref11><pubmed>11754837</pubmed></ref>、互いに異なる生化学的性質も示す。一例を挙げると、C2B領域にはカルシウム非依存的にイノシトールポリリン酸、アダプター複合体AP-2、ニューレキシン(neurexin)などが結合し、またカルシウム依存的にC2B領域同士が結合し多量体を形成するが<ref name=ref12><pubmed>7961887</pubmed></ref> <ref name=ref13><pubmed>9830048</pubmed></ref>、これらの性質はC2A領域には見られない(図2)。カルシウム依存的にC2領域に結合する分子とシナプトタグミン1の結合に必要なカルシウム濃度は5-100μMであり、この濃度は神経細胞で開口放出に必要とされるカルシウムイオン濃度とほぼ一致している<ref name=ref8><pubmed>11399430</pubmed></ref>。 | |||
なお、シナプトタグミンファミリーと同様にC末端側に2つのC2領域を持つタンパク質ファミリーとしてDoc2/rabphilinファミリーやシナプトタグミン様タンパク質Slp(synaptotagmin-like protein)ファミリーが知られており、一部のものではシナプトタグミンとは異なるタイプのカルシウムセンサー(神経伝達物質放出の際の高親和性カルシウムセンサーなど)としての機能が提唱されている[14,15]。 | |||
== | == シナプトタグミン1の神経伝達物質放出における機能 == | ||
[[ | シナプトタグミン1は1981年にシナプス小胞や内分泌細胞の有芯小胞上に豊富に存在する分子量65,000のシナプス小胞抗原タンパク質(p65)として報告され[16]、1990年にその構造が明らかにされた[1]。シナプトタグミン1は大脳、海馬などの脳組織に強く発現しており、ノックアウトマウスを用いた解析の結果、海馬神経細胞における開口放出のうちカルシウム依存的な活動電位と同調した速い放出(synchronous release)に重要であることが明らかとなった[17]。同様な活動電位と同調した速い放出成分の減少は、ショウジョウバエのシナプトタグミン1変異体でも観察されたことから[18]、シナプトタグミン1は活動電位と同調した低親和性のカルシウムセンサーとして機能すると一般的に考えられている。一方で、線虫やショウジョウバエのシナプトタグミン1変異体では開口放出の過程だけではなく、シナプス小胞のリサイクリングの過程にも異常があることが報告されており[19,20]、シナプトタグミン1が単なるカルシウムセンサーではなく、シナプス小胞輸送の様々なステップの制御にも関与する可能性が示唆されている。 | ||
このようなシナプトタグミン1の機能の多様性は、それぞれのC2領域の固有の機能と密接な関連があるものと考えられている。例えば、C2A領域のリン脂質結合能が減少している変異型シナプトタグミン1(R233Q)をノックインしたマウス由来の神経細胞では神経伝達物質の放出が抑制されるが[21]、逆にC2A領域のカルシウム依存的なシンタキシンへの結合が増加している優勢変異型シナプトタグミン1(D232N)をノックインしたマウス由来の神経細胞では神経伝達物質の放出が増加する[22]。一方で、C2A領域へのカルシウムイオン結合能は神経伝達物質放出に必須ではないという報告もあり混沌としているが[23]、シナプトタグミン1のC2A領域に対する機能阻害抗体によりシナプス小胞の融合過程が著しく阻害されることから[24]、C2A領域の機能はやはりシナプス小胞の融合促進に重要と考えられている。 | |||
これに対して、C2B領域はシナプス小胞の融合促進だけではなく[25,26]、シナプス小胞のエンドサイトーシスやドッキングなどの過程[27,28]にも関与するものと考えられている。例えば、ヤリイカ巨大軸索ではC2B領域に対する機能阻害抗体の導入により、シナプス小胞の融合過程には全く影響がなく、シナプス小胞のリサイクリングの過程が特異的に阻害される(恐らくはAP-2との結合を阻害)[29]。一方、C2Bドメインに特異的に結合するイノシトールポリリン酸(イノシトール1,3,4,5-四リン酸(IP4)など)をプレシナプスに導入すると、C2B領域に結合することによりシナプス小胞の融合過程が顕著に阻害される[30]。さらに、C2B領域(特にC2Bエフェクタードメインと呼ばれるβ4ストランド上の塩基性クラスター[12,13])はカルシウム刺激がないときには融合を抑制するようなクランプ的な機能を併せ持つと想定されており[31,32]、ショウジョウバエなどのシナプトタグミン1変異体では自発的な神経伝達物質放出が増大することが知られている[33]。このようなC2B領域の機能の多様性は、C2B領域に複数のエフェクター結合領域が存在することに起因するものと考えられている[5]。また、C2B領域は必ずしも単独で機能するのではなく、一部C2A領域と協調して小胞の融合を促進するモデルも提唱されている[34,35]。 | |||
シナプトタグミンによるカルシウム依存的な小胞融合の促進メカニズムとして現在最も有力な仮説は、膜の融合装置と考えられるSNAREタンパク質とシナプトタグミンとのカルシウム依存的な相互作用により小胞膜と細胞膜の融合が促進されるというモデルである。実際、精製したSNAREタンパク質を組み込んだ2種類のリポソーム(v-SNAREシナプトブレビンを組み込んだリポソームおよびt-SNAREシンタキシンとSNAP-25を組み込んだリポソーム)にカルシウムイオンとシナプトタグミン1の細胞質領域を加えることにより2種類のリポソームの膜融合が顕著に促進される[36]。一方、シナプトタグミンのC2領域のカルシウム依存的なリン脂質の結合が小胞の融合を促進するという仮説や、C2B領域同士のカルシウム依存的なオリゴマー化がシナプス小胞と細胞膜の融合により生じた孔を拡大させるという仮説も提唱されている[37]。 | |||
[[ | |||
== シナプス小胞上で機能する他のシナプトタグミンファミリー == | |||
シナプトタグミン1以外にシナプス小胞上に存在するシナプトタグミンとしてはシナプトタグミン2, 9, 12などが報告されている[38]。このうちシナプトタグミン2およびシナプトタグミン9は、シナプトタグミン1とは脳内において異なる発現パターンを示す[39]。シナプトタグミン2は小脳や脳幹部での発現が高く、そのノックアウトマウスにおいては例えば神経筋接合部における活動電位に依存した放出過程に異常が生じる[40]。一方、シナプトタグミン9の神経系における発現パターンは大脳辺縁系や線条体などに限られており、そのノックアウトマウスにおいては線条体由来の神経細胞における活動電位に依存した放出過程に異常が生じる[39]。シナプトタグミン2およびシナプトタグミン9は系統樹上シナプトタグミン1に最も近縁で同等の機能を有すると考えられており[41]、実際これらのシナプトタグミンの発現によりシナプトタグミン1を欠損する海馬神経細胞からの活動電位に依存した放出が回復することが示されている(ただし、シナプトタグミン1, 2, 9の間では放出速度に違いがある)[39]。シナプトタグミン12(元々の名称はSrg1)は脳組織に広範囲に発現しているが、カルシウムイオンの結合能力がなく、活動電位に依存した放出過程ではなく自発的放出(spontaneous release)の促進に関与することが報告されている[42]。 | |||
== シナプス小胞輸送以外で機能するシナプトタグミンファミリー == | |||
シナプス小胞の輸送以外の神経機能に関わるシナプトタグミンファミリーとしては、シナプトタグミン4、7、10、14などが挙げられる。シナプトタグミン4の局在や機能に関してはこれまで様々な報告があるが、最近の知見ではシナプス小胞ではなくペプチド性分泌因子などの放出に関与する有芯小胞(LDCV: large dense-core vesicle)への局在が有力視されている[43]。例えば、視床下部におけるオキシトシンやバソプレシンの分泌[44,45]や海馬神経細胞における脳由来神経栄養因子(BDNF)の放出制御に関与することが明らかになっている[46]。また、シナプトタグミン4は神経細胞以外にアストロサイトにも発現しており、アストロサイトからのグルタミン酸やATPの放出に関与することが報告されている[47]。さらに、ショウジョウバエにおいては、シナプトタグミン4はプレシナプスではなくポストシナプスにおけるカルシウムセンサーとして機能することが報告されている[48,49]。なお、シナプトタグミン4は動物種、細胞種やカルシウム濃度の条件によって開口放出を正に制御する場合と負に制御する場合があることから、その機能については今後さらなる解析が必要と考えられている[43]。 | |||
シナプトタグミン10も嗅球の神経細胞において有芯小胞に局在し、インスリン様成長因子1(IGF-1)の放出を制御することで嗅球の神経発生に関与することが最近明らかになっている[50]。シナプトタグミン7は海馬神経細胞におけるシナプス小胞の開口放出には関与しないが、交感神経細胞の神経突起の伸長過程を制御することが報告されている[51]。また、シナプトタグミン14のC2B領域のアミノ酸変異により遺伝性の脊髄小脳変性症が発症することから[52]、このアイソフォームの小脳発達過程での重要性が示唆されているが、詳細な機能は明らかになっていない。 | |||
他のシナプトタグミンアイソフォームの神経細胞における局在や機能に関しては現時点では不明であるが、海馬神経細胞に蛍光タンパク質を融合したシナプトタグミンアイソフォームを1つずつ発現させ、その機能部位の同定が現在試みられている[53]。それぞれのシナプトタグミンアイソフォームが神経系において独自の機能を果たしている可能性が高く、今後のさらなる機能解析が期待されている。 | |||
== 参考文献 == | |||
<references /> | |||
(執筆者:森靖典、福田光則 担当編集委員:尾藤晴彦) | |||
2012年5月11日 (金) 16:53時点における版
英語名:synaptotagmin
シナプトタグミンはシナプス小胞上に豊富に存在するカルシウム・リン脂質結合分子として1990年に同定された膜タンパク質である[1]。シナプトタグミンは植物・動物を含め様々な生物種に存在することが現在では知られており、ヒトやマウスでは17種類のアイソフォームの存在が報告されている[2] [3]。シナプトタグミンファミリーはN末端側に膜貫通領域を1カ所持ち、C末端側の細胞質領域に存在する二つのC2領域でカルシウムイオンやリン脂質を結合することが知られている[4] [5] [6] [7]。このカルシウムイオンの結合能を利用して、シナプトタグミンファミリーはシナプス小胞からの神経伝達物質放出をはじめ、開口放出(エクソサイトーシス:exocytosis)の際の主要な「カルシウムセンサー」として機能するものと考えられている。
神経伝達物質放出を司るカルシウムセンサー
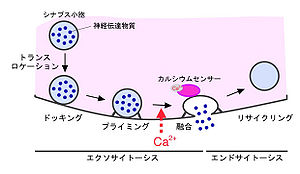
神経細胞間の情報伝達は、主にシナプス部における神経伝達物質のやり取りによって行われている。神経伝達物質はプレシナプスに存在するシナプス小胞に貯蔵されており、開口放出によってシナプス間隙へと放出される。この開口放出機構は、小胞のプレシナプス膜付近への移動(トランスロケーション:translocation)、細胞膜との繋留/接着(テザリング/ドッキング:tethering/docking)、プライミングと呼ばれる融合可能な状態への準備(priming)を経て、小胞膜と細胞膜の融合(fusion)に至る一連の過程から構成されている(図1)。開口放出によって細胞膜に移行した小胞のタンパク質は、その後エンドサイトーシスによって選択的に回収(リサイクリング:recycling)される。これらの過程の中で、特にシナプス小胞と細胞膜の融合は細胞外からのカルシウムイオン流入によって厳密に制御されていることから、シナプス小胞上にはカルシウムイオン上昇を感知するカルシウムセンサー(カルシウムイオンを結合し膜融合を促進する分子で、膜融合の装置そのものではない)の存在が提唱されてきた[8]。遺伝学、生化学などを駆使した近年の目覚ましい研究成果により、現在ではシナプス小胞上に存在するシナプトタグミン1分子が主要なカルシウムセンサー(唯一ではなく、主に低親和性カルシウムセンサーとして機能)であると考えられている[4] [5] [6] [7]。また、シナプス小胞以外のカルシウム依存的な小胞輸送過程に他のシナプトタグミンアイソフォームの関与も相次いで報告され、シナプトタグミンファミリーがかなり普遍的なカルシウムセンサーではないかという概念が定着しつつある。
シナプトタグミンファミリーの構造
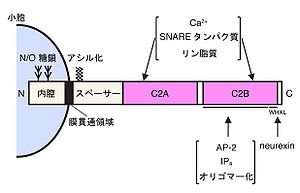
シナプトタグミンはN末端側に膜貫通領域を持つ1回膜貫通型の膜タンパク質で、C末端側の細胞質領域にはC2領域と呼ばれるプロテインキナーゼCのC2調節領域に由来するタンパク質モチーフを2つ持っている(N末端側から、内腔領域、膜貫通領域、スペーサー領域、C2A領域、C2B領域と命名)(図2)。ほ乳類には少なくとも17種類のアイソフォームが存在し、このうちシナプトタグミン1, 4, 7, 12, 14はショウジョウバエからほ乳類に至るまで進化的に保存されている[2] [3]。なお、シナプトタグミン16(元々の名称はStrep14)およびシナプトタグミン17(元々の名称はB/K)は膜貫通領域が欠損しているため、厳密にはシナプトタグミンファミリーの範疇には属さない[2]。シナプトタグミンファミリー間で機能領域と考えられているC2A領域およびC2B領域は高度に保存されているが、他の領域(内腔領域、膜貫通領域およびスペーサー領域)ではほとんど相同性を示さない。シナプトタグミン1, 2では、細胞外に位置する内腔領域でN結合型糖鎖およびO結合型糖鎖の修飾を受けている。また、多くのアイソフォームで膜貫通領域の近傍でアシル化による修飾(システイン残基への脂肪酸の付加)を受け、オリゴマー形成が促進される[9]。二つのC2領域はアミノ酸レベルで40%以上の相同性を示すため、基本的には同様な立体構造を取り(8本のβストランドと3本のカルシウム結合ループにより構成)共にカルシウム結合能を示すが[10] [11]、互いに異なる生化学的性質も示す。一例を挙げると、C2B領域にはカルシウム非依存的にイノシトールポリリン酸、アダプター複合体AP-2、ニューレキシン(neurexin)などが結合し、またカルシウム依存的にC2B領域同士が結合し多量体を形成するが[12] [13]、これらの性質はC2A領域には見られない(図2)。カルシウム依存的にC2領域に結合する分子とシナプトタグミン1の結合に必要なカルシウム濃度は5-100μMであり、この濃度は神経細胞で開口放出に必要とされるカルシウムイオン濃度とほぼ一致している[8]。
なお、シナプトタグミンファミリーと同様にC末端側に2つのC2領域を持つタンパク質ファミリーとしてDoc2/rabphilinファミリーやシナプトタグミン様タンパク質Slp(synaptotagmin-like protein)ファミリーが知られており、一部のものではシナプトタグミンとは異なるタイプのカルシウムセンサー(神経伝達物質放出の際の高親和性カルシウムセンサーなど)としての機能が提唱されている[14,15]。
シナプトタグミン1の神経伝達物質放出における機能
シナプトタグミン1は1981年にシナプス小胞や内分泌細胞の有芯小胞上に豊富に存在する分子量65,000のシナプス小胞抗原タンパク質(p65)として報告され[16]、1990年にその構造が明らかにされた[1]。シナプトタグミン1は大脳、海馬などの脳組織に強く発現しており、ノックアウトマウスを用いた解析の結果、海馬神経細胞における開口放出のうちカルシウム依存的な活動電位と同調した速い放出(synchronous release)に重要であることが明らかとなった[17]。同様な活動電位と同調した速い放出成分の減少は、ショウジョウバエのシナプトタグミン1変異体でも観察されたことから[18]、シナプトタグミン1は活動電位と同調した低親和性のカルシウムセンサーとして機能すると一般的に考えられている。一方で、線虫やショウジョウバエのシナプトタグミン1変異体では開口放出の過程だけではなく、シナプス小胞のリサイクリングの過程にも異常があることが報告されており[19,20]、シナプトタグミン1が単なるカルシウムセンサーではなく、シナプス小胞輸送の様々なステップの制御にも関与する可能性が示唆されている。 このようなシナプトタグミン1の機能の多様性は、それぞれのC2領域の固有の機能と密接な関連があるものと考えられている。例えば、C2A領域のリン脂質結合能が減少している変異型シナプトタグミン1(R233Q)をノックインしたマウス由来の神経細胞では神経伝達物質の放出が抑制されるが[21]、逆にC2A領域のカルシウム依存的なシンタキシンへの結合が増加している優勢変異型シナプトタグミン1(D232N)をノックインしたマウス由来の神経細胞では神経伝達物質の放出が増加する[22]。一方で、C2A領域へのカルシウムイオン結合能は神経伝達物質放出に必須ではないという報告もあり混沌としているが[23]、シナプトタグミン1のC2A領域に対する機能阻害抗体によりシナプス小胞の融合過程が著しく阻害されることから[24]、C2A領域の機能はやはりシナプス小胞の融合促進に重要と考えられている。
これに対して、C2B領域はシナプス小胞の融合促進だけではなく[25,26]、シナプス小胞のエンドサイトーシスやドッキングなどの過程[27,28]にも関与するものと考えられている。例えば、ヤリイカ巨大軸索ではC2B領域に対する機能阻害抗体の導入により、シナプス小胞の融合過程には全く影響がなく、シナプス小胞のリサイクリングの過程が特異的に阻害される(恐らくはAP-2との結合を阻害)[29]。一方、C2Bドメインに特異的に結合するイノシトールポリリン酸(イノシトール1,3,4,5-四リン酸(IP4)など)をプレシナプスに導入すると、C2B領域に結合することによりシナプス小胞の融合過程が顕著に阻害される[30]。さらに、C2B領域(特にC2Bエフェクタードメインと呼ばれるβ4ストランド上の塩基性クラスター[12,13])はカルシウム刺激がないときには融合を抑制するようなクランプ的な機能を併せ持つと想定されており[31,32]、ショウジョウバエなどのシナプトタグミン1変異体では自発的な神経伝達物質放出が増大することが知られている[33]。このようなC2B領域の機能の多様性は、C2B領域に複数のエフェクター結合領域が存在することに起因するものと考えられている[5]。また、C2B領域は必ずしも単独で機能するのではなく、一部C2A領域と協調して小胞の融合を促進するモデルも提唱されている[34,35]。
シナプトタグミンによるカルシウム依存的な小胞融合の促進メカニズムとして現在最も有力な仮説は、膜の融合装置と考えられるSNAREタンパク質とシナプトタグミンとのカルシウム依存的な相互作用により小胞膜と細胞膜の融合が促進されるというモデルである。実際、精製したSNAREタンパク質を組み込んだ2種類のリポソーム(v-SNAREシナプトブレビンを組み込んだリポソームおよびt-SNAREシンタキシンとSNAP-25を組み込んだリポソーム)にカルシウムイオンとシナプトタグミン1の細胞質領域を加えることにより2種類のリポソームの膜融合が顕著に促進される[36]。一方、シナプトタグミンのC2領域のカルシウム依存的なリン脂質の結合が小胞の融合を促進するという仮説や、C2B領域同士のカルシウム依存的なオリゴマー化がシナプス小胞と細胞膜の融合により生じた孔を拡大させるという仮説も提唱されている[37]。
シナプス小胞上で機能する他のシナプトタグミンファミリー
シナプトタグミン1以外にシナプス小胞上に存在するシナプトタグミンとしてはシナプトタグミン2, 9, 12などが報告されている[38]。このうちシナプトタグミン2およびシナプトタグミン9は、シナプトタグミン1とは脳内において異なる発現パターンを示す[39]。シナプトタグミン2は小脳や脳幹部での発現が高く、そのノックアウトマウスにおいては例えば神経筋接合部における活動電位に依存した放出過程に異常が生じる[40]。一方、シナプトタグミン9の神経系における発現パターンは大脳辺縁系や線条体などに限られており、そのノックアウトマウスにおいては線条体由来の神経細胞における活動電位に依存した放出過程に異常が生じる[39]。シナプトタグミン2およびシナプトタグミン9は系統樹上シナプトタグミン1に最も近縁で同等の機能を有すると考えられており[41]、実際これらのシナプトタグミンの発現によりシナプトタグミン1を欠損する海馬神経細胞からの活動電位に依存した放出が回復することが示されている(ただし、シナプトタグミン1, 2, 9の間では放出速度に違いがある)[39]。シナプトタグミン12(元々の名称はSrg1)は脳組織に広範囲に発現しているが、カルシウムイオンの結合能力がなく、活動電位に依存した放出過程ではなく自発的放出(spontaneous release)の促進に関与することが報告されている[42]。
シナプス小胞輸送以外で機能するシナプトタグミンファミリー
シナプス小胞の輸送以外の神経機能に関わるシナプトタグミンファミリーとしては、シナプトタグミン4、7、10、14などが挙げられる。シナプトタグミン4の局在や機能に関してはこれまで様々な報告があるが、最近の知見ではシナプス小胞ではなくペプチド性分泌因子などの放出に関与する有芯小胞(LDCV: large dense-core vesicle)への局在が有力視されている[43]。例えば、視床下部におけるオキシトシンやバソプレシンの分泌[44,45]や海馬神経細胞における脳由来神経栄養因子(BDNF)の放出制御に関与することが明らかになっている[46]。また、シナプトタグミン4は神経細胞以外にアストロサイトにも発現しており、アストロサイトからのグルタミン酸やATPの放出に関与することが報告されている[47]。さらに、ショウジョウバエにおいては、シナプトタグミン4はプレシナプスではなくポストシナプスにおけるカルシウムセンサーとして機能することが報告されている[48,49]。なお、シナプトタグミン4は動物種、細胞種やカルシウム濃度の条件によって開口放出を正に制御する場合と負に制御する場合があることから、その機能については今後さらなる解析が必要と考えられている[43]。
シナプトタグミン10も嗅球の神経細胞において有芯小胞に局在し、インスリン様成長因子1(IGF-1)の放出を制御することで嗅球の神経発生に関与することが最近明らかになっている[50]。シナプトタグミン7は海馬神経細胞におけるシナプス小胞の開口放出には関与しないが、交感神経細胞の神経突起の伸長過程を制御することが報告されている[51]。また、シナプトタグミン14のC2B領域のアミノ酸変異により遺伝性の脊髄小脳変性症が発症することから[52]、このアイソフォームの小脳発達過程での重要性が示唆されているが、詳細な機能は明らかになっていない。
他のシナプトタグミンアイソフォームの神経細胞における局在や機能に関しては現時点では不明であるが、海馬神経細胞に蛍光タンパク質を融合したシナプトタグミンアイソフォームを1つずつ発現させ、その機能部位の同定が現在試みられている[53]。それぞれのシナプトタグミンアイソフォームが神経系において独自の機能を果たしている可能性が高く、今後のさらなる機能解析が期待されている。
参考文献
- ↑
Perin, M.S., Fried, V.A., Mignery, G.A., Jahn, R., & Südhof, T.C. (1990).
Phospholipid binding by a synaptic vesicle protein homologous to the regulatory region of protein kinase C. Nature, 345(6272), 260-3. [PubMed:2333096] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Fukuda, M. (2003).
Molecular cloning, expression, and characterization of a novel class of synaptotagmin (Syt XIV) conserved from Drosophila to humans. Journal of biochemistry, 133(5), 641-9. [PubMed:12801916] [WorldCat] [DOI] - ↑ 3.0 3.1
Craxton, M. (2010).
A manual collection of Syt, Esyt, Rph3a, Rph3al, Doc2, and Dblc2 genes from 46 metazoan genomes--an open access resource for neuroscience and evolutionary biology. BMC genomics, 11, 37. [PubMed:20078875] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Sudhof, T.C. (2004).
The synaptic vesicle cycle. Annual review of neuroscience, 27, 509-47. [PubMed:15217342] [WorldCat] [DOI] - ↑ 5.0 5.1 Fukuda, M.
Molecular mechanism of Exocytosis.
Landes Bioscience, Austin, TX, (2006) 42-61 - ↑ 6.0 6.1
Rizo, J., Chen, X., & Araç, D. (2006).
Unraveling the mechanisms of synaptotagmin and SNARE function in neurotransmitter release. Trends in cell biology, 16(7), 339-50. [PubMed:16698267] [WorldCat] [DOI] - ↑ 7.0 7.1
Chapman, E.R. (2008).
How does synaptotagmin trigger neurotransmitter release? Annual review of biochemistry, 77, 615-41. [PubMed:18275379] [WorldCat] [DOI] - ↑ 8.0 8.1
Augustine, G.J. (2001).
How does calcium trigger neurotransmitter release? Current opinion in neurobiology, 11(3), 320-6. [PubMed:11399430] [WorldCat] [DOI] - ↑
Fukuda, M., Kanno, E., Ogata, Y., & Mikoshiba, K. (2001).
Mechanism of the SDS-resistant synaptotagmin clustering mediated by the cysteine cluster at the interface between the transmembrane and spacer domains. The Journal of biological chemistry, 276(43), 40319-25. [PubMed:11514560] [WorldCat] [DOI] - ↑
Sutton, R.B., Davletov, B.A., Berghuis, A.M., Südhof, T.C., & Sprang, S.R. (1995).
Structure of the first C2 domain of synaptotagmin I: a novel Ca2+/phospholipid-binding fold. Cell, 80(6), 929-38. [PubMed:7697723] [WorldCat] [DOI] - ↑
Fernandez, I., Araç, D., Ubach, J., Gerber, S.H., Shin, O., Gao, Y., ..., & Rizo, J. (2001).
Three-dimensional structure of the synaptotagmin 1 C2B-domain: synaptotagmin 1 as a phospholipid binding machine. Neuron, 32(6), 1057-69. [PubMed:11754837] [WorldCat] [DOI] - ↑
Fukuda, M., Aruga, J., Niinobe, M., Aimoto, S., & Mikoshiba, K. (1994).
Inositol-1,3,4,5-tetrakisphosphate binding to C2B domain of IP4BP/synaptotagmin II. The Journal of biological chemistry, 269(46), 29206-11. [PubMed:7961887] [WorldCat] - ↑
Chapman, E.R., Desai, R.C., Davis, A.F., & Tornehl, C.K. (1998).
Delineation of the oligomerization, AP-2 binding, and synprint binding region of the C2B domain of synaptotagmin. The Journal of biological chemistry, 273(49), 32966-72. [PubMed:9830048] [WorldCat] [DOI]
(執筆者:森靖典、福田光則 担当編集委員:尾藤晴彦)