遅いシナプス後電位
石川 太郎、籾山 俊彦
東京慈恵会医科大学 薬理学講座
DOI:10.14931/bsd.2434 原稿受付日:2012年9月13日 原稿完成日:2012年11月3日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英:slow postsynaptic potential
同義語:遅いシナプス電位、緩徐シナプス(後)電位
類義語:遅いシナプス電流 (slow synaptic current)、遅いシナプス後電流 (slow postsynaptic current)、遅いシナプス伝達 (slow synaptic transmission)、遅いEPSP (slow EPSP)、遅いIPSP (slow IPSP)
イオンチャネル型受容体(ionotropic receptors)を介して数ミリ秒~数10ミリ秒の時間経過で発生する「速いシナプス電位(fast synaptic potential)」に対して、代謝型受容体(代謝活性型受容体(meabotropic receptors)を介して数100ミリ秒~数分の時間経過で発生するシナプス電位を「遅いシナプス電位(slow synaptic potential)」と呼ぶ。遅いシナプス電位には興奮性(脱分極性)と抑制性(過分極性)のものがあり、様々な神経伝達物質によって伝達されている。
先駆的研究について
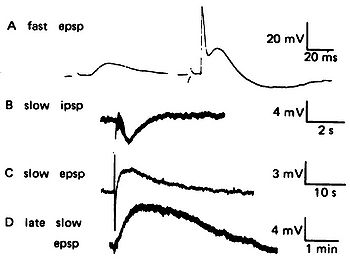
A. (左)速い興奮性シナプス後電位、(右)閾値を超えて活動電位を発火している。B. 遅い抑制性シナプス後電位。 C. 遅いシナプス後電位。D. 後期の遅いシナプス電位。Jan et al. (1979)[1]より転載(© Jan et al.)。
遅いシナプス電位については、1950年代から1980年代にかけて、ウシガエルの交感神経節(sympathetic ganglion)を用いた研究で多くの事実が明らかにされた。このシナプスでは、ニコチン性アセチルコリン受容体を介した速い興奮性シナプス電位の他に、ムスカリン性アセチルコリン受容体を介した遅い抑制性電位と興奮性電位があり、さらに、LHRH-like peptide(哺乳動物のLHRHに類似したペプチド)による後期の遅いシナプス電位(late slow synaptic potential)があることが明らかにされた[1]。これらの発見の経緯は久場による総説[2]に詳しい。
伝達物質と受容体の種類
速いシナプス伝達を担うイオンチャネル型受容体はそれ自体にイオンが透過する孔(pore)を持っているのに対し、遅いシナプス伝達を担う代謝型受容体はそれ自体にはイオンチャンネルとしての機能はなく、細胞内シグナル伝達を介してイオンチャンネルに働きかけることによって膜電位に影響を与える。神経系において遅いシナプス電位に関わる代謝型受容体の殆どはGタンパク質共役受容体(G-protein coupled receptors) [3]である。 神経系に存在する主なGタンパク質共役受容体としては、代謝型グルタミン酸受容体(metabotropic glutamate receptor)、GABAB受容体(型)、ドーパミン受容体(dopamine receptor)、セロトニン(5-HT)受容体(serotonin receptor)(3型を除く)、アドレナリン受容体(adrenergic receptor)、アデノシン受容体(adenosine receptor)、ムスカリン性アセチルコリン受容体(muscarinic acetylcholine receptor)、カンナビノイド受容体(cannabinoid receptor)、ヒスタミン受容体(histamine receptor)、P2Y受容体(P2Y receptor)があり、各々のリガンドにより活性化される。
また、Gタンパク質共役受容体以外にも、TrkB等の受容体型チロシンキナーゼが神経栄養因子(BDNF等)により活性化され、細胞内シグナル伝達を介して膜電位に影響を与える例が知られている[4]。
イオンチャンネルの種類
Gタンパク質シグナリングによって影響を受けるイオンチャンネルは数多いが、その中でシナプス電位として観察される電位変化をもたらすイオンチャンネルは、Gタンパク質共役型内向き整流性カリウムチャネル(GIRK channel)(Kir3により構成される)[5]、KCNQチャンネル(KvLQTやM channelとも呼ばれ、Kv7により構成される)[6]、およびTRPチャンネル(Transient receptor potentialchannel)[7][8]等である。
GIRKチャンネルやKCNQチャンネルのようにカリウムイオンを選択的に透過するチャンネルの場合は、開口により膜電位はカリウムの平衡電位である-80 mV付近に近づくため、静止膜電位から過分極する。逆に、閉口する場合には膜電位は脱分極する。TRPチャンネルのような非選択的陽イオンチャンネルの場合は、0 mV付近が平衡電位であるため、開口により膜電位は脱分極し、閉口により過分極する方向に向かう。 また、いずれのチャンネルの場合も、開口の場合には、電流が膜を通り易くなるため、膜抵抗が減少する。逆に、閉口の場合には膜抵抗は増加する。
GIRKチャンネルはGタンパク質共役受容体のGβγ サブユニットにより活性化されるのに加え、cAMP依存性蛋白質リン酸化酵素(protein kinase A, PKA)依存的リン酸化によって活性化され、カルシウム/リン脂質依存性蛋白質リン酸化酵素(protein kinase C, PKC)依存的リン酸化で阻害される。また、ホスホリパーゼC (PLC)の活性化により細胞膜のホスファチジルイノシトール-4,5-ビスリン酸 (phosphatidylinositol-4,5-bisphosphate, PI(4,5)P2)が枯渇するとGIRKチャンネルおよびKCNQチャンネルは阻害される[5][6]。TRPチャンネルの活性化もPLCの活性化により誘導される[9]。
受容体の局在と伝達様式
速いシナプス電位はシナプス前線維を一回刺激することで惹起できるが、遅いシナプス電位を惹起するためにはシナプス前線維を高頻度で連続刺激する必要があることが初期の研究から知られていた。このことから、遅いシナプス電位を惹起するためにはより多量の伝達物質の放出と伝達物質の細胞外蓄積が必要であることが示唆された。このため、速いシナプス電位を担う受容体はシナプス接合部に存在するのに対し、遅いシナプス電位を担う受容体はシナプス周辺やシナプス外に存在すると推定されていた[5][10]。実際、近年の免疫標識法による研究によって、代謝型受容体がシナプス外に多く存在することが示されている[11]。ただし、どの程度の割合で受容体がシナプス外に存在するかは、受容体の種類や細胞の種類によって様々であると考えられる。
受容体がシナプス外に多く局在している場合の伝達様式は、シナプス前膜とシナプス後膜の間において1対1で伝達が行われる「シナプス伝達(synaptic transmission)」の原則から外れ、むしろ複数のシナプス前終末から放出された伝達物質の総和をシナプス外において感受している様式(多数対1の関係)や、1つのシナプス前終末から放出された伝達物質が周辺の複数の細胞の受容体に作用する様式(1対多数の関係、spill-over)、もしくはこれらの組み合わせによる多数対多数の伝達様式になっていると考えられる。このような伝達様式は「シナプス伝達」と言うよりも、むしろ「総量的伝達(volume transmission)」[12]や「神経修飾(neuromodulation)」と呼ぶ方が適している。
生理的意義
一般的に遅いシナプス電位の振幅は小さく、興奮性伝達の場合においても、それ自体で閾値に達して活動電位の発火を引き起こすことは殆どない。むしろ、速いシナプス伝達による発火のしやすさを調節したり、自発発火(spontaneous firing)に影響を与えたりするなど、修飾的な役割が主であると考えられる。例えば、興奮性の遅いシナプス後電位は、数mVの脱分極をもたらすことで膜電位を閾値に近づけるため、そこに速いシナプス伝達等による脱分極が加わった場合には、比較的容易に閾値に達して活動電位を発火する。逆に、抑制性の遅いシナプス後電位が発生している最中は、その細胞は発火しにくい傾向になる。
また、遅いシナプス伝達は膜抵抗にも影響を与える。その意義を理解する為には、膜電位変化ΔVがΔV = R(膜抵抗)×I(膜電流)で決まることを思い出すと良い。例えば、カリウムチャンネルの閉口を伴う遅いシナプス後電位の場合は、膜抵抗(R)が増加する。その状態で、もし早い興奮性シナプス電流(I)が発生した場合には、シナプス電位はより振幅の大きな脱分極(ΔV)として生じる。このため、閾値への到達がより容易になり、活動電位が発生しやすくなる。
なお、代謝型受容体の活性化により引き起こされるのは膜電位の変化(遅いシナプス電位)だけではなく、これと平行して、細胞内貯蔵Ca2+の放出等の様々な細胞内シグナル伝達系が活性化されて、細胞内タンパク質のリン酸化や遺伝子発現が引き起こされ、膜電位変化の持続時間以上の長期的な影響を与え得ることに注意すべきである。また、カルシウム透過性のあるTRPチャンネルが開口すれば、直接的に細胞内カルシウム濃度の上昇を引き起こし、細胞内カルシウムシグナリングに影響をあたえることも重要である。
さらに、遅いシナプス後電位が生じる状況においては、周辺の細胞にも伝達物質が到達し、その影響が生じる可能性がある。これは、上述の「総量的伝達」や「神経修飾」と呼ぶべき状態に相当する。この場合、シナプス前終末においては、シナプス前抑制や促通が起こり、シナプス伝達物質の放出効率に変化を来すこともある。また、グリア細胞も影響を受けるなど、比較的広範囲の影響が生じ得ることに注意すべきである。
参考文献
- ↑ 1.0 1.1
Jan, Y.N., Jan, L.Y., & Kuffler, S.W. (1979).
A peptide as a possible transmitter in sympathetic ganglia of the frog. Proceedings of the National Academy of Sciences of the United States of America, 76(3), 1501-5. [PubMed:35789] [PMC] [WorldCat] [DOI] - ↑ 久場健司
興奮膜とシナプス生理学の黎明の頃―纐纈教三先生の研究史を辿りながら
日本生理学雑誌: 2007, 69(12): 362-377日本生理学雑誌 第69巻 12号 - ↑ Bertil Hille
G protein-coupled receptor
Scholarpedia: 2009, 4(12):8214 Scholarpedia - ↑
Chao, M.V. (2003).
Neurotrophins and their receptors: a convergence point for many signalling pathways. Nature reviews. Neuroscience, 4(4), 299-309. [PubMed:12671646] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Lüscher, C., & Slesinger, P.A. (2010).
Emerging roles for G protein-gated inwardly rectifying potassium (GIRK) channels in health and disease. Nature reviews. Neuroscience, 11(5), 301-15. [PubMed:20389305] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Brown, D.A., & Passmore, G.M. (2009).
Neural KCNQ (Kv7) channels. British journal of pharmacology, 156(8), 1185-95. [PubMed:19298256] [PMC] [WorldCat] [DOI] - ↑
Moran, M.M., Xu, H., & Clapham, D.E. (2004).
TRP ion channels in the nervous system. Current opinion in neurobiology, 14(3), 362-9. [PubMed:15194117] [WorldCat] [DOI] - ↑
Hartmann, J., Dragicevic, E., Adelsberger, H., Henning, H.A., Sumser, M., Abramowitz, J., ..., & Konnerth, A. (2008).
TRPC3 channels are required for synaptic transmission and motor coordination. Neuron, 59(3), 392-8. [PubMed:18701065] [PMC] [WorldCat] [DOI] - ↑
Putney, J.W. (2005).
Physiological mechanisms of TRPC activation. Pflugers Archiv : European journal of physiology, 451(1), 29-34. [PubMed:16133266] [WorldCat] [DOI] - ↑
Scanziani, M. (2000).
GABA spillover activates postsynaptic GABA(B) receptors to control rhythmic hippocampal activity. Neuron, 25(3), 673-81. [PubMed:10774734] [WorldCat] [DOI] - ↑
Kulik, A., Vida, I., Luján, R., Haas, C.A., López-Bendito, G., Shigemoto, R., & Frotscher, M. (2003).
Subcellular localization of metabotropic GABA(B) receptor subunits GABA(B1a/b) and GABA(B2) in the rat hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(35), 11026-35. [PubMed:14657159] [PMC] [WorldCat] - ↑
Agnati, L.F., Zoli, M., Strömberg, I., & Fuxe, K. (1995).
Intercellular communication in the brain: wiring versus volume transmission. Neuroscience, 69(3), 711-26. [PubMed:8596642] [WorldCat] [DOI]