シャルコー・マリー・トゥース病
橋口昭大、高嶋 博
鹿児島大学脳神経内科
DOI:10.14931/bsd.9595 原稿受付日:2020年11月16日 原稿完成日:2020年12月26日
担当編集委員:山中 宏二(名古屋大学 環境医学研究所 病態神経科学)
英:Charcot-Marie-Tooth disease 独:Morbus Charcot-Marie-Tooth 仏:maladie de Charcot-Marie-Tooth
同義語:遺伝性運動性感覚性ニューロパチー(hereditary motor and sensory neuropathy, HMSN)
英略号:CMT
シャルコー・マリー・トゥース病は遺伝性に運動と感覚の両方の末梢神経障害をきたす疾患の総称である。遺伝形式、臨床像、神経伝導検査により様々に分類される。近年の遺伝子解析技術の進歩に伴い遺伝子診断される症例が増えており、新規原因遺伝子の発見も続いている。同じ遺伝子変異であっても臨床像に違いがあるなど、臨床所見から原因遺伝子を特定することは非常に困難であることもわかってきた。そのため、確定診断をするためには遺伝子検査が欠かせなくなってきている。
シャルコー・マリー・トゥース病とは
1886年にフランス人神経学者であるJean-Martin CharcotとPierre Marieが 連名で ‘特に足の筋萎縮で始まり後に手にも筋萎縮がひろがる家族性の疾患’としてフランスの家系を報告し[1]、同年イギリス人神経学者のHoward Henry Toothも ‘Peroneal type(腓骨型)’の筋萎縮症としてイギリスの症例を報告した[2]。この3人が初めて報告したため、遺伝性末梢神経障害の総称としてシャルコー・マリー・トゥース病の名称が用いられるようになった。シャルコー・マリー・トゥース病の中には脱髄型、軸索型、中間型、常染色体顕性遺伝形式、常染色体潜性遺伝形式、X染色体遺伝形式など様々なタイプがある。
1989年Vanceらはシャルコー・マリー・トゥース病の中で最も多い常染色体顕性遺伝形式の脱髄型シャルコー・マリー・トゥース病(CMT1A)において原因遺伝子が17番染色体にあることを発見し[3]、1991年Lupskiらのグループ[4]とRaeymaekersらのグループ[5]がほぼ同時期にCMT1Aの原因が17番染色体のPMP22 (peripheral myelin protein 22) 遺伝子の重複であることを発見した。これによりシャルコー・マリー・トゥース病の遺伝子検査の歴史が始まり、PMP22重複の検査(Fluorescence in situ hybridization (FISH)法)は保険適応の外注委託検査として実施可能である。
診断
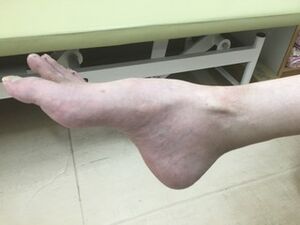
自験例
臨床所見
発症年齢は小児期(20歳未満)であることが多いが、成人以降に発症するシャルコー・マリー・トゥース病も決して少なくない。筋萎縮と筋力低下は下肢遠位筋に特に認められ、逆シャンペンボトル様筋萎縮や凹足/pes cavus(図1)、槌状趾がみられる。後に手内筋の萎縮、猿手、鷲手などもみられる様になる。感覚障害は、異常感覚と感覚鈍麻の両方がみられるが軽度の事が多い。
電気生理学的分類
正中神経運動神経伝導速度(正常 50 m/s 以上)が38 m/sより遅いものを「脱髄型」、38 m/sより速いものを「軸索型」、その前後のものを「中間型」と分類する。電気生理学的分類と遺伝形式、一部重症度により以下の様に診断分類される。
| 電気生理学的分類 | 遺伝形式 | 診断 | 備考 |
|---|---|---|---|
| 脱髄型 | 常染色体顕性 | CMT1 | |
| 常染色体潜性 | CMT4 | ||
| 軸索型 | 常染色体顕性、常染色体潜性 | CMT2 | 常染色体潜性のものはAR-CMT2と表現 |
| 脱髄型・軸索型 | 常染色体顕性、常染色体潜性 | DSS*/CMT3 | 乳幼児期発症の重症型 |
| 中間型 | 常染色体顕性 | CMT-DI | |
| 常染色体潜性 | CMT-RI | ||
| 脱髄型・中間型・軸索型 | X染色体 | CMTX | 電気生理学的に中間型のことが多い |
*DSS:デジェリン・ソッタス病(Dejerine-Sottas病)
診断基準
厚生労働省の指定難病判定にも用いられる「シャルコー・マリー・トゥース病の診療向上に関するエビデンスを構築する研究班」による診断基準[6]を下に示す。この診断基準は必ずしも家族歴がなくても孤発性の患者もシャルコー・マリー・トゥース病と診断することができる。シャルコー・マリー・トゥース病には感覚障害の非常に軽度のものやほとんど認めないものもあり、逆に感覚障害が顕著で運動障害が非常に軽度のものもある。
|
①以下の臨床症状(のうち2項目)を満たす。 ②神経伝導検査の異常(のうち2項目)を満たす。 ③シャルコー・マリー・トゥース病に特有の遺伝子異常(表3)がある。 |
診断のカテゴリー ①、②を満たすものをProbableとする。 Probableのうち③を満たすものをDefiniteとする。
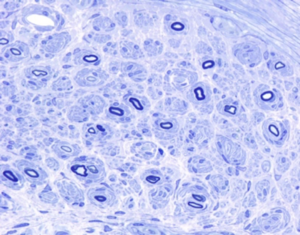
onion bulb formation

節性脱髄
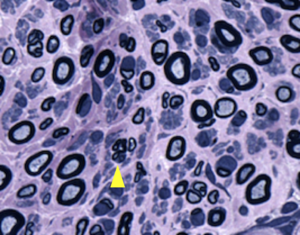
再生線維クラスター(矢頭)
病理所見
シャルコー・マリー・トゥース病の診断に病理所見は必須では無いが、病型を決める参考になる。脱髄型シャルコー・マリー・トゥース病では脱髄所見であるonion bulb formation(図2)や節性脱髄(図3)がみられる。軸索型CMTでは有髄線維の減少や神経線維再生にともなう再生線維クラスター(図4)がみられる。いずれの所見もシャルコー・マリー・トゥース病に特異的な所見では無く、一般的に脱髄型ニューロパチーや軸索変性にみられる所見である。
鑑別診断
鑑別が必要なものとして以下の疾患を挙げる。
病態生理
シャルコー・マリー・トゥース病の原因遺伝子は既に70以上発見されている。それらの遺伝子を病態別に分類すると以下の1-9.(表3)に分類できる。記述した遺伝子はほんの一部でありそれぞれの病態関連遺伝子が多数報告されている。
PMP22タンパク質は1. ミエリンコンポーネントの代表的なタンパク質であり、CMT1Bの原因遺伝子であるmyelin protein zero (MPZ)遺伝子、CMTX1の原因遺伝子であるgap junction protein beta 1 (GJB1)遺伝子などもこれに該当する遺伝子である。
2. ミエリン関連タンパク質転写因子、3. ミエリン関連タンパク質の輸送・代謝・処理、4. 細胞分化・維持に関連する遺伝子にはそれぞれearly growth response 2 (EGR2)遺伝子、SET binding factor 2 (SBF2)遺伝子、N-myc downstream regulated 1 (NDRG1)遺伝子などがこれに該当する。これらの遺伝子は主にミエリン形成に関連する遺伝子であるが、3. ミエリン関連タンパク質の輸送・代謝・処理関連遺伝子に該当するrab protein 7 (RAB7)遺伝子は小胞輸送と膜貫通の調節機構により細胞内物質輸送と関連し、軸索型シャルコー・マリー・トゥース病(CMT2B)の原因である。
5. ニューロフィラメント・タンパク質輸送関連遺伝子にはneurofilament, light polypeptide (NEFL)遺伝子などが該当し、NEFL遺伝子変異は脱髄型シャルコー・マリー・トゥース病(CMT1F)にも軸索型シャルコー・マリー・トゥース病(CMT2E)のどちらにもなりうる。
6. ミトコンドリア関連遺伝子で最も重要なものはmitofusin 2 (MFN2)遺伝子である。MFN2遺伝子変異は軸索型シャルコー・マリー・トゥース病(CMT2A2)の原因となり軸索型シャルコー・マリー・トゥース病のなかで最も多い[7]。
7. DNA修復・転写・核酸合成関連遺伝子に該当するphosphoribosyl pyrophosphate synthetase 1 (PRPS1)遺伝子はX染色体にありプリン・核酸代謝に関連し、CMTX5の原因遺伝子である。
8. イオンチャネル関連遺伝子には、transient receptor potential cation channel, subfamily V, member 4 (TRPV4)遺伝子が該当する。TRPV4はCa2+浸透圧性カチオンチャネルをコードしており、CMT2Cの原因遺伝子である。
9. アミノアシルtRNA合成酵素関連遺伝子はシャルコー・マリー・トゥース病の原因遺伝子として近年複数同定されている。特定のtRNAに、対応するアミノ酸を結合させるアミノアシル化と関連するためアミノ酸の数だけ存在する。GARS (glycyl-tRNA synthetase)を始め、AARS (alanyl-tRNA synthetase), YARS (tyrosyl-tRNA synthetase)などがシャルコー・マリー・トゥース病の原因遺伝子として既に同定されている。
| 遺伝子名 | CMT病型 | その他病型 |
|---|---|---|
| 1. ミエリンコンポーネント | ||
| GJB1 | CMTX1 | |
| MPZ | CMT1B, CMT2I, CMT2J, CMT-DID | |
| PMP22 | CMT1A, CMT1E, DSS | HNPP |
| PRX | CMT4F, DSS | |
| 2. ミエリン関連タンパク質転写因子 | ||
| EGR2 | CMT1D, DSS | |
| SOX10 | PCWH症候群 | |
| 3. ミエリン関連タンパク質の輸送・代謝・処理 | ||
| DNM2 | CMT2M, CMT-DIB | 中心核ミオパチー |
| FIG4 | CMT4J | ALS11 |
| GNB4 | CMT-DIF | |
| LITAF | CMT1C | |
| LRSAM1 | CMT2P | |
| MTMR2 | CMT4B1 | |
| RAB7 | CMT2B | |
| SBF2 | CMT4B2 | |
| SH3TC2 | CMT4C | |
| TRIM2 | CMT2R | |
| TFG | HMSN-P (Okinawa type) | |
| 4. 細胞分化・維持 | ||
| FGD4 | CMT4H | |
| MME | CMT2T | SCA43 |
| NDRG1 | CMT4D | |
| ARHGEF10 | demyelinating neuropathy | |
| DHH | GDMN | |
| 5. ニューロフィラメント・タンパク質輸送関連 | ||
| HSPB1 | CMT2F | dHMN2B |
| HSPB8 | CMT2L | dHMN2A |
| KIF1B | CMT2A1 | |
| NEFH | CMT2CC | |
| NEFL | CMT1F, CMT2E, CMT-DIG | |
| GAN | giant axonal neurotpahy 1 | |
| 6. ミトコンドリア関連 | ||
| COX6A1 | CMT-RID | |
| GDAP1 | CMT2K, CMT-RIA, CMT4A | |
| MFN2 | CMT2A2 | HMSN6A |
| PDK3 | CMTX6 | |
| COA7 | SCAN3 | |
| HK1 | HMSN-Russe | |
| 7. DNA修復・転写・核酸合成 | ||
| LMNA | CMT2B1 | EDMD2 |
| MORC2 | CMT2Z | |
| PRPS1 | CMTX5 | Arts症候群、家族性難聴 |
| APTX | AOA1 | |
| SETX | AOA2, ALS4 | |
| TDP1 | SCAN1 | |
| 8. イオンチャネル・トランスポーター | ||
| TRPV4 | CMT2C | dHMN8 |
| SLC12A6 | Andermann症候群 | |
| 9. アミノアシルtRNA合成酵素 | ||
| AARS | CMT2N | |
| GARS | CMT2D | dHMN5A, SMAJI |
| HARS | CMT2W | |
| KARS | CMT-RIB | |
| MARS | CMT2U | |
| YARS | CMT-DIC | |
遺伝子略称一覧:GJB1: gap junction protein beta 1; MPZ: myelin protein zero; PMP22: peripheral myelin protein 22; PRX: periaxin; DHH: desert hedgehog; EGR2: early growth response 2; SOX10: SRY-box transcription factor 10; DNM2: dynamin 2; FIG4: FIG4 phosphoinositide 5-phosphatase; GNB4: G protein subunit beta 4; LITAF: lipopolysaccharide-induced TNF-α factor; LRSAM1: leucine rich repeat and sterile alpha motif containing 1; MTMR2: myotubularin-related protein 2; RAB7: Ras-related GTPase 7; SBF2: SET-binding factor 2; SH3TC2: SH3 domain and tetratricopeptide repeats 2; TRIM2: tripartite motif containing 2; TFG: trafficking from ER to golgi regulator; FGD4: FYVE, RhoGEF and PH domain containing 4; MME: membrane metalloendopeptidase; NDRG1: N-myc downstream regulated 1; ARHGEF10: Rho guanine nucleotide exchange factor 10; HSPB1: heat shock protein 1; HSPB8: heat shock protein 8; KIF1B: kinesin family member 1B; NEFH: neurofilament heavy chain polypeptide; NEFL: neurofilament light chain polypeptide; GAN1: gigaxonin 1; COX6A1: cytochrome c oxidase subunit 6A1; GDAP1: ganglioside-induced differentiation-associated protein 1; MFN2: mitofusin 2; PDK3: pyruvate dehydrogenase kinase 3; COA7: cytochrome c oxidase assembly factor 7; HK1: hexokinase 1; LMNA: lamin A/C; MORC2: MORC family CW-type zinc finger 2; PRPS1: phosphoribosyl pyrophosphate synthetase 1; APTX: aprataxin; SETX: senataxin; TDP1: tyrosyl-DNA phosphodiesterase 1; TRPV4: transient receptor potential cation channel subfamily V member 4; SLC12A6: solute carrier family 12 member 6 (=KCC3: K-Cl cotransporter family 3); AARS: alanyl-tRNA synthetase 1; GARS: glycyl-tRNA synthetase; HARS: histidyl-tRNA synthetase 1; KARS: lysyl-ARS; MARS: methionyl-tRNA synthetase 1; YARS: tyrosyl-tRNA synthetase 1
病名略称一覧:HNPP: hereditary neuropathy, with liability to pressure palsies; PCWH: peripheral demyelinating neuropathy, central dysmyelination, Waardenburg syndrome, and Hirschsprung disease; ALS: amyotrophic lateral sclerosis; SCA: spinocerebellar ataxia; GDMN: 46,XY gonadal dysgenesis with minifascifular neuropathy; dHMN: distal hereditary motor neuropathy; SCAN: spinocerebellar ataxia, autosomal recessive, with axonal neuropathy; AOA: ataxia-oculomotor apraxia; EDMD: Emery-Dreifuss muscular dystrophy; SMAJI: spinal muscular atrophy, infantile, James type
治療
シャルコー・マリー・トゥース病の症状に効果が証明された治療薬はまだない。神経栄養因子やシャルコー・マリー・トゥース病原因遺伝子の解明に伴い遺伝子治療など新たな治療戦略が研究されているが、現状では実用的ではない。シャルコー・マリー・トゥース病の中で最も多いCMT1Aに関してはアスコルビン酸がPMP22の過剰な発現を抑制すると期待され、欧米で無作為化比較対照試験まで実施されたがアスコルビン酸の有用性は示されなかった[8]。他にも、ニューロトロフィン3、ニューレグリン、クルクミン、プロゲステロン刺激薬など治療効果の検討がされているが今だ有用性は認めていない。最近では、histone deacetylase (HDAC) 6阻害剤の触媒作用とユビキチンとの相互作用を通じての非触媒作用の両方がシャルコー・マリー・トゥース病を含む希少疾患に有用ではないかと期待され研究されている[9]。
疫学
過去の欧米の報告では有病率は2500人に1人とされてきた[10]が、本邦の最近の疫学では1万人に1人程度となっている[11]。脱髄型シャルコー・マリー・トゥース病の中ではPMP22遺伝子重複によるCMT1Aが脱髄型シャルコー・マリー・トゥース病の約70%[12]、シャルコー・マリー・トゥース病全体の約50%[13]と最多である。軸索型ではMFN2遺伝子変異によるCMT2A2が最も多く、CMTXではGJB1遺伝子変異によるCMTX1が最も多い[7]。
参考文献
- ↑ Charcot JM, Marie P. (1886)
On a particular form of muscular atrophy that is often familial, appearing in the feet and legs and later reaching the hands. Rev Med Interne. 6:97-138 - ↑ Tooth HH. (1886).
The peroneal type of progressive muscular atrophy. London: HK Lewis. 1886 - ↑
Vance, J.M., Nicholson, G.A., Yamaoka, L.H., Stajich, J., Stewart, C.S., Speer, M.C., ..., & Pericak-Vance, M.A. (1989).
Linkage of Charcot-Marie-Tooth neuropathy type 1a to chromosome 17. Experimental neurology, 104(2), 186-9. [PubMed:2707366] [WorldCat] [DOI] - ↑
Lupski, J.R., de Oca-Luna, R.M., Slaugenhaupt, S., Pentao, L., Guzzetta, V., Trask, B.J., ..., & Patel, P.I. (1991).
DNA duplication associated with Charcot-Marie-Tooth disease type 1A. Cell, 66(2), 219-32. [PubMed:1677316] [WorldCat] [DOI] - ↑
Raeymaekers, P., Timmerman, V., Nelis, E., De Jonghe, P., Hoogendijk, J.E., Baas, F., ..., & Bolhuis, P.A. (1991).
Duplication in chromosome 17p11.2 in Charcot-Marie-Tooth neuropathy type 1a (CMT 1a). The HMSN Collaborative Research Group. Neuromuscular disorders : NMD, 1(2), 93-7. [PubMed:1822787] [WorldCat] [DOI] - ↑ シャルコー・マリー・トゥース病診療マニュアル編集委員会編 (2015).
シャルコー・マリー・トゥース病診療マニュアル. 2版. 京都:金芳堂 p.127 - ↑ 7.0 7.1
Yoshimura, A., Yuan, J.H., Hashiguchi, A., Ando, M., Higuchi, Y., Nakamura, T., ..., & Takashima, H. (2019).
Genetic profile and onset features of 1005 patients with Charcot-Marie-Tooth disease in Japan. Journal of neurology, neurosurgery, and psychiatry, 90(2), 195-202. [PubMed:30257968] [PMC] [WorldCat] [DOI] - ↑
Lewis, R.A., McDermott, M.P., Herrmann, D.N., Hoke, A., Clawson, L.L., Siskind, C., ..., & Muscle Study Group (2013).
High-dosage ascorbic acid treatment in Charcot-Marie-Tooth disease type 1A: results of a randomized, double-masked, controlled trial. JAMA neurology, 70(8), 981-7. [PubMed:23797954] [PMC] [WorldCat] [DOI] - ↑
Brindisi, M., Saraswati, A.P., Brogi, S., Gemma, S., Butini, S., & Campiani, G. (2020).
Old but Gold: Tracking the New Guise of Histone Deacetylase 6 (HDAC6) Enzyme as a Biomarker and Therapeutic Target in Rare Diseases. Journal of medicinal chemistry, 63(1), 23-39. [PubMed:31415174] [WorldCat] [DOI] - ↑
Skre, H. (1974).
Genetic and clinical aspects of Charcot-Marie-Tooth's disease. Clinical genetics, 6(2), 98-118. [PubMed:4430158] [WorldCat] [DOI] - ↑
Kurihara, S., Adachi, Y., Wada, K., Awaki, E., Harada, H., & Nakashima, K. (2002).
An epidemiological genetic study of Charcot-Marie-Tooth disease in Western Japan. Neuroepidemiology, 21(5), 246-50. [PubMed:12207153] [WorldCat] [DOI] - ↑
Boerkoel, C.F., Takashima, H., Garcia, C.A., Olney, R.K., Johnson, J., Berry, K., ..., & Lupski, J.R. (2002).
Charcot-Marie-Tooth disease and related neuropathies: mutation distribution and genotype-phenotype correlation. Annals of neurology, 51(2), 190-201. [PubMed:11835375] [WorldCat] [DOI] - ↑
Szigeti, K., Nelis, E., & Lupski, J.R. (2006).
Molecular diagnostics of Charcot-Marie-Tooth disease and related peripheral neuropathies. Neuromolecular medicine, 8(1-2), 243-54. [PubMed:16775379] [WorldCat] [DOI]