陽電子断層撮像法
水間 広、尾上 浩隆
国立研究開発法人理化学研究所 ライフサイエンス技術基盤研究センター
DOI:10.14931/bsd.6818 原稿受付日:2016年2月1日 原稿完成日:2016年2月5日
担当編集委員:田中 啓治(国立研究開発法人理化学研究所 脳科学総合研究センター)
英: positron emission tomography 独: Positronen-Emissions-Tomographie 仏: tomoscintigraphie par émission de positons
英略語:PET
陽電子断層撮像法は、プラスの電荷を持つ陽電子を放出する核種により標識された化合物(PETプローブ)を用い、体内における分子の動態を通して生理的機能や病態に関連した空間的および時間的な変化をin vivoかつ本来の機能を保ったままの状態で非侵襲的に明らかにするイメージング法である。臨床ではガン細胞の中には正常細胞よりも多く糖を取込む性質を持つことからガンの診断に広く利用されており、他に局所脳血流(regional cerebral blood flow, rCBF)や局所糖代謝率(regional cerebral metabolic rate of glucose, rCMRglc)を測定することによって脳機能検査にも応用されている。また、神経伝達物質の受容体や合成酵素など、分子の機能に基づいた脳の神経化学的な側面を定量的かつ高感度に評価することに長けたイメージング法でもあり、近年では、アミロイドβタンパク質やタウタンパク質を特異的に認識するPETプローブの開発も盛んに行われており、アルツハイマー病の早期診断や治療薬の開発にも利用されている。
計測原理と装置
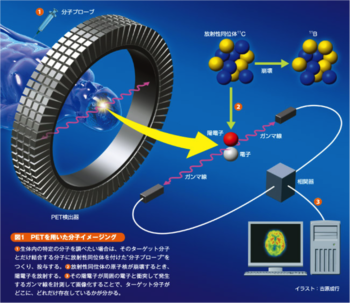
1. 生体内の特定の分子を調べたい場合は、そのターゲット分子とだけ結合する分子に放射性同位体を付けた「分子プローブ」を作り、投与する。
2. 放射性同位体の原子核が崩壊する時、陽電子を放射する。
3. その陽電子が周囲の電子と衝突して発生するγ線を計測して画像化することで、ターゲット分子がどこに、どれだけ存在しているかが分かる。
陽電子断層撮像法では、多く存在する放射性核種の中でもβ+壊変により陽電子(電子の反粒子、プラスに荷電)を放出する核種(陽電子放出核種)を用いる。一般的に使用される陽電子放出核種は、11C、13N、15Oおよび18Fなどで、生体を構成する元素が多いことから分子の化学的性質を変えることなく標識することが特長である。
それぞれ物理学的半減期は11C(20分)、13N(10分)、15O(2分)、18F(110分)と、3H(12.3年)や14C(5730年)に比べ非常に短く生体への長期間被曝を避けることができる。
これら短寿命の陽電子放出核種は、加速器のサイクロトロンでターゲットとなる原子核にプロトンなどの荷電粒子を入射することで生成される。
生体イメージングでは、陽電子放出核種で標識された化合物を投与(主に溶液は静脈内、ガスは吸引)し、生体内でβ+壊変して放出された陽電子と自由電子の衝突によって対消滅した際に一対の511keVの消滅γ線(annihilation γray)を生じる。この消滅γ線はリング状に配置されたシンチレータと光電子増倍管(PMT, photomultiplier) を組み込んだγ線検出器に入射し、同時計数検出器により検出された場合のみに検出器間の直線上でのイベントとして記録され、累積した空間情報から定量的な断層画像として再構成される(図1)。
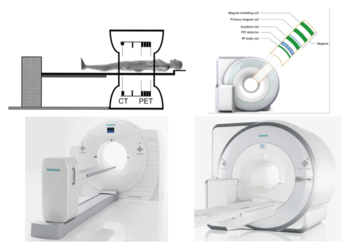
放射性トレーサーを用いることで生体における分子発現や機能を観察することができるが、CTやMRI装置のような体の構造や組織の形態などの解剖学的な情報を得ることはできない。現在では、両者を補完するために、陽電子断層撮像法とCTを一体化した装置、PET/CT(図2左)が主流であり、さらに最近では、MRIの中に陽電子断層撮像法を組み込んだPET/MR(図2右)も開発されている。
それぞれのモダリティーの画像を重ね合わせた融合画像を作成することで、からだの正確な位置情報が得られるだけでなく、PET/MRでは、陽電子断層撮像法による局所糖代謝率と機能的MRIによるBOLD効果といった脳機能に関する二つの異なる情報を同時に収集することもできる[1]。
また、基礎研究用に様々な小動物用の陽電子断層撮像法が開発されている。マウスからサルなど様々な実験動物を用いた陽電子断層撮像法実験は、新規のPETプローブの開発や創薬研究に用いられていて、ファースト・イン・ヒューマン試験を実施するためのトランスレーショナルリサーチとしての役割を担う実験に利用されている。
脳機能計測
機能的MRI と同様に、陽電子断層撮像法でも、15Oでラベルされた水(H215O)を用いて脳賦活試験を行うことができる。これは神経活動の増加によって引き起こされた局所脳血流の増大を計測することで間接的に皮質下の神経活動を測定する。H215Oを用いた局所血流の測定には約1分程度の時間を要し、神経活動の測定法としては、時間分解能は低いが、数種類のタスクを各々数回程度陽電子断層撮像法スキャンし、個別に賦活部位を同定することも可能である。脳賦活試験は、現在では、より高い時間分解能と空間分解能を持つ機能的MRIが主流であるが、ペースメーカーを持つ患者等、磁性体の問題などがある場合に用いられる。
グルコースの類縁体である2-デオキシグルコース(2DG)を18Fで標識したフルオロデオキシグルコース(18F-FDG)を用いることにより、脳の局所糖代謝率(rCMRglc)を測定することができる。18Fの物理的半減期が110分で、18F-FDGを用いたグルコース代謝の測定には最低でも60分程度の時間が必要であることから、この方法でも、神経活動の早い変化を捉えることはできないが、脳におけるグルコース代謝率の変化はシナプス活動を強く反映していることから[2]、神経細胞よりもむしろシナプスの機能に障害が起こるアルツハイマー病などの神経変性疾患等の患者の脳機能検査に用いられている。ただし、定量的なグルコース利用能(CGU)を算出するためには、動脈血中における18F-FDGの動態情報が必要であり、撮像と同時並行して連続的な動脈血採血を行う必要がある。動脈血採血の負担は大きいことから、近年、これを回避するために特殊な小型のγ線検出器を用いて頸動脈などから情報得る方法も試みられている。
近年、小動物用を用いるための様々な陽電子断層撮像法装置が開発されており[3]、ヒト同様に、動物の脳に機能についても陽電子断層撮像法を用いた研究が様々なされている。動物の場合、頭部を不動化するために麻酔を施さなければならないが、麻酔下では脳活動は抑制され生理的な脳機能を測定することができないことや、使用する麻酔薬の種類によってPETプローブの動態が変わってしまうなどの問題が報告されている[4] [5]。このため動頭蓋骨に装着した特殊な器具で頭部を固定することにより無麻酔下での測定する方法が様々な動物で報告されている[4] [6] [7]。
様々なPETプローブとその応用
様々な標的分子を特異的に認識するためには生体内物質の他に、標的分子に親和性、選択性の高い薬剤やペプチド、抗体などの高分子化合物などに陽電子放出核種を標識し、標的分子の体内分布や機能変化を定量的に測定することができる(表)。例えば、パーキンソン病では、中脳の黒質ドーパミン細胞の変性、脱落により、投射先である線条体などで神経伝達物質であるドーパミン産生が減少し運動障害が徐々に進行するが、陽電子断層撮像法では、線条体における前シナプスに存在するドーパミントランスポーターやドーパミン合成酵素を、11C-2-carbomethoxy-3-(4-fluorophenyl)tropane(11C-CFT)や18F-fluoro-l-dopa(18F-DOPA)といったそれぞれに特異的なPETプローブを用いて、ドーパミン神経の変性を特異的かつ定量的に描出することが可能である。
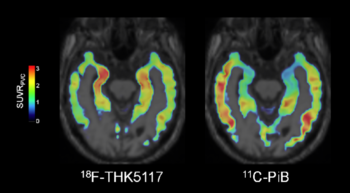
また、アルツハイマー病の患者の脳では、病態の進行に伴う神経変性や脳機能の低下を18F-FDGを使って捉えることができるが、発症原因の一つ考えられているβアミロイドタンパク質やタウタンパク質を特異的に認識するPETプローブ(例えば、11C-PiBや18F-THK5117)を用いて[9] [10]、それぞれのタンパク質の脳における蓄積を測定することも可能である(図3)。これらのPETプローブによるイメージングは、アルツハイマー病の早期診断だけでなく薬の開発にも応用されている。
参考文献
- ↑
Wehrl, H.F., Wiehr, S., Divine, M.R., Gatidis, S., Gullberg, G.T., Maier, F.C., ..., & Pichler, B.J. (2014).
Preclinical and Translational PET/MR Imaging. Journal of nuclear medicine : official publication, Society of Nuclear Medicine, 55(Supplement 2), 11S-18S. [PubMed:24833493] [WorldCat] [DOI] - ↑
Magistretti, P.J., & Pellerin, L. (1996).
Cellular bases of brain energy metabolism and their relevance to functional brain imaging: evidence for a prominent role of astrocytes. Cerebral cortex (New York, N.Y. : 1991), 6(1), 50-61. [PubMed:8670638] [WorldCat] [DOI] - ↑ 浜松医科大学 光尖端医学教育研究センター
- ↑ 4.0 4.1
Onoe, H., Inoue, O., Suzuki, K., Tsukada, H., Itoh, T., Mataga, N., & Watanabe, Y. (1994).
Ketamine increases the striatal N-[11C]methylspiperone binding in vivo: positron emission tomography study using conscious rhesus monkey. Brain research, 663(2), 191-8. [PubMed:7874501] [WorldCat] [DOI] - ↑
Kobayashi, K., Inoue, O., Watanabe, Y., Onoe, H., & Långström, B. (1995).
Difference in response of D2 receptor binding between 11C-N-methylspiperone and 11C-raclopride against anesthetics in rhesus monkey brain. Journal of neural transmission. General section, 100(2), 147-51. [PubMed:8962684] - ↑
Mizuma, H., Shukuri, M., Hayashi, T., Watanabe, Y., & Onoe, H. (2010).
Establishment of in vivo brain imaging method in conscious mice. Journal of nuclear medicine : official publication, Society of Nuclear Medicine, 51(7), 1068-75. [PubMed:20554730] [WorldCat] [DOI] - ↑
Yokoyama, C., Yamanaka, H., Onoe, K., Kawasaki, A., Nagata, H., Shirakami, K., ..., & Onoe, H. (2010).
Mapping of serotonin transporters by positron emission tomography with [11C]DASB in conscious common marmosets: comparison with rhesus monkeys. Synapse (New York, N.Y.), 64(8), 594-601. [PubMed:20340166] [WorldCat] [DOI] - ↑ 東北大学加齢医学研究所
- ↑
Klunk, W.E., Engler, H., Nordberg, A., Wang, Y., Blomqvist, G., Holt, D.P., ..., & Långström, B. (2004).
Imaging brain amyloid in Alzheimer's disease with Pittsburgh Compound-B. Annals of neurology, 55(3), 306-19. [PubMed:14991808] [WorldCat] [DOI] - ↑
Harada, R., Okamura, N., Furumoto, S., Furukawa, K., Ishiki, A., Tomita, N., ..., & Kudo, Y. (2015).
[(18)F]THK-5117 PET for assessing neurofibrillary pathology in Alzheimer's disease. European journal of nuclear medicine and molecular imaging, 42(7), 1052-61. [PubMed:25792456] [WorldCat] [DOI]