「熱ショックタンパク質」の版間の差分
細編集の要約なし |
Hiroshiishii (トーク | 投稿記録) 細編集の要約なし |
||
| (4人の利用者による、間の70版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Heat shock protein [[Image:PDB 3hsc EBI.jpg|thumb|right|500px|Hsp70の分子構造と基質結合<span class=]]<pubmed>21403864</pubmed>" class="fck_mw_frame fck_mw_right" /> | |||
<span lang="EN-US">[[wikipedia:ja:熱ショックタンパク質|熱ショックタンパク質]](</span><span lang="EN-US">Heat</span><span lang="EN-US"> Shock Protein</span><span lang="EN-US">; </span><span lang="EN-US">HSP)</span><span lang="EN-US">とは[[wikipedia:ja:細胞|細胞]]が[[wikipedia:ja:ヒート|熱]]、[[wikipedia:ja:化学物質|化学物質]]、[[wikipedia:ja:虚血|虚血]]などのストレスにさらされた際に発現が上昇して細胞を保護する[[wikipedia:ja:タンパク質|タンパク質]]の一群である。分子[[wikipedia:ja:シャペロン|シャペロン]]として機能し、ストレスタンパク質</span><span lang="EN-US">(</span><span lang="EN-US">Stress Protein</span><span lang="EN-US">)</span><span lang="EN-US">とも呼ばれる<ref><pubmed> 4219221 </pubmed></ref></span><span lang="EN-US">。</span><span lang="EN-US">[[wikipedia:ja:熱ショックタンパク質|HSP]]</span><span lang="EN-US">はその分子量により</span><span lang="EN-US">[[wikipedia:en:HSP60|Hsp60]]</span><span lang="EN-US">、[[wikipedia:en:Hsp70|Hsp70]]</span><span lang="EN-US">、[[wikipedia:en:Hsp90|Hsp90]]</span><span lang="EN-US">などと個別に命名されている。</span><span lang="EN-US"> [[wikipedia:ja:熱ショックタンパク質|HSP]]</span><span lang="EN-US">は[[wikipedia:ja:真性細菌|細菌]]から[[wikipedia:ja:ヒト|ヒト]]まで広く似た機能を持つことが知られており、その[[wikipedia:ja:一次構造|アミノ酸配列]]は生物の進化の過程においてよく保存されている。</span> <br> <span lang="EN-US"> </span><span lang="EN-US">[[wikipedia:ja:ヒートショックタンパク質|HSP]]</span><span lang="EN-US">は合成された[[wikipedia:ja:タンパク質|タンパク質]]に結合することにより[[wikipedia:ja:タンパク質|タンパク質]]の[[wikipedia:ja:フォールディング|フォールディング]](折り畳み)を制御する分子[[wikipedia:ja:シャペロン|シャペロン]]としての機能を持ち、また分子[[wikipedia:ja:シャペロン|シャペロン]]の多くは</span><span lang="EN-US">[[wikipedia:ja:熱ショックタンパク質|HSP]]</span><span lang="EN-US">である。高温条件化において変性した[[wikipedia:ja:タンパク質|タンパク質]]、あるいは新生タンパク質の</span><span lang="EN-US">う</span><span lang="EN-US">ち[[wikipedia:ja:フォールディング|フォールディング]]の段階に問題があり、機能できないものなどには</span><span lang="EN-US">[[wikipedia:ja:熱ショックタンパク質|HSP]]</span><span lang="EN-US">が結合してその処理を行</span><span lang="EN-US">う</span><span lang="EN-US">ことが知られている。</span><span lang="EN-US">[[wikipedia:ja:ヒートショックタンパク質|HSP]]</span><span lang="EN-US">はこのよ</span><span lang="EN-US">う</span><span lang="EN-US">な高次構造の破壊された[[wikipedia:ja:タンパク質|タンパク質]]の修復およびタンパク質[[wikipedia:ja:変性|変性]]の抑制機能を有し、修復が不可能であると判断されたタンパク質はユビキチン化を受け、[[wikipedia:ja:プロテアソーム|プロテアソーム]]と呼ばれる[[wikipedia:ja:酵素|酵素]]複合体へ運搬されて分解される。この[[wikipedia:ja:フォールディング|フォールディング]]の段階に異常があり、不良品タンパク質が細胞内に蓄積するとフォールディング病と呼ばれる疾患に陥る。神経変性疾患である筋萎縮性側索硬化症(Amyotrophic | |||
lateral sclerosis; ALS)、アルツハイマー病(Altzheimer’s disease; AD)やパーキンソン病(Parkinson’s disease; PD)もまた[[wikipedia:ja:フォールディング|フォールディング]]の異常に基づくフォールディング病と考えられている<ref><pubmed> 15516999 </pubmed></ref>。</span> | |||
== <span>[[wikipedia:en:Hsp70|Hsp70]]による脳虚血保護作用 </span> == | |||
= | <span lang="EN-US"> 脳虚血の動物モデルや培養組織において、[[wikipedia:en:Hsp70|Hsp70]]を過剰発現させると虚血による損傷が軽減され、神経とグリア細胞に保護作用を示す。これらの作用は[[wikipedia:en:Hsp70|Hsp70]]の[[wikipedia:ja:C末端|カルボキシ末端]]を介すると考えられている<ref><pubmed> 16292251 </pubmed></ref></span><span lang="EN-US">。</span> | ||
<span lang="EN-US"> </span> | |||
== | == <span>神経変性疾患モデルと[[wikipedia:en:Hsp70|Hsp70]] </span> == | ||
= | <span> 神経においてβアミロイドを過剰発現して<span lang="EN-US">ADを再構成した系で、[[wikipedia:en:Hsp70|Hsp70]]を強制発現するとβアミロイドを介する神経毒性が回避される<ref><pubmed> 14973234 </pubmed></ref>。</span></span><span lang="EN-US">またADマウスモデルにおいて[[wikipedia:en:Hsp70|Hsp70]]を過剰発現させると、Aβの発現およびAβの組織沈着そして神経とシナプスの脱落が軽減され認知機能の低下が抑制されると報告されている<ref><pubmed> 21471357 </pubmed></ref>。また</span><span>αシヌクレイン発現による''<span lang="EN-US">Drosophila</span>''(ショウジョウバエ)パーキンソン病モデルにおいて、ヒト<span lang="EN-US">[[wikipedia:en:Hsp70|Hsp70]]を発現させると、 αシヌクレインによる毒性から免れると報告されている<ref><pubmed> 11823645 </pubmed></ref>。 </span></span> | ||
| |||
== <span>[[wikipedia:en:Hsp90|Hsp90]]βと神経筋接合部 </span> == | |||
<span>アセチルコリン受容体は細胞内で<span lang="EN-US">Rapsynというタンパク質を介して[[wikipedia:en:Hsp90|Hsp90]]βと会合し、 神経筋接合部の発達と維持に関わっている<ref><pubmed> 18940591 </pubmed></ref></span></span><span lang="EN-US">。</span> | |||
| |||
== <span><span lang="EN-US">熱ショックタンパク質作動薬 </span></span> == | |||
== | <span lang="EN-US"> 熱ショックタンパク質の作動薬である[[wikipedia:en:Arimoclomol|Arimoclomol]]はマウスALSモデルにおいて[[wikipedia:en:Hsp70|Hsp70]]、[[wikipedia:en:Hsp90|Hsp90]]の発現を亢進し、病気の進行を抑えることが分かっている<ref><pubmed> 15034571 </pubmed></ref></span>。また培養運動神経に熱ショックやグルタミン酸を投与した場合に[[wikipedia:en:Hsp70|Hsp70]]の発現が阻害されるが、 [[wikipedia:en:Arimoclomol|Arimoclomol]]を加えるとこれが回避される。<span lang="EN-US">製薬会社の</span><span lang="EN-US">[[wikipedia:en:CytRx|CytRx]]は、[[wikipedia:en:Clinical trial|臨床試験]]第2相を施行している<ref name="urlPhase II/III Randomized, Placebo-Controlled Trial of Arimoclomol in SOD1 Positive Familial Amyotrophic Lateral Sclerosis - Full Text View - ClinicalTrials.gov">{{cite web |url=http://clinicaltrials.gov/ct2/show/NCT00706147 |title=Phase II/III Randomized, Placebo-Controlled Trial of Arimoclomol in SOD1 Positive Familial Amyotrophic Lateral Sclerosis - Full Text View - ClinicalTrials.gov |format= |work= |accessdate=2009-05-18}}</ref></span><span lang="EN-US">。</span> | ||
= | <span lang="EN-US"><span style="mso-spacerun: yes"> </span>ニシキギ科の植物から抽出した[[wikipedia:en:Quinone methide|quinine methide]] tritepeneであるCelastrolはPD、ALSそしてハンチントン病などの動物モデルにおいて、[[wikipedia:en:Hsp70|Hsp70]]を誘導し、保護的に働く<ref><pubmed> 16092942 </pubmed></ref></span>。 | ||
| |||
== | == <span>熱ショックによる前処理と神経保護作用 </span> == | ||
= | <span> あらかじめ熱ショックを組織に加えることにより、<span lang="EN-US">[[wikipedia:en:Hsp70|Hsp70]]、[[wikipedia:en:HSPA8|Hsc70]]、Hsp32や[[wikipedia:en:Hsp27|Hsp27]]が亢進し、神経保護作用を示すことが分かっている<ref><pubmed> 10341239 </pubmed></ref>。熱ストレスにより[[wikipedia:en:HSPA8|Hsc70]]が大脳皮質のシナプスに局在し、[[wikipedia:en:Chaperone DnaJ|Hsp40]]と会合し、変性タンパク質をリフォールディングする。また熱ストレスによりグリア細胞から[[wikipedia:en:Hsp70|Hsp70]]が産生され、細胞間を移動し、隣り合う神経細胞の突起に輸送されることが分かっている<ref><pubmed> 3947949 </pubmed></ref>。</span><span style="color:black">この生理反応を応用し、坐骨神経細胞の切断端に[[wikipedia:en:Hsp70|Hsp70]]/[[wikipedia:en:HSPA8|Hsc70]]を細胞外から添加すると神経細胞死が抑制されると報告されている<ref><pubmed> 9222601 </pubmed></ref>。</span></span> | ||
: | |||
| |||
=== | == <span lang="EN-US">[[wikipedia:en:HSPA8|Hsc70]]の発現と神経変性疾患 </span> == | ||
= | <span lang="EN-US"> [[wikipedia:en:HSPA8|Hsc70]]は神経組織において発現が高い。ALSの病変となる脊髄では比較的高いレベルの[[wikipedia:en:HSPA8|Hsc70]]が発現しているが、ADの病変となる海馬や内嗅皮質においては低レベルの発現が見られる。そしてPDの病変箇所である黒質においては中間の発現レベルであることが確認されており、丁度それぞれの疾患の発症頻度とよく逆相関しているため、[[wikipedia:en:HSPA8|Hsc70]]の神経変性疾患における神経保護作用が示唆されている<ref><pubmed> 17441507 </pubmed></ref>。</span> | ||
== | == <span>自己免疫疾患と[[wikipedia:en:Hsp70|Hsp70]] </span> == | ||
[[wikipedia:en:Hsp70|Hsp70]]は[[wikipedia:ja:抗原|抗原]]に結合して[[wikipedia:ja:主要組織適合遺伝子複合体|MHCI、MHCII]]依存経路どちらにおいても[[wikipedia:ja:抗原|抗原]]性を高めると報告されている[1]。また[[wikipedia:ja:多発性硬化症|多発性硬化症]](multiple sclerosis; MS)の動物モデルである実験的自己免疫性脳脊髄炎([[wikipedia:en:Experimental autoimmune encephalomyelitis|experimental autoimmune encephalomyelitis]] ; EAE)の誘導および進展に[[wikipedia:en:Hsp70|Hsp70]]が関わると報告されている[1]。実際にMS患者の脳脊髄液からはHsp70に対する自己抗体が、運動神経疾患の患者と比較して有意に多く観察されている。そしてMS検体において、自己抗原であるミエリン基質タンパク質([[wikipedia:en:myelin basic protein|myelin basic protein]]; MBP)や[[wikipedia:en: Myelin proteolipid protein|proteolipid protein]](PLP)と[[wikipedia:en:Hsp70|Hsp70]]との会合も観察されている。しかし一方で[[wikipedia:en:Hsp70|Hsp70]]が[[wikipedia:ja:ナチュラルキラー細胞|ナチュラルキラー細胞]]に働きかけて([[wikipedia:en:Experimental autoimmune encephalomyelitis|EAE]]の進展を抑制するとする報告もあるため、中枢神経系の自己免疫における病原と保護両者に関わる二面性が議論されている[1]。 | |||
: | |||
: | <br> <span lang="EN-US">== 参考文献<span style="mso-spacerun: yes"> </span>==</span> <br> <br> <references /> | ||
この用語にリダイレクトする同義語:ユビキチン、神経変性疾患、筋萎縮性側索硬化症、アルツハイマー病、パーキンソン病、(序説で)、グリア細胞(Hsp70による脳虚血保護作用の解説で)、アミロイド、シナプス、ショウジョウバエ(神経変性疾患モデルとHsp70の解説で)、神経筋接合部、アセチルコリン(Hsp90βと神経筋接合部の解説で)、グルタミン酸、ハンチントン病(熱ショックタンパク質作動薬の解説で)、大脳皮質(熱ショックによる前処理と神経保護作用の解説で)、海馬、黒質(Hsc70の発現と神経変性疾患の解説で)<br> | |||
この用語にリダイレクトする関連語:脳虚血(Hsp70による脳虚血保護作用の解説で)、シヌクレイン(神経変性疾患モデルとHsp70の解説で)、神経保護作用、坐骨神経、神経細胞死(熱ショックによる前処理と神経保護作用の解説で)、内嗅皮質(Hsc70の発現と神経変性疾患の解説で) | |||
執筆者:石井宏史、山下俊英 担当編集委員:柚崎通介 | |||
2012年1月25日 (水) 13:33時点における版
英語名:Heat shock protein
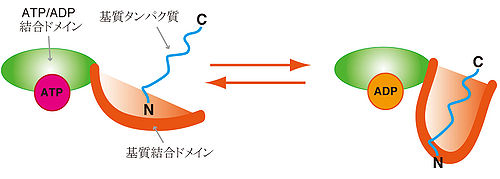
<pubmed>21403864</pubmed>" class="fck_mw_frame fck_mw_right" />
熱ショックタンパク質(Heat Shock Protein; HSP)とは細胞が熱、化学物質、虚血などのストレスにさらされた際に発現が上昇して細胞を保護するタンパク質の一群である。分子シャペロンとして機能し、ストレスタンパク質(Stress Protein)とも呼ばれる[1]。HSPはその分子量によりHsp60、Hsp70、Hsp90などと個別に命名されている。 HSPは細菌からヒトまで広く似た機能を持つことが知られており、そのアミノ酸配列は生物の進化の過程においてよく保存されている。
HSPは合成されたタンパク質に結合することによりタンパク質のフォールディング(折り畳み)を制御する分子シャペロンとしての機能を持ち、また分子シャペロンの多くはHSPである。高温条件化において変性したタンパク質、あるいは新生タンパク質のうちフォールディングの段階に問題があり、機能できないものなどにはHSPが結合してその処理を行うことが知られている。HSPはこのような高次構造の破壊されたタンパク質の修復およびタンパク質変性の抑制機能を有し、修復が不可能であると判断されたタンパク質はユビキチン化を受け、プロテアソームと呼ばれる酵素複合体へ運搬されて分解される。このフォールディングの段階に異常があり、不良品タンパク質が細胞内に蓄積するとフォールディング病と呼ばれる疾患に陥る。神経変性疾患である筋萎縮性側索硬化症(Amyotrophic
lateral sclerosis; ALS)、アルツハイマー病(Altzheimer’s disease; AD)やパーキンソン病(Parkinson’s disease; PD)もまたフォールディングの異常に基づくフォールディング病と考えられている[2]。
Hsp70による脳虚血保護作用
脳虚血の動物モデルや培養組織において、Hsp70を過剰発現させると虚血による損傷が軽減され、神経とグリア細胞に保護作用を示す。これらの作用はHsp70のカルボキシ末端を介すると考えられている[3]。
神経変性疾患モデルとHsp70
神経においてβアミロイドを過剰発現してADを再構成した系で、Hsp70を強制発現するとβアミロイドを介する神経毒性が回避される[4]。またADマウスモデルにおいてHsp70を過剰発現させると、Aβの発現およびAβの組織沈着そして神経とシナプスの脱落が軽減され認知機能の低下が抑制されると報告されている[5]。またαシヌクレイン発現によるDrosophila(ショウジョウバエ)パーキンソン病モデルにおいて、ヒトHsp70を発現させると、 αシヌクレインによる毒性から免れると報告されている[6]。
Hsp90βと神経筋接合部
アセチルコリン受容体は細胞内でRapsynというタンパク質を介してHsp90βと会合し、 神経筋接合部の発達と維持に関わっている[7]。
熱ショックタンパク質作動薬
熱ショックタンパク質の作動薬であるArimoclomolはマウスALSモデルにおいてHsp70、Hsp90の発現を亢進し、病気の進行を抑えることが分かっている[8]。また培養運動神経に熱ショックやグルタミン酸を投与した場合にHsp70の発現が阻害されるが、 Arimoclomolを加えるとこれが回避される。製薬会社のCytRxは、臨床試験第2相を施行している[9]。
ニシキギ科の植物から抽出したquinine methide tritepeneであるCelastrolはPD、ALSそしてハンチントン病などの動物モデルにおいて、Hsp70を誘導し、保護的に働く[10]。
熱ショックによる前処理と神経保護作用
あらかじめ熱ショックを組織に加えることにより、Hsp70、Hsc70、Hsp32やHsp27が亢進し、神経保護作用を示すことが分かっている[11]。熱ストレスによりHsc70が大脳皮質のシナプスに局在し、Hsp40と会合し、変性タンパク質をリフォールディングする。また熱ストレスによりグリア細胞からHsp70が産生され、細胞間を移動し、隣り合う神経細胞の突起に輸送されることが分かっている[12]。この生理反応を応用し、坐骨神経細胞の切断端にHsp70/Hsc70を細胞外から添加すると神経細胞死が抑制されると報告されている[13]。
Hsc70の発現と神経変性疾患
Hsc70は神経組織において発現が高い。ALSの病変となる脊髄では比較的高いレベルのHsc70が発現しているが、ADの病変となる海馬や内嗅皮質においては低レベルの発現が見られる。そしてPDの病変箇所である黒質においては中間の発現レベルであることが確認されており、丁度それぞれの疾患の発症頻度とよく逆相関しているため、Hsc70の神経変性疾患における神経保護作用が示唆されている[14]。
自己免疫疾患とHsp70
Hsp70は抗原に結合してMHCI、MHCII依存経路どちらにおいても抗原性を高めると報告されている[1]。また多発性硬化症(multiple sclerosis; MS)の動物モデルである実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis ; EAE)の誘導および進展にHsp70が関わると報告されている[1]。実際にMS患者の脳脊髄液からはHsp70に対する自己抗体が、運動神経疾患の患者と比較して有意に多く観察されている。そしてMS検体において、自己抗原であるミエリン基質タンパク質(myelin basic protein; MBP)やproteolipid protein(PLP)とHsp70との会合も観察されている。しかし一方でHsp70がナチュラルキラー細胞に働きかけて(EAEの進展を抑制するとする報告もあるため、中枢神経系の自己免疫における病原と保護両者に関わる二面性が議論されている[1]。
== 参考文献 ==
- ↑
Tissières, A., Mitchell, H.K., & Tracy, U.M. (1974).
Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs. Journal of molecular biology, 84(3), 389-98. [PubMed:4219221] [WorldCat] [DOI] - ↑
Selkoe, D.J. (2004).
Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature cell biology, 6(11), 1054-61. [PubMed:15516999] [WorldCat] [DOI] - ↑
Sun, Y., Ouyang, Y.B., Xu, L., Chow, A.M., Anderson, R., Hecker, J.G., & Giffard, R.G. (2006).
The carboxyl-terminal domain of inducible Hsp70 protects from ischemic injury in vivo and in vitro. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 26(7), 937-50. [PubMed:16292251] [WorldCat] [DOI] - ↑
Magrané, J., Smith, R.C., Walsh, K., & Querfurth, H.W. (2004).
Heat shock protein 70 participates in the neuroprotective response to intracellularly expressed beta-amyloid in neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(7), 1700-6. [PubMed:14973234] [PMC] [WorldCat] [DOI] - ↑
Hoshino, T., Murao, N., Namba, T., Takehara, M., Adachi, H., Katsuno, M., ..., & Mizushima, T. (2011).
Suppression of Alzheimer's disease-related phenotypes by expression of heat shock protein 70 in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(14), 5225-34. [PubMed:21471357] [PMC] [WorldCat] [DOI] - ↑
Auluck, P.K., Chan, H.Y., Trojanowski, J.Q., Lee, V.M., & Bonini, N.M. (2002).
Chaperone suppression of alpha-synuclein toxicity in a Drosophila model for Parkinson's disease. Science (New York, N.Y.), 295(5556), 865-8. [PubMed:11823645] [WorldCat] [DOI] - ↑
Luo, S., Zhang, B., Dong, X.P., Tao, Y., Ting, A., Zhou, Z., ..., & Mei, L. (2008).
HSP90 beta regulates rapsyn turnover and subsequent AChR cluster formation and maintenance. Neuron, 60(1), 97-110. [PubMed:18940591] [PMC] [WorldCat] [DOI] - ↑
Kieran, D., Kalmar, B., Dick, J.R., Riddoch-Contreras, J., Burnstock, G., & Greensmith, L. (2004).
Treatment with arimoclomol, a coinducer of heat shock proteins, delays disease progression in ALS mice. Nature medicine, 10(4), 402-5. [PubMed:15034571] [WorldCat] [DOI] - ↑ "Phase II/III Randomized, Placebo-Controlled Trial of Arimoclomol in SOD1 Positive Familial Amyotrophic Lateral Sclerosis - Full Text View - ClinicalTrials.gov". Retrieved 2009-05-18.
- ↑
Cleren, C., Calingasan, N.Y., Chen, J., & Beal, M.F. (2005).
Celastrol protects against MPTP- and 3-nitropropionic acid-induced neurotoxicity. Journal of neurochemistry, 94(4), 995-1004. [PubMed:16092942] [WorldCat] [DOI] - ↑
Karunanithi, S., Barclay, J.W., Robertson, R.M., Brown, I.R., & Atwood, H.L. (1999).
Neuroprotection at Drosophila synapses conferred by prior heat shock. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(11), 4360-9. [PubMed:10341239] [PMC] [WorldCat] - ↑
Tytell, M., Greenberg, S.G., & Lasek, R.J. (1986).
Heat shock-like protein is transferred from glia to axon. Brain research, 363(1), 161-4. [PubMed:3947949] [WorldCat] [DOI] - ↑
Houenou, L.J., Li, L., Lei, M., Kent, C.R., & Tytell, M. (1996).
Exogenous heat shock cognate protein Hsc 70 prevents axotomy-induced death of spinal sensory neurons. Cell stress & chaperones, 1(3), 161-6. [PubMed:9222601] [PMC] [WorldCat] [DOI] - ↑
Chen, S., & Brown, I.R. (2007).
Neuronal expression of constitutive heat shock proteins: implications for neurodegenerative diseases. Cell stress & chaperones, 12(1), 51-8. [PubMed:17441507] [PMC] [WorldCat] [DOI]
この用語にリダイレクトする同義語:ユビキチン、神経変性疾患、筋萎縮性側索硬化症、アルツハイマー病、パーキンソン病、(序説で)、グリア細胞(Hsp70による脳虚血保護作用の解説で)、アミロイド、シナプス、ショウジョウバエ(神経変性疾患モデルとHsp70の解説で)、神経筋接合部、アセチルコリン(Hsp90βと神経筋接合部の解説で)、グルタミン酸、ハンチントン病(熱ショックタンパク質作動薬の解説で)、大脳皮質(熱ショックによる前処理と神経保護作用の解説で)、海馬、黒質(Hsc70の発現と神経変性疾患の解説で)
この用語にリダイレクトする関連語:脳虚血(Hsp70による脳虚血保護作用の解説で)、シヌクレイン(神経変性疾患モデルとHsp70の解説で)、神経保護作用、坐骨神経、神経細胞死(熱ショックによる前処理と神経保護作用の解説で)、内嗅皮質(Hsc70の発現と神経変性疾患の解説で)
執筆者:石井宏史、山下俊英 担当編集委員:柚崎通介