「Nogo」の版間の差分
細編集の要約なし |
Masashifujitani (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の96版が非表示) | |||
| 1行目: | 1行目: | ||
(読み方)ノゴ (英)Nogo 同じ | |||
= 概要 = | |||
Nogoは[http://www.google.co.jp/url?sa=t&rct=j&q=%E8%84%8A%E6%A4%8E%E5%8B%95%E7%89%A9&source=web&cd=1&ved=0CEEQFjAA&url=http%3A%2F%2Fja.wikipedia.org%2Fwiki%2F%25E8%2584%258A%25E6%25A4%258E%25E5%258B%2595%25E7%2589%25A9&ei=FQQpT6r-IYqKiALQs6mnCg&usg=AFQjCNEMyPXU2vKjYUi-j9mp-vbwpyQsDQ&sig2=xrvLW8tBJAIDL6XyHQnVLQ&cad=rja 脊椎動物]の[http://www.google.co.jp/url?sa=t&rct=j&q=%E4%B8%AD%E6%9E%A2%E7%A5%9E%E7%B5%8C&source=web&cd=1&ved=0CEMQFjAA&url=http%3A%2F%2Fja.wikipedia.org%2Fwiki%2F%25E4%25B8%25AD%25E6%259E%25A2%25E7%25A5%259E%25E7%25B5%258C%25E7%25B3%25BB&ei=KQQpT6jIOsKciAK_zKjFCg&usg=AFQjCNEucNIrcGtiIzEsSSwgWXtf2ZuPRQ&sig2=ofAyMolJHTpXkaybncm6Gw&cad=rja 中枢神経]の[http://kotobank.jp/word/%E8%BB%B8%E7%B4%A2 軸索]伸長の阻害効果をもち、軸索損傷後の再生を阻害する分子であると考えられている。Nogo-A蛋白内には2つの軸索伸張阻害作用を有する[http://ja.wikipedia.org/wiki/%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA%E3%83%89%E3%83%A1%E3%82%A4%E3%83%B3 蛋白ドメイン]があり(Δ20とNogo-66)、軸索伸長阻害のみならず、軸索の先端の[http://www.google.co.jp/url?sa=t&rct=j&q=%E6%88%90%E9%95%B7%E5%86%86%E9%8C%90&source=web&cd=1&ved=0CCkQFjAA&url=http%3A%2F%2Fja.wikipedia.org%2Fwiki%2F%25E6%2588%2590%25E9%2595%25B7%25E5%2586%2586%25E9%258C%2590&ei=JQUpT9_pG8TUiALgkYDgCg&usg=AFQjCNFBZXVxTHKMsBRC7guZLsTRVXK2Ew&sig2=WTOTaoy2DdkSienrylh4cw&cad=rja 成長円錐]を虚脱させる作用を持っている。動物実験によりNogo-Aあるいはその下流のシグナルを阻害することにより、神経損傷時における神経軸索の再生を促すことが示されてきた。このことから軸索が損傷を受け、その再生ができないことにより重度の後遺障害が残る脊髄損傷や[http://www.google.co.jp/url?sa=t&rct=j&q=%E5%A4%9A%E7%99%BA%E6%80%A7%E7%A1%AC%E5%8C%96%E7%97%87&source=web&cd=1&ved=0CEAQFjAA&url=http%3A%2F%2Fja.wikipedia.org%2Fwiki%2F%25E5%25A4%259A%25E7%2599%25BA%25E6%2580%25A7%25E7%25A1%25AC%25E5%258C%2596%25E7%2597%2587&ei=WgUpT6SiGqThiALw2Pm1Cg&usg=AFQjCNHBe0ifIb3nQo2DTvLeVqqeC157sA&sig2=pAi3Mua1pHqq2MFZ1peNjA&cad=rja 多発性硬化症]のような脱髄疾患における軸索再生治療への期待がかけられている。また、病態時のみならず、脳内の学習と記憶のプロセスを強化する課程において重要な役割を果たすことが分かっている。 <br> | |||
== | = 発見の歴史<br> = | ||
=== 研究の萌芽 <br> === | |||
今からおよそ80年前に、スペインの神経学者Ramon y Cajalが再生阻害の謎を解く重要なヒントを見いだす<ref>Ramon y Cajal, S. Degeneration and regeneration of the nervous system. Hafner, New York, 1928.</ref>。Cajalは、感覚を伝える後根神経という末梢神経の軸索を切断し、その後の軸索の再生を観察した。再生しかけた軸索は、脊髄の中に侵入できず、再生できなかった。その後、Aguayoらは、脊髄の損傷による欠損部を末梢神経の周囲組織をグラフトとして移植することで、このグラフト内を軸索が再生する結果を得た<ref><pubmed> 6171034 </pubmed></ref>。これらにより、神経細胞自体には再生する力があり、神経細胞を取り巻く環境が再生に適していないのではないかと考えられるようになった。<br> 1980年代、更に研究が進展し、ミエリンが神経突起の伸展を抑制することが報告された。そして、Schwabらは、ミエリンの中に再生を阻害している分子が存在していると考え、ミエリンの各フラクションに対する抗体を作成した。In vitroの実験により、IN-1抗体はミエリンの作用を中和し、220 kDaの糖蛋白に結合することが判明した。また、IN-1抗体を脊髄損傷させたラットに投与すると、軸索再生と運動機能の回復が認められた<ref><pubmed> 2300171</pubmed></ref>。これら一連の成果により、軸索再生阻害という概念が実在のものとして信じられるようになった。しかし再生阻害を担う蛋白の単離は10年かかっても実現しなかった。 | |||
=== Nogoとその受容体の発見<br> === | |||
Schwabのグループは1999年に、IN-1抗体の認識する蛋白の部分配列を公開した<ref><pubmed> 9668118</pubmed></ref>。このペプチド配列をもとに、長年捜し求めた目的の蛋白がクローニングされ、3つのグループによって同時に報告された<ref><pubmed> 10667796</pubmed></ref><ref><pubmed> 10667797</pubmed></ref><ref><pubmed> 10667780</pubmed></ref>。Nogoと名付けられたこの蛋白はその配列情報から2回膜貫通構造をもっていると考えられ、培養神経細胞に対して突起伸展抑制作用をもっていた。Nogoは選択的スプライシングによって3つの長さの異なる蛋白が作られる。このうち最も長いNogo-Aには再生阻害に働く2つのドメインが存在する。Schwabらはアミノ端のNogoがより重要であると考えているが、Strittmatterらは膜貫通領域に囲まれる66個のアミノ酸からなるペプチド部分(Nogo-66)の再生抑制作用に注目し研究を進めた。<br> そして、Nogoの神経細胞上の受容体が同定された。StrittmatterらはNogo-66の受容体Nogo受容体NgRを同定した<ref><pubmed> 11201742</pubmed></ref>。NgR1は細胞内ドメインをもたないGPIアンカー型蛋白であり、Nogo-66に対し高親和性を示すことが分かった。 | |||
[[Image:Nogo 一次構造.jpg|frame|right|250px|(図1)Nogo蛋白の一次構造]] | |||
= | = 蛋白の一次構造とドメイン = | ||
図1に示されるとおり、Nogo蛋白の一次構造は、''RTN4''遺伝子によりコードされる二回膜貫通型の蛋白である。 ''RTN4''遺伝子からは、3つのアイソフォームNogo-A,Nogo-B,Nogo-Cが作られる。軸索阻害作用を持つNogo-66はNogo-A,-B,-Cに共通のドメインである。一方、Δ20ドメインは、Nogo-Aのみが持つことが分かっている。<br> | |||
二回膜貫通型ではあるが、図2で示されるように、アミノ末端部は、細胞外に露出していると考えられている。<br> | |||
= | = 蛋白の機能 <br> = | ||
=== <span style="font-weight: bold;">成体神経細胞に対する軸索伸展阻害作用</span> === | |||
==== | ==== 受容体と細胞内シグナル ==== | ||
Nogo受容体はGPIアンカー型蛋白であり、細胞内ドメインを持っていない。したがってNogo受容体は神経細胞内にシグナルを伝達することができないため、シグナル伝達を担う別の受容体がNogo受容体と共受容体を形成しているのではないかと考えられた。[[Image:Revised Nogo signal.jpg|frame|right|500px|(図2)Nogoのシグナル伝達経路]]<br> その頃、山下(現大阪大学教授)らは機能の良く分かっていなかった神経栄養因子の受容体であるp75受容体の発生時における役割を明らかにした。p75は、主として末梢神経の軸索伸展を促進していることが報告された<ref>Yamashita, T., Tucker, K.L., Barde, Y.A.: Neuron, 24: 585-593 (1999)</ref>。その後、山下等はこのp75が軸索伸展阻害因子の一つMAG(Myelin Associated Glycoprotein)のシグナルを神経細胞に伝える受容体であることを見い出した<ref>Yamashita, T., Higuchi, H., Tohyama, M.: J. Cell Biol., 157, 565-570 (2002)</ref>。P75を欠失しているマウスの神経細胞はMAGに対する反応性を失ったのである。<br> 次に、p75がMAGのシグナルを伝える受容体であれば、p75とNogo受容体は共受容体を形成し、MAGのみならずNogoとOMgp(Oligodendrocyte Myelin glycoprotein)のシグナルも伝えていることが予測される。その仮説は直ちに検証され、Heらによって正しいことが証明された<ref>Wang, K.C., et al.: Nature, 420, 72-78 (2002)</ref>。こうしてp75は再生阻害のキープレーヤーであると考えられるようになった。<br> それではp75を介してどのような細胞内シグナルが形成されるのだろうか。 ニューロトロフィンがp75に作用して軸索の伸展を促すメカニズムは、Rhoの不活性化である<ref>Yamashita, T., Tucker, K.L., Barde, Y.A.: Neuron, 24: 585-593 (1999)</ref>。Rhoはアクチン骨格系あるいはチューブリンを制御することによって、細胞の形態形成の鍵となる蛋白である。MAG によりp75を介してRhoが活性化されること、さらに、p75によりRhoとRhoの活性化阻害蛋白であるRho guanine nucleotide dissociation inhibitor(Rho GDI)が解離することでRhoが活性化に導かれる事実が判明した。<br> しかしながらp75/Nogo受容体のみでは、ある種の細胞ではリガンドで刺激してもRhoが活性化しない。そこでLingo-1が新しいp75/Nogo受容体コンポーネントの仲間入りした。これにより、p75/Nogo受容体/Lingo-1という受容体複合によりRhoが活性化されて、軸索伸展が阻止されるという基本モデルが完成した(図2左側)。<br> | |||
==== Nogoは本当に再生阻害因子か? ==== | |||
ここまでの急速な研究の発展により、中枢神経がなぜ再生しないのかという疑問に分子の言葉で答えられるようになったと多くの研究者が考えた。しかしながら、現在は、この単純なモデルの一つ一つが検証され、再検討されてきている。 | |||
まず、第一の疑問はNogoはin vivoで、再生阻害蛋白として働くのか?という根本的なものであった。それまで、Nogoを阻害するとin vivoで、軸索再生が促進されると言うことは、中和抗体(IN-1)や、阻害ペプチド(NEP1-40)によって証明されていた。そこで、Nogoのノックアウトマウスを3つのグループが独自に作成し、脊髄損傷後の軸索再生を評価した。しかしその結果は食い違っていた。Strittmatterらは、ノックアウトマウスでは再生は促進され、運動機能の回復も良かったと報告した。Tessier-Lavigneらは、再生は認められなかったと断じ、Schwabは軽度の再生線維と芽生え現象を確認した。3つのトップグループがそれぞれ異なった結果を報告した理由は今もって解明されていない。 | |||
さらに、このシグナル伝達経路に関する検証も行われた。Tessier-LavigneのグループはNogo受容体のノックアウトマウスを作成し、その神経細胞を用いて、軸索伸展阻害の実験をin vitroで行った。神経細胞は野生型と同様に、ミエリンのみならずNogo-66によって突起の伸展阻害がおこったのである。これに対して、P75ノックアウトマウスの神経細胞はNogo-66に不応性であることが再度確認された。以上の結果が正しいとすると、p75はミエリン由来因子の受容体であるが、Nogo受容体はそうではないということになる。 | |||
更に、Nogo受容体及び、P75ノックアウトマウスを用いて、脊髄損傷後の再生が評価された。しかしながらこれらのマウスで再生は認められなかったのである。従ってNogo受容体, p75受容体にシグナルが集約されるというモデル自体も再検討されるに至った。<br> | |||
=== PirBの発見 === | |||
これらの結果から、Tessier-Lavigneのグループより、Nogo66に対する別の受容体が報告された。それが、paired immunoglobulin-like receptor B(PirB)である。Atwalらは、Nogo-66に対する受容体をスクリーニングし、NgRと共に、leukocyte immunoglobulin (Ig)-like recep- tor B2 (LILRB2)を発見した。これは、マウスのPirBのオルソログに当たる。これらは、50%のホモロジーしか共有していないし、PirBは細胞外の免疫グロブリン様ドメインが4つしかないが、Nogo-66のみならず、MAG,OMgpもNgRと同様に結合することが示された。<ref><pubmed> 18988857 </pubmed></ref><br> | |||
現在PirBの想定されるシグナル伝達機構は、SHPと結合し、その脱リン酸化機構を介してTrkBのシグナルを制御するというものなど、現在報告が増えてきている。 | |||
=== ミエリン由来阻害因子の再検証 === | |||
ミエリン由来因子はin vivoで再生阻害に働いているのか?これに関しても、最近否定的な結果が得られた。WIlliamらは、主要な再生阻害因子と考えられてきたNogo, MAG,OMgpのトリプルノックアウトマウスを作成して、軸索再生を詳細に脊髄損傷モデルにより検討したところ、全く再生が促進されないことが分かった。このことにより、ミエリン由来あるいは、グリア瘢痕由来の別の再生阻害因子の存在を考えるべきである。我々は、ここに、RGMという分子が重要であることを報告している。 | |||
<br> | |||
<references /> | == その他の機能 == | ||
==== <span style="font-weight: bold;"> 胎生期神経前駆細胞の放射状移動を制御</span><br> ==== | |||
==== Critical periodの形成に関わり、成体の軸索の再編成を制御し、神経ネットワークの可塑性を制御<br> ==== | |||
==== βセクレターゼ活性の制御によるAPPの切断を制御<br> ==== | |||
<br> | |||
<br> | |||
<br> | |||
<references /><br> | |||
<br> | |||
<br> | |||
2012年2月4日 (土) 09:53時点における版
(読み方)ノゴ (英)Nogo 同じ
概要
Nogoは脊椎動物の中枢神経の軸索伸長の阻害効果をもち、軸索損傷後の再生を阻害する分子であると考えられている。Nogo-A蛋白内には2つの軸索伸張阻害作用を有する蛋白ドメインがあり(Δ20とNogo-66)、軸索伸長阻害のみならず、軸索の先端の成長円錐を虚脱させる作用を持っている。動物実験によりNogo-Aあるいはその下流のシグナルを阻害することにより、神経損傷時における神経軸索の再生を促すことが示されてきた。このことから軸索が損傷を受け、その再生ができないことにより重度の後遺障害が残る脊髄損傷や多発性硬化症のような脱髄疾患における軸索再生治療への期待がかけられている。また、病態時のみならず、脳内の学習と記憶のプロセスを強化する課程において重要な役割を果たすことが分かっている。
発見の歴史
研究の萌芽
今からおよそ80年前に、スペインの神経学者Ramon y Cajalが再生阻害の謎を解く重要なヒントを見いだす[1]。Cajalは、感覚を伝える後根神経という末梢神経の軸索を切断し、その後の軸索の再生を観察した。再生しかけた軸索は、脊髄の中に侵入できず、再生できなかった。その後、Aguayoらは、脊髄の損傷による欠損部を末梢神経の周囲組織をグラフトとして移植することで、このグラフト内を軸索が再生する結果を得た[2]。これらにより、神経細胞自体には再生する力があり、神経細胞を取り巻く環境が再生に適していないのではないかと考えられるようになった。
1980年代、更に研究が進展し、ミエリンが神経突起の伸展を抑制することが報告された。そして、Schwabらは、ミエリンの中に再生を阻害している分子が存在していると考え、ミエリンの各フラクションに対する抗体を作成した。In vitroの実験により、IN-1抗体はミエリンの作用を中和し、220 kDaの糖蛋白に結合することが判明した。また、IN-1抗体を脊髄損傷させたラットに投与すると、軸索再生と運動機能の回復が認められた[3]。これら一連の成果により、軸索再生阻害という概念が実在のものとして信じられるようになった。しかし再生阻害を担う蛋白の単離は10年かかっても実現しなかった。
Nogoとその受容体の発見
Schwabのグループは1999年に、IN-1抗体の認識する蛋白の部分配列を公開した[4]。このペプチド配列をもとに、長年捜し求めた目的の蛋白がクローニングされ、3つのグループによって同時に報告された[5][6][7]。Nogoと名付けられたこの蛋白はその配列情報から2回膜貫通構造をもっていると考えられ、培養神経細胞に対して突起伸展抑制作用をもっていた。Nogoは選択的スプライシングによって3つの長さの異なる蛋白が作られる。このうち最も長いNogo-Aには再生阻害に働く2つのドメインが存在する。Schwabらはアミノ端のNogoがより重要であると考えているが、Strittmatterらは膜貫通領域に囲まれる66個のアミノ酸からなるペプチド部分(Nogo-66)の再生抑制作用に注目し研究を進めた。
そして、Nogoの神経細胞上の受容体が同定された。StrittmatterらはNogo-66の受容体Nogo受容体NgRを同定した[8]。NgR1は細胞内ドメインをもたないGPIアンカー型蛋白であり、Nogo-66に対し高親和性を示すことが分かった。
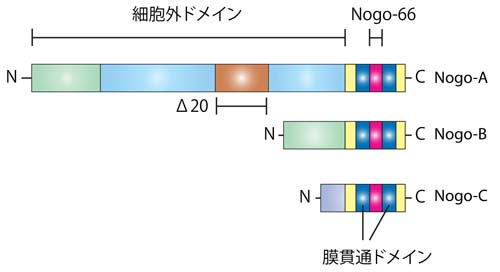
蛋白の一次構造とドメイン
図1に示されるとおり、Nogo蛋白の一次構造は、RTN4遺伝子によりコードされる二回膜貫通型の蛋白である。 RTN4遺伝子からは、3つのアイソフォームNogo-A,Nogo-B,Nogo-Cが作られる。軸索阻害作用を持つNogo-66はNogo-A,-B,-Cに共通のドメインである。一方、Δ20ドメインは、Nogo-Aのみが持つことが分かっている。
二回膜貫通型ではあるが、図2で示されるように、アミノ末端部は、細胞外に露出していると考えられている。
蛋白の機能
成体神経細胞に対する軸索伸展阻害作用
受容体と細胞内シグナル
Nogo受容体はGPIアンカー型蛋白であり、細胞内ドメインを持っていない。したがってNogo受容体は神経細胞内にシグナルを伝達することができないため、シグナル伝達を担う別の受容体がNogo受容体と共受容体を形成しているのではないかと考えられた。
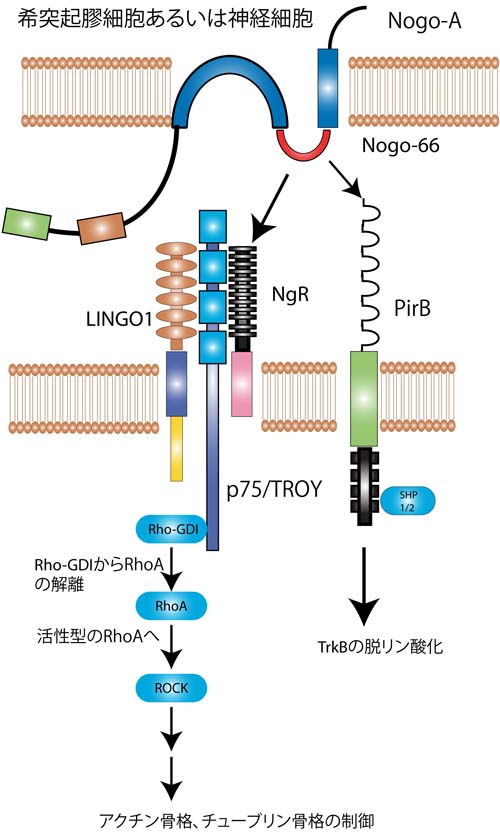
その頃、山下(現大阪大学教授)らは機能の良く分かっていなかった神経栄養因子の受容体であるp75受容体の発生時における役割を明らかにした。p75は、主として末梢神経の軸索伸展を促進していることが報告された[9]。その後、山下等はこのp75が軸索伸展阻害因子の一つMAG(Myelin Associated Glycoprotein)のシグナルを神経細胞に伝える受容体であることを見い出した[10]。P75を欠失しているマウスの神経細胞はMAGに対する反応性を失ったのである。
次に、p75がMAGのシグナルを伝える受容体であれば、p75とNogo受容体は共受容体を形成し、MAGのみならずNogoとOMgp(Oligodendrocyte Myelin glycoprotein)のシグナルも伝えていることが予測される。その仮説は直ちに検証され、Heらによって正しいことが証明された[11]。こうしてp75は再生阻害のキープレーヤーであると考えられるようになった。
それではp75を介してどのような細胞内シグナルが形成されるのだろうか。 ニューロトロフィンがp75に作用して軸索の伸展を促すメカニズムは、Rhoの不活性化である[12]。Rhoはアクチン骨格系あるいはチューブリンを制御することによって、細胞の形態形成の鍵となる蛋白である。MAG によりp75を介してRhoが活性化されること、さらに、p75によりRhoとRhoの活性化阻害蛋白であるRho guanine nucleotide dissociation inhibitor(Rho GDI)が解離することでRhoが活性化に導かれる事実が判明した。
しかしながらp75/Nogo受容体のみでは、ある種の細胞ではリガンドで刺激してもRhoが活性化しない。そこでLingo-1が新しいp75/Nogo受容体コンポーネントの仲間入りした。これにより、p75/Nogo受容体/Lingo-1という受容体複合によりRhoが活性化されて、軸索伸展が阻止されるという基本モデルが完成した(図2左側)。
Nogoは本当に再生阻害因子か?
ここまでの急速な研究の発展により、中枢神経がなぜ再生しないのかという疑問に分子の言葉で答えられるようになったと多くの研究者が考えた。しかしながら、現在は、この単純なモデルの一つ一つが検証され、再検討されてきている。
まず、第一の疑問はNogoはin vivoで、再生阻害蛋白として働くのか?という根本的なものであった。それまで、Nogoを阻害するとin vivoで、軸索再生が促進されると言うことは、中和抗体(IN-1)や、阻害ペプチド(NEP1-40)によって証明されていた。そこで、Nogoのノックアウトマウスを3つのグループが独自に作成し、脊髄損傷後の軸索再生を評価した。しかしその結果は食い違っていた。Strittmatterらは、ノックアウトマウスでは再生は促進され、運動機能の回復も良かったと報告した。Tessier-Lavigneらは、再生は認められなかったと断じ、Schwabは軽度の再生線維と芽生え現象を確認した。3つのトップグループがそれぞれ異なった結果を報告した理由は今もって解明されていない。
さらに、このシグナル伝達経路に関する検証も行われた。Tessier-LavigneのグループはNogo受容体のノックアウトマウスを作成し、その神経細胞を用いて、軸索伸展阻害の実験をin vitroで行った。神経細胞は野生型と同様に、ミエリンのみならずNogo-66によって突起の伸展阻害がおこったのである。これに対して、P75ノックアウトマウスの神経細胞はNogo-66に不応性であることが再度確認された。以上の結果が正しいとすると、p75はミエリン由来因子の受容体であるが、Nogo受容体はそうではないということになる。
更に、Nogo受容体及び、P75ノックアウトマウスを用いて、脊髄損傷後の再生が評価された。しかしながらこれらのマウスで再生は認められなかったのである。従ってNogo受容体, p75受容体にシグナルが集約されるというモデル自体も再検討されるに至った。
PirBの発見
これらの結果から、Tessier-Lavigneのグループより、Nogo66に対する別の受容体が報告された。それが、paired immunoglobulin-like receptor B(PirB)である。Atwalらは、Nogo-66に対する受容体をスクリーニングし、NgRと共に、leukocyte immunoglobulin (Ig)-like recep- tor B2 (LILRB2)を発見した。これは、マウスのPirBのオルソログに当たる。これらは、50%のホモロジーしか共有していないし、PirBは細胞外の免疫グロブリン様ドメインが4つしかないが、Nogo-66のみならず、MAG,OMgpもNgRと同様に結合することが示された。[13]
現在PirBの想定されるシグナル伝達機構は、SHPと結合し、その脱リン酸化機構を介してTrkBのシグナルを制御するというものなど、現在報告が増えてきている。
ミエリン由来阻害因子の再検証
ミエリン由来因子はin vivoで再生阻害に働いているのか?これに関しても、最近否定的な結果が得られた。WIlliamらは、主要な再生阻害因子と考えられてきたNogo, MAG,OMgpのトリプルノックアウトマウスを作成して、軸索再生を詳細に脊髄損傷モデルにより検討したところ、全く再生が促進されないことが分かった。このことにより、ミエリン由来あるいは、グリア瘢痕由来の別の再生阻害因子の存在を考えるべきである。我々は、ここに、RGMという分子が重要であることを報告している。
その他の機能
胎生期神経前駆細胞の放射状移動を制御
Critical periodの形成に関わり、成体の軸索の再編成を制御し、神経ネットワークの可塑性を制御
βセクレターゼ活性の制御によるAPPの切断を制御
- ↑ Ramon y Cajal, S. Degeneration and regeneration of the nervous system. Hafner, New York, 1928.
- ↑
David, S., & Aguayo, A.J. (1981).
Axonal elongation into peripheral nervous system "bridges" after central nervous system injury in adult rats. Science (New York, N.Y.), 214(4523), 931-3. [PubMed:6171034] [WorldCat] [DOI] - ↑
Schnell, L., & Schwab, M.E. (1990).
Axonal regeneration in the rat spinal cord produced by an antibody against myelin-associated neurite growth inhibitors. Nature, 343(6255), 269-72. [PubMed:2300171] [WorldCat] [DOI] - ↑
Spillmann, A.A., Bandtlow, C.E., Lottspeich, F., Keller, F., & Schwab, M.E. (1998).
Identification and characterization of a bovine neurite growth inhibitor (bNI-220). The Journal of biological chemistry, 273(30), 19283-93. [PubMed:9668118] [WorldCat] [DOI] - ↑
Chen, M.S., Huber, A.B., van der Haar, M.E., Frank, M., Schnell, L., Spillmann, A.A., ..., & Schwab, M.E. (2000).
Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1. Nature, 403(6768), 434-9. [PubMed:10667796] [WorldCat] [DOI] - ↑
GrandPré, T., Nakamura, F., Vartanian, T., & Strittmatter, S.M. (2000).
Identification of the Nogo inhibitor of axon regeneration as a Reticulon protein. Nature, 403(6768), 439-44. [PubMed:10667797] [WorldCat] [DOI] - ↑
Prinjha, R., Moore, S.E., Vinson, M., Blake, S., Morrow, R., Christie, G., ..., & Walsh, F.S. (2000).
Inhibitor of neurite outgrowth in humans. Nature, 403(6768), 383-4. [PubMed:10667780] [WorldCat] [DOI] - ↑
Fournier, A.E., GrandPre, T., & Strittmatter, S.M. (2001).
Identification of a receptor mediating Nogo-66 inhibition of axonal regeneration. Nature, 409(6818), 341-6. [PubMed:11201742] [WorldCat] [DOI] - ↑ Yamashita, T., Tucker, K.L., Barde, Y.A.: Neuron, 24: 585-593 (1999)
- ↑ Yamashita, T., Higuchi, H., Tohyama, M.: J. Cell Biol., 157, 565-570 (2002)
- ↑ Wang, K.C., et al.: Nature, 420, 72-78 (2002)
- ↑ Yamashita, T., Tucker, K.L., Barde, Y.A.: Neuron, 24: 585-593 (1999)
- ↑
Atwal, J.K., Pinkston-Gosse, J., Syken, J., Stawicki, S., Wu, Y., Shatz, C., & Tessier-Lavigne, M. (2008).
PirB is a functional receptor for myelin inhibitors of axonal regeneration. Science (New York, N.Y.), 322(5903), 967-70. [PubMed:18988857] [WorldCat] [DOI]