「プレキシン」の版間の差分
Fumikazusuto (トーク | 投稿記録) 細 →構造 |
Fumikazusuto (トーク | 投稿記録) 細 →構造 |
||
| 4行目: | 4行目: | ||
[[ファイル:プレキシン基本構造.png|400px|thumb|右|基本構造]] | [[ファイル:プレキシン基本構造.png|400px|thumb|右|基本構造]] | ||
プレキシン分子は1回膜貫通型のタイプI型膜分子であり、アミノ末端よりシグナル配列、sema-domain、3つのMRS(またはPSI-domain)、6つ、あるいは4つのIPT-domain、膜貫通部位、細胞内領域を有する。sema-domainは相互作用分子であるセマフォリン(semaphorin)と類似した構造であり、HGF受容体のc-Metの細胞外領域にも存在する。 MRS (c-Met-related sequence)は、プレキシンとc-Metならびにc-Met-like kinaseと類似した配列として見出された配列で、基本的に8つのCystein残基を含む約50アミノ酸残基からなる配列である。この配列はplexin, semaphorin, integrin(β-integrin)にて認められることから、それぞれの分子の頭文字をとってPSI-domainとも呼ばれている。IPT-domainは、immunoglobulin (Ig)様構造をとると予測されている部位で、nuclear factor of transcription factors (NFAT) ファミリーにも存在することより、IPT (immunoblobulin-like fold shared by plexins and transcription factors)と名付けられている。また、細胞外領域には糖鎖の結合が予測されるN-linked glycosylation部位も複数存在し、糖鎖修飾による活性制御が推定されている。細胞内領域は高度に保存されており、プレキシンファミリー分子間で共通する部位としてGAP-related domainとその中間にhinge-domainが存在する。また、A-type plexin分子には膜貫通部位付近にFERM-domain結合配列が、B-type plexin分子にはC末端にPDZ-domain結合配列が存在する。<br /> | プレキシン分子は1回膜貫通型のタイプI型膜分子であり、アミノ末端よりシグナル配列、sema-domain、3つのMRS(またはPSI-domain)、6つ、あるいは4つのIPT-domain、膜貫通部位、細胞内領域を有する。sema-domainは相互作用分子であるセマフォリン(semaphorin)と類似した構造であり、HGF受容体のc-Metの細胞外領域にも存在する。 MRS (c-Met-related sequence)は、プレキシンとc-Metならびにc-Met-like kinaseと類似した配列として見出された配列で、基本的に8つのCystein残基を含む約50アミノ酸残基からなる配列である。この配列はplexin, semaphorin, integrin(β-integrin)にて認められることから、それぞれの分子の頭文字をとってPSI-domainとも呼ばれている。IPT-domainは、immunoglobulin (Ig)様構造をとると予測されている部位で、nuclear factor of transcription factors (NFAT) ファミリーにも存在することより、IPT (immunoblobulin-like fold shared by plexins and transcription factors)と名付けられている。また、細胞外領域には糖鎖の結合が予測されるN-linked glycosylation部位も複数存在し、糖鎖修飾による活性制御が推定されている。細胞内領域は高度に保存されており、プレキシンファミリー分子間で共通する部位としてGAP-related domainとその中間にhinge-domainが存在する。また、A-type plexin分子には膜貫通部位付近にFERM-domain結合配列が、B-type plexin分子にはC末端にPDZ-domain結合配列が存在する。<br /> | ||
主たる相互作用分子であるセマフォリンとは、sema-domain同士を介して結合する。結晶解析により、いずれのsema-domainも7-bladed β—propeller構造をとることが明らかになった。1つのblade(羽根)はA~Dの4つのβシートにより構成される。プレキシン、セマフォリンともに、第1と第2blade間ならびに第5blade中のß5Cとß5D間に、それぞれextrusion 1、extrusion 2とそれぞれ名付けられた突出部位をもつ。これら2つのextrusion、ならびに第3bladeより構成される構造でプレキシンとセマフォリンの結合が制御される。例えば、αヘリック構造からなるextrusion 2には、相互作用に必要なアミノ酸が含まれている(Sema6Aとplexin-A2の場合、それぞれK393と A396)。また、Sema6A—Plexin-A2結合における結晶構造解析より、plexin-A2は、Sema6A非結合時にはリガンド結合部位にてホモフィリックな(同種分子間での)結合様式をとり、一方、Sema6Aの存在下では同様な部位にてSema6A結合すること、すなわち、リガンドの存在、非存在下において結合相手を代えることが明らかとなっている。 | 主たる相互作用分子であるセマフォリンとは、sema-domain同士を介して結合する。結晶解析により、いずれのsema-domainも7-bladed β—propeller構造をとることが明らかになった。1つのblade(羽根)はA~Dの4つのβシートにより構成される。プレキシン、セマフォリンともに、第1と第2blade間ならびに第5blade中のß5Cとß5D間に、それぞれextrusion 1、extrusion 2とそれぞれ名付けられた突出部位をもつ。これら2つのextrusion、ならびに第3bladeより構成される構造でプレキシンとセマフォリンの結合が制御される。例えば、αヘリック構造からなるextrusion 2には、相互作用に必要なアミノ酸が含まれている(Sema6Aとplexin-A2の場合、それぞれK393と A396)。また、Sema6A—Plexin-A2結合における結晶構造解析より、plexin-A2は、Sema6A非結合時にはリガンド結合部位にてホモフィリックな(同種分子間での)結合様式をとり、一方、Sema6Aの存在下では同様な部位にてSema6A結合すること、すなわち、リガンドの存在、非存在下において結合相手を代えることが明らかとなっている。 | ||
2016年2月10日 (水) 10:36時点における版
プレキシンは、1回膜貫通型のタイプI型膜分子であり、アフリカツメガエルの視覚系組織に対するモノクローナル抗体B2の抗原として同定された。発見当初、相同分子間接着活性を持つ分子として見出され、その後、主に軸索誘導(ガイド)分子セマフォリン(semaphorin)の受容体としても機能することが明らかになっている。脊椎動物では9種類の分子からなる分子ファミリーを構成し、そのアミノ酸配列の類似性から4つのサブファミリ(A、B、C、D)に分類されている。培養系や生体内での解析により、神経回路形成期において、神経細胞移動、軸索誘導、軸索剪定、樹状突起形成、スパイン形成の制御など様々な現象に関与することが明らかになっている。また、神経系以外では、免疫系、骨形成、血管形成など生体内の多様な局面で機能する。
構造
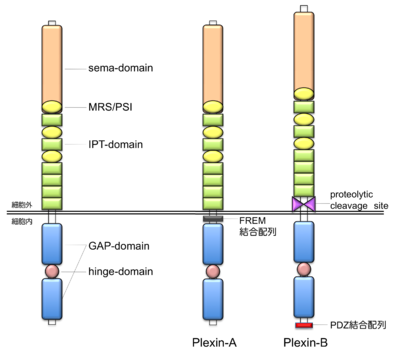
プレキシン分子は1回膜貫通型のタイプI型膜分子であり、アミノ末端よりシグナル配列、sema-domain、3つのMRS(またはPSI-domain)、6つ、あるいは4つのIPT-domain、膜貫通部位、細胞内領域を有する。sema-domainは相互作用分子であるセマフォリン(semaphorin)と類似した構造であり、HGF受容体のc-Metの細胞外領域にも存在する。 MRS (c-Met-related sequence)は、プレキシンとc-Metならびにc-Met-like kinaseと類似した配列として見出された配列で、基本的に8つのCystein残基を含む約50アミノ酸残基からなる配列である。この配列はplexin, semaphorin, integrin(β-integrin)にて認められることから、それぞれの分子の頭文字をとってPSI-domainとも呼ばれている。IPT-domainは、immunoglobulin (Ig)様構造をとると予測されている部位で、nuclear factor of transcription factors (NFAT) ファミリーにも存在することより、IPT (immunoblobulin-like fold shared by plexins and transcription factors)と名付けられている。また、細胞外領域には糖鎖の結合が予測されるN-linked glycosylation部位も複数存在し、糖鎖修飾による活性制御が推定されている。細胞内領域は高度に保存されており、プレキシンファミリー分子間で共通する部位としてGAP-related domainとその中間にhinge-domainが存在する。また、A-type plexin分子には膜貫通部位付近にFERM-domain結合配列が、B-type plexin分子にはC末端にPDZ-domain結合配列が存在する。
主たる相互作用分子であるセマフォリンとは、sema-domain同士を介して結合する。結晶解析により、いずれのsema-domainも7-bladed β—propeller構造をとることが明らかになった。1つのblade(羽根)はA~Dの4つのβシートにより構成される。プレキシン、セマフォリンともに、第1と第2blade間ならびに第5blade中のß5Cとß5D間に、それぞれextrusion 1、extrusion 2とそれぞれ名付けられた突出部位をもつ。これら2つのextrusion、ならびに第3bladeより構成される構造でプレキシンとセマフォリンの結合が制御される。例えば、αヘリック構造からなるextrusion 2には、相互作用に必要なアミノ酸が含まれている(Sema6Aとplexin-A2の場合、それぞれK393と A396)。また、Sema6A—Plexin-A2結合における結晶構造解析より、plexin-A2は、Sema6A非結合時にはリガンド結合部位にてホモフィリックな(同種分子間での)結合様式をとり、一方、Sema6Aの存在下では同様な部位にてSema6A結合すること、すなわち、リガンドの存在、非存在下において結合相手を代えることが明らかとなっている。
Plexin subfamily
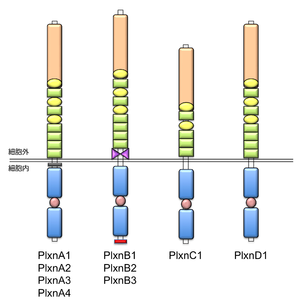
脊椎動物において、9つのプレキシン分子はアミノ酸配列の類似性をもとに4つのサブファミリーに分類される。これらの構成は、A-type plexin (4分子: plexin-A1 , plexin-A2 , plexin-A3, plexin-A4)、B-type plexin (3分子: plexin-B1, plexin-B2, plexin-B3), C-type plexin (1分子: plexin-C1)、D-type plexin (1分子: plexin-D1)である。
相互作用分子
細胞外領域
細胞外領域は、主にセマフォリンとその共受容体と相互作用する。
A-type plexin 2つのニューロピリン分子(neuropilin-1,neuropilin-2)を介して、Sema3Eを除く分泌型 class 3 semaphorin (Sema3A, Sema3B, Sema3C, Sema3D, Sema3F)と結合する。また、class 5とclass 6の膜貫通型セマフォリンとは直接結合するとともに、その結合には特異性がある。これまでに、plexin-A1は、Sema5A, Sema6C, Sema6Dと直接結合し、Sema5Bとは遺伝学的な相互作用が報告されている。plexin-A2は、Sema5A、Sema6A, Sema6Bと、plexin-A4はSema6A, Sema6Bとそれぞれ結合し、plexin-A3は、Sema5A、Sema5Bと遺伝学的な相互作用をする。Plexin-A4は、Sema6A, Sema6Bとの直接的な結合が示されている。さらに近年、A-type plexinは、軸索ガイド分子Slit分子のC末端側領域と結合することが示されている。
B-type plexin 主に膜貫通型セマフォリンのうち、class 4とclass 5セマフォリンと直接結合する。plexin-B1はSema4A, Sema4Dと、plexin-B2はSema4A, Sema4C, Sema4Gと、plexin-B3はSema4A, Sema5Aとの相互作用が示されている。
C-type plexin class 7 semaphorinである Sema7Aとviral semaphorin (A39R)と結合する。
D-type plexin class 3 semaphorinのうちSema3Eと直接結合する。
細胞内領域での結合分子
細胞内領域には細胞骨格系を制御する分子との相互作用が知られている。これまでに、small GTP結合分子(Rnd分子ファミリー、R-Ras, M-Rasなど)やFynチロシンキナーゼが結合することが報告されている。また、A-type plexinは、juxtamembrane 付近でFERM-domain を含むFARM1, FARM2と、また、B-type plexinはC末端にてPDZ-domaiを含むLARG, PDZ-RhoGEFと結合する。 p190 RhoGAP,
機能と役割
培養系や生体内での解析により、プレキシン分子は軸索誘導分子セマフォリンのシグナルを細胞内に伝達する受容体として機能することが示されている。セマフォリンは、神経細胞の種類や、神経細胞の部位(樹状突起や成長円錐など)で作用が異なることが知られているが、主として伸長中の軸索先端部にある成長円錐を崩壊させる作用や細胞移動抑制など、細胞骨格形成に対して負の作用を引き起こす。また、プレキシン分子は神経回路形成の多様な局面を制御していることが示されている。以下に代表的な現象とそれに関わるプレキシン分子とその相互作用分子について紹介する。
神経細胞移動
神経前駆細胞や神経細胞は生み出された後、特定の様式で移動し所定の部位に位置する。このような細胞移動の過程において、プレキシンは、セマフォリンの細胞移動抑制作用を細胞内に伝達する事により、細胞移動を制御する。例えば、Sema6A/plexin-A2シグナルが小脳顆粒細胞の移動開始を制御する。また、末梢神経系において、plexin-A3とplexin-A4はSema3Aの細胞移動抑制作用をNrp1とともに細胞内に伝達することにより、交感神経節の形成を制御することが報告されている。また、大脳新皮質の形成期において重要な働きを担うカハール—レチウス細胞(Cajal-Retzius (CR) cells)において、Plexin-D1は、Sema3Eの細胞移動抑制の作用シグナルをCR細胞内に伝達し、皮質分子層でのCR細胞の分布を制御する。
軸索誘導(軸索ガイド)
発生期において、神経細胞体から伸長する軸索は一定のルート(道筋)を走行する。この過程において、プレキシン分子はニューロピリン依存的または非依存的にセマフォリン分子の軸索反撥シグナルを伝達することにより、軸索走行を制御する。例えば、末梢神経系では、Sema3A/neuropilin-1/plexin-A3/plexin-A4シグナリングが三叉神経線維の軸索走行制御を担い、中枢神経系では、Sema3E/plexin-D1シグナリングが皮質遠心性線維の軸索走行を制御する。また、type-A plexinは、Slit分子のC末端側領域(SlitC)の受容体として機能し、特にplexin-A1は、SlitCの軸索反撥シグナルを伝達することで脊髄交連線維の走行を制御することが報告されている。
軸索投射/接続
神経回路形成期に軸索は標的細胞に投射し接続する。この際に、適切な標的細胞への選択的な投射/接続や、標的細胞における細胞部位選択性がある。プレキシンは、非標的細胞または非投射部位からのセマフォリンシグナルを受容することにより、これらの細胞への接続を抑制する役割を担う。例えば、脊髄神経回路において、固有受容反射弓を構成する固有受容感覚線維は反射弓を構成する運動神経細胞とは直接的な単シナプス結合を持たないことが知られている。このシナプス結合の特性において、運動神経からは反撥性のSema3Eが分泌され、plexin-D1が固有受容感覚線維でこのシグナルを受容することにより、単シナプス結合を抑制することが明らかになっている。他方、海馬では、錐体細胞樹状突起へ投射・接続する線維は、その由来に応じた部位選択性があり、このことにより由来の異なる軸索による層構造が形成される。海馬苔状線維(mossy fiber)は標的細胞であるCA3錐体細胞の頂上突起(apical dendrite)の起始部に選択的投射・接続を行う。この選択性において、plexin-A4は、CA3内に存在する軸索反撥性Sema6A/Sema6Bシグナルを苔状線維にて受容し、細胞部位選択性を制御する。一方、plexin-A2は、錐体細胞の樹状突起に存在し、Sema6A/Sema6Bの反撥シグナルを抑制する作用とplexin-A2自身による軸索伸長作用により、plexin-A4を有する苔状線維の標的部位への投射を可能にすることで、部位特異的な投射を制御する。
軸索剪定(刈込み)
発生発達期において、一部の軸索は一時的な標的細胞と接続した後に剪定(刈込み)される。この現象において、プレキシン分子は剪定される軸索上にて、一時的な標的細胞からの反撥性セマフォリンシグナルを受容することで、軸索剪定を制御する。例えば、海馬CA1錐体細胞の軸索は中核隔内側部と一時的な接続を形成したのち剪定を受けるが、この際にPlexin-A3は、錐体細胞側にて中核隔内側部からの反撥性Sema3A/Sema3Fシグナルを樹状することにより、軸索剪定を制御する。Plexin-A3はこの他にも海馬苔上線維の剪定において、Sema3Fシグナルをneuropilin-2と共受容することにより軸索剪定を制御している。なお、細胞内へのシグナル伝達について、neuropilin-2の細胞内領域がRacGAPであるβ2-Chimaerinと直接結合しRac1活性を制御することで、苔状線維の軸索剪定が生じることが報告されている。
細胞死
生み出された神経細胞のうち細胞死により除去される神経細胞が存在する。末梢神経節である後根神経節を構成する感覚神経細胞は、発生過程において細胞死により減少する。この過程で、plexin-A3は分泌型セマフォリンであるSema3Aのシグナルを細胞内に伝達することで細胞死に関与する。
樹状突起形成
スパイン形成
興奮性シナプスの形態の特徴として、後シナプス側にスパインと呼ばれる棘状隆起が形成される。このスパインは神経回路の発達従い刈込みを受けることが知られている。この過程において、plexin-A3はSema3Fのスパイン形成抑制シグナルをNrp2と共に細胞内に伝達する事で頂上樹状突起のスパイン形成を制御する。一方、plexin-A4はSema3Aのスパイン形成抑制シグナルをNrp1とともに細胞内に伝達する事により基底受容突起の形成を制御する事が報告されている。海馬では、歯状回顆粒細胞のスパイン形成について自閉症関連遺伝子Sema5Aの関与が指摘されており、Sema5Aもスパイン形成を抑制する作用を示す。plexin-A2はSema5Aのスパイン形成抑制シグナルを細胞内に伝達することでスパイン形成を制御する。