「アポトーシスプロテアーゼ活性化因子-1」の版間の差分
細 →構造 |
細編集の要約なし |
||
| (同じ利用者による、間の1版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/masayukimiura 三浦 正幸]、[https://researchmap.jp/shinodanatsuki 篠田 夏樹]</font><br> | <font size="+1">[http://researchmap.jp/masayukimiura 三浦 正幸]、[https://researchmap.jp/shinodanatsuki 篠田 夏樹]</font><br> | ||
''東京大学大学院薬学系研究科 遺伝学教室''<br> | ''東京大学大学院薬学系研究科 遺伝学教室''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2025年2月28日 原稿完成日:2025年8月13日<br> | ||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](京都大学大学院医学研究科 システム神経薬理学分野)<br> | |||
</div> | </div> | ||
英語名:Apoptotic protease activating factor 1<br> | 英語名:Apoptotic protease activating factor 1<br> | ||
略称:Apaf-1 | 略称:Apaf-1 | ||
{{box|text= 哺乳類細胞では放射線や、栄養因子除去によってアポトーシス経路が活性化されるとミトコンドリア膜間腔からシトクロムcが細胞質ゾルに漏出する。Apoptotic protease activating factor 1 (Apaf-1) は放出されたシトクロムcと結合するとヌクレオチド交換が引き起こされ, 結合していたADP/dADPがATP/dATPに置換される。このアポトソームにプロカスパーゼ- | {{box|text= 哺乳類細胞では放射線や、栄養因子除去によってアポトーシス経路が活性化されるとミトコンドリア膜間腔からシトクロムcが細胞質ゾルに漏出する。Apoptotic protease activating factor 1 (Apaf-1) は放出されたシトクロムcと結合するとヌクレオチド交換が引き起こされ, 結合していたADP/dADPがATP/dATPに置換される。このアポトソームにプロカスパーゼ-9がリクルートされることによって活性化され、活性型カスパーゼ-9は、プロカスパーゼ-3や7を切断することによって活性化させる。活性型カスパーゼ-3や7は広範な基質の切断を介してアポトーシスを実行する。このアポトーシス実行経路は内因性経路と呼ばれる。}} | ||
== アポトーシスプロテアーゼ活性化因子-1とは == | == アポトーシスプロテアーゼ活性化因子-1とは == | ||
H. Ellisと[[wj:ロバート・ホロビッツ|H.R. Horvitz]]は線虫''[[C. elegans]]''を用いた遺伝学的スクリーニングによって全ての[[プログラム細胞死]]実行に必要な遺伝子として[[ced-3]]と[[ced-4]]を同定した。後の研究によってCed-3は[[カスパーゼ]]であることが分った<ref name=Ellis1986><pubmed>3955651</pubmed></ref> | H. Ellisと[[wj:ロバート・ホロビッツ|H.R. Horvitz]]は線虫''[[C. elegans]]''を用いた遺伝学的スクリーニングによって全ての[[プログラム細胞死]]実行に必要な遺伝子として[[ced-3]]と[[ced-4]]を同定した。後の研究によってCed-3は[[カスパーゼ]]であることが分った<ref name=Ellis1986><pubmed>3955651</pubmed></ref>。[[w:Junying Yuan|J. Yuan]]とH.R. Horvitzはced-4遺伝子のクローニングを行いその一次配列を決定したが、Ced-4が他の生物でも保存されているかについては予測ができなかった<ref name=Yuan1992><pubmed>1286611</pubmed></ref>。 | ||
X. Wangらは生化学的な分画が可能なin vitro細胞死アッセイ系を作りアポトーシス経路に関わる分子の同定を進めた。このアッセイ系は[[HeLa細胞]]の[[細胞質]]抽出液に[[ハムスター]]の[[肝臓]]からとった[[核]]を入れ、[[ | X. Wangらは生化学的な分画が可能なin vitro細胞死アッセイ系を作りアポトーシス経路に関わる分子の同定を進めた。このアッセイ系は[[HeLa細胞]]の[[細胞質]]抽出液に[[ハムスター]]の[[肝臓]]からとった[[核]]を入れ、[[deoxyadenosine triphosphate]] ([[dATP]])を加えると[[カスパーゼ-3]]の活性化とアポトーシスに特徴的なDNAの断片化が起こるというものである<ref name=Liu1996><pubmed>8689682</pubmed></ref>。このアッセイ系で細胞質抽出液を分画し、dATP依存的にカスパーゼ3の活性化に必要な3つのApoptotic protease activating factor (Apaf)を同定した。遺伝子クローニングの結果、Apaf-1はCED-4哺乳類ホモログ<ref name=Zou1997><pubmed>9267021</pubmed></ref>、[[Apaf-2]]は[[シトクロムc]]<ref name=Liu1996 /> [3]、Apaf-3は[[カスパーゼ9]]であった<ref name=Li1997><pubmed>9390557</pubmed></ref>。 | ||
この研究によって内因性のアポトーシス実行経路が明らかになった。進化的にCed-4/Apaf-1が保存されているかのさらなる検討が[[ショウジョウバエ]]を用いてなされ、[[Dark]]/[[HAC-1]]/[[Dapaf-1]]が同定された。この遺伝子は発生や放射線で誘導されるアポトーシスに必要であることが示された<ref name=Rodriguez1999><pubmed>10559939</pubmed></ref><ref name=Zhou1999><pubmed>10619022</pubmed></ref><ref name=Kanuka1999><pubmed>10619023</pubmed></ref> | この研究によって内因性のアポトーシス実行経路が明らかになった。進化的にCed-4/Apaf-1が保存されているかのさらなる検討が[[ショウジョウバエ]]を用いてなされ、[[Dark]]/[[HAC-1]]/[[Dapaf-1]]が同定された。この遺伝子は発生や放射線で誘導されるアポトーシスに必要であることが示された<ref name=Rodriguez1999><pubmed>10559939</pubmed></ref><ref name=Zhou1999><pubmed>10619022</pubmed></ref><ref name=Kanuka1999><pubmed>10619023</pubmed></ref>。 | ||
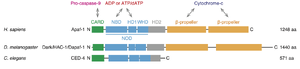
[[ファイル:Miura Apaf-1 Fig1.png|サムネイル|'''図1. Apaf-1およびそのオルソログのドメイン構造と結合分子''']] | [[ファイル:Miura Apaf-1 Fig1.png|サムネイル|'''図1. Apaf-1およびそのオルソログのドメイン構造と結合分子''']] | ||
[[ファイル:Miura Apaf-1 Fig2.png|サムネイル|'''図2. Apaf-1とシトクロムcによるアポトソーム形成'''<br>アポトソーム形成の結果、プロカスパーゼ9が活性化され、アポトーシスが起こる。]] | [[ファイル:Miura Apaf-1 Fig2.png|サムネイル|'''図2. Apaf-1とシトクロムcによるアポトソーム形成'''<br>アポトソーム形成の結果、プロカスパーゼ9が活性化され、アポトーシスが起こる。]] | ||
== 構造 == | == 構造 == | ||
[[ヒト]]Apaf-1はN末端側から[[caspase recruitment domain]] (CARD)、[[α/β nucleotide-binding domain]] (NBD) と[[helical domain 1]] (HD1)、及び[[winged helix domain]] (WHD) からなる[[nucleotide-dependent oligomerization domain]] (NOD)、それに続く[[helical domain 2]] (HD2)、そしてC末端側の[[WD40リピート]]からなる2つの[[β-propellerドメイン]]からなる('''図1''')。CARDはプロカスパーゼ9のCARDとの相互作用を介して結合し、NODはNBD-HD1界面において[[ADP]]または[[ATP]]/dATPと結合し、β-propellerドメインはシトクロムcと結合する<ref name=Riedl2007><pubmed>17377525</pubmed></ref> | [[ヒト]]Apaf-1はN末端側から[[caspase recruitment domain]] (CARD)、[[α/β nucleotide-binding domain]] (NBD) と[[helical domain 1]] (HD1)、及び[[winged helix domain]] (WHD) からなる[[nucleotide-dependent oligomerization domain]] (NOD)、それに続く[[helical domain 2]] (HD2)、そしてC末端側の[[WD40リピート]]からなる2つの[[β-propellerドメイン]]からなる('''図1''')。CARDはプロカスパーゼ9のCARDとの相互作用を介して結合し、NODはNBD-HD1界面において[[ADP]]または[[ATP]]/dATPと結合し、β-propellerドメインはシトクロムcと結合する<ref name=Riedl2007><pubmed>17377525</pubmed></ref>('''図1''')。通常、Apaf-1はADPと結合した不活性な単量体として存在する。[[ミトコンドリア]]膜間腔から漏出したシトクロムcと結合し、さらにADPがATP/dATPに置き換わることで構造が変化し、7量体からなるアポトソームを形成する<ref name=Cheng2016><pubmed>27697150</pubmed></ref><ref name=Dorstyn2018><pubmed>29765111</pubmed></ref>('''図2''')。 | ||
ショウジョウバエのオルソログであるDark/HAC-1/Dapaf-1は同様のドメイン構造を有するが、線虫のオルソログであるCED-4では2つのβ-propellerドメインを欠いている('''図1''')。選択的スプライシングによりβ-propellerドメインを欠失したアイソフォームが[[マウス]] ([[Apaf-1S]]) 及びショウジョウバエ ([[Dapaf-1S]]) で報告されている。Dapaf-1Sアイソフォームの過剰発現はカスパーゼを活性化できる<ref name=Kanuka1999 /> | ショウジョウバエのオルソログであるDark/HAC-1/Dapaf-1は同様のドメイン構造を有するが、線虫のオルソログであるCED-4では2つのβ-propellerドメインを欠いている('''図1''')。選択的スプライシングによりβ-propellerドメインを欠失したアイソフォームが[[マウス]] ([[Apaf-1S]]) 及びショウジョウバエ ([[Dapaf-1S]]) で報告されている。Dapaf-1Sアイソフォームの過剰発現はカスパーゼを活性化できる<ref name=Kanuka1999 />。 | ||
== 発現 == | == 発現 == | ||
ヒトではApaf-1は全身性に低く発現しているが、[[骨髄]]で相対的に高い発現を示す。細胞内ではApaf-1は[[細胞質]]に局在し、アポトーシス刺激においてその局在が変化することはない<ref name=Hausmann2000><pubmed>10791976</pubmed></ref> | ヒトではApaf-1は全身性に低く発現しているが、[[骨髄]]で相対的に高い発現を示す。細胞内ではApaf-1は[[細胞質]]に局在し、アポトーシス刺激においてその局在が変化することはない<ref name=Hausmann2000><pubmed>10791976</pubmed></ref>。ただし、化学療法抵抗性の[[Rajiバーキットリンパ腫]]細胞株ではApaf-1が形質膜へと局在することが報告されている<ref name=Sun2005><pubmed>15692060</pubmed></ref>。 | ||
神経細胞では分化や成熟によってApaf-1の発現が減少し、シトクロムcの細胞質ゾルへの漏出依存的なアポトーシスに抵抗性になることが報告されている<ref name=Wright2004><pubmed>15504912</pubmed></ref><ref name=Johnson2007><pubmed>18093951</pubmed></ref> | 神経細胞では分化や成熟によってApaf-1の発現が減少し、シトクロムcの細胞質ゾルへの漏出依存的なアポトーシスに抵抗性になることが報告されている<ref name=Wright2004><pubmed>15504912</pubmed></ref><ref name=Johnson2007><pubmed>18093951</pubmed></ref>。 | ||
DNA傷害依存的な細胞死誘導条件においては、Apaf-1は[[転写因子]][[p53]]によって転写誘導されることが報告されている<ref name=Fortin2001><pubmed>11591730</pubmed></ref> | DNA傷害依存的な細胞死誘導条件においては、Apaf-1は[[転写因子]][[p53]]によって転写誘導されることが報告されている<ref name=Fortin2001><pubmed>11591730</pubmed></ref>。また、Apaf-1は転写因子[[E2F]]によっても転写誘導される<ref name=Moroni2001><pubmed>11389439</pubmed></ref>。Apaf-1の5’UTRには[[internal ribosome entry site]] ([[IRES]]) が存在する<ref name=Coldwell2000><pubmed>10702798</pubmed></ref>。アポトーシス条件においてキャップ依存的な翻訳が抑制されることから、このIRESによってアポトーシス条件においてもApaf-1の発現が維持されると考えられている。 | ||
== 機能 == | == 機能 == | ||
哺乳類ではアポトーシス刺激によってミトコンドリアから細胞質に漏出したシトクロムcがApaf-1にATP/dATP依存的にと結合し7量体からなる[[アポトソーム]] | 哺乳類ではアポトーシス刺激によってミトコンドリアから細胞質に漏出したシトクロムcがApaf-1にATP/dATP依存的にと結合し7量体からなる[[アポトソーム]]を形成する('''図2''')。さらに[[プロカスパーゼ9]]が互いのCARDドメインを介してアポトソームにリクルートされる。プロカスパーゼ9はアポトソームが形成されると活性化される<ref name=Yuan2010><pubmed>20462491</pubmed></ref>。Apaf-1アポトソームでのApaf-1とプロカスパーゼ9との量比はおよそ7:4であり<ref name=Hua2014><pubmed>25313070</pubmed></ref>、1つから2つのカスパーゼ9の2量体 (活性化型) を含むと考えられている<ref name=Cheng2016 />('''図2''')。また、ミトコンドリア膜透過性遷移が生じた際には、カスパーゼ4とApaf-1がApaf-1パイロソームと呼ばれるタンパク質複合体を形成し、[[パイロトーシス]]を誘導する<ref name=Xu2021><pubmed>33308446</pubmed></ref>。 | ||
ショウジョウバエDark/HAC-1/Dapaf-1もApaf-1と同様にシトクロムcと結合するβ-propellerドメインを有しシトクロムcと結合できるが<ref name=Kanuka1999 /> | ショウジョウバエDark/HAC-1/Dapaf-1もApaf-1と同様にシトクロムcと結合するβ-propellerドメインを有しシトクロムcと結合できるが<ref name=Kanuka1999 />、8量体からなるアポトソームの形成にシトクロムcは不要である<ref name=Yuan2011><pubmed>21220123</pubmed></ref><ref name=Dorstyn2004><pubmed>15533997</pubmed></ref><ref name=Dorstyn2002><pubmed>11901173</pubmed></ref><ref name=Yu2006><pubmed>16310803</pubmed></ref>。 | ||
自己不活性型Dark単量体は[[プロDronc]]と会合することによってアポトソームを形成して、プロDroncを活性化することが示唆されている<ref name=Tiana2024><pubmed>38381783</pubmed></ref> | 自己不活性型Dark単量体は[[プロDronc]]と会合することによってアポトソームを形成して、プロDroncを活性化することが示唆されている<ref name=Tiana2024><pubmed>38381783</pubmed></ref>。線虫のCed-4は8量体を形成し、そこに2分子のCed-3が入り活性化すると考えられている<ref name=Qi2010><pubmed>20434985</pubmed></ref>。ショウジョウバエの全てのプログラム細胞死、ショウジョウバエ、マウスでは発生でおこるアポトーシスの殆どはApaf-1を必要としている<ref name=Rodriguez1999><pubmed>10559939</pubmed></ref><ref name=Zhou1999><pubmed>10619022</pubmed></ref><ref name=Kanuka1999><pubmed>10619023</pubmed></ref><ref name=Yoshida1998><pubmed>9753321</pubmed></ref>。また、放射線や栄養因子除去といった内因性のアポトーシス刺激による細胞死実行に必要な分子として機能する<ref name=Riedl2007><pubmed>17377525</pubmed></ref>。 | ||
== 疾患との関わり == | == 疾患との関わり == | ||
内因性のアポトーシスの実行に必須の因子として、Apaf-1の不活性化は多くのヒトがん細胞で報告されている<ref name=Fadeel2008><pubmed>17975549</pubmed></ref> | 内因性のアポトーシスの実行に必須の因子として、Apaf-1の不活性化は多くのヒトがん細胞で報告されている<ref name=Fadeel2008><pubmed>17975549</pubmed></ref>。例えば、多くの転移性[[黒色腫]]ではApaf-1の発現が抑制されており、発現が抑制されている細胞は化学療法薬へと耐性になることが報告されている<ref name=Soengas2001><pubmed>11196646</pubmed></ref>。発現の抑制方法は明らかではないが、[[DNAメチル化]]阻害剤によってApaf-1の発現が回復したことから、[[エピジェネティック]]な制御の寄与が考えられている<ref name=Soengas2001><pubmed>11196646</pubmed></ref>。 | ||
== 関連語 == | == 関連語 == | ||
2025年8月14日 (木) 11:10時点における最新版
三浦 正幸、篠田 夏樹
東京大学大学院薬学系研究科 遺伝学教室
DOI:10.14931/bsd.11180 原稿受付日:2025年2月28日 原稿完成日:2025年8月13日
担当編集委員:林 康紀(京都大学大学院医学研究科 システム神経薬理学分野)
英語名:Apoptotic protease activating factor 1
略称:Apaf-1
哺乳類細胞では放射線や、栄養因子除去によってアポトーシス経路が活性化されるとミトコンドリア膜間腔からシトクロムcが細胞質ゾルに漏出する。Apoptotic protease activating factor 1 (Apaf-1) は放出されたシトクロムcと結合するとヌクレオチド交換が引き起こされ, 結合していたADP/dADPがATP/dATPに置換される。このアポトソームにプロカスパーゼ-9がリクルートされることによって活性化され、活性型カスパーゼ-9は、プロカスパーゼ-3や7を切断することによって活性化させる。活性型カスパーゼ-3や7は広範な基質の切断を介してアポトーシスを実行する。このアポトーシス実行経路は内因性経路と呼ばれる。
アポトーシスプロテアーゼ活性化因子-1とは
H. EllisとH.R. Horvitzは線虫C. elegansを用いた遺伝学的スクリーニングによって全てのプログラム細胞死実行に必要な遺伝子としてced-3とced-4を同定した。後の研究によってCed-3はカスパーゼであることが分った[1]。J. YuanとH.R. Horvitzはced-4遺伝子のクローニングを行いその一次配列を決定したが、Ced-4が他の生物でも保存されているかについては予測ができなかった[2]。
X. Wangらは生化学的な分画が可能なin vitro細胞死アッセイ系を作りアポトーシス経路に関わる分子の同定を進めた。このアッセイ系はHeLa細胞の細胞質抽出液にハムスターの肝臓からとった核を入れ、deoxyadenosine triphosphate (dATP)を加えるとカスパーゼ-3の活性化とアポトーシスに特徴的なDNAの断片化が起こるというものである[3]。このアッセイ系で細胞質抽出液を分画し、dATP依存的にカスパーゼ3の活性化に必要な3つのApoptotic protease activating factor (Apaf)を同定した。遺伝子クローニングの結果、Apaf-1はCED-4哺乳類ホモログ[4]、Apaf-2はシトクロムc[3] [3]、Apaf-3はカスパーゼ9であった[5]。
この研究によって内因性のアポトーシス実行経路が明らかになった。進化的にCed-4/Apaf-1が保存されているかのさらなる検討がショウジョウバエを用いてなされ、Dark/HAC-1/Dapaf-1が同定された。この遺伝子は発生や放射線で誘導されるアポトーシスに必要であることが示された[6][7][8]。
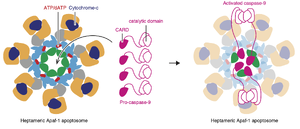
アポトソーム形成の結果、プロカスパーゼ9が活性化され、アポトーシスが起こる。
構造
ヒトApaf-1はN末端側からcaspase recruitment domain (CARD)、α/β nucleotide-binding domain (NBD) とhelical domain 1 (HD1)、及びwinged helix domain (WHD) からなるnucleotide-dependent oligomerization domain (NOD)、それに続くhelical domain 2 (HD2)、そしてC末端側のWD40リピートからなる2つのβ-propellerドメインからなる(図1)。CARDはプロカスパーゼ9のCARDとの相互作用を介して結合し、NODはNBD-HD1界面においてADPまたはATP/dATPと結合し、β-propellerドメインはシトクロムcと結合する[9](図1)。通常、Apaf-1はADPと結合した不活性な単量体として存在する。ミトコンドリア膜間腔から漏出したシトクロムcと結合し、さらにADPがATP/dATPに置き換わることで構造が変化し、7量体からなるアポトソームを形成する[10][11](図2)。
ショウジョウバエのオルソログであるDark/HAC-1/Dapaf-1は同様のドメイン構造を有するが、線虫のオルソログであるCED-4では2つのβ-propellerドメインを欠いている(図1)。選択的スプライシングによりβ-propellerドメインを欠失したアイソフォームがマウス (Apaf-1S) 及びショウジョウバエ (Dapaf-1S) で報告されている。Dapaf-1Sアイソフォームの過剰発現はカスパーゼを活性化できる[8]。
発現
ヒトではApaf-1は全身性に低く発現しているが、骨髄で相対的に高い発現を示す。細胞内ではApaf-1は細胞質に局在し、アポトーシス刺激においてその局在が変化することはない[12]。ただし、化学療法抵抗性のRajiバーキットリンパ腫細胞株ではApaf-1が形質膜へと局在することが報告されている[13]。
神経細胞では分化や成熟によってApaf-1の発現が減少し、シトクロムcの細胞質ゾルへの漏出依存的なアポトーシスに抵抗性になることが報告されている[14][15]。
DNA傷害依存的な細胞死誘導条件においては、Apaf-1は転写因子p53によって転写誘導されることが報告されている[16]。また、Apaf-1は転写因子E2Fによっても転写誘導される[17]。Apaf-1の5’UTRにはinternal ribosome entry site (IRES) が存在する[18]。アポトーシス条件においてキャップ依存的な翻訳が抑制されることから、このIRESによってアポトーシス条件においてもApaf-1の発現が維持されると考えられている。
機能
哺乳類ではアポトーシス刺激によってミトコンドリアから細胞質に漏出したシトクロムcがApaf-1にATP/dATP依存的にと結合し7量体からなるアポトソームを形成する(図2)。さらにプロカスパーゼ9が互いのCARDドメインを介してアポトソームにリクルートされる。プロカスパーゼ9はアポトソームが形成されると活性化される[19]。Apaf-1アポトソームでのApaf-1とプロカスパーゼ9との量比はおよそ7:4であり[20]、1つから2つのカスパーゼ9の2量体 (活性化型) を含むと考えられている[10](図2)。また、ミトコンドリア膜透過性遷移が生じた際には、カスパーゼ4とApaf-1がApaf-1パイロソームと呼ばれるタンパク質複合体を形成し、パイロトーシスを誘導する[21]。
ショウジョウバエDark/HAC-1/Dapaf-1もApaf-1と同様にシトクロムcと結合するβ-propellerドメインを有しシトクロムcと結合できるが[8]、8量体からなるアポトソームの形成にシトクロムcは不要である[22][23][24][25]。
自己不活性型Dark単量体はプロDroncと会合することによってアポトソームを形成して、プロDroncを活性化することが示唆されている[26]。線虫のCed-4は8量体を形成し、そこに2分子のCed-3が入り活性化すると考えられている[27]。ショウジョウバエの全てのプログラム細胞死、ショウジョウバエ、マウスでは発生でおこるアポトーシスの殆どはApaf-1を必要としている[6][7][8][28]。また、放射線や栄養因子除去といった内因性のアポトーシス刺激による細胞死実行に必要な分子として機能する[9]。
疾患との関わり
内因性のアポトーシスの実行に必須の因子として、Apaf-1の不活性化は多くのヒトがん細胞で報告されている[29]。例えば、多くの転移性黒色腫ではApaf-1の発現が抑制されており、発現が抑制されている細胞は化学療法薬へと耐性になることが報告されている[30]。発現の抑制方法は明らかではないが、DNAメチル化阻害剤によってApaf-1の発現が回復したことから、エピジェネティックな制御の寄与が考えられている[30]。
関連語
参考文献
- ↑
Ellis, H.M., & Horvitz, H.R. (1986).
Genetic control of programmed cell death in the nematode C. elegans. Cell, 44(6), 817-29. [PubMed:3955651] [WorldCat] [DOI] - ↑
Yuan, J., & Horvitz, H.R. (1992).
The Caenorhabditis elegans cell death gene ced-4 encodes a novel protein and is expressed during the period of extensive programmed cell death. Development (Cambridge, England), 116(2), 309-20. [PubMed:1286611] [WorldCat] [DOI] - ↑ 3.0 3.1
Liu, X., Kim, C.N., Yang, J., Jemmerson, R., & Wang, X. (1996).
Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell, 86(1), 147-57. [PubMed:8689682] [WorldCat] [DOI] - ↑
Zou, H., Henzel, W.J., Liu, X., Lutschg, A., & Wang, X. (1997).
Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome c-dependent activation of caspase-3. Cell, 90(3), 405-13. [PubMed:9267021] [WorldCat] [DOI] - ↑
Li, P., Nijhawan, D., Budihardjo, I., Srinivasula, S.M., Ahmad, M., Alnemri, E.S., & Wang, X. (1997).
Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell, 91(4), 479-89. [PubMed:9390557] [WorldCat] [DOI] - ↑ 6.0 6.1
Rodriguez, A., Oliver, H., Zou, H., Chen, P., Wang, X., & Abrams, J.M. (1999).
Dark is a Drosophila homologue of Apaf-1/CED-4 and functions in an evolutionarily conserved death pathway. Nature cell biology, 1(5), 272-9. [PubMed:10559939] [WorldCat] [DOI] - ↑ 7.0 7.1
Zhou, L., Song, Z., Tittel, J., & Steller, H. (1999).
HAC-1, a Drosophila homolog of APAF-1 and CED-4 functions in developmental and radiation-induced apoptosis. Molecular cell, 4(5), 745-55. [PubMed:10619022] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Kanuka, H., Sawamoto, K., Inohara, N., Matsuno, K., Okano, H., & Miura, M. (1999).
Control of the cell death pathway by Dapaf-1, a Drosophila Apaf-1/CED-4-related caspase activator. Molecular cell, 4(5), 757-69. [PubMed:10619023] [WorldCat] [DOI] - ↑ 9.0 9.1
Riedl, S.J., & Salvesen, G.S. (2007).
The apoptosome: signalling platform of cell death. Nature reviews. Molecular cell biology, 8(5), 405-13. [PubMed:17377525] [WorldCat] [DOI] - ↑ 10.0 10.1
Cheng, T.C., Hong, C., Akey, I.V., Yuan, S., & Akey, C.W. (2016).
A near atomic structure of the active human apoptosome. eLife, 5. [PubMed:27697150] [PMC] [WorldCat] [DOI] - ↑
Dorstyn, L., Akey, C.W., & Kumar, S. (2018).
New insights into apoptosome structure and function. Cell death and differentiation, 25(7), 1194-1208. [PubMed:29765111] [PMC] [WorldCat] [DOI] - ↑
Hausmann, G., O'Reilly, L.A., van Driel, R., Beaumont, J.G., Strasser, A., Adams, J.M., & Huang, D.C. (2000).
Pro-apoptotic apoptosis protease-activating factor 1 (Apaf-1) has a cytoplasmic localization distinct from Bcl-2 or Bcl-x(L). The Journal of cell biology, 149(3), 623-34. [PubMed:10791976] [PMC] [WorldCat] [DOI] - ↑
Sun, Y., Orrenius, S., Pervaiz, S., & Fadeel, B. (2005).
Plasma membrane sequestration of apoptotic protease-activating factor-1 in human B-lymphoma cells: a novel mechanism of chemoresistance. Blood, 105(10), 4070-7. [PubMed:15692060] [WorldCat] [DOI] - ↑
Wright, K.M., Linhoff, M.W., Potts, P.R., & Deshmukh, M. (2004).
Decreased apoptosome activity with neuronal differentiation sets the threshold for strict IAP regulation of apoptosis. The Journal of cell biology, 167(2), 303-13. [PubMed:15504912] [PMC] [WorldCat] [DOI] - ↑
Johnson, C.E., Huang, Y.Y., Parrish, A.B., Smith, M.I., Vaughn, A.E., Zhang, Q., ..., & Deshmukh, M. (2007).
Differential Apaf-1 levels allow cytochrome c to induce apoptosis in brain tumors but not in normal neural tissues. Proceedings of the National Academy of Sciences of the United States of America, 104(52), 20820-5. [PubMed:18093951] [PMC] [WorldCat] [DOI] - ↑
Fortin, A., Cregan, S.P., MacLaurin, J.G., Kushwaha, N., Hickman, E.S., Thompson, C.S., ..., & Slack, R.S. (2001).
APAF1 is a key transcriptional target for p53 in the regulation of neuronal cell death. The Journal of cell biology, 155(2), 207-16. [PubMed:11591730] [PMC] [WorldCat] [DOI] - ↑
Moroni, M.C., Hickman, E.S., Lazzerini Denchi, E., Caprara, G., Colli, E., Cecconi, F., ..., & Helin, K. (2001).
Apaf-1 is a transcriptional target for E2F and p53. Nature cell biology, 3(6), 552-8. [PubMed:11389439] [WorldCat] [DOI] - ↑
Coldwell, M.J., Mitchell, S.A., Stoneley, M., MacFarlane, M., & Willis, A.E. (2000).
Initiation of Apaf-1 translation by internal ribosome entry. Oncogene, 19(7), 899-905. [PubMed:10702798] [WorldCat] [DOI] - ↑
Yuan, S., Yu, X., Topf, M., Ludtke, S.J., Wang, X., & Akey, C.W. (2010).
Structure of an apoptosome-procaspase-9 CARD complex. Structure (London, England : 1993), 18(5), 571-83. [PubMed:20462491] [PMC] [WorldCat] [DOI] - ↑
Hu, Q., Wu, D., Chen, W., Yan, Z., Yan, C., He, T., ..., & Shi, Y. (2014).
Molecular determinants of caspase-9 activation by the Apaf-1 apoptosome. Proceedings of the National Academy of Sciences of the United States of America, 111(46), 16254-61. [PubMed:25313070] [PMC] [WorldCat] [DOI] - ↑
Xu, W., Che, Y., Zhang, Q., Huang, H., Ding, C., Wang, Y., ..., & Hao, H. (2021).
Apaf-1 Pyroptosome Senses Mitochondrial Permeability Transition. Cell metabolism, 33(2), 424-436.e10. [PubMed:33308446] [WorldCat] [DOI] - ↑
Yuan, S., Yu, X., Topf, M., Dorstyn, L., Kumar, S., Ludtke, S.J., & Akey, C.W. (2011).
Structure of the Drosophila apoptosome at 6.9 å resolution. Structure (London, England : 1993), 19(1), 128-40. [PubMed:21220123] [PMC] [WorldCat] [DOI] - ↑
Dorstyn, L., Mills, K., Lazebnik, Y., & Kumar, S. (2004).
The two cytochrome c species, DC3 and DC4, are not required for caspase activation and apoptosis in Drosophila cells. The Journal of cell biology, 167(3), 405-10. [PubMed:15533997] [PMC] [WorldCat] [DOI] - ↑
Dorstyn, L., Read, S., Cakouros, D., Huh, J.R., Hay, B.A., & Kumar, S. (2002).
The role of cytochrome c in caspase activation in Drosophila melanogaster cells. The Journal of cell biology, 156(6), 1089-98. [PubMed:11901173] [PMC] [WorldCat] [DOI] - ↑
Yu, X., Wang, L., Acehan, D., Wang, X., & Akey, C.W. (2006).
Three-dimensional structure of a double apoptosome formed by the Drosophila Apaf-1 related killer. Journal of molecular biology, 355(3), 577-89. [PubMed:16310803] [WorldCat] [DOI] - ↑
Tian, L., Li, Y., & Shi, Y. (2024).
Dark and Dronc activation in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America, 121(9), e2312784121. [PubMed:38381783] [PMC] [WorldCat] [DOI] - ↑
Qi, S., Pang, Y., Hu, Q., Liu, Q., Li, H., Zhou, Y., ..., & Shi, Y. (2010).
Crystal structure of the Caenorhabditis elegans apoptosome reveals an octameric assembly of CED-4. Cell, 141(3), 446-57. [PubMed:20434985] [WorldCat] [DOI] - ↑
Yoshida, H., Kong, Y.Y., Yoshida, R., Elia, A.J., Hakem, A., Hakem, R., ..., & Mak, T.W. (1998).
Apaf1 is required for mitochondrial pathways of apoptosis and brain development. Cell, 94(6), 739-50. [PubMed:9753321] [WorldCat] [DOI] - ↑
Fadeel, B., Ottosson, A., & Pervaiz, S. (2008).
Big wheel keeps on turning: apoptosome regulation and its role in chemoresistance. Cell death and differentiation, 15(3), 443-52. [PubMed:17975549] [WorldCat] [DOI] - ↑ 30.0 30.1
Soengas, M.S., Capodieci, P., Polsky, D., Mora, J., Esteller, M., Opitz-Araya, X., ..., & Lowe, S.W. (2001).
Inactivation of the apoptosis effector Apaf-1 in malignant melanoma. Nature, 409(6817), 207-11. [PubMed:11196646] [WorldCat] [DOI]