「テスト」の版間の差分
細編集の要約なし |
|||
| 1行目: | 1行目: | ||
====βセクレターゼ、γセクレターゼ==== | ====βセクレターゼ、γセクレターゼ==== | ||
APP蛋白質は、まず管腔外(AβのN末端側)でβセクレターゼ、続いて膜貫通部位(AβのC末端側)でγセクレターゼによって切断されることによりAβが産生される。 βセクレターゼの正体は[[β-site APP cleaving enzyme 1]]([[BACE1]])という1回膜貫通型の[[アスパラギン酸プロテアーゼ]]である。γセクレターゼは、原因遺伝子としての''PSEN1''、''PSEN2''の発見により9回膜貫通型蛋白質のプレセニリンがγセクレターゼの活性中心を構成することがわかったが、プレセニリン単独では活性を持たず、[[ニカストリン]]、[[Aph-1]]、[[Pen-2]]とともに4量体を形成することによって初めて活性を持つことが分かった。γセクレターゼによってAβ40、Aβ42が産生されるが、''PSEN''の変異の中には総Aβ産生が上昇したり、凝集性の高いAβ42の産生比率を増大させるものがあるが、全ての変異について同様の効果が証明されているわけではない。γセクレターゼの切断は段階的切断(sequential cleavage)様式をとることが示されており、[[Aβ49]]→[[Aβ46]]→[[Aβ43]]→Aβ40と[[Aβ48]]→[[Aβ45]]→Aβ42→[[Aβ38]]という、3ペプチドごとに切断する(Aβ42→Aβ38のみ4ペプチド)2つの系列があることが推測されている<ref><pubmed> 19828817 </pubmed></ref>。Aβ42とAβ40の産生比率の違いが病態に関係すると考えられてきたが、トリペプチド仮説により酵素側だけでなく基質側にも関心が集まっている。 | APP蛋白質は、まず管腔外(AβのN末端側)でβセクレターゼ、続いて膜貫通部位(AβのC末端側)でγセクレターゼによって切断されることによりAβが産生される。 βセクレターゼの正体は[[β-site APP cleaving enzyme 1]]([[BACE1]])という1回膜貫通型の[[アスパラギン酸プロテアーゼ]]である。γセクレターゼは、原因遺伝子としての''PSEN1''、''PSEN2''の発見により9回膜貫通型蛋白質のプレセニリンがγセクレターゼの活性中心を構成することがわかったが、プレセニリン単独では活性を持たず、[[ニカストリン]]、[[Aph-1]]、[[Pen-2]]とともに4量体を形成することによって初めて活性を持つことが分かった。γセクレターゼによってAβ40、Aβ42が産生されるが、''PSEN''の変異の中には総Aβ産生が上昇したり、凝集性の高いAβ42の産生比率を増大させるものがあるが、全ての変異について同様の効果が証明されているわけではない。γセクレターゼの切断は段階的切断(sequential cleavage)様式をとることが示されており、[[Aβ49]]→[[Aβ46]]→[[Aβ43]]→Aβ40と[[Aβ48]]→[[Aβ45]]→Aβ42→[[Aβ38]]という、3ペプチドごとに切断する(Aβ42→Aβ38のみ4ペプチド)2つの系列があることが推測されている<ref><pubmed> 19828817 </pubmed></ref>。Aβ42とAβ40の産生比率の違いが病態に関係すると考えられてきたが、トリペプチド仮説により酵素側だけでなく基質側にも関心が集まっている。 | ||
===病態機序の仮説=== | |||
====アセチルコリン仮説==== | |||
分子生物学的手法の導入される前の1970年代の研究により、AD患者脳では、大脳の各部位で[[アセチルコリン#生合成|コリンアセチル転移酵素]] ([[[アセチルコリン#生合成|choline acetyltransferase]])の活性低下が観察された。また投射元の大脳基底部(主に[[マイネルト核]])の[[コリン]]作動性神経細胞の減少が示され、この減少こそが病態の中心であるとの説である。1990年前後から[[アセチルコリン]]仮説に基づきAD治療薬としてアセチルコリンを増加させる作用の[[アセチルコリン#代謝、分解|アセチルコリンエステラーゼ]][[阻害剤]]が開発された。現在では病態の本流ではなく、下流の現象であると考えられている。 | |||
====アミロイドカスケード仮説==== | |||
AD脳ではAβとタウの両方の蓄積を認めることから、どちらが先に起こる現象か、どちらが病態の中心にあるか、長年議論があった(”BAPtists” vs “TAUists”)。正常高齢者の病理学的な検討から、Aβの蓄積は認めるが神経原線維変化を認めない症例があること(逆の症例はない)、家族性ADの家系からAβ産生に関係する''APP''、''PSEN1''、''PSEN2''の変異が見つかったことから、Aβが上流であると考えられるようになった。 | |||
アミロイドカスケード仮説とは、 | |||
#''APP''や''PSEN1''、''PSEN2''の変異により、 | |||
#Aβ42の産生と蓄積が増加し、 | |||
#Aβのオリゴマー化と沈着が起こり、 | |||
#Aβオリゴマーのシナプスへの毒性が惹起され、 | |||
#シナプスや神経細胞傷害が起こり、 | |||
#神経細胞内で恒常性が変化し、 | |||
#キナーゼ活性が変化し、 | |||
#神経原線維変化を生じ、 | |||
#同時に神経細胞・神経突起の機能障害と遂には神経細胞死が起こり、 | |||
#認知症を生じる | |||
という仮説である<ref><pubmed> 12130773 </pubmed></ref>。タウの毒性発揮には必ずしも神経原線維変化を伴わないと考えられており(神経原線維変化はむしろ保護的に働くと考えらえている)、8.は脇道である。 | |||
孤発性ADをこの仮説に則って説明するために、孤発性ADでも何らかの要因によるAβの産生上昇、Aβ42比率の上昇、Aβのクリアランスの低下が想定されている。''APP''にAD抵抗性変異が見つかり、その変異はAβ産生を減少させる効果があることは、この仮説を支持するデータである。また、ADのモデルであるAPP[[トランスジェニックマウス]]でも、タウをノックアウトするとAβの蓄積があるにも関わらず認知機能障害が起こらなくなることも、ADの病態においてタウがAPPの下流にあることを支持する<ref><pubmed> 17478722 </pubmed></ref>。 | |||
現在開発過程にあるADの病態に作用する疾患修飾薬(根本治療薬)の多くは、この仮説に基づいてAβの産生や蓄積に焦点を当てて開発されたものである。 | |||
====オリゴマー仮説==== | |||
Aβの細胞外への分泌は生理的状況でも行われており、主には[[ネプリライシン]]によりAβが分解されることによって平衡状態が保たれている。何らかの要因で過剰となった可溶性Aβは、最終的にミスフォールドされた不溶性の高い凝集体(老人斑)を形成する。アミロイドカスケード仮説が広く信じられるようになっても、この過程のどのAβ種が毒性発揮するかは謎のままであったが、Aβオリゴマーとモノマーを含むが線維体を含まない培養上清をラットの海馬に打ち込んだところ[[長期増強]]([[LTP]])が抑制されることを示した報告<ref><pubmed> 11932745 </pubmed></ref>以降、Aβオリゴマーの毒性を示した研究が相次ぎ、「Aβオリゴマーこそが毒性発揮の中心的役割を担う」と考えられるようになった。日本人の家族性認知症家系で同定された''APP'' E693Δ変異(Aβ配列内の22番目アミノ酸Eの欠失)は、臨床的にアミロイドPETで検出されたAβ沈着はごくわずかであり、培養細胞レベルではAβの分泌は著明に減る(細胞内に貯留する)が、線維体を形成せず主にダイマー~テトラマーを含むオリゴマーの形成が顕著に促進されることが示された<ref><pubmed> 18300294 </pubmed></ref>。またこの変異を有するAPP[[トランスジェニックマウス]]においても老人斑を形成しないが記憶障害を生じ、[[シナプス]]の変性やタウのリン酸化やグリオーシスや神経細胞死が生じていることが示された<ref><pubmed> 20371804 </pubmed></ref>。これはADの病態におけるオリゴマー化の重要性を支持するデータである。 | |||
この仮説に基づいてオリゴマーを標的とした創薬も行われている。 | |||
==バイオマーカーとpreclinical AD== | |||
[[バイオマーカー]]とは疾患の病態(病理変化)を反映する定量的な指標を意味する。診断や病期のステージングに用いられる。 | |||
体液バイオマーカーには、ADの二つの特徴的な微細構造物、老人斑と神経原線維変化を反映するものとして、[[脳脊髄液]](cerebrospinal fluid, CSF)Aβとタウが用いられる。Aβの蓄積が始まるとCSF中のAβ42が減少し、Aβ42/40比率が低下する。また、タウの変化が始まるとCSF中の総タウ、リン酸化タウが上昇する。総タウは他疾患でも上昇するが、リン酸化タウの上昇はADに特異性が高い。血漿や血清AβではCSFを超える感度・特異度は得られていない。また画像バイオマーカーとしては、Aβ凝集を検出するアミロイドPET、シナプス機能障害を表す機能MRI、神経細胞傷害を反映した糖代謝低下を検出するFDG-PET、神経細胞死を反映する構造的MRIによる海馬や側頭葉の容積定量が挙げられる。 | |||
アミロイドカスケード仮説に基づくと、バイオマーカーの変化は、 | |||
#脳内アミロイド沈着〔CSF Aβ、アミロイドPET〕 | |||
#シナプスおよび神経細胞機能不全〔FDG-PET、機能的MRI〕 | |||
#タウによる神経変性〔CSFタウ〕 | |||
#神経細胞死・脳萎縮〔構造的MRI〕 | |||
#認知機能障害 | |||
#全般機能障害 | |||
の順で出現すると考えられており<ref><pubmed> 20083042 </pubmed></ref>、家族性ADの未発症保因者の観察研究から概ね正しいことが示されている<ref><pubmed> 22784036 </pubmed></ref>。 | |||
Aβ沈着が始まってから認知症発症まで15年前後の時間差があることが推測されている。このようにバイオマーカー変化は症状に先立って出現することが示されており、2011年のNIA-AAの診断基準改訂の際に、 Aβ沈着を示唆するバイオマーカーデータを認めるが認知機能は正常あるいはMCIとは言えない程度の軽微な障害のみである段階として、「preclinical AD」という診断区分が研究目的のみに利用が制限されるものとして提言されている<ref><pubmed> 21514248 </pubmed></ref>。 | |||
健常高齢者におけるpreclinical ADの割合は、オーストラリアの大規模観察研究(Australian Imaging, Biomarkers and Lifestyle, AIBL)によると、177例の60歳以上の認知機能健常者のうち33%がPiBを用いたアミロイドPET陽性であり、60代では18%だが80歳以上では65%に上ることが示されている<ref><pubmed> 20472326 </pubmed></ref>。日本でもJapanese Alzheimer's Disease Neuroimaging Initiative(J-ADNI)という観察研究が施行されており、60歳以上のアミロイド沈着バイオマーカー陽性率は20数%と目されている。疾患修飾薬の治験の失敗から、疾患修飾薬による治療介入は病理変化が少ない段階ほど効果を得やすいと考えられてきている。その点でpreclinical ADという病期は良い対象であり、2013年中の開始を目指してpreclinical ADを対象とした治験が計画されている。 | |||
==治療== | |||
疾患修飾薬と症状改善薬に区別して述べる。 | |||
===症状改善薬=== | |||
症状改善薬は症状を緩和する効果はあるが、病態の進行を抑制しない薬を指す。多くはアセチルコリン仮説に基づいて創薬された薬物で、コリン作動性のものが多い。アセチルコリンエステラーゼ阻害剤の[[ドネペジル]]、[[ガランタミン]]、[[リバスチグミン]]、[[NMDA型グルタミン酸受容体]][[アンタゴニスト]]の[[メマンチン]]が上市されている他、アセチルコリン受容体部分アゴニストや[[セロトニン]]受容体アンタゴニストが臨床開発段階にある。 | |||
===疾患修飾薬=== | |||
[[ファイル:Ryokoihara-Fig2.png|thumb|350px|'''図2.アミロイドカスケード仮説とそれに基づいた創薬''']] 疾患修飾薬は病態の進行そのものを抑制あるいは遅らせる薬である。アミロイドカスケード仮説に基づいた研究開発が盛んになされている。Aβの産生抑制、Aβのクリアランス促進、蓄積したAβの除去、Aβが惹起する神経毒性からの神経細胞保護、タウを介した毒性の抑制といった作用を狙った創薬である。残念ながら2013年現在までに第III相試験が成功した薬はないが、以下これまでに[[wikipedia:ja:臨床治験|臨床治験]]に入った薬物について述べる。 | |||
*'''Aβ産生阻害''' | *'''Aβ産生阻害''' | ||
: γセクレターゼ阻害剤は基質である[[Notch]]を介した重大な副作用のため開発が中止され、総Aβ中のAβ42の比率を低下させるγセクレターゼ修飾薬も開発が中断されている。脳内移行性やbioavailabilityの低さへの対策からγセクレターゼより遅れたが、BACE1阻害剤が臨床開発段階にある。BACE1の全ての基質は十分に明らかになっていないが、BACE1をノックアウトしても重大な形態・機能異常を認めないことから、γセクレターゼ阻害剤ほどの副作用は出現しないと期待されている。 | : γセクレターゼ阻害剤は基質である[[Notch]]を介した重大な副作用のため開発が中止され、総Aβ中のAβ42の比率を低下させるγセクレターゼ修飾薬も開発が中断されている。脳内移行性やbioavailabilityの低さへの対策からγセクレターゼより遅れたが、BACE1阻害剤が臨床開発段階にある。BACE1の全ての基質は十分に明らかになっていないが、BACE1をノックアウトしても重大な形態・機能異常を認めないことから、γセクレターゼ阻害剤ほどの副作用は出現しないと期待されている。 | ||
2013年5月11日 (土) 15:09時点における版
βセクレターゼ、γセクレターゼ
APP蛋白質は、まず管腔外(AβのN末端側)でβセクレターゼ、続いて膜貫通部位(AβのC末端側)でγセクレターゼによって切断されることによりAβが産生される。 βセクレターゼの正体はβ-site APP cleaving enzyme 1(BACE1)という1回膜貫通型のアスパラギン酸プロテアーゼである。γセクレターゼは、原因遺伝子としてのPSEN1、PSEN2の発見により9回膜貫通型蛋白質のプレセニリンがγセクレターゼの活性中心を構成することがわかったが、プレセニリン単独では活性を持たず、ニカストリン、Aph-1、Pen-2とともに4量体を形成することによって初めて活性を持つことが分かった。γセクレターゼによってAβ40、Aβ42が産生されるが、PSENの変異の中には総Aβ産生が上昇したり、凝集性の高いAβ42の産生比率を増大させるものがあるが、全ての変異について同様の効果が証明されているわけではない。γセクレターゼの切断は段階的切断(sequential cleavage)様式をとることが示されており、Aβ49→Aβ46→Aβ43→Aβ40とAβ48→Aβ45→Aβ42→Aβ38という、3ペプチドごとに切断する(Aβ42→Aβ38のみ4ペプチド)2つの系列があることが推測されている[1]。Aβ42とAβ40の産生比率の違いが病態に関係すると考えられてきたが、トリペプチド仮説により酵素側だけでなく基質側にも関心が集まっている。
病態機序の仮説
アセチルコリン仮説
分子生物学的手法の導入される前の1970年代の研究により、AD患者脳では、大脳の各部位でコリンアセチル転移酵素 ([[[アセチルコリン#生合成|choline acetyltransferase]])の活性低下が観察された。また投射元の大脳基底部(主にマイネルト核)のコリン作動性神経細胞の減少が示され、この減少こそが病態の中心であるとの説である。1990年前後からアセチルコリン仮説に基づきAD治療薬としてアセチルコリンを増加させる作用のアセチルコリンエステラーゼ阻害剤が開発された。現在では病態の本流ではなく、下流の現象であると考えられている。
アミロイドカスケード仮説
AD脳ではAβとタウの両方の蓄積を認めることから、どちらが先に起こる現象か、どちらが病態の中心にあるか、長年議論があった(”BAPtists” vs “TAUists”)。正常高齢者の病理学的な検討から、Aβの蓄積は認めるが神経原線維変化を認めない症例があること(逆の症例はない)、家族性ADの家系からAβ産生に関係するAPP、PSEN1、PSEN2の変異が見つかったことから、Aβが上流であると考えられるようになった。
アミロイドカスケード仮説とは、
- APPやPSEN1、PSEN2の変異により、
- Aβ42の産生と蓄積が増加し、
- Aβのオリゴマー化と沈着が起こり、
- Aβオリゴマーのシナプスへの毒性が惹起され、
- シナプスや神経細胞傷害が起こり、
- 神経細胞内で恒常性が変化し、
- キナーゼ活性が変化し、
- 神経原線維変化を生じ、
- 同時に神経細胞・神経突起の機能障害と遂には神経細胞死が起こり、
- 認知症を生じる
という仮説である[2]。タウの毒性発揮には必ずしも神経原線維変化を伴わないと考えられており(神経原線維変化はむしろ保護的に働くと考えらえている)、8.は脇道である。
孤発性ADをこの仮説に則って説明するために、孤発性ADでも何らかの要因によるAβの産生上昇、Aβ42比率の上昇、Aβのクリアランスの低下が想定されている。APPにAD抵抗性変異が見つかり、その変異はAβ産生を減少させる効果があることは、この仮説を支持するデータである。また、ADのモデルであるAPPトランスジェニックマウスでも、タウをノックアウトするとAβの蓄積があるにも関わらず認知機能障害が起こらなくなることも、ADの病態においてタウがAPPの下流にあることを支持する[3]。
現在開発過程にあるADの病態に作用する疾患修飾薬(根本治療薬)の多くは、この仮説に基づいてAβの産生や蓄積に焦点を当てて開発されたものである。
オリゴマー仮説
Aβの細胞外への分泌は生理的状況でも行われており、主にはネプリライシンによりAβが分解されることによって平衡状態が保たれている。何らかの要因で過剰となった可溶性Aβは、最終的にミスフォールドされた不溶性の高い凝集体(老人斑)を形成する。アミロイドカスケード仮説が広く信じられるようになっても、この過程のどのAβ種が毒性発揮するかは謎のままであったが、Aβオリゴマーとモノマーを含むが線維体を含まない培養上清をラットの海馬に打ち込んだところ長期増強(LTP)が抑制されることを示した報告[4]以降、Aβオリゴマーの毒性を示した研究が相次ぎ、「Aβオリゴマーこそが毒性発揮の中心的役割を担う」と考えられるようになった。日本人の家族性認知症家系で同定されたAPP E693Δ変異(Aβ配列内の22番目アミノ酸Eの欠失)は、臨床的にアミロイドPETで検出されたAβ沈着はごくわずかであり、培養細胞レベルではAβの分泌は著明に減る(細胞内に貯留する)が、線維体を形成せず主にダイマー~テトラマーを含むオリゴマーの形成が顕著に促進されることが示された[5]。またこの変異を有するAPPトランスジェニックマウスにおいても老人斑を形成しないが記憶障害を生じ、シナプスの変性やタウのリン酸化やグリオーシスや神経細胞死が生じていることが示された[6]。これはADの病態におけるオリゴマー化の重要性を支持するデータである。
この仮説に基づいてオリゴマーを標的とした創薬も行われている。
バイオマーカーとpreclinical AD
バイオマーカーとは疾患の病態(病理変化)を反映する定量的な指標を意味する。診断や病期のステージングに用いられる。
体液バイオマーカーには、ADの二つの特徴的な微細構造物、老人斑と神経原線維変化を反映するものとして、脳脊髄液(cerebrospinal fluid, CSF)Aβとタウが用いられる。Aβの蓄積が始まるとCSF中のAβ42が減少し、Aβ42/40比率が低下する。また、タウの変化が始まるとCSF中の総タウ、リン酸化タウが上昇する。総タウは他疾患でも上昇するが、リン酸化タウの上昇はADに特異性が高い。血漿や血清AβではCSFを超える感度・特異度は得られていない。また画像バイオマーカーとしては、Aβ凝集を検出するアミロイドPET、シナプス機能障害を表す機能MRI、神経細胞傷害を反映した糖代謝低下を検出するFDG-PET、神経細胞死を反映する構造的MRIによる海馬や側頭葉の容積定量が挙げられる。
アミロイドカスケード仮説に基づくと、バイオマーカーの変化は、
- 脳内アミロイド沈着〔CSF Aβ、アミロイドPET〕
- シナプスおよび神経細胞機能不全〔FDG-PET、機能的MRI〕
- タウによる神経変性〔CSFタウ〕
- 神経細胞死・脳萎縮〔構造的MRI〕
- 認知機能障害
- 全般機能障害
の順で出現すると考えられており[7]、家族性ADの未発症保因者の観察研究から概ね正しいことが示されている[8]。
Aβ沈着が始まってから認知症発症まで15年前後の時間差があることが推測されている。このようにバイオマーカー変化は症状に先立って出現することが示されており、2011年のNIA-AAの診断基準改訂の際に、 Aβ沈着を示唆するバイオマーカーデータを認めるが認知機能は正常あるいはMCIとは言えない程度の軽微な障害のみである段階として、「preclinical AD」という診断区分が研究目的のみに利用が制限されるものとして提言されている[9]。
健常高齢者におけるpreclinical ADの割合は、オーストラリアの大規模観察研究(Australian Imaging, Biomarkers and Lifestyle, AIBL)によると、177例の60歳以上の認知機能健常者のうち33%がPiBを用いたアミロイドPET陽性であり、60代では18%だが80歳以上では65%に上ることが示されている[10]。日本でもJapanese Alzheimer's Disease Neuroimaging Initiative(J-ADNI)という観察研究が施行されており、60歳以上のアミロイド沈着バイオマーカー陽性率は20数%と目されている。疾患修飾薬の治験の失敗から、疾患修飾薬による治療介入は病理変化が少ない段階ほど効果を得やすいと考えられてきている。その点でpreclinical ADという病期は良い対象であり、2013年中の開始を目指してpreclinical ADを対象とした治験が計画されている。
治療
疾患修飾薬と症状改善薬に区別して述べる。
症状改善薬
症状改善薬は症状を緩和する効果はあるが、病態の進行を抑制しない薬を指す。多くはアセチルコリン仮説に基づいて創薬された薬物で、コリン作動性のものが多い。アセチルコリンエステラーゼ阻害剤のドネペジル、ガランタミン、リバスチグミン、NMDA型グルタミン酸受容体アンタゴニストのメマンチンが上市されている他、アセチルコリン受容体部分アゴニストやセロトニン受容体アンタゴニストが臨床開発段階にある。
疾患修飾薬
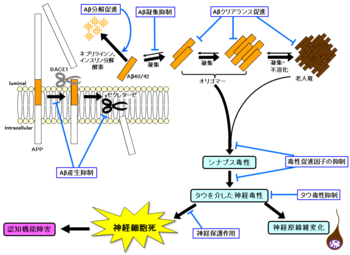
疾患修飾薬は病態の進行そのものを抑制あるいは遅らせる薬である。アミロイドカスケード仮説に基づいた研究開発が盛んになされている。Aβの産生抑制、Aβのクリアランス促進、蓄積したAβの除去、Aβが惹起する神経毒性からの神経細胞保護、タウを介した毒性の抑制といった作用を狙った創薬である。残念ながら2013年現在までに第III相試験が成功した薬はないが、以下これまでに臨床治験に入った薬物について述べる。
- Aβ産生阻害
- γセクレターゼ阻害剤は基質であるNotchを介した重大な副作用のため開発が中止され、総Aβ中のAβ42の比率を低下させるγセクレターゼ修飾薬も開発が中断されている。脳内移行性やbioavailabilityの低さへの対策からγセクレターゼより遅れたが、BACE1阻害剤が臨床開発段階にある。BACE1の全ての基質は十分に明らかになっていないが、BACE1をノックアウトしても重大な形態・機能異常を認めないことから、γセクレターゼ阻害剤ほどの副作用は出現しないと期待されている。
- ↑
Takami, M., Nagashima, Y., Sano, Y., Ishihara, S., Morishima-Kawashima, M., Funamoto, S., & Ihara, Y. (2009).
gamma-Secretase: successive tripeptide and tetrapeptide release from the transmembrane domain of beta-carboxyl terminal fragment. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(41), 13042-52. [PubMed:19828817] [PMC] [WorldCat] [DOI] - ↑
Hardy, J., & Selkoe, D.J. (2002).
The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science (New York, N.Y.), 297(5580), 353-6. [PubMed:12130773] [WorldCat] [DOI] - ↑
Roberson, E.D., Scearce-Levie, K., Palop, J.J., Yan, F., Cheng, I.H., Wu, T., ..., & Mucke, L. (2007).
Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer's disease mouse model. Science (New York, N.Y.), 316(5825), 750-4. [PubMed:17478722] [WorldCat] [DOI] - ↑
Walsh, D.M., Klyubin, I., Fadeeva, J.V., Cullen, W.K., Anwyl, R., Wolfe, M.S., ..., & Selkoe, D.J. (2002).
Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature, 416(6880), 535-9. [PubMed:11932745] [WorldCat] [DOI] - ↑
Tomiyama, T., Nagata, T., Shimada, H., Teraoka, R., Fukushima, A., Kanemitsu, H., ..., & Mori, H. (2008).
A new amyloid beta variant favoring oligomerization in Alzheimer's-type dementia. Annals of neurology, 63(3), 377-87. [PubMed:18300294] [WorldCat] [DOI] - ↑
Tomiyama, T., Matsuyama, S., Iso, H., Umeda, T., Takuma, H., Ohnishi, K., ..., & Mori, H. (2010).
A mouse model of amyloid beta oligomers: their contribution to synaptic alteration, abnormal tau phosphorylation, glial activation, and neuronal loss in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(14), 4845-56. [PubMed:20371804] [PMC] [WorldCat] [DOI] - ↑
Jack, C.R., Knopman, D.S., Jagust, W.J., Shaw, L.M., Aisen, P.S., Weiner, M.W., ..., & Trojanowski, J.Q. (2010).
Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade. The Lancet. Neurology, 9(1), 119-28. [PubMed:20083042] [PMC] [WorldCat] [DOI] - ↑
Bateman, R.J., Xiong, C., Benzinger, T.L., Fagan, A.M., Goate, A., Fox, N.C., ..., & Dominantly Inherited Alzheimer Network (2012).
Clinical and biomarker changes in dominantly inherited Alzheimer's disease. The New England journal of medicine, 367(9), 795-804. [PubMed:22784036] [PMC] [WorldCat] [DOI] - ↑
Sperling, R.A., Aisen, P.S., Beckett, L.A., Bennett, D.A., Craft, S., Fagan, A.M., ..., & Phelps, C.H. (2011).
Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer's & dementia : the journal of the Alzheimer's Association, 7(3), 280-92. [PubMed:21514248] [PMC] [WorldCat] [DOI] - ↑
Rowe, C.C., Ellis, K.A., Rimajova, M., Bourgeat, P., Pike, K.E., Jones, G., ..., & Villemagne, V.L. (2010).
Amyloid imaging results from the Australian Imaging, Biomarkers and Lifestyle (AIBL) study of aging. Neurobiology of aging, 31(8), 1275-83. [PubMed:20472326] [WorldCat] [DOI]