「SYNGAP1」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 11行目: | 11行目: | ||
{{box|text= SYNGAP1は、シナプス後部に局在するRasGAP蛋白質であり、CaMKIIの下流においてRasの活性を制御することで、シナプス可塑性に関与している。C末端のコイルドコイル領域やPDZリガンドを介しPSD-95と結合することで、PSD-95と共に液-液相分離現象を起こし、シナプス後膜肥厚 (postsynaptic density; PSD) という脂質二重膜を持たない細胞小器官の生化学的基盤を提供していると考えられている。}} | {{box|text= SYNGAP1は、シナプス後部に局在するRasGAP蛋白質であり、CaMKIIの下流においてRasの活性を制御することで、シナプス可塑性に関与している。C末端のコイルドコイル領域やPDZリガンドを介しPSD-95と結合することで、PSD-95と共に液-液相分離現象を起こし、シナプス後膜肥厚 (postsynaptic density; PSD) という脂質二重膜を持たない細胞小器官の生化学的基盤を提供していると考えられている。}} | ||
[[ファイル: | [[ファイル:SYNGAP1 Fig1.png|サムネイル|'''図1. SYNGAP1の構造'''<br>N末より、[[PHドメイン]]、[[C2ドメイン]]、[[GAPドメイン]]、[[コイルドコイル領域]]を持つ。α1アイソフォームのみ、[[PSD-95]]との結合に必要な[[PDZリガンド]]を持つ。N末にA,B,Cのスプライシングアイソフォーム、C末にα1,α2,β,γのスプライシングアイソフォームを持つ。実際のスプライシングはN末、C末の組み合わせであるため、SYNGAP Aα1のように表記する。]] | ||
[[ファイル: | [[ファイル:SYNGAP1 Fig2.png|サムネイル|'''図2. SYNGAP1の機能'''<br> | ||
'''A.''' SYNGAP1は基底状態においては[[シナプス]]に高度に蓄積し、[[Ras]]の活性を低く保っている。シナプスの[[NMDA型グルタミン酸受容体]]刺激により、[[Ca2+/カルモジュリン依存性蛋白質リン酸化酵素II|Ca<sup>2+</sup>/カルモジュリン依存性蛋白質リン酸化酵素II]] ([[CaMKII]])が活性化されると、[[リン酸化]]され、[[スパイン]]の外に分散し、[[AMPA型グルタミン酸受容体]]のシナプスへの挿入、スパイン肥大化を引き起こす。<br> | '''A.''' SYNGAP1は基底状態においては[[シナプス]]に高度に蓄積し、[[Ras]]の活性を低く保っている。シナプスの[[NMDA型グルタミン酸受容体]]刺激により、[[Ca2+/カルモジュリン依存性蛋白質リン酸化酵素II|Ca<sup>2+</sup>/カルモジュリン依存性蛋白質リン酸化酵素II]] ([[CaMKII]])が活性化されると、[[リン酸化]]され、[[スパイン]]の外に分散し、[[AMPA型グルタミン酸受容体]]のシナプスへの挿入、スパイン肥大化を引き起こす。<br> | ||
'''B.''' SYNGAP1は''in vitro''でPSD-95とPhase separationを引き起こす。シナプスにおける豊富な存在と、この生化学的性質は、SYNGAP/PSD-95複合体が[[PSD]]という脂質二重膜を持たない[[細胞小器官]]の生化学的基盤を提供するのに適している。文献<ref name=Zeng2016 />からElsevier社の許可により引用。]] | '''B.''' SYNGAP1は''in vitro''でPSD-95とPhase separationを引き起こす。シナプスにおける豊富な存在と、この生化学的性質は、SYNGAP/PSD-95複合体が[[PSD]]という脂質二重膜を持たない[[細胞小器官]]の生化学的基盤を提供するのに適している。文献<ref name=Zeng2016 />からElsevier社の許可により引用。]] | ||
[[ファイル: | [[ファイル:SYNGAP1 Fig3.png|サムネイル|'''図3. SYNGAP1の発達障害との関連'''<br>[[知的障害]]、[[自閉症]]などの発達障害において、SYNGAP1の変異が高頻度に見出されている。遺伝子の構造と、見つかった変異の一例を示す。]] | ||
== イントロダクション == | == イントロダクション == | ||
| 36行目: | 36行目: | ||
=== コイルドコイル領域 === | === コイルドコイル領域 === | ||
PSD-95との液-液相分離に必須の領域で、他の液-液相分離を引き起こすタンパクと同様、決まった3次構造を取りにくい[[天然変性領域]]で、他のタンパクと多価結合を引き起こす。SYNGAP1 3分子はこの領域で[[βヘリックス]]が絡み合ったような三量体を形成する。[[wj: | PSD-95との液-液相分離に必須の領域で、他の液-液相分離を引き起こすタンパクと同様、決まった3次構造を取りにくい[[天然変性領域]]で、他のタンパクと多価結合を引き起こす。SYNGAP1 3分子はこの領域で[[βヘリックス]]が絡み合ったような三量体を形成する。[[wj:ゲルろ過|ゲルろ過]]法を用いた解析により''in vitro''でここに2分子のPSD-95が結合することが分かっている<ref name=Zeng2016><pubmed>27565345</pubmed></ref> 。 | ||
=== PDZ ligand === | === PDZ ligand === | ||
| 49行目: | 49行目: | ||
== ファミリー == | == ファミリー == | ||
ドメイン構造が保存されているSYNGAP1ファミリー分子として、SYNGAP1以外には[[DAB2IP]]、[[RASAL2]]、[[RASAL3]]が報告されている<ref name=King2013><pubmed>23443682</pubmed></ref> 。 | |||
DAB2IPは、[[血管内皮]]細胞において[[腫瘍壊死因子]] ([[TNF]])シグナルを下流の[[ASK1]]に受け渡し、そのかわりに[[NFκB]]を抑制することにより、TNF依存的な[[アポトーシス]]を促進している<ref name=Zhang2004><pubmed>15310755</pubmed></ref> 。[[wj:前立腺がん|前立腺がん]]、[[wj:肺がん|肺がん]]、[[wj:乳がん|乳がん]]、[[wj:消化器がん|消化器がん]]等においてDAB2IPの発現の抑制がみられる。1つの[[一塩基多型]](rs1571801)が前立腺がんの悪性化に関与していることも知られている<ref name=Duggan2007><pubmed>18073375</pubmed></ref> 。 | DAB2IPは、[[血管内皮]]細胞において[[腫瘍壊死因子]] ([[TNF]])シグナルを下流の[[ASK1]]に受け渡し、そのかわりに[[NFκB]]を抑制することにより、TNF依存的な[[アポトーシス]]を促進している<ref name=Zhang2004><pubmed>15310755</pubmed></ref> 。[[wj:前立腺がん|前立腺がん]]、[[wj:肺がん|肺がん]]、[[wj:乳がん|乳がん]]、[[wj:消化器がん|消化器がん]]等においてDAB2IPの発現の抑制がみられる。1つの[[一塩基多型]](rs1571801)が前立腺がんの悪性化に関与していることも知られている<ref name=Duggan2007><pubmed>18073375</pubmed></ref> 。 | ||
| 56行目: | 56行目: | ||
== 発現== | == 発現== | ||
[[ファイル: | [[ファイル:SYNGAP1 Fig4.png|サムネイル|'''図4. SYNGAP1の神経細胞内分布'''<br>GFP-SYNGAP1(緑)とmCherry(マゼンタ)を海馬培養神経細胞DIV21に発現させ、共焦点顕微鏡にて観察。スケールバー50 µm。]] | ||
=== 組織発現=== | === 組織発現=== | ||
ウェスタンブロットでは、脳に特異的に発現している。特に[[海馬]]、[[大脳皮質]]に発現が多い<ref name=Chen1998><pubmed>9620694</pubmed></ref><ref name=Kim1998><pubmed>9581761</pubmed></ref> 。 | ウェスタンブロットでは、脳に特異的に発現している。特に[[海馬]]、[[大脳皮質]]に発現が多い<ref name=Chen1998><pubmed>9620694</pubmed></ref><ref name=Kim1998><pubmed>9581761</pubmed></ref> 。 | ||
=== 細胞内分布 === | === 細胞内分布 === | ||
[[グルタミン酸]]性[[興奮性シナプス]]のシナプス後部に高度に蓄積している<ref name=Chen1998><pubmed>9620694</pubmed></ref><ref name=Kim1998><pubmed>9581761</pubmed></ref> 。α1、α2、β、γアイソフォーム間で細胞内局在が若干異なるという報告もある<ref name=Li2001><pubmed>11278737</pubmed></ref> 。 | [[グルタミン酸]]性[[興奮性シナプス]]のシナプス後部に高度に蓄積している<ref name=Chen1998><pubmed>9620694</pubmed></ref><ref name=Kim1998><pubmed>9581761</pubmed></ref> ('''図4''')。α1、α2、β、γアイソフォーム間で細胞内局在が若干異なるという報告もある<ref name=Li2001><pubmed>11278737</pubmed></ref> 。 | ||
各シナプスでのNMDA型グルタミン酸受容体活動レベルによりダイナミックに局在変化する。NMDA型グルタミン酸受容体-CaMKIIの活性化レベルが低い状態では、PSD-95と結合しシナプス後部に高度に蓄積している。NMDA型グルタミン酸受容体-CaMKIIの活性化により、CaMKIIがSYNGAP1をリン酸化することで、SYNGAP-PSD-95の結合が減弱し、SYNGAP1がシナプス外に分散する<ref name=Araki2015><pubmed>25569349</pubmed></ref> 。 | 各シナプスでのNMDA型グルタミン酸受容体活動レベルによりダイナミックに局在変化する。NMDA型グルタミン酸受容体-CaMKIIの活性化レベルが低い状態では、PSD-95と結合しシナプス後部に高度に蓄積している。NMDA型グルタミン酸受容体-CaMKIIの活性化により、CaMKIIがSYNGAP1をリン酸化することで、SYNGAP-PSD-95の結合が減弱し、SYNGAP1がシナプス外に分散する<ref name=Araki2015><pubmed>25569349</pubmed></ref> 。 | ||
| 85行目: | 85行目: | ||
SYNGAP1のC末のコイルドコイル領域は、PSD-95との液−液相分離に必須の領域で、決まった三次元構造を取りにくい[[天然変性領域]]であると考えられている。これにより、他のタンパクとill-definedな多価結合をし、液−液相分離を引き起こす。SYNGAP1においては、コイル構造が3本からまったトライマーを形成し、ここに2分子のPSD-95が結合する。これにより、''in vitro''の液体中で生理的濃度で自発的に分離し、濃縮相のなかに別の濃縮相(condensed phase)を形成する<ref name=Zeng2016><pubmed>27565345</pubmed></ref> 。 | SYNGAP1のC末のコイルドコイル領域は、PSD-95との液−液相分離に必須の領域で、決まった三次元構造を取りにくい[[天然変性領域]]であると考えられている。これにより、他のタンパクとill-definedな多価結合をし、液−液相分離を引き起こす。SYNGAP1においては、コイル構造が3本からまったトライマーを形成し、ここに2分子のPSD-95が結合する。これにより、''in vitro''の液体中で生理的濃度で自発的に分離し、濃縮相のなかに別の濃縮相(condensed phase)を形成する<ref name=Zeng2016><pubmed>27565345</pubmed></ref> 。 | ||
SYNGAP1は[[シナプス後膜肥厚]] (PSD)画分のなかで全タンパク中3番目に豊富に存在している(PSD-95は4番目)。この豊富な量とSYNGAP1/PSD-95複合体の生化学的性質は、SYNGAP1/ | SYNGAP1は[[シナプス後膜肥厚]] (PSD)画分のなかで全タンパク中3番目に豊富に存在している(PSD-95は4番目)。この豊富な量とSYNGAP1/PSD-95複合体の生化学的性質は、SYNGAP1/PSD-95複合体が脂質二重膜を持たないPSDという構造物の生化学的基盤を提供しうることを示唆している。 | ||
この液−液相分離に必要なSYNGAP1の配列に変異を入れると、[[化学的LTP]]の閾値が下がり、より弱いNMDA型グルタミン酸受容体-CaMKII刺激で強いLTP(AMPA型グルタミン酸受容体のシナプス挿入とシナプス肥大化)が観察されるようになる。このことより、SYNGAP1/PSD-95の液−液相分離は、適正量のNMDA型グルタミン酸受容体-CaMKII刺激が来たときにのみ長期増強を引き起こすよう(少ないNMDA型グルタミン酸受容体刺激では長期増強が起きないよう)に機能し、もって回路全体の興奮性を正常に(高くなりすぎなように)保っていると考えられる<ref name=Zeng2016><pubmed>27565345</pubmed></ref> 。 | この液−液相分離に必要なSYNGAP1の配列に変異を入れると、[[化学的LTP]]の閾値が下がり、より弱いNMDA型グルタミン酸受容体-CaMKII刺激で強いLTP(AMPA型グルタミン酸受容体のシナプス挿入とシナプス肥大化)が観察されるようになる。このことより、SYNGAP1/PSD-95の液−液相分離は、適正量のNMDA型グルタミン酸受容体-CaMKII刺激が来たときにのみ長期増強を引き起こすよう(少ないNMDA型グルタミン酸受容体刺激では長期増強が起きないよう)に機能し、もって回路全体の興奮性を正常に(高くなりすぎなように)保っていると考えられる<ref name=Zeng2016><pubmed>27565345</pubmed></ref> 。 | ||
2019年10月19日 (土) 12:48時点における版
荒木 陽一、Richard L. Huganir
Johns Hopkins University School of Medicine
DOI:10.14931/bsd.7992 原稿受付日:2019年10月8日 原稿完成日:2019年10月XX日
担当編集委員:林 康紀(京都大学大学院 医学研究科 システム神経薬理学分野)
正式名称: シナプス局在性Ras-GTP加水分解活性化タンパク
英語正式名称: Synaptic Ras-GTPase activating protein 1
英語略称、蛋白質名:SYNGAP1
SYNGAP1は、シナプス後部に局在するRasGAP蛋白質であり、CaMKIIの下流においてRasの活性を制御することで、シナプス可塑性に関与している。C末端のコイルドコイル領域やPDZリガンドを介しPSD-95と結合することで、PSD-95と共に液-液相分離現象を起こし、シナプス後膜肥厚 (postsynaptic density; PSD) という脂質二重膜を持たない細胞小器官の生化学的基盤を提供していると考えられている。
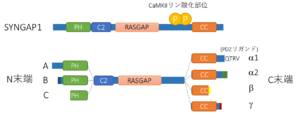
N末より、PHドメイン、C2ドメイン、GAPドメイン、コイルドコイル領域を持つ。α1アイソフォームのみ、PSD-95との結合に必要なPDZリガンドを持つ。N末にA,B,Cのスプライシングアイソフォーム、C末にα1,α2,β,γのスプライシングアイソフォームを持つ。実際のスプライシングはN末、C末の組み合わせであるため、SYNGAP Aα1のように表記する。
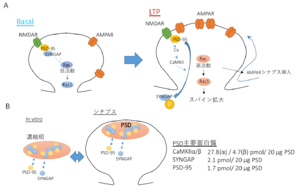
A. SYNGAP1は基底状態においてはシナプスに高度に蓄積し、Rasの活性を低く保っている。シナプスのNMDA型グルタミン酸受容体刺激により、Ca2+/カルモジュリン依存性蛋白質リン酸化酵素II (CaMKII)が活性化されると、リン酸化され、スパインの外に分散し、AMPA型グルタミン酸受容体のシナプスへの挿入、スパイン肥大化を引き起こす。
B. SYNGAP1はin vitroでPSD-95とPhase separationを引き起こす。シナプスにおける豊富な存在と、この生化学的性質は、SYNGAP/PSD-95複合体がPSDという脂質二重膜を持たない細胞小器官の生化学的基盤を提供するのに適している。文献[1]からElsevier社の許可により引用。
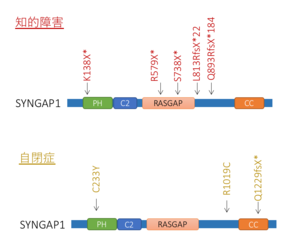
知的障害、自閉症などの発達障害において、SYNGAP1の変異が高頻度に見出されている。遺伝子の構造と、見つかった変異の一例を示す。
イントロダクション
SYNGAP1 (Synaptic Ras-GTPase Activating Protein 1)は、シナプスに高度に蓄積する低分子GTP結合蛋白質Rasに対するGTPase活性化蛋白質 (RasGAP)である(図1)。Ca2+/カルモジュリン依存性蛋白質リン酸化酵素II (CaMKII)の下流においてシナプス内のRasの活性を制御することで[2][3] 、シナプス可塑性(長期増強現象)の発現に深くかかわっている[4][5] 。RasGAPとして、基底状態ではRasに結合したGTPの加水分解を促進する(GTP->GDP)ことで、Rasの活性化を阻害しているが、NMDA型グルタミン酸受容体 (NMDAR)-CaMKIIシグナルに依存してリン酸化されることでシナプス外に移動し、結果的にNMDAR依存的にシナプスでのRasの活性化を誘導する(図2A)。これにより、AMPA型グルタミン酸受容体 (AMPAR)のシナプス後部への挿入やスパインの肥大化を引き起こす[6] 。
PSD蛋白質の質量分析計による解析によると、SYNGAP1はCaMKIIα/β (それぞれ27.8、4.7 pmol/20 μg)に次いでシナプス内で3番目に濃度の高い蛋白質(∼2.1 pmol/20 μg) であり、主要な足場蛋白質PSD-95(1.73 pmol/20 μg; 4番目)よりも存在比が大きく、シグナル伝達以外での役割の解明が待たれていた[7][8] 。またSYNGAP1はそのPDZリガンドを介し、PSD-95をシナプスに集積させる調節因子であることもわかっていた[9] 。2016年、C末端のコイルドコイル領域とPDZリガンドを介しPSD-95と結合することで、PSD-95とともに水層より液-液相分離現象を起こし、濃縮相を形成することが明らかにされた。この相転移が、脂質二重膜を持たないPSDという細胞小器官の物質的基盤を提供している可能性が示唆された(図2B)[10][1] 。
SYNGAP1の変異は、近年のエクソーム解析の発展により、知的障害や自閉症等の発達障害において高率に見出されており、その頻度は全遺伝子中有数(4番目)に高く、イギリスにおける解析では全発達障害例の約0.75%でSYNGAP1の変異が認められるとしている(図3)[11] 。
構造
N末端側から、PHドメイン、C2ドメイン、GAPドメイン、SH3結合配列、コイルドコイル領域、PDZリガンド(α1アイソフォームのみ)を持つ(図1) [2][3] 。SH3結合配列とコイルドコイル領域の間の配列、およびコイルドコイル領域は、CaMKII、Plk2、cdk5等によりリン酸化される[12][13] 。コイルドコイル領域、PDZリガンドはPSD-95との液-液相分離現象に必須である[1] 。これらのCaMKIIリン酸化部位、コイルドコイル領域、PDZリガンドはシナプス可塑性(長期増強現象)の発現に必要である[6][1] 。
PH-C2ドメイン
一般的にはリン脂質等の生体膜脂質への結合部位と考えられているが、SYNGAP1において特定の分子は同定されていない。C2ドメインはRapGAP活性に必須である[14] 。
GAPドメイン
RasおよびRapGAP活性を持つと考えられている[2][3] 。その基質特異性はCaMKIIによるリン酸化により制御されている[15] 。神経細胞内でRacGAPを制御しているという報告もあるが、その活性はRasGAP活性を介するものであるとされている(Ras-Tiam1-Rac1経路)[16] 。
コイルドコイル領域
PSD-95との液-液相分離に必須の領域で、他の液-液相分離を引き起こすタンパクと同様、決まった3次構造を取りにくい天然変性領域で、他のタンパクと多価結合を引き起こす。SYNGAP1 3分子はこの領域でβヘリックスが絡み合ったような三量体を形成する。ゲルろ過法を用いた解析によりin vitroでここに2分子のPSD-95が結合することが分かっている[1] 。
PDZ ligand
α1アイソフォームのみ、-FPPWVQQTRVというPDZリガンドを含むC末端を持ち、PSD-95、SAP-97等のMAGUKファミリー蛋白質と結合することが知られている。
In vitroの結果によると、PSD-95のPDZ1、2ドメインより、PDZ3ドメインに強く結合する。これは、PSD-95 PDZ3のC末のαCへリックスが結合を安定化するからだとされている。SYNGAP1の(-3)T-V(0)が、PSD-95のPDZ3ドメイン(αB/ βB groove)と通常のPDZ結合をするのに加え、 SYNGAP1(-9)F-V(-5)がPSD-95のαCへリックスが作る疎水性ポケットに入り、結合が安定化される[1] 。
スプライシングアイソフォーム
N末端に長いほうから順にA, B, Cの3つのアイソフォームがあり、一番短いCアイソフォームはPHドメインの一部が欠失している(図1)。
C末端にはα1、α2、β、γの4つのアイソフォームがある[17][18] 。α1だけがPDZリガンドを有し、前述したCaMKIIを介したシナプス可塑性制御や、液-液相分離現象にかかわっている。
ファミリー
ドメイン構造が保存されているSYNGAP1ファミリー分子として、SYNGAP1以外にはDAB2IP、RASAL2、RASAL3が報告されている[19] 。
DAB2IPは、血管内皮細胞において腫瘍壊死因子 (TNF)シグナルを下流のASK1に受け渡し、そのかわりにNFκBを抑制することにより、TNF依存的なアポトーシスを促進している[20] 。前立腺がん、肺がん、乳がん、消化器がん等においてDAB2IPの発現の抑制がみられる。1つの一塩基多型(rs1571801)が前立腺がんの悪性化に関与していることも知られている[21] 。
RASAL2は、星状細胞腫においてRhoGAPとして働き、ノックダウンによりRhoの活性化、間葉性細胞腫(編集部コメント:種ではないでしょうか?)から遊走性細胞腫への転化が見られる[22] 。
発現
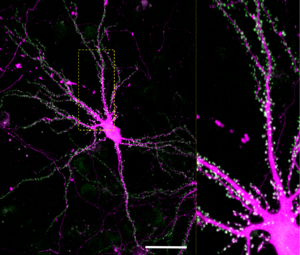
GFP-SYNGAP1(緑)とmCherry(マゼンタ)を海馬培養神経細胞DIV21に発現させ、共焦点顕微鏡にて観察。スケールバー50 µm。
組織発現
ウェスタンブロットでは、脳に特異的に発現している。特に海馬、大脳皮質に発現が多い[2][3] 。
細胞内分布
グルタミン酸性興奮性シナプスのシナプス後部に高度に蓄積している[2][3] (図4)。α1、α2、β、γアイソフォーム間で細胞内局在が若干異なるという報告もある[17] 。
各シナプスでのNMDA型グルタミン酸受容体活動レベルによりダイナミックに局在変化する。NMDA型グルタミン酸受容体-CaMKIIの活性化レベルが低い状態では、PSD-95と結合しシナプス後部に高度に蓄積している。NMDA型グルタミン酸受容体-CaMKIIの活性化により、CaMKIIがSYNGAP1をリン酸化することで、SYNGAP-PSD-95の結合が減弱し、SYNGAP1がシナプス外に分散する[6] 。
機能
SYNGAP1ノックアウトマウスは、ホモ個体(-/-)は生後数日で致死、ヘテロ(+/-)は海馬スライスにおいてCA3-CA1シナプスの長期増強現象(LTP)が減弱する。一方LTDへの影響は限定的かほぼない[4][5] 。
マウスSYNGAP1ヘテロ(+/-)個体の脳では、Ras下流のERKキナーゼの異常な活性化(リン酸化)が見られ[5] 、行動レベルでは作業記憶が劇的に障害される[23] 。SYNGAP機能欠失による発達障害患者と同じく、てんかんを併発することが多い。その他、SYNGAPヘテロマウスの表現型は、睡眠障害、感覚プロセスの異常、危険予測の欠如、繰り返し行動の増加、などがあり、広範にヒトの発達障害の表現型を模していると考えられる[24] 。
神経細胞におけるSYNGAP1のノックダウン実験では、シナプスが異常肥大化し、シナプス結合が異常に増強される表現型が見られることから、SYNGAP1の正常機能は、RasGAP活性を介してRas-ERK活性化レベルを低く抑え、シナプス結合強度を(刺激がない状態では)低く保つこと、NMDA型グルタミン酸受容体-CaMKII刺激が来たときにのみシナプス外に離散し、Ras/Rac1活性化を通じたスパイン肥大化とAMPA型グルタミン酸受容体の挿入を介して、シナプス強度を増強することだと考えられる[6] 。
シナプス情報伝達
シナプスにはその入力の強度に応じ、出力を一定に保つようなフィードバック機構が備わっており、synaptic scalingとよばれる。polo-like kinase 2 (PLK2; 別名SNK)は、神経の活性化により発現誘導されるセリン/スレオニンキナーゼであり、Rap-GAPであるSPARのリン酸化、ユビキチン化後の分解等を介して、synaptic scalingに深くかかわるキナーゼであることが知られている[25] 。SYNGAP1は、神経の活性化により誘導されたPlk2により、そのGAPドメインのC末側をリン酸化される。これにより、SYNGAP1のRas-GAP活性が増加し、シナプス強度を引き下げることにより、synaptic downscalingに関与しているとされる[12] 。
またSYNGAP1は、発達期においてERK-Rheb-mTORの経路を負に制御することでシナプスに局在したAMPA型グルタミン酸受容体を低く制御すること、SYNGAP1の発現をknockdownすることでこの経路を阻害すると、テトロドトキシン+2-アミノ-5-ホスホノペンタン酸 (APV、NMDA型グルタミン酸受容体の拮抗阻害剤)処理によりsynaptic scalingが障害される[26] 。
長期増強現象
NMDA型グルタミン酸受容体-CaMKIIの活性化により、SYNGAP1がリン酸化されるとPSD-95との結合が外れ、シナプス後部から樹状突起軸の細胞質部分へと分散していく(図2)。この分散は、能動的なものではなく、PSD-95というアンカーから外れたことによる単純拡散であると考えられている[6] 。
Rasの負の制御要因であったSYNGAP1がNMDA型グルタミン酸受容体-CaMKII依存的にシナプス内から外に移動することで、シナプス内Rasの活性が増加し、AMPA型グルタミン酸受容体のシナプス後部への挿入、アクチンの重合にともなうシナプス肥大化が引き起こされる。
相転移によるPSDの生化学的基盤の提供
SYNGAP1のC末のコイルドコイル領域は、PSD-95との液−液相分離に必須の領域で、決まった三次元構造を取りにくい天然変性領域であると考えられている。これにより、他のタンパクとill-definedな多価結合をし、液−液相分離を引き起こす。SYNGAP1においては、コイル構造が3本からまったトライマーを形成し、ここに2分子のPSD-95が結合する。これにより、in vitroの液体中で生理的濃度で自発的に分離し、濃縮相のなかに別の濃縮相(condensed phase)を形成する[1] 。
SYNGAP1はシナプス後膜肥厚 (PSD)画分のなかで全タンパク中3番目に豊富に存在している(PSD-95は4番目)。この豊富な量とSYNGAP1/PSD-95複合体の生化学的性質は、SYNGAP1/PSD-95複合体が脂質二重膜を持たないPSDという構造物の生化学的基盤を提供しうることを示唆している。
この液−液相分離に必要なSYNGAP1の配列に変異を入れると、化学的LTPの閾値が下がり、より弱いNMDA型グルタミン酸受容体-CaMKII刺激で強いLTP(AMPA型グルタミン酸受容体のシナプス挿入とシナプス肥大化)が観察されるようになる。このことより、SYNGAP1/PSD-95の液−液相分離は、適正量のNMDA型グルタミン酸受容体-CaMKII刺激が来たときにのみ長期増強を引き起こすよう(少ないNMDA型グルタミン酸受容体刺激では長期増強が起きないよう)に機能し、もって回路全体の興奮性を正常に(高くなりすぎなように)保っていると考えられる[1] 。
発達障害との関連
SYNGAP1の変異が知的障害、自閉症などの広範な発達障害に関与していることが近年多数報告されている。
OMIMにおいてSYNGAP1変異による発達障害はSYNGAP1関連知的障害と分類されている (OMIM #612621)。イギリスにおける大規模調査によると、全発達障害症例のうち約0.75%程度にSYNGAP1の変異が認められた[11] 。この頻度は、ARID1B、SCN2A、ANKRD11に次ぎ全遺伝子中4番目に多い(図3)。その他の小規模報告でも、数%を占めるとされ、たとえば2009年の初報告では、コントロール群475例にSYNGAP1変異が認められないなか、知的障害(non-syndromic mental retardation; NSMR) 群94症例中3例(約3%)にSYNGAP1変異が見いだされている[27] 。
症状として、発達の遅れと知的障害(中程度から高度)(100%)に加え、てんかん(発作起始は全般性で、頻度の高い順にミオクロニー発作、非定型欠神発作、強直性間代発作等)(84%)、斜視(約60%)、自閉症(約50%)を併発する[28] 。
詳細はSYNGAP1関連知的障害の項目参照。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7
Zeng, M., Shang, Y., Araki, Y., Guo, T., Huganir, R.L., & Zhang, M. (2016).
Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell, 166(5), 1163-1175.e12. [PubMed:27565345] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4
Chen, H.J., Rojas-Soto, M., Oguni, A., & Kennedy, M.B. (1998).
A synaptic Ras-GTPase activating protein (p135 SynGAP) inhibited by CaM kinase II. Neuron, 20(5), 895-904. [PubMed:9620694] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4
Kim, J.H., Liao, D., Lau, L.F., & Huganir, R.L. (1998).
SynGAP: a synaptic RasGAP that associates with the PSD-95/SAP90 protein family. Neuron, 20(4), 683-91. [PubMed:9581761] [WorldCat] [DOI] - ↑ 4.0 4.1
Kim, J.H., Lee, H.K., Takamiya, K., & Huganir, R.L. (2003).
The role of synaptic GTPase-activating protein in neuronal development and synaptic plasticity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(4), 1119-24. [PubMed:12598599] [PMC] [WorldCat] - ↑ 5.0 5.1 5.2
Komiyama, N.H., Watabe, A.M., Carlisle, H.J., Porter, K., Charlesworth, P., Monti, J., ..., & Grant, S.G. (2002).
SynGAP regulates ERK/MAPK signaling, synaptic plasticity, and learning in the complex with postsynaptic density 95 and NMDA receptor. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(22), 9721-32. [PubMed:12427827] [PMC] [WorldCat] - ↑ 6.0 6.1 6.2 6.3 6.4
Araki, Y., Zeng, M., Zhang, M., & Huganir, R.L. (2015).
Rapid dispersion of SynGAP from synaptic spines triggers AMPA receptor insertion and spine enlargement during LTP. Neuron, 85(1), 173-189. [PubMed:25569349] [PMC] [WorldCat] [DOI] - ↑
Cheng, D., Hoogenraad, C.C., Rush, J., Ramm, E., Schlager, M.A., Duong, D.M., ..., & Peng, J. (2006).
Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & cellular proteomics : MCP, 5(6), 1158-70. [PubMed:16507876] [WorldCat] [DOI] - ↑
Sheng, M., & Hoogenraad, C.C. (2007).
The postsynaptic architecture of excitatory synapses: a more quantitative view. Annual review of biochemistry, 76, 823-47. [PubMed:17243894] [WorldCat] [DOI] - ↑
Nonaka, M., Doi, T., Fujiyoshi, Y., Takemoto-Kimura, S., & Bito, H. (2006).
Essential contribution of the ligand-binding beta B/beta C loop of PDZ1 and PDZ2 in the regulation of postsynaptic clustering, scaffolding, and localization of postsynaptic density-95. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(3), 763-74. [PubMed:16421296] [PMC] [WorldCat] [DOI] - ↑
Zeng, M., Chen, X., Guan, D., Xu, J., Wu, H., Tong, P., & Zhang, M. (2018).
Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell, 174(5), 1172-1187.e16. [PubMed:30078712] [WorldCat] [DOI] - ↑ 11.0 11.1
Deciphering Developmental Disorders Study (2015).
Large-scale discovery of novel genetic causes of developmental disorders. Nature, 519(7542), 223-8. [PubMed:25533962] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Lee, K.J., Lee, Y., Rozeboom, A., Lee, J.Y., Udagawa, N., Hoe, H.S., & Pak, D.T. (2011).
Requirement for Plk2 in orchestrated ras and rap signaling, homeostatic structural plasticity, and memory. Neuron, 69(5), 957-73. [PubMed:21382555] [PMC] [WorldCat] [DOI] - ↑
Oh, J.S., Manzerra, P., & Kennedy, M.B. (2004).
Regulation of the neuron-specific Ras GTPase-activating protein, synGAP, by Ca2+/calmodulin-dependent protein kinase II. The Journal of biological chemistry, 279(17), 17980-8. [PubMed:14970204] [WorldCat] [DOI] - ↑
Pena, V., Hothorn, M., Eberth, A., Kaschau, N., Parret, A., Gremer, L., ..., & Scheffzek, K. (2008).
The C2 domain of SynGAP is essential for stimulation of the Rap GTPase reaction. EMBO reports, 9(4), 350-5. [PubMed:18323856] [PMC] [WorldCat] [DOI] - ↑
Walkup, W.G., Washburn, L., Sweredoski, M.J., Carlisle, H.J., Graham, R.L., Hess, S., & Kennedy, M.B. (2015).
Phosphorylation of synaptic GTPase-activating protein (synGAP) by Ca2+/calmodulin-dependent protein kinase II (CaMKII) and cyclin-dependent kinase 5 (CDK5) alters the ratio of its GAP activity toward Ras and Rap GTPases. The Journal of biological chemistry, 290(8), 4908-27. [PubMed:25533468] [PMC] [WorldCat] [DOI] - ↑
Carlisle, H.J., Manzerra, P., Marcora, E., & Kennedy, M.B. (2008).
SynGAP regulates steady-state and activity-dependent phosphorylation of cofilin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(50), 13673-83. [PubMed:19074040] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Li, W., Okano, A., Tian, Q.B., Nakayama, K., Furihata, T., Nawa, H., & Suzuki, T. (2001).
Characterization of a novel synGAP isoform, synGAP-beta. The Journal of biological chemistry, 276(24), 21417-24. [PubMed:11278737] [WorldCat] [DOI] - ↑
McMahon, A.C., Barnett, M.W., O'Leary, T.S., Stoney, P.N., Collins, M.O., Papadia, S., ..., & Kind, P.C. (2012).
SynGAP isoforms exert opposing effects on synaptic strength. Nature communications, 3, 900. [PubMed:22692543] [PMC] [WorldCat] [DOI] - ↑
King, P.D., Lubeck, B.A., & Lapinski, P.E. (2013).
Nonredundant functions for Ras GTPase-activating proteins in tissue homeostasis. Science signaling, 6(264), re1. [PubMed:23443682] [PMC] [WorldCat] [DOI] - ↑
Zhang, H., Zhang, R., Luo, Y., D'Alessio, A., Pober, J.S., & Min, W. (2004).
AIP1/DAB2IP, a novel member of the Ras-GAP family, transduces TRAF2-induced ASK1-JNK activation. The Journal of biological chemistry, 279(43), 44955-65. [PubMed:15310755] [WorldCat] [DOI] - ↑
Duggan, D., Zheng, S.L., Knowlton, M., Benitez, D., Dimitrov, L., Wiklund, F., ..., & Carpten, J.D. (2007).
Two genome-wide association studies of aggressive prostate cancer implicate putative prostate tumor suppressor gene DAB2IP. Journal of the National Cancer Institute, 99(24), 1836-44. [PubMed:18073375] [WorldCat] [DOI] - ↑
Weeks, A., Okolowsky, N., Golbourn, B., Ivanchuk, S., Smith, C., & Rutka, J.T. (2012).
ECT2 and RASAL2 mediate mesenchymal-amoeboid transition in human astrocytoma cells. The American journal of pathology, 181(2), 662-74. [PubMed:22683310] [WorldCat] [DOI] - ↑
Clement, J.P., Aceti, M., Creson, T.K., Ozkan, E.D., Shi, Y., Reish, N.J., ..., & Rumbaugh, G. (2012).
Pathogenic SYNGAP1 mutations impair cognitive development by disrupting maturation of dendritic spine synapses. Cell, 151(4), 709-723. [PubMed:23141534] [PMC] [WorldCat] [DOI] - ↑
Guo, X., Hamilton, P.J., Reish, N.J., Sweatt, J.D., Miller, C.A., & Rumbaugh, G. (2009).
Reduced expression of the NMDA receptor-interacting protein SynGAP causes behavioral abnormalities that model symptoms of Schizophrenia. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 34(7), 1659-72. [PubMed:19145222] [PMC] [WorldCat] [DOI] - ↑
Pak, D.T., & Sheng, M. (2003).
Targeted protein degradation and synapse remodeling by an inducible protein kinase. Science (New York, N.Y.), 302(5649), 1368-73. [PubMed:14576440] [WorldCat] [DOI] - ↑
Wang, C.C., Held, R.G., & Hall, B.J. (2013).
SynGAP regulates protein synthesis and homeostatic synaptic plasticity in developing cortical networks. PloS one, 8(12), e83941. [PubMed:24391850] [PMC] [WorldCat] [DOI] - ↑
Hamdan, F.F., Gauthier, J., Spiegelman, D., Noreau, A., Yang, Y., Pellerin, S., ..., & Synapse to Disease Group (2009).
Mutations in SYNGAP1 in autosomal nonsyndromic mental retardation. The New England journal of medicine, 360(6), 599-605. [PubMed:19196676] [PMC] [WorldCat] [DOI] - ↑
Holder, J.L., Hamdan, F.F., & Michaud, J.L. (1993-2019).
SYNGAP1-Related Intellectual Disability. In Adam, M.P., Ardinger, H.H., Pagon, R.A., Wallace, S.E., Bean, L.J.H., Stephens, K., & Amemiya, A. (Eds.), GeneReviews®. Seattle (WA): University of Washington, Seattle. [PubMed:30789692]