「アドヘレンスジャンクション」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の4版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/7000004035 丸尾 知彦]、[http://researchmap.jp/hirake5ma 高井 義美]</font><br> | <font size="+1">[http://researchmap.jp/7000004035 丸尾 知彦]、[http://researchmap.jp/hirake5ma 高井 義美]</font><br> | ||
''神戸大学 大学院 医学研究科''<br> | ''神戸大学 大学院 医学研究科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年12月29日 原稿完成日:2015年12月30日<br> | ||
担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター)<br> | 担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター)<br> | ||
</div> | </div> | ||
英:adherence junction 英略称:AJ 独:Adhäsionsverbindungen | 英:adherence junction 英略称:AJ 独:Adhäsionsverbindungen | ||
同義語:接着結合 | |||
{{box|text= アドへレンスジャンクションは細胞間接合部位において形成される、タンパク質複合体からなる機能構造体である。アドへレンスジャンクションは主として物理的に強固な細胞間接着をにない、発生期の器官形成や生体の恒常性に重要な役割を果たす。上皮組織においては、細胞周囲を取り囲むベルト状の構造ゾニューラアドヘレンスおよびスポット状のアドヒージョンプラークがアドへレンスジャンクションとしてくくられる。また線維芽細胞や心筋などでは、より非連続的なスポット状のアドへレンスジャンクション構造が存在する。神経系におけるアドへレンスジャンクションも必須の構造として機能している。例えば、側脳室神経上皮細胞は脳室側の頂端部にアドへレンスジャンクションを有し、発生期の大脳皮質の構築に重要な役割を果たす。また、シナプス結合部位の近傍には上皮細胞のアドへレンスジャンクション類似の接着分子を含む構造であるプンクタアドヘレンスジャンクションが形成され、シナプスの形成、維持や可塑性に関与している。アドへレンスジャンクションの接着は主としてカドヘリン-カテニン複合体によって担われ、アクチン骨格系、更には微小管骨格系に連結されているが、その形成過程ではネクチン-アファディン複合体も重要な役割を果たす。}} | {{box|text= アドへレンスジャンクションは細胞間接合部位において形成される、タンパク質複合体からなる機能構造体である。アドへレンスジャンクションは主として物理的に強固な細胞間接着をにない、発生期の器官形成や生体の恒常性に重要な役割を果たす。上皮組織においては、細胞周囲を取り囲むベルト状の構造ゾニューラアドヘレンスおよびスポット状のアドヒージョンプラークがアドへレンスジャンクションとしてくくられる。また線維芽細胞や心筋などでは、より非連続的なスポット状のアドへレンスジャンクション構造が存在する。神経系におけるアドへレンスジャンクションも必須の構造として機能している。例えば、側脳室神経上皮細胞は脳室側の頂端部にアドへレンスジャンクションを有し、発生期の大脳皮質の構築に重要な役割を果たす。また、シナプス結合部位の近傍には上皮細胞のアドへレンスジャンクション類似の接着分子を含む構造であるプンクタアドヘレンスジャンクションが形成され、シナプスの形成、維持や可塑性に関与している。アドへレンスジャンクションの接着は主としてカドヘリン-カテニン複合体によって担われ、アクチン骨格系、更には微小管骨格系に連結されているが、その形成過程ではネクチン-アファディン複合体も重要な役割を果たす。}} | ||
==構造とその多様性== | ==構造とその多様性== | ||
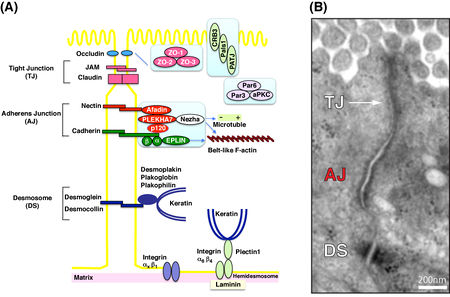
[[ファイル:Maruo.jpg|サムネイル| | [[ファイル:Maruo.jpg|サムネイル|450px|右|'''図. アドヘレンスジャンクション'''<br>(A)上皮細胞における接着構造複合体の模式図<br>(B)同構造の電子顕微鏡写真<br>溝口明先生(三重大学)御供与。]] | ||
アドヘレンスジャンクションは、[[細胞間接着]]構造の一つであり、[[上皮細胞]]の[[電子顕微鏡]] | アドヘレンスジャンクションは、[[細胞間接着]]構造の一つであり、[[上皮細胞]]の[[電子顕微鏡]]観察によって初めて同定された<ref name=ref1><pubmed> 13944428 </pubmed></ref>。その形態学的な特徴は、10-20nmの間隔で向かい合う高電荷密度の斑として見いだされる2細胞の[[形質膜]]および細胞内構造、ロッド状の分子が観察される細胞間隙である<ref name=ref2><pubmed> 7198124 </pubmed></ref><ref name=ref3><pubmed> 11243886 </pubmed></ref><ref name=ref4><pubmed> 20571587 </pubmed></ref><ref name=ref5><pubmed> 20457565 </pubmed></ref>。 | ||
アドヘレンスジャンクションは、ほぼ全ての[[多細胞生物]]に存在する、最も基本的な接着構造の一つである。[[脊椎動物]]では、上皮細胞、[[筋]]、[[線維芽細胞]]や[[神経細胞]]をはじめ、多くの細胞種でこの構造が見いだされる。しかし、それらの細胞が接着する環境などによりその接着様式は異なり、多様な形態が存在する。 | アドヘレンスジャンクションは、ほぼ全ての[[多細胞生物]]に存在する、最も基本的な接着構造の一つである。[[脊椎動物]]では、上皮細胞、[[筋]]、[[線維芽細胞]]や[[神経細胞]]をはじめ、多くの細胞種でこの構造が見いだされる。しかし、それらの細胞が接着する環境などによりその接着様式は異なり、多様な形態が存在する。 | ||
| 18行目: | 20行目: | ||
極性を持った上皮細胞では、アドヘレンスジャンクションは[[ゾニューラアドヘレンス]](zonula adherens)ないし[[ベルト状アドヘレンスジャンクション]]と呼ばれる細胞の周囲を完全に囲う構造に加え、スポット状の[[アドヒージョンプラーク]]として存在しており、細胞の頂端面側から[[密着結合]](tight Junction、TJ、極性上皮ではzunula occludens)、アドヘレンスジャンクション(zonula adherens)、[[デスモソーム]](極性上皮ではmacula adherens)の順に並んだ複合接着装置を形成している('''図''')。 | 極性を持った上皮細胞では、アドヘレンスジャンクションは[[ゾニューラアドヘレンス]](zonula adherens)ないし[[ベルト状アドヘレンスジャンクション]]と呼ばれる細胞の周囲を完全に囲う構造に加え、スポット状の[[アドヒージョンプラーク]]として存在しており、細胞の頂端面側から[[密着結合]](tight Junction、TJ、極性上皮ではzunula occludens)、アドヘレンスジャンクション(zonula adherens)、[[デスモソーム]](極性上皮ではmacula adherens)の順に並んだ複合接着装置を形成している('''図''')。 | ||
一方、線維芽細胞や[[心筋]] | 一方、線維芽細胞や[[心筋]]では点状の非連続的なアドヘレンスジャンクションが<ref name=ref6><pubmed> 7738090 </pubmed></ref>、また神経細胞の[[シナプス]]結合近傍には、[[プンクタアドヘレンスジャンクション]](puncta adherens junction、PAJ)と呼ばれる[[シナプス小胞]]の集積しないアドヘレンスジャンクション様接着構造が存在する<ref name=ref7><pubmed> 4073530 </pubmed></ref>。さらに発生期の神経上皮細胞は[[脳室]]側を頂端面とした[[極性上皮]]様のベルト状アドヘレンスジャンクション構造を持つが、このアドヘレンスジャンクションの脳質側には、密着結合が発生期初期にのみ存在し<ref name=ref8><pubmed> 8954735 </pubmed></ref>、その後アドヘレンスジャンクションとは別の分子構成を持つ接着構造が現れるなど<ref name=ref9><pubmed> 19506035 </pubmed></ref>、他の極性上皮の複合接着装置とは異なる特徴を持つ。このように、アドヘレンスジャンクションは[[動物]]種、細胞種に依存して多様な特性をもつ接着構造であることが明らかになっている。 | ||
==分子構成== | ==分子構成== | ||
アドヘレンスジャンクションの主な構成分子は[[wj:竹市雅俊|竹市]]らの発見した[[カドヘリン]]、およびその細胞内領域結合タンパク質である[[カテニン]]、さらにそれを裏打ちする[[アクチン]] | 細胞間接着構造はおのおの機能的に分化しており、異なった接着分子とその裏打ち分子により構成されている。例えば上皮細胞では、密着結合には4回膜貫通型接着分子である[[オクルーディン]]、[[クローディン]]および[[免疫グロブリンスーパーファミリー]]に属する[[接着分子]][[JAM]]が[[ZO-1]]/[[ZO-2|2]]/[[ZO-3|3]]に裏打ちされてバリア機能を発現しており、また[[デスモソーム]]ではカドヘリンスーパーファミリーに属する接着分子[[デスモグレイン]]、[[デスモコリン]]が、[[アルマジロファミリー]]の[[プラコグロビン]]、[[プラコフィリン]]と[[プラキンファミリー]]の[[デスモプラキン]]を介して[[ケラチン]][[中間径フィラメント]]に接続されている。 | ||
アドヘレンスジャンクションの主な構成分子は[[wj:竹市雅俊|竹市]]らの発見した[[カドヘリン]]、およびその細胞内領域結合タンパク質である[[カテニン]]、さらにそれを裏打ちする[[アクチン]]骨格系である<ref name=ref4></ref><ref name=ref5></ref>。また高井らが同定した、アクチン結合分子[[アファディン]]とそれと結合する[[免疫グロブリンスーパーファミリー]]に属する[[接着分子]][[ネクチン]]もまたアドヘレンスジャンクションに高度に濃縮し、両者は細胞内外でクロストークしてアドヘレンスジャンクション複合体の形成と機能を制御している<ref name=ref10><pubmed> 18648374 </pubmed></ref>。 | |||
=== クラシックカドヘリン === | === クラシックカドヘリン === | ||
カドヘリンはカドヘリンスーパーファミリーに属する一連の[[細胞膜]]貫通型分子の総称であり、アドヘレンスジャンクションで機能するカドヘリンは主に20種類程度の分子群により構成されるクラシックカドヘリンファミリー(当初に発見されたことからこのように呼ばれる)に属する。 | カドヘリンはカドヘリンスーパーファミリーに属する一連の[[細胞膜]]貫通型分子の総称であり、アドヘレンスジャンクションで機能するカドヘリンは主に20種類程度の分子群により構成されるクラシックカドヘリンファミリー(当初に発見されたことからこのように呼ばれる)に属する。 | ||
クラシックカドヘリンはその細胞外にファミリー間で保存された5つのカドヘリンリピートないしECドメインと呼ばれるドメインからなる繰り返し構造を特徴とした細胞外領域、それに続く膜貫通領域と細胞内領域を有する一回膜貫通型の[[細胞接着分子]]である。カドヘリンは[[カルシウムイオン]]依存性に同種分子同士の強固な接着をにない、また高度に保存された細胞内領域でカテニンと結合して細胞内骨格系と細胞膜のアドヘレンスジャンクション分子複合体をつなぐ上で必須の役割を果たしている。カドヘリンやカテニンの機能を阻害するとアドヘレンスジャンクションの形成と維持に障害が生じ、胚形成や、神経系での[[大脳皮質]] | クラシックカドヘリンはその細胞外にファミリー間で保存された5つのカドヘリンリピートないしECドメインと呼ばれるドメインからなる繰り返し構造を特徴とした細胞外領域、それに続く膜貫通領域と細胞内領域を有する一回膜貫通型の[[細胞接着分子]]である。カドヘリンは[[カルシウムイオン]]依存性に同種分子同士の強固な接着をにない、また高度に保存された細胞内領域でカテニンと結合して細胞内骨格系と細胞膜のアドヘレンスジャンクション分子複合体をつなぐ上で必須の役割を果たしている。カドヘリンやカテニンの機能を阻害するとアドヘレンスジャンクションの形成と維持に障害が生じ、胚形成や、神経系での[[大脳皮質]]の構造形成などに重要な機能を果たしていることが明らかになっている。また、シナプス形成や機能においても重要な役割を果たしていることが知られている(後述)<ref name=ref4></ref><ref name=ref5></ref>。 | ||
=== カテニン === | === カテニン === | ||
カテニンはカドヘリンの裏打ち分子として、接着した細胞膜を[[細胞骨格]]系に結びつける重要な働きをになっている。カテニンのうちカドヘリンに結合するのは[[p120カテニン]]と[[カテニン#β–カテニン、プラコグロビン|β-カテニン]]であり、β-カテニンは[[Α-カテニン|α-カテニン]]と結合しカドヘリン-カテニン複合体を形成する。α- | カテニンはカドヘリンの裏打ち分子として、接着した細胞膜を[[細胞骨格]]系に結びつける重要な働きをになっている。カテニンのうちカドヘリンに結合するのは[[p120カテニン]]と[[カテニン#β–カテニン、プラコグロビン|β-カテニン]]であり、β-カテニンは[[Α-カテニン|α-カテニン]]と結合しカドヘリン-カテニン複合体を形成する。α-カテニンがアクチン線維と結合することから、カドヘリン-カテニン系とアクチン線維が連動していることが想定されてきたが、それに反して、カドヘリン-カテニン複合体は直接アクチンには結合しないことが示された<ref name=ref11><pubmed> 16325582 </pubmed></ref>。この問題に関しては、さらに分子メカニズムの解明に大きな進展があった。すなわち、アクチン骨格系とカドヘリン-カテニン系をつなぐものとして、アクチンとα-カテニンに結合する分子[[エプリン]]が同定され、ベルト状アドヘレンスジャンクションの形成に必要であることが解明された<ref name=ref12><pubmed> 18093941 </pubmed></ref>。 | ||
一方、[[p120-カテニン]]は[[PLEKHA7]]と結合し、PLEKHA7が[[微小管]]マイナス端結合分子[[Nezha]]と結合することで、カドヘリン- | 一方、[[p120-カテニン]]は[[PLEKHA7]]と結合し、PLEKHA7が[[微小管]]マイナス端結合分子[[Nezha]]と結合することで、カドヘリン-カテニン系を介してアドヘレンスジャンクションと微小管が連結されることもわかっており<ref name=ref13><pubmed> 19041755 </pubmed></ref>、複雑な細胞骨格系の裏打ちがアドヘレンスジャンクションの機能を制御していることが明らかになりつつある。β-カテニンにはまた、[[Wntシグナル]]経路のメディエーターとしての働きや、シナプスにおけるタンパク質複合体のリンカーとしての働きなどがあり、カドヘリンと共益するアドヘレンスジャンクション形成や機能における役割以外にも重要な分子であるが、それらとアドヘレンスジャンクションの機能を仲介している可能性も示唆されている<ref name=ref14><pubmed> 22617422 </pubmed></ref>。 | ||
=== ネクチン−アファディン複合体 === | === ネクチン−アファディン複合体 === | ||
アドヘレンスジャンクションにおけるもう一つの重要な分子複合体は免疫グロブリンファミリー接着分子ネクチンとその細胞内裏打ち結合タンパク質であるアファディンよりなるものである<ref name=ref15><pubmed> 9334353 </pubmed></ref><ref name=ref16><pubmed> 10225955 </pubmed></ref>。アファディンの全欠損[[マウス]]は胚形成の不全を引き起こし、胎生致死となる<ref name=ref17><pubmed> 10477764 </pubmed></ref>。アファディンはアクチン繊維と直接的に<ref name=ref15></ref>、またPLEKHA7との結合を介して微小管と連結しており<ref name=ref18><pubmed> 23990464 </pubmed></ref>、またネクチン-アファディン系はカドヘリン-カテニン系をアドヘレンスジャンクションに誘導することで、アドヘレンスジャンクションの形成と機能に必須の役割を果たす。 | |||
カドヘリン-カテニン系と異なる点として、ネクチンは異種分子間結合力が同種分子間結合力よりも強く、異なるネクチンを発現する異種細胞間に形成されるアドヘレンスジャンクション形成に重要な役割を果たしていることがある。例えば、[[ネクチン-1]]、[[ネクチン-3|-3]]の[[ノックアウトマウス]]では、[[内耳]]の[[有毛細胞]] | カドヘリン-カテニン系と異なる点として、ネクチンは異種分子間結合力が同種分子間結合力よりも強く、異なるネクチンを発現する異種細胞間に形成されるアドヘレンスジャンクション形成に重要な役割を果たしていることがある。例えば、[[ネクチン-1]]、[[ネクチン-3|-3]]の[[ノックアウトマウス]]では、[[内耳]]の[[有毛細胞]]・支持細胞間の接着に異常が生じ、野生型では起こりえなかった感覚細胞同士の接着が生じてその配列が乱れる<ref name=ref19><pubmed> 21798896 </pubmed></ref>他、全身の多くの臓器でネクチンの異種細胞間アドヘレンスジャンクションにおける機能が明らかになっている<ref name=ref20><pubmed> 23027581 </pubmed></ref>。 | ||
== 神経系における役割 == | == 神経系における役割 == | ||
上述の通り、発生期の神経系でカドヘリンやカテニンの機能を阻害すると、アドヘレンスジャンクションが崩壊して[[大脳皮質]] | 上述の通り、発生期の神経系でカドヘリンやカテニンの機能を阻害すると、アドヘレンスジャンクションが崩壊して[[大脳皮質]]の構造形成に障害が生じる<ref name=ref21><pubmed> 17222817 </pubmed></ref><ref name=ref22><pubmed> 14596855 </pubmed></ref>。同様に、活性化型[[aPKC]]の強制発現マウスやアファディン欠損マウスにおいても、側[[脳室帯]]のアドヘレンスジャンクションの形成不全による異常が生じる<ref name=ref23><pubmed> 16571631 </pubmed></ref><ref name=ref24><pubmed> 24236178 </pubmed></ref>。大脳皮質表層の[[カハール・レチウス細胞]]と神経細胞の接着はネクチン-1とネクチン-3、およびそれらを裏打ちするアファディンに依存しており、これらの異常もまた、大脳皮質形成に障害を来す<ref name=ref25><pubmed> 23931996 </pubmed></ref>。 | ||
このように、大脳皮質形成においてアドヘレンスジャンクションは多くの局面で重要な役割を果たしており、その機能を阻害すると層構造の異常や水頭症など様々な形でマクロな表現型を来す。また、[[軸索]]側のネクチン−1と[[樹状突起]]側のネクチン- | このように、大脳皮質形成においてアドヘレンスジャンクションは多くの局面で重要な役割を果たしており、その機能を阻害すると層構造の異常や水頭症など様々な形でマクロな表現型を来す。また、[[軸索]]側のネクチン−1と[[樹状突起]]側のネクチン-3は共益して働き、神経細胞の軸索と樹状突起がお互いを認識して接着し、正しくシナプスを形成する過程に重要な役割を果たしている<ref name=ref26><pubmed> 11827984 </pubmed></ref><ref name=ref27><pubmed> 16801389 </pubmed></ref> 。さらに、カドヘリン、カテニンはシナプス近傍のプンクタアドヘレンスジャンクションに集積し、生化学的には[[シナプス後肥厚部]]分画にも一部濃縮されており、形成過程のみならず、成熟したシナプスにおいても多様な役割を果たしている<ref name=ref28><pubmed> 8909549 </pubmed></ref><ref name=ref29><pubmed> 12123610 </pubmed></ref><ref name=ref30><pubmed> 15034585 </pubmed></ref><ref name=ref31><pubmed> 17481398 </pubmed></ref><ref name=ref32><pubmed> 22138644 </pubmed></ref>。 | ||
== アドヘレンスジャンクションにおけるタンパク質複合体の動的平衡 == | == アドヘレンスジャンクションにおけるタンパク質複合体の動的平衡 == | ||
アドヘレンスジャンクションは強固な結合をになう一方で、アドヘレンスジャンクションを構成する細胞が分裂、侵入し、また排除されるといった動的な側面を併せ持ち、また維持過程においても常に構成分子が入れ替わる動的平行状態にある。主要な接着分子であるカドヘリンは、成熟したアドヘレンスジャンクションにおいては、膜上の拡散よりもむしろ[[エンドサイトーシス]]と[[エクソサイトーシス]]による小胞リサイクリング過程によってその動的平衡を保っていることが明らかになりつつある。この過程にはアクチン動態、[[Rhoファミリー低分子量Gタンパク質]]、[[細胞極性]]制御因子[[Par]]などが関わっている。このようなアドヘレンスジャンクションの動的特性は、組織と器官の形態形成に重要な役割を果たしている<ref name=ref33><pubmed> 21422226 </pubmed></ref>。 | |||
== | == ヒト疾患との関係 == | ||
多岐にわたる[[ヒト]]疾患と、アドヘレンスジャンクション構成因子の遺伝的な異常の関係性が示唆されている。 | 多岐にわたる[[ヒト]]疾患と、アドヘレンスジャンクション構成因子の遺伝的な異常の関係性が示唆されている。 | ||
神経系疾患としては、[[知的障害]](Intellectual disability, ID)と[[M-カドヘリン]]([[CDH15]])の複数の[[点変異]](細胞接着活性が著しく低下する)が関連していること | 神経系疾患としては、[[知的障害]](Intellectual disability, ID)と[[M-カドヘリン]]([[CDH15]])の複数の[[点変異]](細胞接着活性が著しく低下する)が関連していること<ref name=ref34><pubmed> 19012874 </pubmed></ref>、重度の知的障害、[[小頭症]]および[[痙縮]]を呈する複数の患者とβ-カテニンのヘテロの[[フレームシフト変異]]が関連していること<ref name=ref35><pubmed> 23033978 </pubmed></ref>、[[若年性網膜黄斑変性]]を伴う[[先天性貧毛症]]の原因遺伝子として[[P-カドヘリン]]([[CDH3]])が<ref name=ref36><pubmed> 11544476 </pubmed></ref>、[[精神発達遅滞]]を伴うことがあり[[口唇口蓋裂]]を主な症状とする[[マルガリータ島症候群]]の原因遺伝子としてネクチン−1が同定されたこと<ref name=ref37><pubmed> 10932188 </pubmed></ref>などが知られている。 | ||
浸潤性の上皮性の[[がん]]においては、アドヘレンスジャンクション接着分子の発現量の異常が観察され、[[上皮間葉転換]](epithelial-mesenchymal transition, EMT)をおこし、カドヘリンの発現量が減少して接着から乖離し、運動性を向上させる。[[胃がん]]においては、家族性のものが見つかっており、やはり[[E-カドヘリン]] | 浸潤性の上皮性の[[がん]]においては、アドヘレンスジャンクション接着分子の発現量の異常が観察され、[[上皮間葉転換]](epithelial-mesenchymal transition, EMT)をおこし、カドヘリンの発現量が減少して接着から乖離し、運動性を向上させる。[[胃がん]]においては、家族性のものが見つかっており、やはり[[E-カドヘリン]]の変異により上皮間葉転換がおこり、悪性度の高い胃がんが生じることが判明している<ref name=ref38><pubmed> 9537325 </pubmed></ref>。 | ||
さらにネクチンは当初各種[[ウイルス]]の受容体として同定されてきた経緯を持ち、ネクチン-1、−2は[[wj: | さらにネクチンは当初各種[[ウイルス]]の受容体として同定されてきた経緯を持ち、ネクチン-1、−2は[[wj:単純ヘルペスウイルス|単純ヘルペスウイルス]]の<ref name=ref10></ref>、ネクチン−4は[[wj:麻疹ウイルス|麻疹ウイルス]]<ref name=ref39><pubmed> 22048310 </pubmed></ref>をはじめとした、各種ウイルスの受容体としてその生活環に関与している。 | ||
==関連項目== | ==関連項目== | ||
| 62行目: | 66行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2015年12月30日 (水) 15:36時点における最新版
丸尾 知彦、高井 義美
神戸大学 大学院 医学研究科
DOI:10.14931/bsd.6623 原稿受付日:2015年12月29日 原稿完成日:2015年12月30日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英:adherence junction 英略称:AJ 独:Adhäsionsverbindungen
同義語:接着結合
アドへレンスジャンクションは細胞間接合部位において形成される、タンパク質複合体からなる機能構造体である。アドへレンスジャンクションは主として物理的に強固な細胞間接着をにない、発生期の器官形成や生体の恒常性に重要な役割を果たす。上皮組織においては、細胞周囲を取り囲むベルト状の構造ゾニューラアドヘレンスおよびスポット状のアドヒージョンプラークがアドへレンスジャンクションとしてくくられる。また線維芽細胞や心筋などでは、より非連続的なスポット状のアドへレンスジャンクション構造が存在する。神経系におけるアドへレンスジャンクションも必須の構造として機能している。例えば、側脳室神経上皮細胞は脳室側の頂端部にアドへレンスジャンクションを有し、発生期の大脳皮質の構築に重要な役割を果たす。また、シナプス結合部位の近傍には上皮細胞のアドへレンスジャンクション類似の接着分子を含む構造であるプンクタアドヘレンスジャンクションが形成され、シナプスの形成、維持や可塑性に関与している。アドへレンスジャンクションの接着は主としてカドヘリン-カテニン複合体によって担われ、アクチン骨格系、更には微小管骨格系に連結されているが、その形成過程ではネクチン-アファディン複合体も重要な役割を果たす。
構造とその多様性
アドヘレンスジャンクションは、細胞間接着構造の一つであり、上皮細胞の電子顕微鏡観察によって初めて同定された[1]。その形態学的な特徴は、10-20nmの間隔で向かい合う高電荷密度の斑として見いだされる2細胞の形質膜および細胞内構造、ロッド状の分子が観察される細胞間隙である[2][3][4][5]。
アドヘレンスジャンクションは、ほぼ全ての多細胞生物に存在する、最も基本的な接着構造の一つである。脊椎動物では、上皮細胞、筋、線維芽細胞や神経細胞をはじめ、多くの細胞種でこの構造が見いだされる。しかし、それらの細胞が接着する環境などによりその接着様式は異なり、多様な形態が存在する。
極性を持った上皮細胞では、アドヘレンスジャンクションはゾニューラアドヘレンス(zonula adherens)ないしベルト状アドヘレンスジャンクションと呼ばれる細胞の周囲を完全に囲う構造に加え、スポット状のアドヒージョンプラークとして存在しており、細胞の頂端面側から密着結合(tight Junction、TJ、極性上皮ではzunula occludens)、アドヘレンスジャンクション(zonula adherens)、デスモソーム(極性上皮ではmacula adherens)の順に並んだ複合接着装置を形成している(図)。
一方、線維芽細胞や心筋では点状の非連続的なアドヘレンスジャンクションが[6]、また神経細胞のシナプス結合近傍には、プンクタアドヘレンスジャンクション(puncta adherens junction、PAJ)と呼ばれるシナプス小胞の集積しないアドヘレンスジャンクション様接着構造が存在する[7]。さらに発生期の神経上皮細胞は脳室側を頂端面とした極性上皮様のベルト状アドヘレンスジャンクション構造を持つが、このアドヘレンスジャンクションの脳質側には、密着結合が発生期初期にのみ存在し[8]、その後アドヘレンスジャンクションとは別の分子構成を持つ接着構造が現れるなど[9]、他の極性上皮の複合接着装置とは異なる特徴を持つ。このように、アドヘレンスジャンクションは動物種、細胞種に依存して多様な特性をもつ接着構造であることが明らかになっている。
分子構成
細胞間接着構造はおのおの機能的に分化しており、異なった接着分子とその裏打ち分子により構成されている。例えば上皮細胞では、密着結合には4回膜貫通型接着分子であるオクルーディン、クローディンおよび免疫グロブリンスーパーファミリーに属する接着分子JAMがZO-1/2/3に裏打ちされてバリア機能を発現しており、またデスモソームではカドヘリンスーパーファミリーに属する接着分子デスモグレイン、デスモコリンが、アルマジロファミリーのプラコグロビン、プラコフィリンとプラキンファミリーのデスモプラキンを介してケラチン中間径フィラメントに接続されている。
アドヘレンスジャンクションの主な構成分子は竹市らの発見したカドヘリン、およびその細胞内領域結合タンパク質であるカテニン、さらにそれを裏打ちするアクチン骨格系である[4][5]。また高井らが同定した、アクチン結合分子アファディンとそれと結合する免疫グロブリンスーパーファミリーに属する接着分子ネクチンもまたアドヘレンスジャンクションに高度に濃縮し、両者は細胞内外でクロストークしてアドヘレンスジャンクション複合体の形成と機能を制御している[10]。
クラシックカドヘリン
カドヘリンはカドヘリンスーパーファミリーに属する一連の細胞膜貫通型分子の総称であり、アドヘレンスジャンクションで機能するカドヘリンは主に20種類程度の分子群により構成されるクラシックカドヘリンファミリー(当初に発見されたことからこのように呼ばれる)に属する。
クラシックカドヘリンはその細胞外にファミリー間で保存された5つのカドヘリンリピートないしECドメインと呼ばれるドメインからなる繰り返し構造を特徴とした細胞外領域、それに続く膜貫通領域と細胞内領域を有する一回膜貫通型の細胞接着分子である。カドヘリンはカルシウムイオン依存性に同種分子同士の強固な接着をにない、また高度に保存された細胞内領域でカテニンと結合して細胞内骨格系と細胞膜のアドヘレンスジャンクション分子複合体をつなぐ上で必須の役割を果たしている。カドヘリンやカテニンの機能を阻害するとアドヘレンスジャンクションの形成と維持に障害が生じ、胚形成や、神経系での大脳皮質の構造形成などに重要な機能を果たしていることが明らかになっている。また、シナプス形成や機能においても重要な役割を果たしていることが知られている(後述)[4][5]。
カテニン
カテニンはカドヘリンの裏打ち分子として、接着した細胞膜を細胞骨格系に結びつける重要な働きをになっている。カテニンのうちカドヘリンに結合するのはp120カテニンとβ-カテニンであり、β-カテニンはα-カテニンと結合しカドヘリン-カテニン複合体を形成する。α-カテニンがアクチン線維と結合することから、カドヘリン-カテニン系とアクチン線維が連動していることが想定されてきたが、それに反して、カドヘリン-カテニン複合体は直接アクチンには結合しないことが示された[11]。この問題に関しては、さらに分子メカニズムの解明に大きな進展があった。すなわち、アクチン骨格系とカドヘリン-カテニン系をつなぐものとして、アクチンとα-カテニンに結合する分子エプリンが同定され、ベルト状アドヘレンスジャンクションの形成に必要であることが解明された[12]。
一方、p120-カテニンはPLEKHA7と結合し、PLEKHA7が微小管マイナス端結合分子Nezhaと結合することで、カドヘリン-カテニン系を介してアドヘレンスジャンクションと微小管が連結されることもわかっており[13]、複雑な細胞骨格系の裏打ちがアドヘレンスジャンクションの機能を制御していることが明らかになりつつある。β-カテニンにはまた、Wntシグナル経路のメディエーターとしての働きや、シナプスにおけるタンパク質複合体のリンカーとしての働きなどがあり、カドヘリンと共益するアドヘレンスジャンクション形成や機能における役割以外にも重要な分子であるが、それらとアドヘレンスジャンクションの機能を仲介している可能性も示唆されている[14]。
ネクチン−アファディン複合体
アドヘレンスジャンクションにおけるもう一つの重要な分子複合体は免疫グロブリンファミリー接着分子ネクチンとその細胞内裏打ち結合タンパク質であるアファディンよりなるものである[15][16]。アファディンの全欠損マウスは胚形成の不全を引き起こし、胎生致死となる[17]。アファディンはアクチン繊維と直接的に[15]、またPLEKHA7との結合を介して微小管と連結しており[18]、またネクチン-アファディン系はカドヘリン-カテニン系をアドヘレンスジャンクションに誘導することで、アドヘレンスジャンクションの形成と機能に必須の役割を果たす。
カドヘリン-カテニン系と異なる点として、ネクチンは異種分子間結合力が同種分子間結合力よりも強く、異なるネクチンを発現する異種細胞間に形成されるアドヘレンスジャンクション形成に重要な役割を果たしていることがある。例えば、ネクチン-1、-3のノックアウトマウスでは、内耳の有毛細胞・支持細胞間の接着に異常が生じ、野生型では起こりえなかった感覚細胞同士の接着が生じてその配列が乱れる[19]他、全身の多くの臓器でネクチンの異種細胞間アドヘレンスジャンクションにおける機能が明らかになっている[20]。
神経系における役割
上述の通り、発生期の神経系でカドヘリンやカテニンの機能を阻害すると、アドヘレンスジャンクションが崩壊して大脳皮質の構造形成に障害が生じる[21][22]。同様に、活性化型aPKCの強制発現マウスやアファディン欠損マウスにおいても、側脳室帯のアドヘレンスジャンクションの形成不全による異常が生じる[23][24]。大脳皮質表層のカハール・レチウス細胞と神経細胞の接着はネクチン-1とネクチン-3、およびそれらを裏打ちするアファディンに依存しており、これらの異常もまた、大脳皮質形成に障害を来す[25]。
このように、大脳皮質形成においてアドヘレンスジャンクションは多くの局面で重要な役割を果たしており、その機能を阻害すると層構造の異常や水頭症など様々な形でマクロな表現型を来す。また、軸索側のネクチン−1と樹状突起側のネクチン-3は共益して働き、神経細胞の軸索と樹状突起がお互いを認識して接着し、正しくシナプスを形成する過程に重要な役割を果たしている[26][27] 。さらに、カドヘリン、カテニンはシナプス近傍のプンクタアドヘレンスジャンクションに集積し、生化学的にはシナプス後肥厚部分画にも一部濃縮されており、形成過程のみならず、成熟したシナプスにおいても多様な役割を果たしている[28][29][30][31][32]。
アドヘレンスジャンクションにおけるタンパク質複合体の動的平衡
アドヘレンスジャンクションは強固な結合をになう一方で、アドヘレンスジャンクションを構成する細胞が分裂、侵入し、また排除されるといった動的な側面を併せ持ち、また維持過程においても常に構成分子が入れ替わる動的平行状態にある。主要な接着分子であるカドヘリンは、成熟したアドヘレンスジャンクションにおいては、膜上の拡散よりもむしろエンドサイトーシスとエクソサイトーシスによる小胞リサイクリング過程によってその動的平衡を保っていることが明らかになりつつある。この過程にはアクチン動態、Rhoファミリー低分子量Gタンパク質、細胞極性制御因子Parなどが関わっている。このようなアドヘレンスジャンクションの動的特性は、組織と器官の形態形成に重要な役割を果たしている[33]。
ヒト疾患との関係
多岐にわたるヒト疾患と、アドヘレンスジャンクション構成因子の遺伝的な異常の関係性が示唆されている。
神経系疾患としては、知的障害(Intellectual disability, ID)とM-カドヘリン(CDH15)の複数の点変異(細胞接着活性が著しく低下する)が関連していること[34]、重度の知的障害、小頭症および痙縮を呈する複数の患者とβ-カテニンのヘテロのフレームシフト変異が関連していること[35]、若年性網膜黄斑変性を伴う先天性貧毛症の原因遺伝子としてP-カドヘリン(CDH3)が[36]、精神発達遅滞を伴うことがあり口唇口蓋裂を主な症状とするマルガリータ島症候群の原因遺伝子としてネクチン−1が同定されたこと[37]などが知られている。
浸潤性の上皮性のがんにおいては、アドヘレンスジャンクション接着分子の発現量の異常が観察され、上皮間葉転換(epithelial-mesenchymal transition, EMT)をおこし、カドヘリンの発現量が減少して接着から乖離し、運動性を向上させる。胃がんにおいては、家族性のものが見つかっており、やはりE-カドヘリンの変異により上皮間葉転換がおこり、悪性度の高い胃がんが生じることが判明している[38]。
さらにネクチンは当初各種ウイルスの受容体として同定されてきた経緯を持ち、ネクチン-1、−2は単純ヘルペスウイルスの[10]、ネクチン−4は麻疹ウイルス[39]をはじめとした、各種ウイルスの受容体としてその生活環に関与している。
関連項目
参考文献
- ↑
FARQUHAR, M.G., & PALADE, G.E. (1963).
Junctional complexes in various epithelia. The Journal of cell biology, 17, 375-412. [PubMed:13944428] [PMC] [WorldCat] [DOI] - ↑
Hirokawa, N., & Heuser, J.E. (1981).
Quick-freeze, deep-etch visualization of the cytoskeleton beneath surface differentiations of intestinal epithelial cells. The Journal of cell biology, 91(2 Pt 1), 399-409. [PubMed:7198124] [PMC] [WorldCat] [DOI] - ↑
Miyaguchi, K. (2000).
Ultrastructure of the zonula adherens revealed by rapid-freeze deep-etching. Journal of structural biology, 132(3), 169-78. [PubMed:11243886] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Harris, T.J., & Tepass, U. (2010).
Adherens junctions: from molecules to morphogenesis. Nature reviews. Molecular cell biology, 11(7), 502-14. [PubMed:20571587] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Meng, W., & Takeichi, M. (2009).
Adherens junction: molecular architecture and regulation. Cold Spring Harbor perspectives in biology, 1(6), a002899. [PubMed:20457565] [PMC] [WorldCat] [DOI] - ↑
Yonemura, S., Itoh, M., Nagafuchi, A., & Tsukita, S. (1995).
Cell-to-cell adherens junction formation and actin filament organization: similarities and differences between non-polarized fibroblasts and polarized epithelial cells. Journal of cell science, 108 ( Pt 1), 127-42. [PubMed:7738090] [WorldCat] - ↑
Spacek, J. (1985).
Relationships between synaptic junctions, puncta adhaerentia and the spine apparatus at neocortical axo-spinous synapses. A serial section study. Anatomy and embryology, 173(1), 129-35. [PubMed:4073530] [WorldCat] [DOI] - ↑
Aaku-Saraste, E., Hellwig, A., & Huttner, W.B. (1996).
Loss of occludin and functional tight junctions, but not ZO-1, during neural tube closure--remodeling of the neuroepithelium prior to neurogenesis. Developmental biology, 180(2), 664-79. [PubMed:8954735] [WorldCat] [DOI] - ↑
Ishiuchi, T., Misaki, K., Yonemura, S., Takeichi, M., & Tanoue, T. (2009).
Mammalian Fat and Dachsous cadherins regulate apical membrane organization in the embryonic cerebral cortex. The Journal of cell biology, 185(6), 959-67. [PubMed:19506035] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Takai, Y., Miyoshi, J., Ikeda, W., & Ogita, H. (2008).
Nectins and nectin-like molecules: roles in contact inhibition of cell movement and proliferation. Nature reviews. Molecular cell biology, 9(8), 603-15. [PubMed:18648374] [WorldCat] [DOI] - ↑
Yamada, S., Pokutta, S., Drees, F., Weis, W.I., & Nelson, W.J. (2005).
Deconstructing the cadherin-catenin-actin complex. Cell, 123(5), 889-901. [PubMed:16325582] [PMC] [WorldCat] [DOI] - ↑
Abe, K., & Takeichi, M. (2008).
EPLIN mediates linkage of the cadherin catenin complex to F-actin and stabilizes the circumferential actin belt. Proceedings of the National Academy of Sciences of the United States of America, 105(1), 13-9. [PubMed:18093941] [PMC] [WorldCat] [DOI] - ↑
Meng, W., Mushika, Y., Ichii, T., & Takeichi, M. (2008).
Anchorage of microtubule minus ends to adherens junctions regulates epithelial cell-cell contacts. Cell, 135(5), 948-59. [PubMed:19041755] [WorldCat] [DOI] - ↑
Valenta, T., Hausmann, G., & Basler, K. (2012).
The many faces and functions of β-catenin. The EMBO journal, 31(12), 2714-36. [PubMed:22617422] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Mandai, K., Nakanishi, H., Satoh, A., Obaishi, H., Wada, M., Nishioka, H., ..., & Takai, Y. (1997).
Afadin: A novel actin filament-binding protein with one PDZ domain localized at cadherin-based cell-to-cell adherens junction. The Journal of cell biology, 139(2), 517-28. [PubMed:9334353] [PMC] [WorldCat] [DOI] - ↑
Takahashi, K., Nakanishi, H., Miyahara, M., Mandai, K., Satoh, K., Satoh, A., ..., & Takai, Y. (1999).
Nectin/PRR: an immunoglobulin-like cell adhesion molecule recruited to cadherin-based adherens junctions through interaction with Afadin, a PDZ domain-containing protein. The Journal of cell biology, 145(3), 539-49. [PubMed:10225955] [PMC] [WorldCat] [DOI] - ↑
Ikeda, W., Nakanishi, H., Miyoshi, J., Mandai, K., Ishizaki, H., Tanaka, M., ..., & Takai, Y. (1999).
Afadin: A key molecule essential for structural organization of cell-cell junctions of polarized epithelia during embryogenesis. The Journal of cell biology, 146(5), 1117-32. [PubMed:10477764] [PMC] [WorldCat] [DOI] - ↑
Kurita, S., Yamada, T., Rikitsu, E., Ikeda, W., & Takai, Y. (2013).
Binding between the junctional proteins afadin and PLEKHA7 and implication in the formation of adherens junction in epithelial cells. The Journal of biological chemistry, 288(41), 29356-68. [PubMed:23990464] [PMC] [WorldCat] [DOI] - ↑
Togashi, H., Kominami, K., Waseda, M., Komura, H., Miyoshi, J., Takeichi, M., & Takai, Y. (2011).
Nectins establish a checkerboard-like cellular pattern in the auditory epithelium. Science (New York, N.Y.), 333(6046), 1144-7. [PubMed:21798896] [WorldCat] [DOI] - ↑
Rikitake, Y., Mandai, K., & Takai, Y. (2012).
The role of nectins in different types of cell-cell adhesion. Journal of cell science, 125(Pt 16), 3713-22. [PubMed:23027581] [WorldCat] [DOI] - ↑
Kadowaki, M., Nakamura, S., Machon, O., Krauss, S., Radice, G.L., & Takeichi, M. (2007).
N-cadherin mediates cortical organization in the mouse brain. Developmental biology, 304(1), 22-33. [PubMed:17222817] [WorldCat] [DOI] - ↑
Machon, O., van den Bout, C.J., Backman, M., Kemler, R., & Krauss, S. (2003).
Role of beta-catenin in the developing cortical and hippocampal neuroepithelium. Neuroscience, 122(1), 129-43. [PubMed:14596855] [WorldCat] [DOI] - ↑
Imai, F., Hirai, S., Akimoto, K., Koyama, H., Miyata, T., Ogawa, M., ..., & Ohno, S. (2006).
Inactivation of aPKClambda results in the loss of adherens junctions in neuroepithelial cells without affecting neurogenesis in mouse neocortex. Development (Cambridge, England), 133(9), 1735-44. [PubMed:16571631] [WorldCat] [DOI] - ↑
Yamamoto, H., Maruo, T., Majima, T., Ishizaki, H., Tanaka-Okamoto, M., Miyoshi, J., ..., & Takai, Y. (2013).
Genetic deletion of afadin causes hydrocephalus by destruction of adherens junctions in radial glial and ependymal cells in the midbrain. PloS one, 8(11), e80356. [PubMed:24236178] [PMC] [WorldCat] [DOI] - ↑
Gil-Sanz, C., Franco, S.J., Martinez-Garay, I., Espinosa, A., Harkins-Perry, S., & Müller, U. (2013).
Cajal-Retzius cells instruct neuronal migration by coincidence signaling between secreted and contact-dependent guidance cues. Neuron, 79(3), 461-77. [PubMed:23931996] [PMC] [WorldCat] [DOI] - ↑
Mizoguchi, A., Nakanishi, H., Kimura, K., Matsubara, K., Ozaki-Kuroda, K., Katata, T., ..., & Takai, Y. (2002).
Nectin: an adhesion molecule involved in formation of synapses. The Journal of cell biology, 156(3), 555-65. [PubMed:11827984] [PMC] [WorldCat] [DOI] - ↑
Togashi, H., Miyoshi, J., Honda, T., Sakisaka, T., Takai, Y., & Takeichi, M. (2006).
Interneurite affinity is regulated by heterophilic nectin interactions in concert with the cadherin machinery. The Journal of cell biology, 174(1), 141-51. [PubMed:16801389] [PMC] [WorldCat] [DOI] - ↑
Uchida, N., Honjo, Y., Johnson, K.R., Wheelock, M.J., & Takeichi, M. (1996).
The catenin/cadherin adhesion system is localized in synaptic junctions bordering transmitter release zones. The Journal of cell biology, 135(3), 767-79. [PubMed:8909549] [PMC] [WorldCat] [DOI] - ↑
Togashi, H., Abe, K., Mizoguchi, A., Takaoka, K., Chisaka, O., & Takeichi, M. (2002).
Cadherin regulates dendritic spine morphogenesis. Neuron, 35(1), 77-89. [PubMed:12123610] [WorldCat] [DOI] - ↑
Abe, K., Chisaka, O., Van Roy, F., & Takeichi, M. (2004).
Stability of dendritic spines and synaptic contacts is controlled by alpha N-catenin. Nature neuroscience, 7(4), 357-63. [PubMed:15034585] [WorldCat] [DOI] - ↑
Saglietti, L., Dequidt, C., Kamieniarz, K., Rousset, M.C., Valnegri, P., Thoumine, O., ..., & Passafaro, M. (2007).
Extracellular interactions between GluR2 and N-cadherin in spine regulation. Neuron, 54(3), 461-77. [PubMed:17481398] [WorldCat] [DOI] - ↑
Vitureira, N., Letellier, M., White, I.J., & Goda, Y. (2011).
Differential control of presynaptic efficacy by postsynaptic N-cadherin and β-catenin. Nature neuroscience, 15(1), 81-9. [PubMed:22138644] [PMC] [WorldCat] [DOI] - ↑
Baum, B., & Georgiou, M. (2011).
Dynamics of adherens junctions in epithelial establishment, maintenance, and remodeling. The Journal of cell biology, 192(6), 907-17. [PubMed:21422226] [PMC] [WorldCat] [DOI] - ↑
Bhalla, K., Luo, Y., Buchan, T., Beachem, M.A., Guzauskas, G.F., Ladd, S., ..., & Srivastava, A.K. (2008).
Alterations in CDH15 and KIRREL3 in patients with mild to severe intellectual disability. American journal of human genetics, 83(6), 703-13. [PubMed:19012874] [PMC] [WorldCat] [DOI] - ↑
de Ligt, J., Willemsen, M.H., van Bon, B.W., Kleefstra, T., Yntema, H.G., Kroes, T., ..., & Vissers, L.E. (2012).
Diagnostic exome sequencing in persons with severe intellectual disability. The New England journal of medicine, 367(20), 1921-9. [PubMed:23033978] [WorldCat] [DOI] - ↑
Sprecher, E., Bergman, R., Richard, G., Lurie, R., Shalev, S., Petronius, D., ..., & Szargel, R. (2001).
Hypotrichosis with juvenile macular dystrophy is caused by a mutation in CDH3, encoding P-cadherin. Nature genetics, 29(2), 134-6. [PubMed:11544476] [WorldCat] [DOI] - ↑
Suzuki, K., Hu, D., Bustos, T., Zlotogora, J., Richieri-Costa, A., Helms, J.A., & Spritz, R.A. (2000).
Mutations of PVRL1, encoding a cell-cell adhesion molecule/herpesvirus receptor, in cleft lip/palate-ectodermal dysplasia. Nature genetics, 25(4), 427-30. [PubMed:10932188] [WorldCat] [DOI] - ↑
Guilford, P., Hopkins, J., Harraway, J., McLeod, M., McLeod, N., Harawira, P., ..., & Reeve, A.E. (1998).
E-cadherin germline mutations in familial gastric cancer. Nature, 392(6674), 402-5. [PubMed:9537325] [WorldCat] [DOI] - ↑
Mühlebach, M.D., Mateo, M., Sinn, P.L., Prüfer, S., Uhlig, K.M., Leonard, V.H., ..., & Cattaneo, R. (2011).
Adherens junction protein nectin-4 is the epithelial receptor for measles virus. Nature, 480(7378), 530-3. [PubMed:22048310] [PMC] [WorldCat] [DOI]