シナプシン
山肩 葉子
生理学研究所生体情報研究系神経シグナル研究部門
DOI:10.14931/bsd.5428 原稿受付日:2014年10月1日 原稿完成日:2014年10月3日
担当編集委員:林 康紀(独立行政法人理化学研究所)
| Synapsin I | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Structure of the C domain of synapsin IA. PDB rendering based on 1auv. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | SYN1; SYN1a; SYN1b; SYNI | ||||||||||||
| External IDs | OMIM: 313440 MGI: 98460 HomoloGene: 48483 GeneCards: SYN1 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 6853 | 20964 | |||||||||||
| Ensembl | ENSG00000008056 | ENSMUSG00000037217 | |||||||||||
| UniProt | P17600 | O88935 | |||||||||||
| RefSeq (mRNA) | NM_006950 | NM_001110780 | |||||||||||
| RefSeq (protein) | NP_008881 | NP_001104250 | |||||||||||
| Location (UCSC) |
Chr X: 47.43 – 47.48 Mb |
Chr X: 20.86 – 20.92 Mb | |||||||||||
| PubMed search | [1] | [2] | |||||||||||
| Synapsin II | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Structure of the C domain of synapsin II. PDB rendering based on 1i7l. | |||||||||||||
| Identifiers | |||||||||||||
| Symbols | SYN2; SYNII; SYNIIa; SYNIIb | ||||||||||||
| External IDs | OMIM: 600755 MGI: 103020 HomoloGene: 49348 GeneCards: SYN2 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 6854 | 20965 | |||||||||||
| Ensembl | ENSG00000157152 | ENSMUSG00000009394 | |||||||||||
| UniProt | Q86VA8 | Q64332 | |||||||||||
| RefSeq (mRNA) | NM_003178 | NM_001111015 | |||||||||||
| RefSeq (protein) | NP_003169 | NP_001104485 | |||||||||||
| Location (UCSC) |
Chr 3: 12.05 – 12.23 Mb |
Chr 6: 115.13 – 115.28 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
| Synapsin III | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Structure of synapsin III C domain in complex with AMPPNP. PDB rendering based on 2p0a. | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbol | SYN3 | ||||||||||||
| External IDs | OMIM: 602705 MGI: 1351334 HomoloGene: 68320 GeneCards: SYN3 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 8224 | 27204 | |||||||||||
| Ensembl | ENSG00000185666 | ENSMUSG00000059602 | |||||||||||
| UniProt | O14994 | Q8JZP2 | |||||||||||
| RefSeq (mRNA) | NM_001135774 | NM_001164495 | |||||||||||
| RefSeq (protein) | NP_001129246 | NP_001157967 | |||||||||||
| Location (UCSC) |
Chr 22: 32.91 – 33.45 Mb |
Chr 10: 86.06 – 86.5 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
英語名:synapsin
同義語:プロテインI 、III
シナプシンは、神経系に広く分布する非膜貫通型のシナプス小胞結合タンパク質で、神経終末に局在している。系統発生学的に1つの共通遺伝子から派生した遺伝子ファミリーを構成し、哺乳類では3つの遺伝子から成るシナプシンI、II、IIIが存在する。中でも、シナプシンIとIIは、複数のプロテインキナーゼ、ホスファターゼによって刺激依存的にリン酸化・脱リン酸化を受け、その結果、シナプス小胞や細胞骨格タンパク質への結合状態が変化することから、リン酸化によってシナプス小胞の局在を制御するタンパク質として、注目を集めてきた。近年、ノックアウトマウスの解析等から、シナプシンI、IIは、シナプス前部においてシナプス小胞の予備のプールを維持・安定化するために不可欠の分子であり、連続刺激の際にシナプス小胞を動員し、シナプス抑圧を制限する上で、重要な役割を果たすことがわかってきた。
シナプシンとは
シナプシンは、1970年代にPaul Greengard教授らのグループが、ラット脳のシナプス膜画分でcAMP依存性プロテインキナーゼ(プロテインキナーゼA、PKA)によってリン酸化される主要なタンパク質のひとつとして発見した[1] [2]。これらのリン酸化タンパク質は、プロテインI、プロテインIIと命名され、さらに、プロテインIIIが見いだされた。このうち、プロテインIとIIIは脳に特異的に発現し、シナプス膜画分、特にシナプス小胞画分に多く存在することから、シナプシンI、IIと改名された。一方、プロテインIIは脳以外にも広く分布し、PKAの調節サブユニットであることが判明した。
生化学的なタンパク質精製の結果、シナプシンIは86kDaと80kDaの2つのアイソフォーム(IaとIb)から、シナプシンIIは74kDaと55kDaの2つのアイソフォーム(IIaとIIb)からなることがわかった。また、シナプトソームを用いて、脱分極刺激など細胞内へのCa2+流入を起こすような刺激や、ドーパミン、セロトニン、ノルアドレナリンなど細胞内のcAMPを上昇させるような刺激を与えると、シナプシンI、IIのリン酸化が増大することがわかった。これらリン酸化が、シナプシンのシナプス小胞や細胞骨格タンパク質への結合を劇的に低下させることから、「シナプシンとそのリン酸化によるシナプス小胞の局在の調節」というモデルが提唱された[3] [4]。
神経終末におけるシナプス小胞は、形質膜から離れたところに存在する予備のプールと、刺激が到達した際に直ちに放出可能な形質膜直下のプールを含むリサイクルプールとに大別され、予備のプールが80-90%と大部分を占める。上述の古典的モデルでは、特に、Ca2+/カルモジュリン依存性プロテインキナーゼII(CaMKII)によるシナプシンIのリン酸化が、予備のプールから放出可能なプールへのシナプス小胞の移行を促進しているのではないか、と提唱された。
その後、シナプシンI、II、III遺伝子のノックアウトマウスの作製・解析が進み、近年ではシナプシンI、IIが相補的な役割を果たすと理解され、これらが2量体を形成し、2価性にシナプス小胞に結合して架橋することにより、神経終末においてシナプス小胞の予備のプールを維持・安定化する上で必須の分子であること、またその結果、連続刺激の際に放出可能なシナプス小胞を動員し、シナプス抑圧を制限する上で、特に重要な役割を果たすことがわかってきた[1] [2] [5]。
リン酸化によるシナプシンのタンパク質機能の修飾についても、シナプシンIに特異的なカルボキシル末端側のCaMKIIによるリン酸化よりもむしろ、各シナプシンアイソフォームに共通の、アミノ末端側におけるPKAあるいはCa2+/カルモジュリン依存性プロテインキナーゼI(CaMKI)によるリン酸化に注目が集まりつつある[5]。
一方、シナプシンIIIは、相同性のある遺伝子の検索によって見いだされたアイソフォームであり、シナプシンI、IIとは局在や発現時期が異なることから、異なる機能を果たすものと考えられる。
アイソフォームとドメイン構造
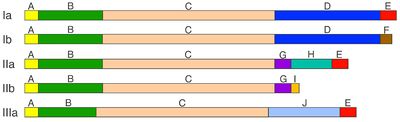
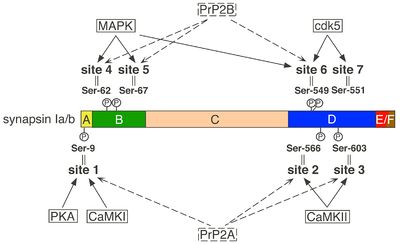
シナプシンは系統発生学的によく保存されたタンパク質ファミリーで、ほとんどの動物に存在する。無脊椎動物ではその遺伝子は1個だが、ほとんどの脊椎動物では3個となり、シナプシンI、II、IIIに対応する。哺乳類ではそれぞれの遺伝子から選択的スプライシングによって複数のアイソフォーム(Ia-b、IIa-b、IIIa-f)が形成され、そのうち主なものは、シナプシンIa、Ib、IIa、IIb、IIIaの5種類である[1] [2] [5](図1)。
各アイソフォームはドメイン構造を示し、アミノ末端側には共通のドメインA、B、Cが存在する。このうち、ドメインAとCはよく保存されており、ドメインBは変動が多い。カルボキシル末端側は、アイソフォーム毎に異なるドメインD〜Jの組み合わせとなっており、このうち、ドメインEをカルボキシル末端に持つものは、aアイソフォームと呼ばれる(シナプシンIa、IIa、IIIa)。
- ドメインAは、すべてのシナプシンに共通するよく保存されたアミノ末端の短い領域で、シナプス小胞膜のリン脂質と直接結合する。また、PKAとCaMKIによってリン酸化される部位(site 1;ラットシナプシンIではSer-9)を含む(図2)。このリン酸化部位は、各アイソフォームに共通して存在し、シナプス小胞への結合を可逆的に調節している。
- ドメインBは、比較的小さなアミノ酸が多く、アイソフォーム間で変動があり、ドメインAとCを繋ぐリンカー部分と考えられている。シナプシンIでは、ここにERK-MAPキナーゼ(ERK1/2- MAPK)によってリン酸化される2カ所の部位(site 4,Ser-62;site 5,Ser-67)が存在する(図2)。
- ドメインCは、大変よく保存された長い領域で、アクチン、スペクトリン、チュブリン、ニューロフィラメントといった細胞骨格タンパク質やシナプス小胞のリン脂質と結合する部分、さらに、シナプシン同士がホモ二量体、あるいはヘテロ二量体を形成するための結合領域を含んでいる。このドメインはATPとも結合し、その結晶構造の解析から、ATPを利用する何らかの酵素機能を持つ可能性が推定されているが、精製したシナプシンI、IIは、いずれもATPを分解しない。
- ドメインDは、シナプシンIに特徴的で、CaMKIIによってリン酸化される2カ所の部位(site 2,Ser-566;site 3,Ser-603)を含む(図2)。さらに、ERK1/2- MAPKとサイクリン依存性キナーゼ(cdk1/5)によってリン酸化される部位(site 6;Ser-549)とそれに隣接したcdk1/5によってリン酸化される部位(site7;Ser-551)が存在する。このドメインは、SH3領域を含むタンパク質と結合する領域やCaMKII、rab3と結合する領域も含んでいる。
- ドメインEは、カルボキシル末端に存在し、シナプシンIa、IIa、IIIaに共通かつ、よく保存されており、シナプシンがシナプス前終末にターゲッティングされるための、重要な要素のひとつと考えられている。また、シナプス小胞の動態に影響を及ぼす領域とも考えられている。
- ドメインFとIは、bアイソフォームのカルボキシル末端を占めるが、その機能はよくわかっていない。
リン酸化とその影響
各アイソフォームに共通のPKA/CaMKIによるsite 1のリン酸化は、シナプシンのシナプス小胞膜への結合を阻害し、シナプス小胞から離れやすくす[1] [2][3] [4]。
シナプシンI に特異的なCaMKIIによるsite 2、3のリン酸化は、その立体構造を大きく変化させ、アクチン並びにシナプス小胞への結合を大きく低下させる。尚、site 3は、CaMKII以外に、p21活性化キナーゼ(PAK)によってもリン酸化される。
シナプシンIのERK1/2-MAPKによるリン酸化(site 4,5;site 6)とcdk1/5によるリン酸化(site 6,7)は、シナプシンIによるアクチンの重合促進・アクチンフィラメント同士の結合促進といった作用を低下させる。
さらに、シナプシンIのドメインCには、Srcによってリン酸化される部位があり(Tyr-301、site 8)、このTyrのリン酸化は、セリン・スレオニンキナーゼによるSerのリン酸化とは逆に、アクチンやシナプス小胞への結合や二量体形成能を促進する方向へ働く。
上述したセリン・スレオニンキナーゼによるリン酸化については、それぞれ部位特異的に脱リン酸化するホスファターゼがあることがわかっている[2] [6](図2)。すなわち、site 1、2・3は、プロテインホスファターゼ2Aによって、site 4・5、6は、プロテインホスファターゼ2B(カルシニューリン)によって、それぞれ脱リン酸化を受ける。
シナプトソームに脱分極刺激を行うと、site 1、site 2/3のリン酸化が増大するのに対し、site 4/5、6はリン酸化が減少する。前者はPKA/CaMKI、CaMKIIの活性化、後者はカルシニューリンの活性化によると考えられる。また、脱分極刺激により、シナプシンの大部分がシナプス小胞から離れることから、シナプシンのリン酸化・脱リン酸化は、シナプス小胞の動態を制御する重要な因子であると考えられている[2] [3] [4]。
組織・細胞内局在
シナプシンは、中枢神経系・末梢神経系に広く分布するが、非神経組織にはほとんど発現していない。シナプシンI、IIは、神経終末に局在し、シナプス小胞に結合しているが、形質膜直下のシナプス小胞よりも、むしろ膜から離れたところにある予備のプールのシナプス小胞に局在している。またその一部は、シナプス小胞から遊離した状態でも存在している。さらにシナプス小胞の中では、グルタミン酸、GABA、ドーパミン・セロトニン・ノルアドレナリン、アセチルコリンといった古典的な神経伝達物質を含む小さなシナプス小胞(small synaptic vesicle)の細胞質側の表面に付着しているが、神経ペプチドを含む有芯顆粒(large dense-core synaptic vesicle)には存在しない。また、シナプシンは、感覚器官のリボンシナプスを除いて、ほとんどのシナプスに存在し、アイソフォーム毎に異なる分布を示す。シナプシンIIは興奮性グルタミン酸作動性シナプスに、シナプシンIは抑制性GABA作動性シナプスに比較的多い[1] [2] [4] [5]。
一方、シナプシンIIIは細胞体に主に発現し、成長円錐にも発現するが、神経終末には局在しない。シナプシンIIIの一部のアイソフォームは非神経組織にも発現している。
シナプシンI、IIは、生下時には発現が低く、シナプス形成の時期に一致して増大し、その後成体においても発現が持続するが、シナプシンIIIは、神経発生の早い時期に一過性に増大し、その後は低いレベルにとどまる。
機能
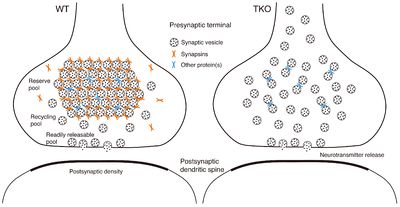
左は野生型(WT)、右はシナプシンI/II/IIIトリプルノックアウトマウス(TKO)のシナプス前終末の模式図。シナプシン(橙色)はシナプス小胞に2価性に結合し、小胞の可動性を制限し安定化することにより、集合体としての予備のプールの形成に必須であると考えられる(左図)。シナプシンI/II/III TKOでは、予備のプールのシナプス小胞の可動性が高まり、集合体としての構造が崩れてしまう(右図)。予備のプールの維持・安定化は、連続刺激の際に放出可能なシナプス小胞を動員するために重要な役割を果たすと考えられる。但し、シナプシン以外にも、シナプス小胞の可動性を制限し、固定化に貢献する分子が存在する可能性がある(青色)。
シナプス小胞の予備のプールの維持・安定化
シナプシンI、II、IIIの単体、ダブル、トリプルノックアウトマウス(KO、DKO、TKO)が作製されたが、それらの脳の構造や形態には大きな異常が認められないことから、シナプシンは正常な脳の発達には必ずしも必要ではないと考えられる[1] [5]。
一方、シナプシンI/II のDKO、シナプシンI/II/IIIのTKOでは、海馬興奮性シナプスにおいて、シナプス小胞の総数が大きく減少し、特にTKOでは、形質膜直下から離れたところに存在する予備のプールのシナプス小胞が選択的に減少していた[1] [2] [4]。これは、ヤツメウナギやイカのシナプスへのシナプシン抗体やドメインEペプチドの注入実験の結果とも一致するものであった。従って、シナプシンはシナプス小胞の予備のプールを維持し、安定化させるために必須の分子であると考えられる。さらに、TKOでは予備のプールのシナプス小胞の可動性が増大し、軸索への拡散傾向が見られたことから、シナプシンは、予備のプールのシナプス小胞の可動性を特異的に制限することにより、集合体としての構造を維持していると考えられる[7] [8](図3)。
連続刺激の際のシナプス抑圧の制限
シナプシンI/II DKOやシナプシンI/II/III TKOの海馬興奮性シナプスでは、通常のシナプス伝達には異常が認められなかったが、連続刺激を与えた際に観察されるシナプス抑圧が、野生型の場合よりも遙かに速く起こり、かつ増強していた[1] [2] [4]。これは、連続刺激の際に放出可能なシナプス小胞の補充が追いつかず、その数が不足するために起こるものと考えられる。従って、シナプシンは、通常のシナプス伝達には必ずしも必要ではないが、形質膜から離れた予備の小胞プールを維持することにより、連続刺激の際に放出可能なシナプス小胞を動員し、シナプス抑圧を制限する上で、重要な役割を果たすと考えられる。
リン酸化によるシナプス小胞の動態の制御
従来、脱分極刺激により、シナプシンの大部分がシナプス小胞から離れることが、カエルの神経筋シナプスやラットのシナプトソーム等で観察されていた[3] [4]。さらに、蛍光ラベルしたシナプシンIaを海馬培養神経細胞に発現させた実験系でも、連続刺激によってシナプシンIがシナプス部から拡散するのが観察されている[9]。このシナプシンIの拡散のスピードは、CaMKII(site 2/3)あるいはPKA(site 1)によるリン酸化部位を非リン酸化型に変異させると遅くなり、またこのとき、シナプス小胞の開口放出のスピードも遅くなった。逆に、シナプシンI/II DKOの海馬培養神経細胞では、連続刺激によるシナプス小胞の開口放出が速くなっており、これらに非リン酸化型のシナプシンIaを発現させると、放出のスピードが遅くなった。これらの結果から、シナプシンは連続刺激の際のシナプス小胞の動態を抑制する調節因子として働き、その機能はリン酸化によってさらに調節されているものと考えられる。
Site 1、site 2/3以外にも、ERK1/2-MAPK・カルシニューリンによるsite 4/5、6のリン酸化・脱リン酸化がシナプス小胞の動態を調節するとされるなど、実際の生体内では、複数のプロテインキナーゼ・ホスファターゼが、複雑に絡み合って制御を行っていると考えられる。
アイソフォーム毎の役割の違い
シナプシンI/II/III TKOの海馬培養神経細胞にシナプシン各アイソフォームを単体で導入したところ、シナプシンIIaのみが、シナプス小胞の予備のプールとシナプス抑圧を一定程度回復させることができた。従って、シナプシンファミリーの中ではシナプシンIIaがその一義的な役割を担うと考えられる [1] [10]。
また、同様の導入実験で各アイソフォームのシナプス前終末へのターゲッティング能を調べたところ、シナプシンIa、IIa、IIb、IIIaは、それぞれ単独でシナプス前終末へのターゲッティングが可能であった。一方、シナプシンIbは単独ではシナプス前終末への局在が見られず、他のアイソフォームとヘテロ二量体を作る必要があったことから、他のアイソフォームの機能を阻害する方向に働く可能性がある[1]。
抑制性シナプスにおける機能
シナプシンI/II/III TKOの海馬の抑制性シナプスでは、興奮性シナプスとは異なり、通常のシナプス伝達自体が低下していた。一方、連続刺激の際のシナプス抑制には著変がなかった。また、シナプス小胞の総数が減少していたが、興奮性シナプスとは異なり、予備のプールだけでなく、放出可能プールも含めて全体的に減少していた。従って、興奮性シナプスと抑制性シナプスでは、シナプシンが異なる働きをしていると考えられる[1] [2]。
シナプシン以外のタンパク質によるシナプス小胞プールの制御の可能性
前述のように、シナプシンは予備のプールの小胞を固定化することにより、シナプス小胞のプール全体の調節に貢献すると考えられるが、シナプシン自身は、予備のプールとリサイクルプールとの分画には直接関わらない、あるいは、予備のプールからリサイクルプールへの移動には、シナプシン以外のタンパク質のリン酸化が関わっているという説もあり、リサイクルプールの大きさを規定するメカニズムは未だ不明である[7] [8] [11]。
さらに、海馬興奮性神経終末の電子線トモグラフィーを用いた三次元再構成によると、シナプス小胞同士を繋ぐ短いフィラメントや、シナプス小胞とシナプス前膜を繋ぐ長いフィラメントが観察され、特に前者はその大きさからシナプシンではないかと考えられていたが、野生型のみならず、シナプシンI/II/III TKOでも観察されたことから、シナプシン以外のタンパク質分子もこれら構造物を構成している可能性がある[12]。
|
関連語
参考文献
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 D Gitler, G J Augustine
Synapsins and regulation of the reserve pool.
Encyclopedia of Neuroscience, Academic Press: 2009, 709-717
DOI: 10.1016/B978-008045046-9.01776-9 - ↑ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 2.8 2.9
Cesca, F., Baldelli, P., Valtorta, F., & Benfenati, F. (2010).
The synapsins: key actors of synapse function and plasticity. Progress in neurobiology, 91(4), 313-48. [PubMed:20438797] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3
Greengard, P., Valtorta, F., Czernik, A.J., & Benfenati, F. (1993).
Synaptic vesicle phosphoproteins and regulation of synaptic function. Science (New York, N.Y.), 259(5096), 780-5. [PubMed:8430330] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6
Hilfiker, S., Pieribone, V.A., Czernik, A.J., Kao, H.T., Augustine, G.J., & Greengard, P. (1999).
Synapsins as regulators of neurotransmitter release. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 354(1381), 269-79. [PubMed:10212475] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 M V Khvotchev, J Sun
Synapsins.
Encyclopedia of Neuroscience, Academic Press: 2009, 705-708
DOI: 10.1016/B978-008045046-9.01374-7 - ↑ 6.0 6.1
Yamagata, Y. (2003).
New aspects of neurotransmitter release and exocytosis: dynamic and differential regulation of synapsin I phosphorylation by acute neuronal excitation in vivo. Journal of pharmacological sciences, 93(1), 22-9. [PubMed:14501147] [WorldCat] [DOI] - ↑ 7.0 7.1
Orenbuch, A., Shalev, L., Marra, V., Sinai, I., Lavy, Y., Kahn, J., ..., & Gitler, D. (2012).
Synapsin selectively controls the mobility of resting pool vesicles at hippocampal terminals. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(12), 3969-80. [PubMed:22442064] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Fornasiero, E.F., Raimondi, A., Guarnieri, F.C., Orlando, M., Fesce, R., Benfenati, F., & Valtorta, F. (2012).
Synapsins contribute to the dynamic spatial organization of synaptic vesicles in an activity-dependent manner. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(35), 12214-27. [PubMed:22933803] [PMC] [WorldCat] [DOI] - ↑
Chi, P., Greengard, P., & Ryan, T.A. (2001).
Synapsin dispersion and reclustering during synaptic activity. Nature neuroscience, 4(12), 1187-93. [PubMed:11685225] [WorldCat] [DOI] - ↑
Gitler, D., Cheng, Q., Greengard, P., & Augustine, G.J. (2008).
Synapsin IIa controls the reserve pool of glutamatergic synaptic vesicles. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(43), 10835-43. [PubMed:18945891] [PMC] [WorldCat] [DOI] - ↑
Gaffield, M.A., & Betz, W.J. (2007).
Synaptic vesicle mobility in mouse motor nerve terminals with and without synapsin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(50), 13691-700. [PubMed:18077680] [PMC] [WorldCat] [DOI] - ↑
Siksou, L., Rostaing, P., Lechaire, J.P., Boudier, T., Ohtsuka, T., Fejtová, A., ..., & Marty, S. (2007).
Three-dimensional architecture of presynaptic terminal cytomatrix. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(26), 6868-77. [PubMed:17596435] [PMC] [WorldCat] [DOI]