ロドプシン
英:Rhodopsin, Visual purple
桿体視物質
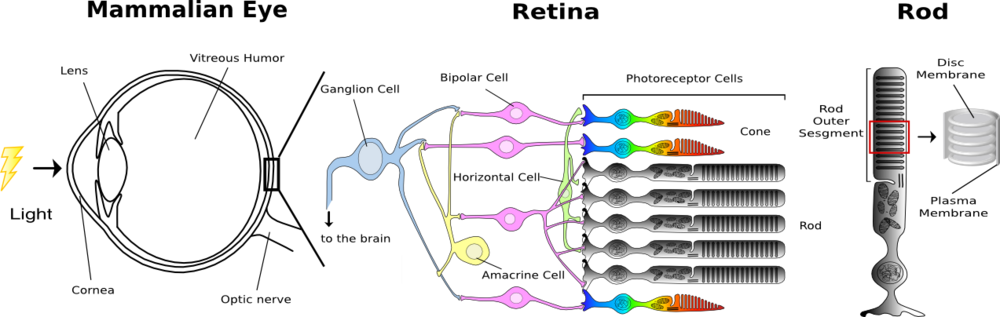
脊椎動物の眼には2種類の視細胞、桿体と錐体が存在し、それぞれ、暗所視、明所視を司る。両視細胞には光を受容するために特別に分化したタンパク質(光受容タンパク質)が含まれ、それらを視物質と呼ぶ。桿体に含まれる視物質(桿体視物質)をロドプシンと呼び、ロドプシンは視物質の代表として多くの研究に利用されている。錐体には複数のサブタイプがあり、それぞれに波長感受性の異なる錐体視物質が含まれている。ヒトの錐体には、赤、緑、青に感受性の高い3種類の錐体視物質がそれぞれ含まれている。そして、これら錐体の応答が統合されることにより、色覚が生じる。 視細胞には繊毛が分化した外節と呼ばれる特別の部位がある。桿体の外節にはパンケーキ状の円盤膜(disk membrane)が何層にも重なっている。そして、ロドプシンはこの円盤膜に埋め込まれて存在している。錐体の外節はひだ状の層構造になっており、この構造の中に錐体視物質が埋め込まれている(図1参照)。 微弱光でも効率よく受容できるように、ロドプシンは桿体の円盤膜に大量に発現している(円盤膜面積の50%以上がロドプシン分子である)。光を受容したロドプシンは構造変化を起こし、Gタンパク質を介して細胞内シグナル伝達系を駆動する。この際にロドプシンの1分子は数百のGタンパク質を活性化し、光情報が増幅される。シグナル伝達系の下流でもさらに増幅機構が働き、その結果として、桿体はわずか1個の光子を受容しただけで応答することができる。円盤膜は定常的にリニューアルされている。外節の根元から新しい円盤膜が作られ、先端の円盤膜は網膜色素上皮細胞に取り込まれる。マウスではおよそ10日で円盤膜が根元から網膜色素上皮細胞層に達する。 「ロドプシン」という名前は、もともとは桿体に含まれる視物質につけられた名前であった。しかし、最近では錐体視物質をはじめロドプシンとアミノ酸配列の相同性をもつ多くの光受容タンパク質が発見されるようになってきた。そこで、これらの光受容タンパク質をまとめてロドプシン類(またはオプシン類)と呼ぶことが多い。
ロドプシンについて初めて報告があったのは1876〜77年頃である。ドイツのFranz Boll (1849-1879)、続いてFriedrich Wilhelm (通称Willy) Kühne(1837−1900)がカエル網膜の桿体視細胞の外節にある赤い物質の感光性を報告した。 Kühneはこの色を“Sehrpurpur”と呼び(英語ではVisual Purple)その基となる化学物質をRhodopsin(日本語で「視紅」)と名付けた。(初期の視物質研究では視物質のことをVisual Purpleと呼んでいたが、しだいにRhodopsinが多く使われるようになり現在ではRhodopsinというのが一般的である。)
ロドプシン分子
ロドプシンの基本構造
発色団レチナール
ロドプシンの大きな特徴の一つは光を受容する発色団としてレチナールを含むことである。つまり、ロドプシンはアポタンパク質と発色団レチナールからなる。アポタンパク質のことをオプシン(opsin)と呼ぶ(桿体視物質のオプシンを特にscotopsinと呼ぶ場合がある)。「オプシン」や「ロドプシン」という言葉は、広義には、ロドプシンに相同なタンパク質という意味でも使われている。
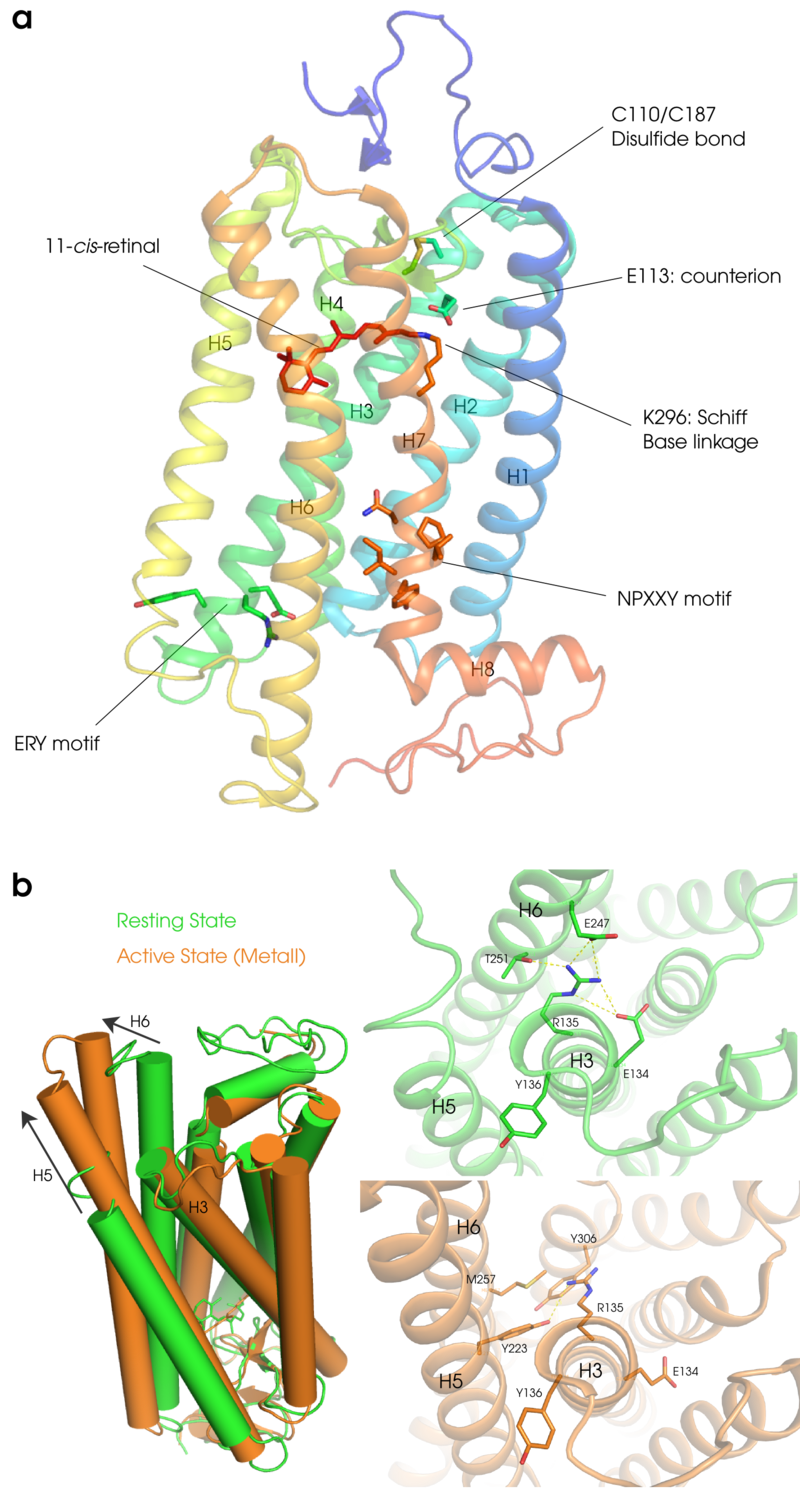
レチナールはビタミンAのアルデヒド型であり、ロドプシン中ではその11-シス型がオプシンのH7(ヘリックス7)の296番目のリシン残基とシッフ塩基結合を介して結合している。光を受容したロドプシンでは、レチナールが11-シス型から全トランス型に光異性化される。その後、ロドプシンのタンパク質部分の構造変化がおこり、Gタンパク質を活性化する状態に変化する。この過程を「ロドプシンの光反応過程」と呼ぶ。生成した全トランスレチナールは、その後タンパク質部分から遊離し、タンパク質部分は新たに11-シス型のレチナールと結合してロドプシンになる。この過程を「ロドプシンの再生」と呼ぶ。タンパク質から遊離したレチナール(all-transに異性化)は視細胞の外に運ばれ、網膜色素上皮細胞で11- シス型に再異性化され視細胞へ戻り、再びオプシンと結合してロドプシンになる。レチナールがどのような経路を経てオプシンと結合するのかは知られておらず、ロドプシン研究の一つの課題となっている。
11-シスレチナールはロドプシンが光を受容するために必須の分子である。また、11-シスレチナールがオプシンと結合すると(ロドプシンになると)、オプシンの暗状態でのGタンパク質活性化能が強く抑制される。一方、光を受容して全トランス型に異性化すると、ロドプシンを高効率でGタンパク質を活性化する状態にする。つまり、薬理学的には、11-シスレチナールはinverse agonist(活性を抑制するリガンド、逆作動薬)、全トランス型レチナールはagonist( 活性を促進するリガンド、作動薬)と考えることができる。
7回膜貫通構造
ロドプシンのタンパク質部分(オプシン)は膜を貫通する7本のα-ヘリックス構造を持つ単一ペプチドである。これらα-ヘリックスは、その間にある細胞質ループ(Cytoplasmic/Intracellular loop: CL/IL)と細胞外ループ(Extracellular loop: EL)でつながれている。N末端が円盤膜の内側(トポロジー的には細胞外)に位置し、C末端が細胞質側にある。ヘリックス領域は膜を貫通するため、レチナールや構造水と相互作用する少数の親水性残基をのぞいて、ほとんどが疎水性残基で構成されている。一方、それ以外の領域には親水性残基が多く見られる。
ヘリックス領域はフレキシブルなループ領域とは異なり、剛体運動(rigid body motion)によってヘッリクス間の配置が変わるような構造変化を起こす。この変化により、ロドプシンの活性状態が生成することが知られている。また、細胞質側の第2、第3ループ(CL2, 3)はGタンパク質と結合するサイトとして重要である。
ヘリックス8
ロドプシンにはヘリックス7とC末端の間に翻訳後修飾(パルミチル化)を受けるシステイン残基が存在し、結合したパルミチン酸は脂質二重膜に挿入されると考えられている。そのため、ヘリックス7とシステイン残基との間が細胞質側のもう一つのループとなり、この領域はさらにヘリックス構造を形成している。このヘリックスはヘリックス8と呼ばれている。膜表面に存在するH8は両親媒性のヘリックスで膜側に疎水性の残基を含んでいる(図2参照)。
翻訳後修飾
視細胞のERで生合成されたオプシンは外節につながる繊毛部分に輸送され、外節の根元から生成する新たな円盤膜に取り込まれていく。前述したように、光受容体であるロドプシンは翻訳後にレチナールを取り込む必要があるが、それ以外にも円盤膜に運ばれるまでにいくつかの翻訳後修飾を受ける。ロドプシンの大きな特徴の一つがC110とC187の間に形成されるS−S結合である(図2参照)。このジスフィルド結合は多くのGPCRでも保存されておりECL2とH3を架橋することによって構造安定化に寄与している。
また、ロドプシンのN2/N15は糖鎖修飾を受ける。このためロドプシンのN2/N15は生物種を超えて良く保存されている。このようなタンパク質のN結合型糖鎖付加は、修飾されるアミノ酸残基の位置は異なるが、オプシン類そしてファミリー1のGPCRにも見られる。一般に、糖鎖修飾はタンパク質の輸送やフォールディングに関わると考えられている。これ以外にもN末端のメチル基はアセチル化され、前述のC末端のC322/C322のシステイン残基はパルミチン酸化(脂質修飾)されている。
膜環境
膜タンパク質であるロドプシンの分子特性はその膜環境に大きく依存する。ただし、ヘリックス領域に囲まれている発色団の光化学的な特性(分子吸光係数、量子収率、光感受性など)は膜環境による影響を受けにくい。一方で、中間体や活性状態の平衡、寿命や生成速度等は膜環境の影響を顕著に受ける。
桿体外節の円盤膜はPC(phosphatidylcholine)やPE(phosphatidylethanolamine)を主成分とし、他にもPS(phosphatidylserine)やPI(phosphatidylinositol)を含むことが知られている。また膜のコレステロール含有量によってロドプシンの活性状態とその前駆体の平衡が変化することが知られている。
シッフ塩基プロトン・対イオン
ロドプシン中でのレチナールはリシン残基とシッフ塩基結合をしている。分子内でレチナールが共有結合しているのは、いつでも光受容出来るように発色団をタンパク質内に留めておく働きがある。さらにシッフ塩基を介したこの共有結合はロドプシンの機能発現にも重要な役割を果たしている。
ロドプシンが可視光(最大吸収波長500nm)を受容できるのは、このシッフ塩基の窒素原子がプロトン化しているからである。レチナールやレチナールシッフ塩基は吸収極大波長が紫外部にあり、紫外光しか吸収することができない。一方、レチナールシッフ塩基がプロトン化すると、分子内の二重結合系が非局在化され、その結果、吸収極大波長が可視部に移動する。
レチナールはオプシンの内部に埋め込まれており、また、そのプロトン化シッフ塩基は疎水的な環境に位置している。そのためそのままでは非常に不安定である。オプシン内にはこの正電荷を安定化する対イオン(counterion)が存在する。ロドプシンではE113が対イオンとして働き、H7のシッフ塩基プロトンの正電荷とH3のグルタミン酸の負電荷の間に塩橋(salt bridge)が形成される。また対イオンはシッフ塩基のpKaを上げシッフ塩基の加水分解を防いでいる。対イオンは単独で働いているのではなく、構造水を含む水素結合ネットワークを形成して働いていると考えられている。
構造モチーフ
ロドプシン類あるいはGタンパク質共役型受容体(GPCR)のファミリー間で良く保存されている構造モチーフが幾つか知られており、これらは受容体の機能発現に重要である。
(D/E)R(Y/W)モチーフはファミリーAのGPCR間でよく保存されている構造モチーフで、ロドプシンではH3の細胞質側末端のE134/R135/Y136に相当する。また、H7とH8の先端にある302番目から306番目の残基はNPXXYモチーフと呼ばれ、このモチーフもファミリー1のGPCRの間でよく保存されている。ロドプシンの暗状態ではR135とE134の間に塩橋がある。また、R135はH6に存在するE247とT251との間で静電的な相互作用をしている(これらの相互作用を通常Ionic Lockと呼ぶ)。ロドプシンが光を受容することによりタンパク質部分の構造変化がおこると、E134は溶液中のプロトンと結合して中性になる。その結果、E134とR135の塩橋がなくなり、R135はNPXXYモチーフ中のY306やその他の残基(M257やY223)と新たな相互作用ネットワークを形成し、ロドプシンの活性構造の形成に寄与していると考えられている(図2参照)。