「光周性」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 21行目: | 21行目: | ||
==制御機構== | ==制御機構== | ||
===光周性の理解に貢献してきたモデル=== | ===光周性の理解に貢献してきたモデル=== | ||
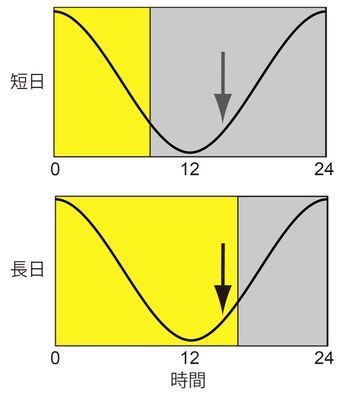
[[Image:external coincidence.jpg''' | [[Image:external coincidence.jpg|thumb|350px|'''図1.外的符合モデルの模式図'''<br>矢印で示した光誘導相に光があたると長日と認識される。黄色部分は明期を、灰色部分は暗期を示す。]]。 | ||
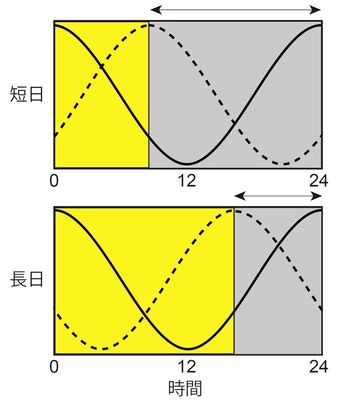
[[Image:internal coincidence.jpg|thumb|350px|'''図2.内的符合モデルの模式図'''<br>Morning振動体とEvening振動体の二つの振動体の位相関係の変化によって日長を測定する。黄色部分は明期を、灰色部分は暗期を示す。]] | |||
光周性は概日リズムの制御と同様に、光を受容する「入力系」、日長を測定する「振動体」、および行動や生理機能を制御する神経系、内分泌系などの「出力系」によって制御されている。生物はある一定の日長を境にして、光周反応を起こしたり、起こさなかったりするが、この境界となる日長を臨界日長あるいは限界日長(critical photoperiod)と呼ぶ。 | 光周性は概日リズムの制御と同様に、光を受容する「入力系」、日長を測定する「振動体」、および行動や生理機能を制御する神経系、内分泌系などの「出力系」によって制御されている。生物はある一定の日長を境にして、光周反応を起こしたり、起こさなかったりするが、この境界となる日長を臨界日長あるいは限界日長(critical photoperiod)と呼ぶ。 | ||
光周性の研究が始まった当初は、日長は砂時計のような仕組みによって測定されていると考えられていたが、現在は支持されていない。その後1936年にBünningは、概日時計が親明相(photophil phase)と親暗相(scotophil phase)を決定しており、この親暗相に光が当たるか否かによって長日、短日が判別されているというBünningの仮説(Bünning’s hypothesis)を提唱した<ref>'''E Bünning'''<br>Die endonome Tagesrhythmik als Grundlage der photoperiodischen Reaktion.<br> ''Ber. Dtsch. Bot. Ges. 1936, 54;590-607''</ref>。この仮説で初めて光周性が振動現象に基づく可能性が指摘された。1940~50年代になると生物を非24時間周期の明暗周期に曝す実験が行われ、概日時計が光周性の制御に関与していることが実験的に証明された。1960年代にはPittendrighがBünningの仮説を発展させた「外的符合モデル(external coincidence model)」を提案した <ref>'''C S Pittendrigh, D H Minis'''<br>The entrainment of circadian oscillations by light and their role as photoperiodic clocks.<br>''Am. Nat. 1964, 98;261-299''</ref> | 光周性の研究が始まった当初は、日長は砂時計のような仕組みによって測定されていると考えられていたが、現在は支持されていない。その後1936年にBünningは、概日時計が親明相(photophil phase)と親暗相(scotophil phase)を決定しており、この親暗相に光が当たるか否かによって長日、短日が判別されているというBünningの仮説(Bünning’s hypothesis)を提唱した<ref>'''E Bünning'''<br>Die endonome Tagesrhythmik als Grundlage der photoperiodischen Reaktion.<br> ''Ber. Dtsch. Bot. Ges. 1936, 54;590-607''</ref>。この仮説で初めて光周性が振動現象に基づく可能性が指摘された。1940~50年代になると生物を非24時間周期の明暗周期に曝す実験が行われ、概日時計が光周性の制御に関与していることが実験的に証明された。1960年代にはPittendrighがBünningの仮説を発展させた「外的符合モデル(external coincidence model)」を提案した <ref>'''C S Pittendrigh, D H Minis'''<br>The entrainment of circadian oscillations by light and their role as photoperiodic clocks.<br>''Am. Nat. 1964, 98;261-299''</ref>(図1)。このモデルでは、光の概日時計を同調させる役割と、光周反応を引き起こす役割の二つの役割が想定されている。またこのモデルでは、1日の中の特定の時間帯の光だけが光周反応を引き起こすことが示されており、光誘導相(photoinducible phase)、あるいは光感受相(photosensitive phase)と呼ばれている。その他のモデルとして、Morning振動体、Evening振動体の二つの振動体の位相関係が日長の変化によって変わることで、光周反応が引き起こされるとする「内的符合モデル(internal coincidence model)」も提唱されている<ref><pubmed> 4506793 </pubmed></ref>(図2)。外的符合モデル、内的符合モデルの二つのモデルは今日においても光周性の制御機構を理解する上で、重要な役割を果たしている。 | ||
===鳥類の光周性の制御機構=== | ===鳥類の光周性の制御機構=== | ||
| 35行目: | 37行目: | ||
====鳥類の光周性を制御する情報伝達機構==== | ====鳥類の光周性を制御する情報伝達機構==== | ||
1960~90年代にはウズラを用いて生理学的な実験が行われた。まず脳の破壊実験により、視床下部内側基底部を破壊すると光周性が失われることが示された<ref><pubmed> 5362399 </pubmed></ref>。また長日刺激によって、細胞の活性化マーカーであるc-Fosが視床下部内側基底部に発現することや、視床下部内側基底部の電気刺激によって性腺刺激ホルモンの分泌が促進されることなどから、視床下部内側基底部が光周性の中枢であると考えられるようになった。2000年代になって光誘導相の光照射によって視床下部内側基底部で発現変動する遺伝子が探索され、脊椎動物の光周性を制御する鍵遺伝子として、DIO2、DIO3遺伝子が単離された<ref><pubmed> 14614506 </pubmed></ref> | [[Image:dio2dio3.jpg'''図3.視床下部内側基底部における甲状腺ホルモン活性化酵素(DIO2)と不活性化酵素(DIO3)のスイッチングが季節繁殖の鍵を握る。長日条件下ではDIO2によってプロホルモンのT4が活性型甲状腺ホルモンT3が合成されるが、短日条件下ではT4、T3ともに不活性型に代謝される。''']] | ||
[[Image:animalphotoperiodism.jpg'''図4.鳥類と哺乳類の光周性の制御機構'''<br>鳥類と哺乳類では光の入力系が異なるが、下垂体隆起部よりも下流は同様な制御機構によって制御されている。]] | |||
1960~90年代にはウズラを用いて生理学的な実験が行われた。まず脳の破壊実験により、視床下部内側基底部を破壊すると光周性が失われることが示された<ref><pubmed> 5362399 </pubmed></ref>。また長日刺激によって、細胞の活性化マーカーであるc-Fosが視床下部内側基底部に発現することや、視床下部内側基底部の電気刺激によって性腺刺激ホルモンの分泌が促進されることなどから、視床下部内側基底部が光周性の中枢であると考えられるようになった。2000年代になって光誘導相の光照射によって視床下部内側基底部で発現変動する遺伝子が探索され、脊椎動物の光周性を制御する鍵遺伝子として、DIO2、DIO3遺伝子が単離された<ref><pubmed> 14614506 </pubmed></ref>。DIO2、DIO3遺伝子はそれぞれ、甲状腺ホルモン活性化酵素(2型脱ヨード酵素)と不活性化酵素(3型脱ヨード酵素)をコードしており、長日刺激によって、視床下部内側基底部において局所的に甲状腺ホルモンが活性化されることが、光周性の制御に重要であることが示された(図3)。その後、ゲノムスケールの遺伝子発現解析によって、日長が12時間を超えると下垂体の付け根に位置する下垂体隆起部(pars tuberalis)において、甲状腺刺激ホルモン(thyroid stimulating hormone: TSH)が産生されることが明らかになった<ref name=ref7><pubmed> 18354476 </pubmed></ref>(図4)。TSHは甲状腺を刺激する下垂体前葉ホルモンであるが、下垂体隆起部で長日刺激によって産生される場合は視床下部内側基底部のDIO2、DIO3の発現を制御することで、光周性を制御するマスターコントロール因子として働くことが明らかにされている<ref name=ref7 />。 | |||
===哺乳類の光周性の制御機構=== | ===哺乳類の光周性の制御機構=== | ||
2013年8月22日 (木) 17:32時点における版
吉村 崇
名古屋大学 大学院生命農学研究科
DOI XXXX/XXXX 原稿受付日:2013年8月20日 原稿完成日:2013年月日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:photoperiodism、 仏:Photopériodisme
光周性とは、日照時間(日長)の変化に対して、生物が示す様々な反応のこと。光周性は繁殖活動、渡り、換毛、代謝活動などに観察され、動物が環境の季節変動に適応するのに役立っている。日長の情報は、鳥類においては脳深部光受容器で受容される一方で、哺乳類では眼で受容され、メラトニンの分泌パターンの情報に変換される。このように哺乳類と鳥類では光周性を制御する光の入力経路が異なるが、長日条件下で下垂体隆起部から分泌される甲状腺刺激ホルモンが視床下部内側基底部に作用し、局所的に甲状腺ホルモンを活性化することで光周性が制御されている点は共通している。ヒトは明瞭な光周性を示さないが、高緯度地方では季節性感情障害という疾患が知られている。
概要
脊椎動物に観察される行動や生理機能の季節変化
自然界に生息する動物は、毎年繰り返し訪れる環境の季節変動に上手に適応するために、季節に応じて様々な行動や生理機能を変化させている。孵卵期間や妊娠期間が数週間程度の鳥類や小さな哺乳類は春に交尾や産卵・出産を行う。一方、約半年の妊娠期間を持つヤギやヒツジなどは秋に交尾して春に出産する。いずれも次世代が温暖で食糧が豊富な春から夏にかけて成長できるように、妊娠期間あるいは孵卵期間を逆算して、繁殖活動を行っている。このように特定の季節にのみ、繁殖活動を行う動物を季節繁殖動物と呼ぶ。春に繁殖活動を開始するものを長日繁殖動物、秋に繁殖活動を開始するものを短日繁殖動物と呼ぶ。また1年を通して繁殖活動を行うものを周年繁殖動物と呼ぶ。繁殖活動の他にも、冬眠、渡り(回遊)、代謝、換毛(換羽)、さえずり、免疫機能などに季節性が観察される。
光周性の発見と生態的意義
動物の行動や生理機能の季節変化については、アリストテレスの「動物誌(De historia animalium)」に既に記述があるが、その制御機構は近年まで謎に包まれていた。1920年代になって、生物が日照時間(日長)の変化をカレンダーとして利用していることが、植物、昆虫、鳥類、哺乳類の順に相次いで明らかにされ、この現象は光周性(photoperiodism)と呼ばれるようになった。季節によって変動する環境因子には、日長の他にも気温、湿度、降水量などがあるが、これらは猛暑、冷夏、暖冬、空梅雨など、年によって大きくばらつく情報である。一方、春分、夏至、秋分、冬至は毎年同じ時期に訪れるため、生物が日長の情報を利用しているのは合理的である。しかし桜の開花の時期が年によってばらつくように、一部の生物は温度の変化も季節の手掛かりとして利用している。この性質は温周性(thermoperiodism)と呼ばれているが、研究はほとんど進んでいない。また1年を通じて日長がほとんど変化しない熱帯地域においては、雨季や乾季、あるいは食糧の多寡が動物の季節適応に影響するという報告もあるが、これらについてもほとんど研究が進んでいない。
制御機構
光周性の理解に貢献してきたモデル
。
光周性は概日リズムの制御と同様に、光を受容する「入力系」、日長を測定する「振動体」、および行動や生理機能を制御する神経系、内分泌系などの「出力系」によって制御されている。生物はある一定の日長を境にして、光周反応を起こしたり、起こさなかったりするが、この境界となる日長を臨界日長あるいは限界日長(critical photoperiod)と呼ぶ。
光周性の研究が始まった当初は、日長は砂時計のような仕組みによって測定されていると考えられていたが、現在は支持されていない。その後1936年にBünningは、概日時計が親明相(photophil phase)と親暗相(scotophil phase)を決定しており、この親暗相に光が当たるか否かによって長日、短日が判別されているというBünningの仮説(Bünning’s hypothesis)を提唱した[1]。この仮説で初めて光周性が振動現象に基づく可能性が指摘された。1940~50年代になると生物を非24時間周期の明暗周期に曝す実験が行われ、概日時計が光周性の制御に関与していることが実験的に証明された。1960年代にはPittendrighがBünningの仮説を発展させた「外的符合モデル(external coincidence model)」を提案した [2](図1)。このモデルでは、光の概日時計を同調させる役割と、光周反応を引き起こす役割の二つの役割が想定されている。またこのモデルでは、1日の中の特定の時間帯の光だけが光周反応を引き起こすことが示されており、光誘導相(photoinducible phase)、あるいは光感受相(photosensitive phase)と呼ばれている。その他のモデルとして、Morning振動体、Evening振動体の二つの振動体の位相関係が日長の変化によって変わることで、光周反応が引き起こされるとする「内的符合モデル(internal coincidence model)」も提唱されている[3](図2)。外的符合モデル、内的符合モデルの二つのモデルは今日においても光周性の制御機構を理解する上で、重要な役割を果たしている。
鳥類の光周性の制御機構
洗練された鳥類の光周反応
鳥類は脊椎動物の中で最も洗練された光周反応を示す。これは鳥類が空を飛ぶために可能な限り身体を軽くしており、短い繁殖期にのみ生殖腺を発達させるためである。例えばウズラでは生殖腺を制御する性腺刺激ホルモン(ゴナドトロピン)の分泌が、短日条件から長日条件に移すと、長日条件1日目の終わりには上昇し、精巣重量も2週間で100倍以上も増加する。
鳥類の光周性を制御する脳深部光受容器
哺乳類においては眼が唯一の光受容器官であるが、哺乳類以外の脊椎動物では眼の他にも松果体や脳深部に光受容器が存在する。Benoitは1936年に眼球除去を施したアヒルの精巣が日長の変化に反応して発達することを明らかにした[4].その後眼球除去及び松果体除去を施したスズメにおいても光周反応が観察され、さらに頭皮の下に墨汁を注入するとこの光周反応が阻害されたことから、光周性を制御する光受容器が脳内に存在することが明らかになった。さらに脳の様々な部位に発光ビーズや光ファイバーを入れて局所的に光を照射した場合、前脳の中核野周辺、および視床下部内側基底部(mediobasal hypothalamus: MBH)付近に光を照射した際に精巣が発達することが報告された。近年の研究でロドプシン、メラノプシン、VAオプシン、オプシン5など、複数のロドプシン類がこれらの部位で発見されており、鳥類の光周性を制御する脳深部光受容器の候補として挙げられている。
鳥類の光周性を制御する情報伝達機構
[[Image:dio2dio3.jpg図3.視床下部内側基底部における甲状腺ホルモン活性化酵素(DIO2)と不活性化酵素(DIO3)のスイッチングが季節繁殖の鍵を握る。長日条件下ではDIO2によってプロホルモンのT4が活性型甲状腺ホルモンT3が合成されるが、短日条件下ではT4、T3ともに不活性型に代謝される。]]
[[Image:animalphotoperiodism.jpg図4.鳥類と哺乳類の光周性の制御機構
鳥類と哺乳類では光の入力系が異なるが、下垂体隆起部よりも下流は同様な制御機構によって制御されている。]]
1960~90年代にはウズラを用いて生理学的な実験が行われた。まず脳の破壊実験により、視床下部内側基底部を破壊すると光周性が失われることが示された[5]。また長日刺激によって、細胞の活性化マーカーであるc-Fosが視床下部内側基底部に発現することや、視床下部内側基底部の電気刺激によって性腺刺激ホルモンの分泌が促進されることなどから、視床下部内側基底部が光周性の中枢であると考えられるようになった。2000年代になって光誘導相の光照射によって視床下部内側基底部で発現変動する遺伝子が探索され、脊椎動物の光周性を制御する鍵遺伝子として、DIO2、DIO3遺伝子が単離された[6]。DIO2、DIO3遺伝子はそれぞれ、甲状腺ホルモン活性化酵素(2型脱ヨード酵素)と不活性化酵素(3型脱ヨード酵素)をコードしており、長日刺激によって、視床下部内側基底部において局所的に甲状腺ホルモンが活性化されることが、光周性の制御に重要であることが示された(図3)。その後、ゲノムスケールの遺伝子発現解析によって、日長が12時間を超えると下垂体の付け根に位置する下垂体隆起部(pars tuberalis)において、甲状腺刺激ホルモン(thyroid stimulating hormone: TSH)が産生されることが明らかになった[7](図4)。TSHは甲状腺を刺激する下垂体前葉ホルモンであるが、下垂体隆起部で長日刺激によって産生される場合は視床下部内側基底部のDIO2、DIO3の発現を制御することで、光周性を制御するマスターコントロール因子として働くことが明らかにされている[7]。
哺乳類の光周性の制御機構
メラトニンによって制御される哺乳類の光周性
哺乳類の光周性は、顕著な光周反応を示すハムスターやヒツジの研究によって理解が進んできた。哺乳類では眼球除去によって光周性が完全に失われるため、光周性を制御する光受容器は眼(網膜)に存在している。眼で受容された光情報は網膜-視床下部路を経て概日ペースメーカーが存在する視交叉上核(suprachiasmatic nucleus: SCN)へと伝えられる[8]。視交叉上核からは室傍核、上頸神経節を経由し、交感神経によって松果体(pineal gland)へ入力する。松果体からは夜間、血中にメラトニンが分泌されるため、メラトニンは夜の長さを全身に伝えている。メラトニンは哺乳類の光周性の制御に必須な役割を果たしており、松果体を除去すると光周性は完全に消失する。また、メラトニンを代償投与すると光周性を人為的に制御できるため、ヒツジの繁殖期や羊毛生産の人為的制御に応用されている。鳥類においてもメラトニンは夜間分泌され、概日リズムの制御や鳴鳥のさえずりを制御しているが、松果体除去やメラトニン投与は鳥類の季節繁殖の制御にはほとんど影響をおよぼさないため、メラトニンは鳥類の光周性の制御には必須ではないと考えられている。
メラトニンの作用機構
哺乳類においてはメラトニンは下垂体隆起部に発現しているMT1メラトニン受容体を介して、TSHの発現を抑制している。哺乳類においても下垂体隆起部のTSHは、鳥類同様、視床下部内側基底部のDIO2の発現誘導と、DIO3の発現抑制を促すことで、季節繁殖を制御している[9]。哺乳類においては性腺刺激ホルモン放出ホルモン(GnRH)および性腺刺激ホルモンの分泌を促すキスペプチンの発現も日長の影響を受けることが知られているが、DIO2、DIO3に遅れて変化する。
ヒトの光周性
ヒトは明瞭な光周性を示さないが、ある限られた季節にのみ、うつ様の症状を発症する季節性感情障害(seasonal affective disorder: SAD)という病気が知られており、光療法の有効性が示されている[10]。季節性感情障害には夏に発症する例も知られているが、多くは日照時間の少ない冬季に観察されるため、「冬季うつ病」とも呼ばれている。うつ病は自殺の原因の一つと考えられているが、熱帯地方では月別自殺者数に偏りがないのに対して、四季の存在する地域では自殺の多い月が決まっている。マウスやラットにおいても不安様行動、あるいはうつ様の行動が日長の変化によって影響を受けることが報告されており、光周性の制御機構の解明が季節性感情障害のメカニズムの解明につながることが期待されている。
関連項目
参考文献
- ↑ E Bünning
Die endonome Tagesrhythmik als Grundlage der photoperiodischen Reaktion.
Ber. Dtsch. Bot. Ges. 1936, 54;590-607 - ↑ C S Pittendrigh, D H Minis
The entrainment of circadian oscillations by light and their role as photoperiodic clocks.
Am. Nat. 1964, 98;261-299 - ↑
Pittendrigh, C.S. (1972).
Circadian surfaces and the diversity of possible roles of circadian organization in photoperiodic induction. Proceedings of the National Academy of Sciences of the United States of America, 69(9), 2734-7. [PubMed:4506793] [PMC] [WorldCat] [DOI] - ↑ J BenoitLe
role des yeux dans l’action stimulante de la lumiere sure le developpement testiulaire chez le canard.
CR Soc. Biol. (Paris) 1935, 118 ;669-671 - ↑
Sharp, P.J., & Follett, B.K. (1969).
The effect of hypothalamic lesions on gonadotrophin release in Japanese quail (Coturnix coturnix japonica). Neuroendocrinology, 5(3), 205-18. [PubMed:5362399] [WorldCat] [DOI] - ↑
Yoshimura, T., Yasuo, S., Watanabe, M., Iigo, M., Yamamura, T., Hirunagi, K., & Ebihara, S. (2003).
Light-induced hormone conversion of T4 to T3 regulates photoperiodic response of gonads in birds. Nature, 426(6963), 178-81. [PubMed:14614506] [WorldCat] [DOI] - ↑ 7.0 7.1
Nakao, N., Ono, H., Yamamura, T., Anraku, T., Takagi, T., Higashi, K., ..., & Yoshimura, T. (2008).
Thyrotrophin in the pars tuberalis triggers photoperiodic response. Nature, 452(7185), 317-22. [PubMed:18354476] [WorldCat] [DOI] - ↑ J Arendt
Melatonin and mammalian pineal gland
Chapman Hall, London:1995 - ↑
Ono, H., Hoshino, Y., Yasuo, S., Watanabe, M., Nakane, Y., Murai, A., ..., & Yoshimura, T. (2008).
Involvement of thyrotropin in photoperiodic signal transduction in mice. Proceedings of the National Academy of Sciences of the United States of America, 105(47), 18238-42. [PubMed:19015516] [PMC] [WorldCat] [DOI] - ↑
Rosenthal, N.E., Sack, D.A., Gillin, J.C., Lewy, A.J., Goodwin, F.K., Davenport, Y., ..., & Wehr, T.A. (1984).
Seasonal affective disorder. A description of the syndrome and preliminary findings with light therapy. Archives of general psychiatry, 41(1), 72-80. [PubMed:6581756] [WorldCat] [DOI]