受容野
英:receptive field 独:rezeptives feld 仏:champ récepteur
感覚系の細胞の受容野 (receptive field)とは、外界あるいは体内に呈示された刺激がその細胞の活動に影響を及ぼしうる末梢の範囲のことである。受容野の場所、サイズ、形および内部構造は細胞により異なり、これらは細胞が特定の刺激に感受性をもつ基盤をなす。一般に感覚処理経路の初期の段階ほど、小さく単純な構造の受容野がみられ、後の段階ほど広く複雑な構造の受容野がみられる。受容野のこのような変化により、感覚系では、その処理経路に沿って、逐次複雑な情報処理がおこなわれる。
受容野の概念と概要
受容野とは
個体は、周囲の環境あるいは体内の変化を刺激としてとらえ知覚することができる。これは感覚受容器で物理エネルギーから電気信号へと変換された刺激情報が大脳皮質感覚野を含む感覚処理経路に沿って伝達されることによる。このとき経路の個々の細胞は自身の電気活動を増加あるいは減少させることで刺激情報の処理伝達を行うが、末梢の特定の部位に生じた刺激しか取り扱わない。この限られた末梢部位の範囲を細胞の受容野とよぶ。受容野の場所は細胞により異なる。視覚の場合は、細胞が光刺激を受け取る網膜の範囲(あるいはその部位に対応する視野範囲)を意味し、体性感覚では、細胞が触圧などの刺激を受け取る体部位の範囲を指す。
受容野の最初の明確な定義はH. K. Hartline (1940) による[1]。彼は、スポット光にたいするカエル網膜神経節細胞の活動を調べたところ、網膜のある範囲に光を照射したとき、あるいは光を取り除いたときにのみ細胞が興奮応答することを見いだし、この範囲を受容野と定義した。
感覚経路と受容野構造の階層性
受容野内部に呈示された刺激は、細胞を興奮させることも抑制することもある。後述するように、ネコの網膜神経説細胞は、受容野の中心部分に光を照射する場合と周辺部分に照射する場合とで反応が異なり、一方では興奮応答がみられ、他方では抑制応答がみられる[2]。このように細胞が刺激に応答する様式は受容野内部で一様でなく、その内部的な構造は受容野構造(receptive field structure)とよばれている。
同じ感覚系でも受容野構造はその処理段階で大きく異なる。これは、感覚処理経路において前段階の出力が収斂と分散を繰り返しながら次段階へと送られていくためである。一般に初期段階では狭く単純な構造の受容野がみられるのにたいし、高次の段階になると広く複雑な構造の受容野がみられる。とくに、初期段階の細胞の受容野は、その内部に複数の刺激が呈示されても、入力信号は単純に線形加算(linear summation)されるだけの場合が多い。このような受容野は線形受容野(linear receptive field)とよばれ、その構造は単純な空間フィルターとして表される。一方、高次の段階では、受容野内部での信号の加算の仕方は非線形(nonlinear)なものとなり、その受容野構造は、複数の空間フィルターや整流機構(rectification)などを縦列、並列に組み合わせた複雑な回路様の機構として記述される。
視覚系の受容野
古典的受容野と非古典的受容野
単独で呈示された刺激が細胞応答を変化させる空間範囲を古典的受容野(classical receptive field, CRF)とよぶ。視覚系で受容野とは古典的受容野を指す場合が多い。古典的受容野の周囲には非古典的受容野(non classical receptive field, nCRF)とよばれる領域があるが、これについては後述する。 以下に、主要な視覚処理経路である、網膜、視床外側膝状体(lateral geniculate nucleus, LGN)、大脳皮質第一次視覚野(primary visual cortex, V1野)を経て高次視覚野へと至る経路の各段階の古典的受容野をみていく[3]。
網膜、視床中継核でみられる受容野
視細胞の受容野
外界の光を電気信号に変換する視細胞には桿体(rod)、錐体(cone)の2種類があり、前者は暗所視に、後者は明所視、色覚に関与している。いずれの受容野も概ね円状で、サイズは非常に小さく、霊長類網膜の中心窩(fovea)では視角にして0.5分程度(1/120度)である。
中心周辺拮抗型受容野
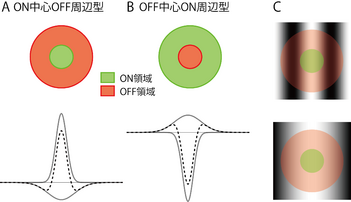
(A) ON中心OFF周辺型 では、明るい光で興奮(暗い光で抑制)がみられる領域(ON領域という、緑で示す)が受容野の中心に 、暗い光で興奮(明るい光で抑制)がみられる領域(OFF領域という)がその周辺に位置し、2つの領域は同心円状に配置する(A)。(B) OFF中心ON周辺型 では、OFF領域が受容野の中心に 、ON領域がその周辺に配置する。A, Bの下段は、これらの構造の1次元断面図であり、明るい光に対する興奮性を正に方向に示している。受容野は、サイズの異なる2つのガウス関数(実線)のの差分であるDOG関数で近似できる(波線)。( C ) ON中心OFF周辺型細胞を2次元サイン波縞刺激でテストするとき、縞の幅が適切であり、縞の明部が受容の中心部に、縞の暗部が受容野の周辺部にくるときに強い興奮応答がみられる(Cの上段)。縞の幅が広く、縞の明部が受容野全体に入るとき細胞はあまり興奮しない。(Cの下段)
視細胞からの入力を受け取る双極細胞(bipolar cell)、次の段階に位置する網膜神経節細胞(retinal ganglion cell)、さらに次の段階の視床LGNの細胞には、明るい光を受容野の中心部(center)に照射したときに興奮応答するON中心型(ON-center type)と、暗い光を照射したときに興奮応答するOFF中心型(OFF-center type)の2種類が存在する[2][4]。いずれも、中心部の周辺に照射された光には逆の応答をする。すなわち、ON中心型細胞は周辺部に明るい光を受けたときに、OFF中心型細胞は暗い光を受けたときに、抑制応答を示す。中心部と周辺部は同心円状に配置し、逆の反応がみられることから、この受容野を中心周辺拮抗型(antagonistic center-surround)とよぶ。神経節細胞ではさらに、中心部、周辺部のそれぞれの内部でも刺激の明暗の違いで反応が逆になり、明るい光で抑制反応がみられる場所では暗い光では興奮反応がみられ、暗い光で抑制反応がみられる場所では明るい光で興奮反応がみられる。このためON中心型の受容野をON中心OFF周辺型(ON-center OFF-surround)とよび(図1A)、OFF中心型の受容野をOFF中心ON周辺型(OFF-center ON-surround)ともよんでいる(図1B)。このような受容野構造をもつ細胞は、2次元のサイン波縞刺激にたいして、明るい光がON領域に、暗い光がOFF領域に入るとき(図1C上)には興奮応答するが、光が一様に入るときには(図1C下)ほとんど反応しないことから、明暗コントラストのエッジ幅や位置の情報を伝達していると捉えることができる。
中心周辺拮抗型の受容野構造は2つのガウス関数の差分であるDOG(difference-of-Gaussians)関数で表すことができる(図1A, Bの下段)[5]。またこのような受容野をもつ細胞の応答は入力刺激と受容野構造の内積で表しうる。ただし、網膜神経節細胞の受容野構造が最も古くから調べられてきたネコでは、このような線形近似が十分に成り立つ細胞とそうでない細胞が存在しており、前者をX細胞、後者をY細胞という[6]。
色対立型受容野と広帯域型受容野
霊長類網膜神経節細胞は、形態的特徴からミジェット細胞とパラソル細胞に区分される。ミジェット細胞は光波長(色)感受性をもち、しかも受容野中心部と周辺部で異なる光波長に感受性があるものが多い。たとえばある細胞は、受容野中心では緑色に興奮応答を示し、周辺部では赤色に抑制応答を示す。このようなタイプの受容野は色対立型(color opponent type)とよよばれる。パラソル細胞の中心部、周辺部では、いずれも広い範囲の光波長に感受性がみられる。このような受容野タイプは広帯域型(broad-band type)とよばれる [7]。
第一次視覚野(V1野)単純型細胞の受容野
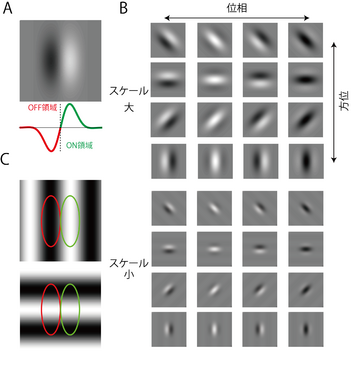
A. ON領域、OFF領域を白、黒であらわしている。1次元のプロファイル(緑: ON領域, 赤: OFF領域)を下段に示す。このような構造はガボールフィルターで表すことができる。B. ガボールフィルターのパラメータを変化させることで、さまざまな方位、スケール、位相の空間構造を表すことができる。このような多様な構造がV1野の単純型細胞群の受容野にみられる。C. Aに示す受容野構造に最適(上段)および不適(下)な2次元サイン波刺激。縞の明るい部分がON領域、暗い部分がOFF領域ともっともマッチするような空間周波数、方位、位相をもつ刺激(上段)が最適な刺激となる。一方、これと直交する方位の縞(下段)に細胞は反応しない。
受容野構造
網膜神経節細胞あるいはLGN細胞に細長いスリット光を呈示するとき、その向き(方位)を変えても反応はあまり変化しない。このことは、これらの細胞の受容野構造がほぼ同心円状であることから予想できる。これにたいし、V1野の大部分の細胞はスリット光が特定の方位を向くときにのみ強く反応する。この方位選択性(orientation selectivity)をもつ細胞の古典的受容野は以下の2つのタイプがある[8] [9]。第一のタイプでは、明るい光で興奮反応がみられるON領域と暗い光で興奮応答がみられるOFF領域が隣あって同じ向きに並ぶ(図2)。ON、OFF領域の伸びる向き、大きさ、位置関係は細胞により様々である。このような受容野構造をもつ細胞を単純型細胞(simple cell)とよぶ。単純型細胞の受容野は、同じ空間軸上に受容野の中心をもつ複数のLGN細胞からの入力が収斂することで、できると考えられる[9][10][11]。第2のタイプでは、ON領域とOFF領域が重なり合う。この構造をもつ細胞を複雑型細胞(complex cell)とよぶ(図3)。
ガボールフィルター による近似
単純型細胞の古典的受容野はガボールフィルーターでよく近似できる(図2B)[12] 。ガボールフィルターはガウス関数とサイン波の積で定義される。ガボールフィルターのパラメーターを変えることで、図2Bに示す様々なサイズ、方位、スケール、そして位相の空間構造を表すことができ[13]、実際にみられる様々な単純型細胞の受容野構造を系統的に表すことができる。
受容野の線形性と刺激選択性
単純型細胞の受容野には、強い線形性がみられ、任意の刺激にたいする細胞の応答は、受容野構造と刺激の内積値を半波整流(half rectification)することで近似できる。[14] [15]。したがって、単純型細胞は、その受容野構造と形がマッチした刺激ほど強く反応する。たとえば2次元サイン波を刺激とする場合、その明暗がON領域、OFF領域とマッチするような方位、空間周波数(spatial frequency)(=サイン波の周期の逆数)、位相(phase)をもつものが適刺激となる(図2C参照)。
時空間受容野と運動方向選択性
細胞は、刺激入力を受けるとそれに対する信号を瞬時に出力するわけでなく、過去一定時間内の入力を加算して出力する。細胞の現在の出力が、過去の入力にどのように依存するのかを表した時間特性を時間受容野 (temporal receptive field)とよぶ。これにたいし、空間範囲という通常の意味での受容野のことを空間受容野(spatial receptive field)という。空間受容野と時間受容野を合わせて時空間受容野(spatiotemporal receptive field)とよんでいる。
単純型細胞の大半は、物体がある向きに向かって動くときに強く反応し、それと反対方向に動くときには反応しない運動方向選択性を示す[8]。このような細胞の時空間受容野では、時間軸に沿ってON領域およびOFF領域の位置がある方向にずれていく[16]。この方向が細胞の好みの運動方向を表す。
受容野の両眼性
網膜に始まる視覚処理経路において左右両眼からの入力がはじめて収斂するV1野では、多くの細胞が両眼に受容野をもつ[8][9] 。単純型細胞では、ON領域やOFF領域の伸びる向きや幅は、左右の受容野で同じであるが、これらの領域の位置関係が、左右で異なる場合が多い。この位置ずれは、奥行き知覚の手がかりとなる網膜上の両眼視差(binocular disparity)にたいする感受性を単純型細胞にもたらしている。ずれの大きさは細胞により異なりあり、このため単純型細胞は、全体として様々な両眼視差を適刺激とする [17] [18]。
複雑型細胞の受容野
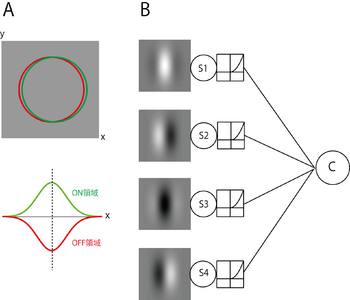
A. 複雑型細胞の受容野の模式図。上に2次元構造、下に1次元断面図を示す。複雑型細胞ではON領域とOFF領域が重なりあっている。B. 複雑型細胞の受容野の内部モデル。右のCが複雑型細胞を表した出力ユニット(エネルギーユニットという)を表す。このモデルでは、単純型細胞を模した4つのサブユニット(S1, S2, S3, S4) からの出力が収斂することでCの出力が形成される。各サブユニットは、共通の方位、空間周波数と、90度ずつ位相のずれたガボールフィルターをもち、フィルターを通過した信号を半波整流して出力する。このような受容野内部構造により、明るい線分や暗い線分が受容野内部のどの位置に呈示されても、その方位や幅が適切であれば、複雑型細胞は興奮応答を示す。
複雑型細胞も、単純型細胞と同様、サイン波の方位や空間周波数に選択性な応答を示す。しかし、単純型細胞の応答がサイン波の位相に強く依存するのにたいし、複雑型細胞では、方位や空間周波数が最適であれば、位相に関係なく強い反応がみられる。この特性は、最適な方位や空間周波数が同じで、最適な位相が異なる単純型細胞群の出力が複雑型細胞で収斂することで、作られうる[9]。これを示すモデルのうち最も単純なものが図3に示すエネルギーモデル(energy model)である。このモデルでは、単純型細胞を模した4つのサブユニット(S1, S2, S3, S4) からの出力が収斂することで、複雑型細胞を模したエネルギーユニット(Cで表す)の応答が形成される。各サブユニットは、共通の方位、空間周波数および90度ずつ位相のずれたガボールフィルターをもち、フィルターを通した入力信号を半波整流して出力する。さらに、各サブユニットが同じ時間受容野をもつようにモデルを拡張することで、エネルギーユニットが運動方向選択性を示すようにできる。この拡張したエネルギーモデルは運動エネルギーモデル(motion energy model)とよばれている[19]。複雑型細胞の大半は運動方向選択性を示すが[8]、その特性は運動エネルギーモデルでうまく説明できる[20]。
複雑型細胞の多くはまた、自身の受容野内部であれば刺激の位置や明暗コントラスに関係なく両眼視差を検出できることが知られている。この性質は両眼視差エネルギーモデル(disparity energy model)でうまく説明される[21]。
非古典的受容野
古典的受容野の周辺には、刺激が単独で呈示されるときには細胞活動に影響しないが、古典的受容野内部の刺激と同時に呈示されると、細胞に主に抑制性の影響を及ぼす空間範囲があり、これを非古典的受容野とよんでいる。
非古典的受容野は網膜の段階ですでに存在しており、視覚経路のほとんど全ての段階でみられるが、ここでは最も多くの研究がなされたV1野の非古典的受容野について述べる。V1野ではこの構造は周辺領域とよばれることも多いが、これは網膜でみられる古典的受容野の周辺部とは全く異なるので注意が必要である。この領域は古典的受容野の周囲に一様に広がるのではなく、ある程度の局在がみられ、古典的受容野の最適方位軸の延長上に広がるもの、最適方位と直交する軸方向に広がるもののほか、斜め方向に広がるものもある[22] [23]。多くは抑制性の影響を及ばすが興奮性の影響も報告されている[24] 。非古典的受容野でみられる抑制には特徴選択性があり、古典的受容野でみられる最適な刺激方位、空間周波数にたいして、非古典的受容野では最も強い抑制がみられる[25][26] 。これらの特性は、ポップアップや図地分化と呼ばれる知覚現象の基盤として[27] 、あるいは線の長さや曲率[28]、主観的輪郭[29] 、テクスチャー境界[23]などさまざまな特徴を検出するための初期機構として注目されている。
高次視覚野における受容野
受容野サイズの変化
V1野以外にも霊長類には30以上もの視覚関連領野があり、これらはV1野、V2野を経て側頭葉(temporal lobe)へと至る腹側経路(ventral pathway)と頭頂葉(parietal lobe)へと至る背側経路(dorsal pathway)の2つの経路として構成されている。腹側経路は主に物体形状の分析に、背側経路は運動や空間位置情報の伝達に関与していると考えられている [30] 。
細胞の受容野サイズは高次の領野ほど大きくなる。霊長類V1野で中心視野に受容野をもつ細胞の受容野サイズは0.1~1度程度であるが、腹側経路の最終段階に位置するTE野では10度以上にもなる。ただし受容野サイズは偏心度にも依存し、中心視野では小さく、周辺視野ほど大きくなる。例えばV1野の周辺視野の受容野サイズは5度から10度程度である。またV1野細胞の受容野位置は対側視野に限られるものが大部分であるが、受容野サイズが大きくなるにつれて、同側視野も含むものが増してくる。TE野では多くの細胞が同側視野を受容野に含む[31]。
背側経路でみられる受容野
空間視に関連の深い背側経路では、受容野の位置が、網膜座標以外の空間座標系に依存するような細胞が多くみられる。たとえば、V3A野やその上位にある7a野には、受容野の位置は網膜座標系で固定されているものの、頭部を基準とした座標系にも依存し、眼球が特定の方向に向くときに強く活動するような細胞が存在する[32]。PO野には、もはや網膜座標には依存せず、頭や体との位置関係で固定された受容野をもつ細胞が現れる[33]。同様の細胞は、視覚入力と体性感覚入力の両方を受けるVIP野や7b野などにもみられる。これらは、身体の一部に受容野をもち、そこへの皮膚刺激とその場所へ向かってくる視覚刺激の両方に応答する[34]。
背側経路の多くの細胞は両眼に受容野をもち、両眼視差に感受性をもつ。これらは物体の奥行き位置や3次元形状の表現に関与していると考えられている[35][36]。
腹側経路でみられる受容野
腹側経路では、高次の段階に向かうにつれて、複雑な物体特徴を適刺激とするような受容野が増してくる。V2野に折れ線に反応する細胞[37] 、V4野にテクスチャー、パターン、曲率や凹凸の情報を伝える細胞[38]、TEO野には物体の部分的特徴、TE野に至っては顔などの極めて複雑な特徴の情報を伝える細胞が存在する[39][40]。これらの細胞の多くは、受容野内部で刺激の位置、向き、あるいは形を定義する手がかり(明るさの違いや色の違いなど)を変えても特徴選択性を維持する。 腹側経路でも、大部分の細胞は両眼に受容野をもち、両眼視差に感受性をもつことから、この経路も奥行き知覚に関与していると考えられている[41]。
体性感覚系の受容野
一次求心性神経繊維の受容野
触圧感覚をもたらす機械受容器には皮膚表面近くに位置するマイスナー小体、メルケル終末と深部にあるパチニ小体、ルフィニ終末の4種類が知られている。マイスナー小体、メルケル終末から出る1次求心性繊維の受容野はスポット状で比較的小さい。例えば、手の場合、これらの繊維の受容野サイズは直径数ミリ程度である。パチニ小体、ルフィニ終末から出る繊維の受容野はそれよりも大きく、境界が不明瞭である場合が多い[42]。自由神経終末である温冷覚受容野からの1次繊維の受容野サイズは、四肢末端では直径数ミリ程度である。痛覚受容器からの繊維には、同程度の比較的狭い受容野をもつ特定的侵害受容ニューロンと、より大きい受容野をもつ広作動閾ニューロンとがある。ただし、いずれの受容器に由来する場合も、体幹に近いところでは一時繊維の受容野サイズは数十平方センチメートルと非常に大きくなる。
体性感覚野の受容野
1次体性感覚野は、視床からの入力が入る3a野、3b野と、そこから入力を受ける2野、1野に区分される。皮膚からの入力は3b野から主に1野へ、筋や腱からの入力は3a野から主に2野へと運ばれる。ただし1野、2野ともに3aおよび3bの両方から入力を受け取り、これらの入力は多くの細胞で収斂している。
各領野の細胞の受容野位置は、その細胞が存在する大脳半球の反対側に体部位に限られる。これらの細胞の受容野サイズは1次繊維と比べるとはるかに大きく、手でも直径数センチメートルある。さらに3a野、3b野より1野や2野のほうが大きい。たとえば3b野の指に受容野をもつ細胞は指一本程度のものが多くあるが、1野や2野には数本の指に受容野が広がるものが数多くみられる [43]。
1野や2野の細胞は、3a野や3b野よりも複雑な受容野特性を示すことが知られており、たとえば表皮をこする物体の動きや、物体が伸びる向きや物体表面のテクスチャーなどに選択性を示す細胞が報告されている[44]。
頭頂葉の体性感覚皮質(5野、7野)は1次体性感覚野から入力を受け取る。この領野の細胞は1次体性感覚野よりも広い受容野をもち、また体の両側の対称な場所に受容野をもつものが多い。たとえばある細胞は両手の5本指全体に受容野をもつ[45]。さらに、これらの細胞は、皮膚だけでなく、いくつかの筋、腱からの入力が収斂しており、手全体や腕全体といった体の各パーツの姿勢の情報を伝達し、運動の体性感覚ガイダンスに関与していると考えられている。
関連項目
参考文献
- ↑ H. K. Hartline
The receptive fields of optic nerve fibers.
Am. J. Physiol.: 1940, 130; 690-699. - ↑ 2.0 2.1
KUFFLER, S.W. (1953).
Discharge patterns and functional organization of mammalian retina. Journal of neurophysiology, 16(1), 37-68. [PubMed:13035466] [WorldCat] [DOI] - ↑ 福田淳 佐藤宏道
脳と視覚 -何をどうみるか
ブレインサイエンスシリーズ14 "共立出版" 2002 - ↑
Kaneko, A. (1973).
Receptive field organization of bipolar and amacrine cells in the goldfish retina. The Journal of physiology, 235(1), 133-53. [PubMed:4778132] [PMC] [WorldCat] [DOI] - ↑
Rodieck, R.W. (1965).
Quantitative analysis of cat retinal ganglion cell response to visual stimuli. Vision research, 5(11), 583-601. [PubMed:5862581] [WorldCat] [DOI] - ↑
Enroth-Cugell, C., & Robson, J.G. (1966).
The contrast sensitivity of retinal ganglion cells of the cat. The Journal of physiology, 187(3), 517-52. [PubMed:16783910] [PMC] [WorldCat] [DOI] - ↑
Dacey, D.M. (1999).
Primate retina: cell types, circuits and color opponency. Progress in retinal and eye research, 18(6), 737-63. [PubMed:10530750] [WorldCat] - ↑ 8.0 8.1 8.2 8.3
HUBEL, D.H., & WIESEL, T.N. (1959).
Receptive fields of single neurones in the cat's striate cortex. The Journal of physiology, 148, 574-91. [PubMed:14403679] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3
Hubel, D.H., & Wiesel, T.N. (1968).
Receptive fields and functional architecture of monkey striate cortex. The Journal of physiology, 195(1), 215-43. [PubMed:4966457] [PMC] [WorldCat] [DOI] - ↑
Tanaka, K. (1983).
Cross-correlation analysis of geniculostriate neuronal relationships in cats. Journal of neurophysiology, 49(6), 1303-18. [PubMed:6875624] [WorldCat] [DOI] - ↑
Chapman, B., Zahs, K.R., & Stryker, M.P. (1991).
Relation of cortical cell orientation selectivity to alignment of receptive fields of the geniculocortical afferents that arborize within a single orientation column in ferret visual cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 11(5), 1347-58. [PubMed:2027051] [WorldCat] - ↑
Jones, J.P., & Palmer, L.A. (1987).
The two-dimensional spatial structure of simple receptive fields in cat striate cortex. Journal of neurophysiology, 58(6), 1187-211. [PubMed:3437330] [WorldCat] [DOI] - ↑
Olshausen, B.A., & Field, D.J. (1996).
Emergence of simple-cell receptive field properties by learning a sparse code for natural images. Nature, 381(6583), 607-9. [PubMed:8637596] [WorldCat] [DOI] - ↑
Movshon, J.A., Thompson, I.D., & Tolhurst, D.J. (1978).
Spatial summation in the receptive fields of simple cells in the cat's striate cortex. The Journal of physiology, 283, 53-77. [PubMed:722589] [PMC] [WorldCat] [DOI] - ↑
Heeger, D.J. (1992).
Half-squaring in responses of cat striate cells. Visual neuroscience, 9(5), 427-43. [PubMed:1450099] [WorldCat] [DOI] - ↑
DeAngelis, G.C., Ohzawa, I., & Freeman, R.D. (1993).
Spatiotemporal organization of simple-cell receptive fields in the cat's striate cortex. II. Linearity of temporal and spatial summation. Journal of neurophysiology, 69(4), 1118-35. [PubMed:8492152] [WorldCat] [DOI] - ↑
DeAngelis, G.C., Ohzawa, I., & Freeman, R.D. (1991).
Depth is encoded in the visual cortex by a specialized receptive field structure. Nature, 352(6331), 156-9. [PubMed:2067576] [WorldCat] [DOI] - ↑
Ferster, D. (1981).
A comparison of binocular depth mechanisms in areas 17 and 18 of the cat visual cortex. The Journal of physiology, 311, 623-55. [PubMed:7264985] [PMC] [WorldCat] [DOI] - ↑
Adelson, E.H., & Bergen, J.R. (1985).
Spatiotemporal energy models for the perception of motion. Journal of the Optical Society of America. A, Optics and image science, 2(2), 284-99. [PubMed:3973762] [WorldCat] - ↑
Emerson, R.C., Bergen, J.R., & Adelson, E.H. (1992).
Directionally selective complex cells and the computation of motion energy in cat visual cortex. Vision research, 32(2), 203-18. [PubMed:1574836] [WorldCat] [DOI] - ↑
Ohzawa, I., DeAngelis, G.C., & Freeman, R.D. (1990).
Stereoscopic depth discrimination in the visual cortex: neurons ideally suited as disparity detectors. Science (New York, N.Y.), 249(4972), 1037-41. [PubMed:2396096] [WorldCat] [DOI] - ↑
Walker, G.A., Ohzawa, I., & Freeman, R.D. (1999).
Asymmetric suppression outside the classical receptive field of the visual cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(23), 10536-53. [PubMed:10575050] [PMC] [WorldCat] - ↑ 23.0 23.1
Tanaka, H., & Ohzawa, I. (2009).
Surround suppression of V1 neurons mediates orientation-based representation of high-order visual features. Journal of neurophysiology, 101(3), 1444-62. [PubMed:19109456] [WorldCat] [DOI] - ↑
Kapadia, M.K., Westheimer, G., & Gilbert, C.D. (2000).
Spatial distribution of contextual interactions in primary visual cortex and in visual perception. Journal of neurophysiology, 84(4), 2048-62. [PubMed:11024097] [WorldCat] [DOI] - ↑
DeAngelis, G.C., Freeman, R.D., & Ohzawa, I. (1994).
Length and width tuning of neurons in the cat's primary visual cortex. Journal of neurophysiology, 71(1), 347-74. [PubMed:8158236] [WorldCat] [DOI] - ↑
Akasaki, T., Sato, H., Yoshimura, Y., Ozeki, H., & Shimegi, S. (2002).
Suppressive effects of receptive field surround on neuronal activity in the cat primary visual cortex. Neuroscience research, 43(3), 207-20. [PubMed:12103439] [WorldCat] [DOI] - ↑
Knierim, J.J., & van Essen, D.C. (1992).
Neuronal responses to static texture patterns in area V1 of the alert macaque monkey. Journal of neurophysiology, 67(4), 961-80. [PubMed:1588394] [WorldCat] [DOI] - ↑
Dobbins, A., Zucker, S.W., & Cynader, M.S. (1987).
Endstopped neurons in the visual cortex as a substrate for calculating curvature. Nature, 329(6138), 438-41. [PubMed:3657960] [WorldCat] [DOI] - ↑
von der Heydt, R., Peterhans, E., & Baumgartner, G. (1984).
Illusory contours and cortical neuron responses. Science (New York, N.Y.), 224(4654), 1260-2. [PubMed:6539501] [WorldCat] [DOI] - ↑
Felleman, D.J., & Van Essen, D.C. (1991).
Distributed hierarchical processing in the primate cerebral cortex. Cerebral cortex (New York, N.Y. : 1991), 1(1), 1-47. [PubMed:1822724] [WorldCat] [DOI] - ↑
Desimone, R., Albright, T.D., Gross, C.G., & Bruce, C. (1984).
Stimulus-selective properties of inferior temporal neurons in the macaque. The Journal of neuroscience : the official journal of the Society for Neuroscience, 4(8), 2051-62. [PubMed:6470767] [WorldCat] - ↑
Colby, C.L., Duhamel, J.R., & Goldberg, M.E. (1993).
Ventral intraparietal area of the macaque: anatomic location and visual response properties. Journal of neurophysiology, 69(3), 902-14. [PubMed:8385201] [WorldCat] [DOI] - ↑
Galletti, C., Battaglini, P.P., & Fattori, P. (1993).
Parietal neurons encoding spatial locations in craniotopic coordinates. Experimental brain research, 96(2), 221-9. [PubMed:8270019] [WorldCat] [DOI] - ↑
Colby, C.L., Duhamel, J.R., & Goldberg, M.E. (1993).
Ventral intraparietal area of the macaque: anatomic location and visual response properties. Journal of neurophysiology, 69(3), 902-14. [PubMed:8385201] [WorldCat] [DOI] - ↑
Galletti, C., Battaglini, P.P., & Fattori, P. (1993).
Parietal neurons encoding spatial locations in craniotopic coordinates. Experimental brain research, 96(2), 221-9. [PubMed:8270019] [WorldCat] [DOI] - ↑
Taira, M., Tsutsui, K.I., Jiang, M., Yara, K., & Sakata, H. (2000).
Parietal neurons represent surface orientation from the gradient of binocular disparity. Journal of neurophysiology, 83(5), 3140-6. [PubMed:10805708] [WorldCat] [DOI] - ↑
Ito, M., & Komatsu, H. (2004).
Representation of angles embedded within contour stimuli in area V2 of macaque monkeys. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(13), 3313-24. [PubMed:15056711] [PMC] [WorldCat] [DOI] - ↑
Gallant, J.L., Braun, J., & Van Essen, D.C. (1993).
Selectivity for polar, hyperbolic, and Cartesian gratings in macaque visual cortex. Science (New York, N.Y.), 259(5091), 100-3. [PubMed:8418487] [WorldCat] [DOI] - ↑
Desimone, R., Albright, T.D., Gross, C.G., & Bruce, C. (1984).
Stimulus-selective properties of inferior temporal neurons in the macaque. The Journal of neuroscience : the official journal of the Society for Neuroscience, 4(8), 2051-62. [PubMed:6470767] [WorldCat] - ↑
Fujita, I., Tanaka, K., Ito, M., & Cheng, K. (1992).
Columns for visual features of objects in monkey inferotemporal cortex. Nature, 360(6402), 343-6. [PubMed:1448150] [WorldCat] [DOI] - ↑
Uka, T., Tanaka, H., Yoshiyama, K., Kato, M., & Fujita, I. (2000).
Disparity selectivity of neurons in monkey inferior temporal cortex. Journal of neurophysiology, 84(1), 120-32. [PubMed:10899190] [WorldCat] [DOI] - ↑ R. S. Johansson and A. B. Vallbo
Tactile sensory coding in the glabrous skin of the human hand.
Trends Neurosci.: 1983, 6; 27-32. - ↑
Mountcastle, V.B. (1997).
The columnar organization of the neocortex. Brain : a journal of neurology, 120 ( Pt 4), 701-22. [PubMed:9153131] [WorldCat] [DOI] - ↑
Hyvärinen, J., & Poranen, A. (1978).
Movement-sensitive and direction and orientation-selective cutaneous receptive fields in the hand area of the post-central gyrus in monkeys. The Journal of physiology, 283, 523-37. [PubMed:102767] [PMC] [WorldCat] [DOI] - ↑
Iwamura, Y., Iriki, A., & Tanaka, M. (1994).
Bilateral hand representation in the postcentral somatosensory cortex. Nature, 369(6481), 554-6. [PubMed:8202155] [WorldCat] [DOI]
(執筆者:田中 宏喜、担当編集委員:藤田 一郎)