神経前駆細胞
水谷健一
神戸学院大学大学院 薬学研究科 幹細胞生物学研究室
DOI:10.14931/bsd.2102 原稿受付日:2017年4月6日 原稿完成日:2017年4月17日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:neural progenitor cell 独:neurale Vorläuferzellen 仏:cellule neuronale progénitrice
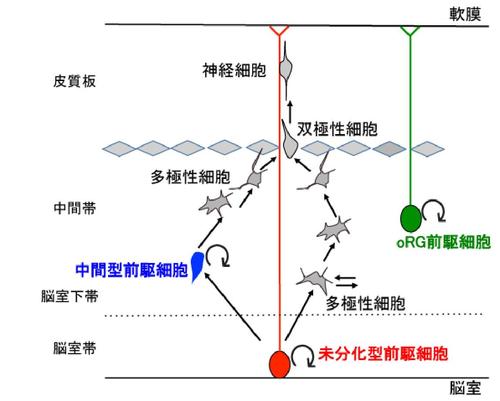
神経前駆細胞とは、神経系の未分化細胞であり、限られた分裂回数の後に分化を遂げるように運命付けられた細胞を指す。たとえば、大脳皮質を構成するグルタミン作動性の神経細胞は、未分化型前駆細胞、中間型前駆細胞、およびoRG前駆細胞といった、形態および機能が異なる少なくとも3つの前駆細胞(図)から生み出されると考えられている。ここでは、各々の前駆細胞の相違点を最近の研究報告を含めて概説する。
神経前駆細胞とは
複雑な大脳皮質は哺乳類の脳の最大の特徴とされるが、これは複数の神経前駆細胞が多様な神経細胞を産生した結果である。すなわち、発生期における大脳皮質(終脳背側)の神経上皮に生じた神経幹細胞が分裂して数を増やし、やがて未分化型前駆細胞(放射状グリア細胞あるいはapical progenitor)、中間型前駆細胞(basal progenitorあるいはintermediate progenitor)、およびoRG前駆細胞(OSVZ (outer subventricular zone) radial glia-like cell)などの各々の前駆細胞が出現するが、これらの細胞は異なる分裂・分化能力を有し、固有の役割を担う結果として、組織における複雑な細胞構築が可能となる [1]。
これらの前駆細胞は、いずれもグルタミン酸作動性の神経細胞の発生に寄与していると考えられているが、明確な形態的・機能的な違いが観察される(図)。まず、未分化型前駆細胞は生み出した細胞をロコモーションと呼ばれる移動様式で放射状突起を伝って皮質板に移動する一方で、中間型前駆細胞は脳室下帯近傍で多極性細胞(複数の突起を有する細胞)に形態を大きく変化することが知られている。また、oRG前駆細胞は基底膜方向にのみ一本の細胞突起を持つことを特徴とし、主に高等哺乳類のOSVZ(外側脳室下帯)に存在し、非対称分裂により神経細胞を生み出す。
こうした前駆細胞における分裂・分化の極めて小さなバランスの変化は、最終的な脳のサイズに対して決定的な影響を及ぼすことが指摘されており [2]、例えば、β-カテニンのトランスジェニックマウスの大脳皮質では、未分化型前駆細胞の増殖性が2倍程度亢進することによって、極端な皮質表面積の拡大が確認されている[3]。
未分化型前駆細胞と中間型前駆細胞
哺乳類の胎生期大脳皮質の神経発生過程においては、未分化型前駆細胞が脳室帯のapical面(頂端面)において自己複製を伴う非対称分裂を行い[4][5][6]、将来の神経細胞もしくは中間型前駆細胞を生じる(図)。つまり、未分化型前駆細胞こそが神経幹細胞と同義的に扱える細胞であると言える。
一方、中間型前駆細胞は限られた分化ポテンシャルを持ち、主に脳室帯のbasal側(基底側)である脳室下帯で1〜3回程度の対称分裂によって神経細胞だけを生じる一過性前駆細胞(“neurogenic transient amplifying cells”)の一種と考えられている[7]。
この中間型前駆細胞は、大脳皮質の層形成、領野形成の構築に重要な役割を担うとされている。たとえば、“upper layer hypothesis”[8]では、中間型前駆細胞が大脳皮質発生後期に上層の神経細胞の発生の運命決定に寄与する可能性が報告されている[9][10]。
また、“intermediate progenitor hypothesis”では、進化に伴う中間型前駆細胞の増殖性亢進が霊長類における大脳皮質表面積の拡大に寄与する可能性が指摘されている[11]。実際、中間型前駆細胞の分子マーカーであるT-box brain protein 2 (Tbr2)のヒトにおける変異は、大脳皮質形成不全との関連性が指摘されており[12]、大脳皮質の細胞構築における中間型前駆細胞の役割に興味が持たれる。
しかしながら、中間型前駆細胞は脳室下帯が形成される以前に出現し、発生期全体を通して豊富に存在するとの報告もあり[13]、定量的な解析においては上層の神経細胞ばかりでなく、深層の神経細胞の大多数(50〜95%)が中間型前駆細胞に由来すると指摘されている[14]。
これらの知見は、領域・時期特異的に異なる性質に制限された中間型前駆細胞が、各々のradial unit(大脳皮質には80個程度の神経細胞で構成されるミニ円柱構造と呼ばれる最小単位の局所神経回路が存在するとされており、単位毎の神経回路が多数並列的に集合体を形成することで、神経回路が形成される)から神経細胞の産生を指数関数的に増幅し、これが広範な大脳皮質発生に寄与する可能性を示唆するものである。
未分化型前駆細胞と中間型前駆細胞を特徴付ける分子機構
それでは、脳室面で分裂する未分化型前駆細胞と非脳室面で分裂する中間型前駆細胞の運命は、どのように決定付けられるのであろうか?
未分化型前駆細胞の維持・増殖にはNotchシグナルが重要な役割を果たすことが知られている[15]。未分化型前駆細胞において、このNotchシグナルをHes1の強制発現によって活性化すると、中間型前駆細胞の分子マーカー(Tbr2など)の発現を抑制すること[16]、未分化型前駆細胞が強いNotchシグナルを利用するのに対して、中間型前駆細胞は減弱したNotchシグナルを利用すること[17]から、Notchシグナルの変化が未分化型前駆細胞から中間型前駆細胞への推移に寄与している可能性がある。
多極性細胞
最近の研究で、未分化型前駆細胞から生み出された未成熟な細胞(脳室帯を離れて皮質板へと移動を開始した直後の細胞)は、分化過程において脳室下帯や中間帯で多極性形態(多数の突起を持つ)細胞へとその形態を大きく変化させることが見出されており[18]、中間型前駆細胞の中には多極性形態を示す細胞が観察される。
この多極性細胞は、多数の突起を様々な方向に伸ばし、その突起を活発に伸縮させながら移動と滞留を繰り返し、全体としてはゆっくりと皮質板へと向かうが、このときの細胞移動は放射状突起を使わないとされている。
最近の研究では、未分化型前駆細胞が生み出した未成熟な細胞は、Tbr2陽性の中間型前駆細胞を経てNeuroD1を発現する多極性形態へと変化する細胞系譜と、Tbr2陽性細胞にならずに直接、NeuroD1陽性の多極性細胞へと変化する細胞系譜が観察されている[19]。
つまり、多極性細胞へ変化するタイミングの異なる2つの細胞系譜が存在することを意味しており、この違いが皮質板へと進入するタイミングの多様性を生むことで、異なる層を構成する神経細胞へと分化する可能性が示唆される。
さらには、未分化型前駆細胞が生み出した細胞が多極性細胞へと変化する際には、ミトコンドリア局在型の活性酸素種の量が大きく減少することが見出されており、実際、多極性細胞のマーカーであるNeuroD1の転写活性は活性酸素種の量に依存して変化することが確認されていることから[20]、細胞内の代謝状態の変化が前駆細胞の推移に関与する可能性がある。さらには、未成熟な細胞と考えられている多極性細胞は、未だ細胞運命が決定されていない細胞が含まれている可能性が指摘されている[21]。
実際、こうした未分化型前駆細胞から中間型前駆細胞および多極性細胞への推移が上手く進行しないと、神経分化に決定的な異常を生じ、大脳皮質における層形成の異常を示すことが報告されている[21][22]]。また。最近の研究では、多極性細胞として移動してきた細胞はサブプレート層で移動を停止し、この際にサブプレートニューロンから伝達されるシグナルによって細胞の性質が変化することが、正常な分化に決定的な役割を果たすことが報告されている[23]。
oRG前駆細胞
さらに最近の研究から、ヒトなどの高等哺乳類の胎生期大脳皮質の外側脳室下帯には、神経細胞を生み出す「新たな前駆細胞」が存在することが明らかになっている[24][25]。この前駆細胞はoRG前駆細胞とよばれ、非脳室面で非対称分裂を行い、霊長類ばかりでなく齧歯類においても少なからず存在していることが確認されている[26]。
今後、これらの個々の前駆細胞が果たす役割が明らかになることで、大脳皮質の発生を制御する分子機構が明確化されることが期待される。
関連項目
参考文献
- ↑
Fietz, S.A., & Huttner, W.B. (2011).
Cortical progenitor expansion, self-renewal and neurogenesis-a polarized perspective. Current opinion in neurobiology, 21(1), 23-35. [PubMed:21036598] [WorldCat] [DOI] - ↑
Rakic, P. (1995).
A small step for the cell, a giant leap for mankind: a hypothesis of neocortical expansion during evolution. Trends in neurosciences, 18(9), 383-8. [PubMed:7482803] [WorldCat] [DOI] - ↑
Chenn, A., & Walsh, C.A. (2002).
Regulation of cerebral cortical size by control of cell cycle exit in neural precursors. Science (New York, N.Y.), 297(5580), 365-9. [PubMed:12130776] [WorldCat] [DOI] - ↑
Miyata, T., Kawaguchi, A., Okano, H., & Ogawa, M. (2001).
Asymmetric inheritance of radial glial fibers by cortical neurons. Neuron, 31(5), 727-41. [PubMed:11567613] [WorldCat] [DOI] - ↑
Miyata, T., Kawaguchi, A., Saito, K., Kawano, M., Muto, T., & Ogawa, M. (2004).
Asymmetric production of surface-dividing and non-surface-dividing cortical progenitor cells. Development (Cambridge, England), 131(13), 3133-45. [PubMed:15175243] [WorldCat] [DOI] - ↑
Konno, D., Shioi, G., Shitamukai, A., Mori, A., Kiyonari, H., Miyata, T., & Matsuzaki, F. (2008).
Neuroepithelial progenitors undergo LGN-dependent planar divisions to maintain self-renewability during mammalian neurogenesis. Nature cell biology, 10(1), 93-101. [PubMed:18084280] [WorldCat] [DOI] - ↑
Noctor, S.C., Martínez-Cerdeño, V., Ivic, L., & Kriegstein, A.R. (2004).
Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature neuroscience, 7(2), 136-44. [PubMed:14703572] [WorldCat] [DOI] - ↑
Smart, I.H., & Smart, M. (1982).
Growth patterns in the lateral wall of the mouse telencephalon: I. Autoradiographic studies of the histogenesis of the isocortex and adjacent areas. Journal of anatomy, 134(Pt 2), 273-98. [PubMed:7076556] [PMC] [WorldCat] - ↑
Tarabykin, V., Stoykova, A., Usman, N., & Gruss, P. (2001).
Cortical upper layer neurons derive from the subventricular zone as indicated by Svet1 gene expression. Development (Cambridge, England), 128(11), 1983-93. [PubMed:11493521] [WorldCat] - ↑
Zimmer, C., Tiveron, M.C., Bodmer, R., & Cremer, H. (2004).
Dynamics of Cux2 expression suggests that an early pool of SVZ precursors is fated to become upper cortical layer neurons. Cerebral cortex (New York, N.Y. : 1991), 14(12), 1408-20. [PubMed:15238450] [WorldCat] [DOI] - ↑
Kriegstein, A., Noctor, S., & Martínez-Cerdeño, V. (2006).
Patterns of neural stem and progenitor cell division may underlie evolutionary cortical expansion. Nature reviews. Neuroscience, 7(11), 883-90. [PubMed:17033683] [WorldCat] [DOI] - ↑
Baala, L., Briault, S., Etchevers, H.C., Laumonnier, F., Natiq, A., Amiel, J., ..., & Lyonnet, S. (2007).
Homozygous silencing of T-box transcription factor EOMES leads to microcephaly with polymicrogyria and corpus callosum agenesis. Nature genetics, 39(4), 454-6. [PubMed:17353897] [WorldCat] [DOI] - ↑
Wu, S.X., Goebbels, S., Nakamura, K., Nakamura, K., Kometani, K., Minato, N., ..., & Tamamaki, N. (2005).
Pyramidal neurons of upper cortical layers generated by NEX-positive progenitor cells in the subventricular zone. Proceedings of the National Academy of Sciences of the United States of America, 102(47), 17172-7. [PubMed:16284248] [PMC] [WorldCat] [DOI] - ↑
Haubensak, W., Attardo, A., Denk, W., & Huttner, W.B. (2004).
Neurons arise in the basal neuroepithelium of the early mammalian telencephalon: a major site of neurogenesis. Proceedings of the National Academy of Sciences of the United States of America, 101(9), 3196-201. [PubMed:14963232] [PMC] [WorldCat] [DOI] - ↑
Hitoshi, S., Alexson, T., Tropepe, V., Donoviel, D., Elia, A.J., Nye, J.S., ..., & van der Kooy, D. (2002).
Notch pathway molecules are essential for the maintenance, but not the generation, of mammalian neural stem cells. Genes & development, 16(7), 846-58. [PubMed:11937492] [PMC] [WorldCat] [DOI] - ↑
Shimojo, H., Ohtsuka, T., & Kageyama, R. (2008).
Oscillations in notch signaling regulate maintenance of neural progenitors. Neuron, 58(1), 52-64. [PubMed:18400163] [WorldCat] [DOI] - ↑
Mizutani, K., Yoon, K., Dang, L., Tokunaga, A., & Gaiano, N. (2007).
Differential Notch signalling distinguishes neural stem cells from intermediate progenitors. Nature, 449(7160), 351-5. [PubMed:17721509] [WorldCat] [DOI] - ↑
Tabata, H., & Nakajima, K. (2003).
Multipolar migration: the third mode of radial neuronal migration in the developing cerebral cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(31), 9996-10001. [PubMed:14602813] [PMC] [WorldCat] - ↑
Tabata, H., Kanatani, S., & Nakajima, K. (2009).
Differences of migratory behavior between direct progeny of apical progenitors and basal progenitors in the developing cerebral cortex. Cerebral cortex (New York, N.Y. : 1991), 19(9), 2092-105. [PubMed:19150920] [WorldCat] [DOI] - ↑
Inoue, M., Iwai, R., Tabata, H., Konno, D., Komabayashi-Suzuki, M., Watanabe, C., ..., & Mizutani, K.I. (2017).
Prdm16 is crucial for progression of the multipolar phase during neural differentiation of the developing neocortex. Development (Cambridge, England), 144(3), 385-399. [PubMed:27993981] [WorldCat] [DOI] - ↑ 21.0 21.1
Miyoshi, G., & Fishell, G. (2012).
Dynamic FoxG1 expression coordinates the integration of multipolar pyramidal neuron precursors into the cortical plate. Neuron, 74(6), 1045-58. [PubMed:22726835] [PMC] [WorldCat] [DOI] - ↑
Ohtaka-Maruyama, C., Hirai, S., Miwa, A., Heng, J.I., Shitara, H., Ishii, R., ..., & Okado, H. (2013).
RP58 regulates the multipolar-bipolar transition of newborn neurons in the developing cerebral cortex. Cell reports, 3(2), 458-71. [PubMed:23395638] [WorldCat] [DOI] - ↑
Ohtaka-Maruyama, C., Okamoto, M., Endo, K., Oshima, M., Kaneko, N., Yura, K., ..., & Maeda, N. (2018).
Synaptic transmission from subplate neurons controls radial migration of neocortical neurons. Science (New York, N.Y.), 360(6386), 313-317. [PubMed:29674592] [WorldCat] [DOI] - ↑
Hansen, D.V., Lui, J.H., Parker, P.R., & Kriegstein, A.R. (2010).
Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature, 464(7288), 554-561. [PubMed:20154730] [WorldCat] [DOI] - ↑
Fietz, S.A., Kelava, I., Vogt, J., Wilsch-Bräuninger, M., Stenzel, D., Fish, J.L., ..., & Huttner, W.B. (2010).
OSVZ progenitors of human and ferret neocortex are epithelial-like and expand by integrin signaling. Nature neuroscience, 13(6), 690-9. [PubMed:20436478] [WorldCat] [DOI] - ↑
Shitamukai, A., Konno, D., & Matsuzaki, F. (2011).
Oblique radial glial divisions in the developing mouse neocortex induce self-renewing progenitors outside the germinal zone that resemble primate outer subventricular zone progenitors. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(10), 3683-95. [PubMed:21389223] [PMC] [WorldCat] [DOI]