ゾーン構造
柏谷 英樹
東京大学 大学院医学系研究科 機能生物学専攻 細胞分子生理学
DOI:10.14931/bsd.1986 原稿受付日:2012年8月1日 原稿完成日:2012年9月19日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
英語名:zonal organization
類似した神経連絡あるいは機能を持つ神経細胞が帯状(ゾーン状)に分布し、その帯状エリアがある神経領域全体を横断し、かつ隣接して複数ある時、その構造をゾーン構造と呼ぶ。哺乳類の嗅覚系や小脳系で観察される構造について用いられている。
主嗅覚系に見られるゾーン構造
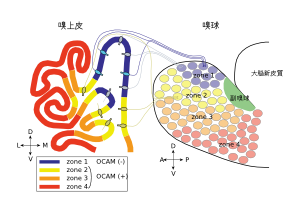
匂い分子受容体の発現パターンで規定される4つのゾーンを嗅上皮冠状断面および嗅球で模式的に表わしている。
嗅上皮におけるゾーン構造
嗅上皮上には、ヒトで数百万個、マウスで数千万個もの嗅細胞がシート状に敷き詰められている。嗅細胞には匂い分子受容体(嗅覚受容体)が発現し、鼻腔に吸い込まれた匂い分子を受容する。匂い分子受容体はヒトでおよそ350種類、マウスではおよそ1000種類存在するが、個々の嗅細胞はこの多種の匂い分子受容体の中から、1種類を選択的に発現する。ある1種類の匂い分子受容体を発現する嗅細胞は、嗅上皮上で前後軸方向に伸びる帯状のエリア(ゾーン)内に存在し、そのゾーン内では偏りなく一様に分布する。複数の匂い分子受容体の発現パターンの比較から、嗅上皮は4つのゾーンに区分され、各匂い分子受容体を発現する嗅細胞はこれら4つのゾーンのうち1つのゾーンに選択的に分布する[1] [2](図1左)。
嗅球におけるゾーン構造
嗅細胞の軸索は一次嗅覚中枢である嗅球へ投射し、嗅球表層部の糸球内でシナプス結合を形成する。糸球には嗅球出力ニューロンである僧帽細胞と房飾細胞の主樹状突起及び介在ニューロンである傍糸球細胞の樹状突起が伸長しており、嗅細胞軸索から興奮性入力を受ける。糸球は嗅球表面側にシート状に配置されており、げっ歯類では片嗅球あたり2000個ほど存在する。それぞれの糸球にはおよそ3000個の嗅細胞がシナプス結合を作るが、ひとつの糸球に軸索投射する嗅細胞は同一の匂い分子受容体を発現する。
同一嗅上皮ゾーンに属する嗅細胞の投射先の糸球は、嗅球を帯状(ゾーン状)に取り巻くように分布を取る。また特定の嗅上皮ゾーンに属する嗅細胞は、対応する嗅球ゾーンに配置する糸球に投射し、嗅球にも嗅上皮のゾーン構造に対応した4つのゾーン構造があることが示された[3] [4](図1右)。このように嗅上皮上の特定のゾーンの嗅細胞が、嗅球上の特定のゾーンに軸索投射する様式は「ゾーンからゾーンへの投射 (zone-to-zone projection)」と呼ばれる。
この主嗅覚系の「ゾーンからゾーンへの投射 」に対応するように様々な分子が発現している。例えば、NCAM familyに属する接着分子OCAMは、嗅上皮の腹側の3つのゾーンの嗅細胞に発現するが、最背側ゾーンの嗅細胞には発現しない。このゾーン状の発現パターンは投射先である嗅球糸球層でも保持され、腹側の3つのゾーンでは発現するが、最背側ゾーンでは発現が見られない[5]。このようなゾーン構造と対応した接着分子の発現の機能的意義はまだ解明されていない。しかし、特定の匂い分子受容体を発現する嗅細胞軸索が収束する糸球の位置は個体間で保存されており、正確な投射先へ軸索をガイダンスする上で重要な役割を果たしているの可能性がある。
主嗅覚系ゾーン構造の再検討
これまで述べてきたように、1990年代前半より、4分割されたゾーン構造が嗅上皮および嗅球に存在すると考えられてきた。しかし近年多くの匂い分子受容体の分布が詳細に検討された結果、嗅上皮、嗅球ともに、背側ゾーンと腹側ゾーンの2つのゾーンに分割されるという説が有力になってきている。およそ80種類の匂い分子受容体の発現分布をin situハイブリダイゼーション法を用いて体系的に調べたところ、いずれの受容体も嗅上皮上で前後軸に沿った帯状の発現分布を示した。しかし腹側に位置する受容体の多くは、その分布が古典的4分割ゾーンには対応せず、受容体に固有な帯状の分布を示した。ただし、古典的4分割ゾーンのうち最背側ゾーンに発現する受容体とそれ以外の腹側ゾーンの受容体の発現領域は互いに排他的であり、主嗅球は少なくとも2つのゾーン構造を有することが示された。腹側ゾーンの受容体の分布は部分的に重なりあっていることから、腹側ゾーン内部には明確なサブゾーンは存在しないと考えられている[6]。
主嗅覚系ゾーン構造の機能
主嗅覚系に見られるゾーン構造は生物学的にどのような意味を持つのであろうか?この問いに対する明確な答えはまだ得られていない。しかしながら、同じ匂い分子に応答する嗅細胞であっても、背側ゾーンに位置するものと腹側ゾーンに位置するもので異なる機能的を有するものがある。背側ゾーンに配置する嗅細胞を選択的に遺伝子工学的に欠損させたマウスでは、トリメチルチアゾリン(TMT:キツネ糞由来の匂い分子で、TMTを嗅がせるとマウスに先天的な忌避行動を惹起する)に対する先天的な忌避行動が消える。一方、この遺伝子操作を行ったマウスでもTMTを用いた匂い学習は成立し、TMTを認識することができた。つまり、TMTに応答する嗅細胞のうち、背側ゾーンにあるものは先天的な匂い忌避反応に、腹側ゾーンにあるものは後天的な匂い学習に寄与する[7]。これらの結果から、背側ゾーンの嗅細胞は先天的にコードされた、匂いに惹起される情動行動に、腹側ゾーンは経験・学習依存的にコードされる、匂いに惹起される行動反応に寄与する可能性が示唆されている。
副嗅覚系に見られるゾーン構造
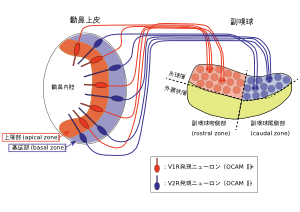
フェロモン受容体の発現パターンで規定される2つのゾーンが鋤鼻上皮冠状断面および副嗅球側矢状断面で模式的に表わされている。
鋤鼻上皮におけるゾーン構造
主嗅覚系とは別にフェロモンを受容するための感覚系として副嗅覚系(鋤鼻(じょび)嗅覚系)が存在する。フェロモン受容体を発現する鋤鼻神経は鋤鼻器の鋤鼻上皮に細胞体を持ち、その軸索を副嗅覚系一次中枢である副嗅球へ投射する。鋤鼻神経に発現するフェロモン受容体はその構造からV1RとV2Rの2群に分類される[8] [9] [10] [11]。げっ歯類では、V1RはGi2αタンパク質と共役しており、鋤鼻上皮上層ゾーン(apical zone)の鋤鼻神経に発現する。V2RはGoαタンパク質と共役しており、鋤鼻上皮基底ゾーン(basal zone)の鋤鼻神経に発現する。つまりV1Rを発現する鋤鼻神経細胞とV2Rを発現する鋤鼻神経細胞は排他的な2つのゾーンを鋤鼻上皮上で形成している[12] [13](図2左)。
副嗅球におけるゾーン構造
鋤鼻上皮上で異なるゾーンに位置するV1R鋤鼻神経、V2R鋤鼻神経は、副嗅球の異なるゾーンに投射する。V1R鋤鼻神経はGi2αを、V2R鋤鼻神経はGoαを共発現するが、鋤鼻神経の投射先である副嗅球糸球層でその発現を調べると、副嗅球吻側ゾーンはGi2α陽性、副嗅球尾側ゾーンではGoα陽性であった。これはV1R鋤鼻神経が、鋤鼻上皮上層ゾーンから副嗅球吻側ゾーンへ、V2R鋤鼻神経は鋤鼻上皮基底ゾーンから副嗅球尾側ゾーンへ、「ゾーンからゾーンへの投射 」をすることを表している(図2右)。実際、個々のV1RやV2Rにレポーター遺伝子を発現させ、それぞれの受容体を発現する鋤鼻神経の投射パターンを調べると、V1R発現細胞は副嗅球吻側ゾーンのいくつかの糸球に、V2R発現細胞では尾側ゾーンのいくつかの糸球に軸索投射している[14]。この副嗅覚系の「ゾーンからゾーンへの投射 」を反映して、V1Rと共発現するOCAMの発現も鋤鼻上皮上層ゾーンと副嗅球吻側ゾーンに限局している[15](図2)。
副嗅覚系におけるゾーン構造の機能
副嗅覚系に見られるゾーン構造の機能的意義は未だに研究段階であるが、ゾーン毎に異なる性状を持つフェロモンの検出に寄与する。尿中に含まれる様々な化学物質に対する鋤鼻神経細胞の応答を調べると、V1Rを発現する鋤鼻神経細胞は揮発性の物質に、V2Rを発現する鋤鼻神経細胞は不揮発性のタンパク質様物質に応答する[16]。また雄マウスの涙から抽出されたペプチドフェロモンESP1はV2Rの一つであるV2Rp5で受容され、副嗅球尾側ゾーンで情報処理される[17]。さらに最初期遺伝子発現によるフェロモン受容体のリガンドスクリーニングにより、V1Rに属する一群の受容体は様々なステロイドによく反応し、個体の生理状態のモニタリングに寄与する。一方、V2Rに属する一群の受容体は同種の性フェロモンや捕食者の発するフェロモンなど、行動に直結するフェロモンによく応答する[18]。
小脳に見られるゾーン構造
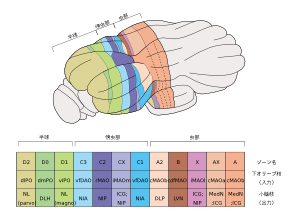
小脳プルキンエ細胞への入出力を基に区分された左小脳皮質の12のゾーンを、背側尾側方向から模式的に表した図。Apps and Hawkes (2009) fig.4 より改変。
小脳におけるゾーン構造
哺乳類の小脳において、小脳皮質出力ニューロンであるプルキンエ細胞はオリーブ核より興奮性入力(登上線維入力)を受け、小脳核へ軸索投射する。小脳皮質は肉眼的には横走する小脳溝によって区分される小脳回が顕著であるが、機能的にはむしろ縦走する区分が重要である。小脳皮質は正中線に沿って内側部が虫部、外側部が半球、虫部と半球に挟まれた領域は中間部と呼ばれ、縦走する3つの帯状の領域に区分される。小脳核は内側より室頂核(内側核)、中位核、歯状核(外側核)と区分されるが、小脳皮質虫部から室頂核へ、中間部は中位核へ、半球部は外側核へ選択的に軸索投射することから、小脳は縦走する3つのゾーンに機能分化すると考えられていた。
1960年代に入り、オリーブ核~小脳皮質~小脳核間の投射様式がより詳細に検討され、それぞれの亜領域間のトポグラフィカルな投射パターンからより細かなゾーン構造の存在が明らかになってきた。研究者によりゾーンの名称や区分に若干の差異があるものの、7つ(A,B,C1,C2,C3,D1,D2)の縦走するゾーン(longitudinal zones)による区分が長く支持されてきた。近年では更に細かな12ゾーン(A, AX, X, B, A2, C1, CX, C2, C3, D1, D0, D2)モデルが提唱されている[19](図3)。
これらのゾーン構造のうち、Bゾーンなどでは「マイクロゾーン」と呼ばれる100~300μm幅と、通常のゾーン構造の幅(~1mm)より更に細かなゾーン構造が見いだされている[20]。マイクロゾーンが全てのlongitudinal zoneに存在するかはまだ不明であるが、小脳皮質は基本的に均一な細胞構築構造を持っているため、マイクロゾーンが小脳における最少機能単位であると予想されている。
小脳におけるゾーン様分子発現
これら神経線維連絡や電気生理学的方法により同定されたゾーン構造とは別に、小脳では様々な分子の発現が前後軸に沿った帯状パターンを示す。もっともよく研究されているのはzebrin II (aldolase C)の発現パターンで、zebrin II発現プルキンエ細胞によるゾーンと発現しないプルキンエ細胞によるゾーンが吻尾軸に沿って交互に並ぶ[21]。zebrin IIの発現パターンと小脳入出力系の詳細な比較から、小脳吻側部ではlongitudinal zoneのC2, C3, D1, D0, D2ゾーンがそれぞれzebrin IIの発現で規定されるP4+(正中線から4番目のzebrin II陽性ゾーン), P4-(正中線から4番目のzebrin II陰性ゾーン), P5+, P5-, P6+ゾーンと一致し、ゾーン状の分子発現と解剖学的・生理学的ゾーン構造との対応が解明されてきている[22] [23]。プルキンエ細胞におけるzebrin IIの発現の有無は、その細胞の生まれた日と密接に関連していて、ゾーン特異的な神経線維連絡の形成と関連することが示唆されている[24]。zebrin IIの発現で区別される2つのゾーンの機能の違いはまだ明らかになっていない。しかしホスホリパーゼCβ (PLCβ)(代謝型グルタミン酸受容体等7回膜貫通型受容体のシグナル伝達に重要)のサブタイプPLCβ3はZebrin II発現プルキンエ細胞に、PLCβ4はzebrin II非発現プルキンエ細胞に特異的に発現することから、zebrin IIで区分される2つのゾーンは異なるシナプス伝達特性を持つ可能性が考えられる[25]。
関連項目
参考文献
- ↑
Ressler, K.J., Sullivan, S.L., & Buck, L.B. (1993).
A zonal organization of odorant receptor gene expression in the olfactory epithelium. Cell, 73(3), 597-609. [PubMed:7683976] [WorldCat] [DOI] - ↑
Vassar, R., Ngai, J., & Axel, R. (1993).
Spatial segregation of odorant receptor expression in the mammalian olfactory epithelium. Cell, 74(2), 309-18. [PubMed:8343958] [WorldCat] [DOI] - ↑
Ressler, K.J., Sullivan, S.L., & Buck, L.B. (1994).
Information coding in the olfactory system: evidence for a stereotyped and highly organized epitope map in the olfactory bulb. Cell, 79(7), 1245-55. [PubMed:7528109] [WorldCat] [DOI] - ↑
Vassar, R., Chao, S.K., Sitcheran, R., Nuñez, J.M., Vosshall, L.B., & Axel, R. (1994).
Topographic organization of sensory projections to the olfactory bulb. Cell, 79(6), 981-91. [PubMed:8001145] [WorldCat] [DOI] - ↑
Yoshihara, Y., Kawasaki, M., Tamada, A., Fujita, H., Hayashi, H., Kagamiyama, H., & Mori, K. (1997).
OCAM: A new member of the neural cell adhesion molecule family related to zone-to-zone projection of olfactory and vomeronasal axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(15), 5830-42. [PubMed:9221781] [WorldCat] - ↑
Miyamichi, K., Serizawa, S., Kimura, H.M., & Sakano, H. (2005).
Continuous and overlapping expression domains of odorant receptor genes in the olfactory epithelium determine the dorsal/ventral positioning of glomeruli in the olfactory bulb. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(14), 3586-92. [PubMed:15814789] [PMC] [WorldCat] [DOI] - ↑
Kobayakawa, K., Kobayakawa, R., Matsumoto, H., Oka, Y., Imai, T., Ikawa, M., ..., & Sakano, H. (2007).
Innate versus learned odour processing in the mouse olfactory bulb. Nature, 450(7169), 503-8. [PubMed:17989651] [WorldCat] [DOI] - ↑
Dulac, C., & Axel, R. (1995).
A novel family of genes encoding putative pheromone receptors in mammals. Cell, 83(2), 195-206. [PubMed:7585937] [WorldCat] [DOI] - ↑
Herrada, G., & Dulac, C. (1997).
A novel family of putative pheromone receptors in mammals with a topographically organized and sexually dimorphic distribution. Cell, 90(4), 763-73. [PubMed:9288755] [WorldCat] [DOI] - ↑
Ryba, N.J., & Tirindelli, R. (1997).
A new multigene family of putative pheromone receptors. Neuron, 19(2), 371-9. [PubMed:9292726] [WorldCat] [DOI] - ↑
Matsunami, H., & Buck, L.B. (1997).
A multigene family encoding a diverse array of putative pheromone receptors in mammals. Cell, 90(4), 775-84. [PubMed:9288756] [WorldCat] [DOI] - ↑
Berghard, A., & Buck, L.B. (1996).
Sensory transduction in vomeronasal neurons: evidence for G alpha o, G alpha i2, and adenylyl cyclase II as major components of a pheromone signaling cascade. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(3), 909-18. [PubMed:8558259] [WorldCat] - ↑
Jia, C., & Halpern, M. (1996).
Subclasses of vomeronasal receptor neurons: differential expression of G proteins (Gi alpha 2 and G(o alpha)) and segregated projections to the accessory olfactory bulb. Brain research, 719(1-2), 117-28. [PubMed:8782871] [WorldCat] [DOI] - ↑
Belluscio, L., Koentges, G., Axel, R., & Dulac, C. (1999).
A map of pheromone receptor activation in the mammalian brain. Cell, 97(2), 209-20. [PubMed:10219242] [WorldCat] [DOI] - ↑
Yoshihara, Y., & Mori, K. (1997).
Basic principles and molecular mechanisms of olfactory axon pathfinding. Cell and tissue research, 290(2), 457-63. [PubMed:9321710] [WorldCat] [DOI] - ↑
Krieger, J., Schmitt, A., Löbel, D., Gudermann, T., Schultz, G., Breer, H., & Boekhoff, I. (1999).
Selective activation of G protein subtypes in the vomeronasal organ upon stimulation with urine-derived compounds. The Journal of biological chemistry, 274(8), 4655-62. [PubMed:9988702] [WorldCat] [DOI] - ↑
Haga, S., Hattori, T., Sato, T., Sato, K., Matsuda, S., Kobayakawa, R., ..., & Touhara, K. (2010).
The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature, 466(7302), 118-22. [PubMed:20596023] [WorldCat] [DOI] - ↑
Isogai, Y., Si, S., Pont-Lezica, L., Tan, T., Kapoor, V., Murthy, V.N., & Dulac, C. (2011).
Molecular organization of vomeronasal chemoreception. Nature, 478(7368), 241-5. [PubMed:21937988] [PMC] [WorldCat] [DOI] - ↑
Apps, R., & Hawkes, R. (2009).
Cerebellar cortical organization: a one-map hypothesis. Nature reviews. Neuroscience, 10(9), 670-81. [PubMed:19693030] [WorldCat] [DOI] - ↑
Andersson, G., & Oscarsson, O. (1978).
Climbing fiber microzones in cerebellar vermis and their projection to different groups of cells in the lateral vestibular nucleus. Experimental brain research, 32(4), 565-79. [PubMed:689129] [WorldCat] [DOI] - ↑
Brochu, G., Maler, L., & Hawkes, R. (1990).
Zebrin II: a polypeptide antigen expressed selectively by Purkinje cells reveals compartments in rat and fish cerebellum. The Journal of comparative neurology, 291(4), 538-52. [PubMed:2329190] [WorldCat] [DOI] - ↑
Sugihara, I., & Shinoda, Y. (2004).
Molecular, topographic, and functional organization of the cerebellar cortex: a study with combined aldolase C and olivocerebellar labeling. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(40), 8771-85. [PubMed:15470143] [PMC] [WorldCat] [DOI] - ↑
Apps, R., & Hawkes, R. (2009).
Cerebellar cortical organization: a one-map hypothesis. Nature reviews. Neuroscience, 10(9), 670-81. [PubMed:19693030] [WorldCat] [DOI] - ↑
Namba, K., Sugihara, I., & Hashimoto, M. (2011).
Close correlation between the birth date of Purkinje cells and the longitudinal compartmentalization of the mouse adult cerebellum. The Journal of comparative neurology, 519(13), 2594-614. [PubMed:21456012] [WorldCat] [DOI] - ↑
Sarna, J.R., Marzban, H., Watanabe, M., & Hawkes, R. (2006).
Complementary stripes of phospholipase Cbeta3 and Cbeta4 expression by Purkinje cell subsets in the mouse cerebellum. The Journal of comparative neurology, 496(3), 303-13. [PubMed:16566000] [WorldCat] [DOI]