カルシウム依存性塩素チャネル
秋田 天平、熊田 竜郎、福田 敦夫
浜松医科大学 医学部
DOI:10.14931/bsd.3454 原稿受付日:2013年3月7日 原稿完成日:2013年4月5日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:calcium-activated chloride channel
細胞内Ca2+濃度の上昇に応じて活性化される塩素チャネルである。古くから神経系の細胞を含む、様々な細胞種で確認されていた最も典型的なカルシウム依存性塩素チャネル(CaCC)の主な責任分子が、近年Anoctamin/TMEM16ファミリーのAno1/TMEM16A及びAno2/TMEM16Bであることが確定した[1][2]。また、卵黄状黄斑ジストロフィ(ベスト病)の原因遺伝子として主に網膜色素上皮に発現し、神経系全般にも或る程度の発現が認められているBestrophinファミリー(Best1-4)もCaCC活性を持つことが知られている[3]。なお、かつてCaCCの候補として挙げられていたCLCA及びTTYHファミリーのCaCCとしての機能については、現在否定的な見解が占める。
構造
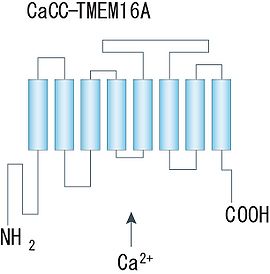
細胞質側にN末端とC末端を持ち、8回膜貫通領域から成る構造が示唆されている。([4]より転載)。
Anoctamin/TMEM16ファミリー
Ano1/TMEM16Aについては、近年二量体を形成していることが示され、アミノ酸疎水性度の解析から、各サブユニットは8回膜貫通領域を持ち、細胞質側に大きなN末端とC末端から成る構造物を持つことが示唆されている(図)。ポア領域やCa2+結合部位及び電位センサー部位は未だ同定されていないが、他のCa2+依存性、電位依存性イオンチャネルでよく知られる構造との類似性は認められていない。
Bestrophinファミリー
Bestrophinチャネルも少なくとも二量体以上の多量体を形成し、各サブユニットは少なくとも4つの膜貫通領域を持つことが示唆されている。各サブユニットのC末端側に、酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるCa2+結合部位がある。Ca2+結合後にN末端とC末端領域の相互作用が起こり活性化することが、ヒトBest1で示されている。
発現
Ano1/TMEM16Aは神経系では主に末梢神経系(後根神経節や交感神経節細胞)に強い発現が認められる。Ano2/TMEM16Bは特に網膜や嗅神経で多く、脳内では大脳皮質、中脳、脳幹部に或る程度の発現が報告されている。
BestrophinファミリーのBest1は広く神経、グリア双方で発現が報告されており、Best2は特に嗅神経での発現が認められている。Best3、Best4は神経系でのタンパク質レベルでの発現は未だ確認されていないが、mRNAは脳内の神経、グリア双方で或る程度の発現が確認されている。
機能
Ano1/TMEM16Aが発現する後根神経節細胞は細胞内Cl–濃度が高く(>30 mM)、古くからCaCC活性化による活動電位の後脱分極相の形成が知られている。即ち、この神経でのAno1/TMEM16Aの活性化は膜興奮性を高め、それが例えば発痛物質ブラジキニンの作用後の細胞内Ca2+濃度上昇に伴う痛覚神経の発火頻度上昇に関わることが知られている[5]。また、嗅神経の嗅毛では、におい物質のGタンパク質共役型受容体への結合により、cAMP依存性陽イオンチャネルとともにAno2/TMEM16Bが活性化され、ともに脱分極性の電流をもたらすことで嗅神経の発火を誘起することが知られている。但し、Ano2/TMEM16B KOマウスでそのCaCC成分が消失しても、嗅覚自体にはそれほど強い影響を与えないことも報告されている[6]。
一方、細胞内Cl–濃度が低い(<10 mM)多くの成熟神経細胞では、CaCC活性は膜興奮性を抑制する。例えば海馬の錐体細胞では、活動電位中のCa2+流入により活性化されたAno2/TMEM16Bによる活動電位の再分極の促進や、興奮性シナプス入力時のCa2+流入により活性化されたAno2/TMEM16Bによるシナプス後電位の抑制が認められている[7]。
Best1については、近年アストログリアの主なCaCCであると報告されると同時に、同チャネルを通じてグルタミン酸やGABAがアストログリアから周囲に放出されることにより、シナプス機能や神経興奮性の調節が行われるとの報告がなされた[8][9]。Best2はかつて嗅神経でのCaCC候補の1つであったが、Best2 KOマウスとWTマウスでCaCCに大きな相違が認められず、後に嗅神経でのCaCCは上記のようにAno2/TMEM16Bによることが確定している。
Best3、Best4の神経系での機能は未だ調べられていない。
BestrophinチャネルはHCO3–に対する透過性が高く、またL型電位依存性Ca2+チャネルとの相互作用を介してCa2+流入量も変化させうることから、細胞内Ca2+動態やpHの恒常性維持にも寄与している可能性が示唆されている[2][3]。
疾患との関連
Ano1/TMEM16A及びAno2/TMEM16Bの異常と神経系疾患との関連は未だ不明である。但し、Ano1/TMEM16AはCaCCの機能が判明する以前より、悪性腫瘍、特に消化管間質腫瘍(GIST)で豊富に発現していることが知られており、それはその腫瘍の起源とされる消化管運動のペースメーカー細胞(カハールの介在細胞、interstitial cell of Cajal; ICC)がAno1を豊富に発現していることを反映すると考えられている。
Best1については、卵黄状黄斑ジストロフィ(ベスト病)や硝子体網脈絡膜症の発症と関わる変異体が100種類以上知られており、それらの変異体の多くでCaCC機能の減退が認められている。しかし、その減退と発症機序との関連には不明点や疑問点が多い。また、それらの変異体と神経・グリア機能の異常との関連等も未だ明らかになっていない。
参考文献
- ↑
Huang, F., Wong, X., & Jan, L.Y. (2012).
International Union of Basic and Clinical Pharmacology. LXXXV: calcium-activated chloride channels. Pharmacological reviews, 64(1), 1-15. [PubMed:22090471] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Duran, C., Thompson, C.H., Xiao, Q., & Hartzell, H.C. (2010).
Chloride channels: often enigmatic, rarely predictable. Annual review of physiology, 72, 95-121. [PubMed:19827947] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Hartzell, H.C., Qu, Z., Yu, K., Xiao, Q., & Chien, L.T. (2008).
Molecular physiology of bestrophins: multifunctional membrane proteins linked to best disease and other retinopathies. Physiological reviews, 88(2), 639-72. [PubMed:18391176] [WorldCat] [DOI] - ↑
Verkman, A.S., & Galietta, L.J. (2009).
Chloride channels as drug targets. Nature reviews. Drug discovery, 8(2), 153-71. [PubMed:19153558] [PMC] [WorldCat] [DOI] - ↑
Liu, B., Linley, J.E., Du, X., Zhang, X., Ooi, L., Zhang, H., & Gamper, N. (2010).
The acute nociceptive signals induced by bradykinin in rat sensory neurons are mediated by inhibition of M-type K+ channels and activation of Ca2+-activated Cl- channels. The Journal of clinical investigation, 120(4), 1240-52. [PubMed:20335661] [PMC] [WorldCat] [DOI] - ↑
Billig, G.M., Pál, B., Fidzinski, P., & Jentsch, T.J. (2011).
Ca2+-activated Cl− currents are dispensable for olfaction. Nature neuroscience, 14(6), 763-9. [PubMed:21516098] [WorldCat] [DOI] - ↑
Huang, W.C., Xiao, S., Huang, F., Harfe, B.D., Jan, Y.N., & Jan, L.Y. (2012).
Calcium-activated chloride channels (CaCCs) regulate action potential and synaptic response in hippocampal neurons. Neuron, 74(1), 179-92. [PubMed:22500639] [PMC] [WorldCat] [DOI] - ↑
Lee, S., Yoon, B.E., Berglund, K., Oh, S.J., Park, H., Shin, H.S., ..., & Lee, C.J. (2010).
Channel-mediated tonic GABA release from glia. Science (New York, N.Y.), 330(6005), 790-6. [PubMed:20929730] [WorldCat] [DOI] - ↑
Woo, D.H., Han, K.S., Shim, J.W., Yoon, B.E., Kim, E., Bae, J.Y., ..., & Lee, C.J. (2012).
TREK-1 and Best1 channels mediate fast and slow glutamate release in astrocytes upon GPCR activation. Cell, 151(1), 25-40. [PubMed:23021213] [WorldCat] [DOI]