「ゲート」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0132108 中條 浩一]、[http://researchmap.jp/yoshihirokubo 久保 義弘]</font><br> | <font size="+1">[http://researchmap.jp/read0132108 中條 浩一]、[http://researchmap.jp/yoshihirokubo 久保 義弘]</font><br> | ||
''自然科学研究機構 生理学研究所''<br> | ''自然科学研究機構 生理学研究所''<br> | ||
DOI XXXX/XXXX 原稿受付日:2012年6月5日 原稿完成日:2013年8月12日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
2013年8月12日 (月) 10:15時点における版
中條 浩一、久保 義弘
自然科学研究機構 生理学研究所
DOI XXXX/XXXX 原稿受付日:2012年6月5日 原稿完成日:2013年8月12日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:gate 独: Tor 仏: porte
同義語:ゲーティング
ゲートとは、イオンチャネル開閉を制御する機構である。閉状態にあるイオンチャネルは、脱分極やリガンド結合などの刺激を受けて構造変化を起こす。最終的にゲートが開くことでイオンを透過させることができる開状態になる。ゲートは通常S6セグメントなどイオン透過路であるポアドメインに備わっている機構である。しかし、ゲーティングという言葉にはもう少し幅広い意味があり、例えば電位依存性チャネルであれば、膜電位センサーの動きも含めた閉状態から開状態への一連の構造変化を指すことが多い。イオンチャネルのゲーティングは60年以上前のHodgkin-Huxley方程式の時代から精力的に研究されてきた、生物物理学の最重要課題の一つである。近年の結晶構造解析やそれに基づくシミュレーションなどにより、構造的な側面からの理解が深まりつつある。
ゲートとは
イオンチャネルの多くには「ゲート」と呼ばれる開閉機構が備わっている。脱分極、リガンド結合、細胞内カルシウム濃度の上昇などの刺激に応答する形でゲートが開き、イオンが透過する。脱分極(あるいは過分極)に応答して開くイオンチャネルを電位依存性チャネル(voltage-gated channel)、リガンドが結合して開くチャネルをリガンド依存性チャネル(ligand-gated channel)と呼ぶなど、ゲート機構によってイオンチャネルを分類することができる。以下電位依存性チャネルのゲートを中心に解説する。
電位依存性チャネルのゲート
研究の歴史
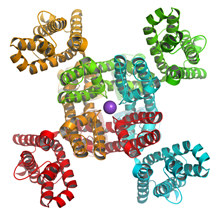
中央にポアドメイン、外側に4つの膜電位センサードメインを持つ。中央紫の球はカリウムイオン。
1950年代にHodgkinとHuxleyによってイカの巨大軸索の活動電位の発生に関わる膜電位依存性のナトリウムイオンとカリウムイオンの透過性の変化が記載されて以来、電位依存性チャネルのゲーティング機構の解明はイオンチャネル研究のもっとも中心的な課題の一つであり続けている。HodgkinとHuxleyは、カリウムイオンのコンダクタンスに関して、膜電位依存的に動く仮想的な4つのゲート”n”を仮定し、これら4つのnが膜電位依存的に独立に開状態と閉状態を行き来し、4つすべてが開状態になることで初めてカリウムイオンが流れるとした。すなわちカリウムイオン電流がn4に比例するというモデル(Hodgkin-Huxley方程式)を考案した[1]。ナトリウムイオン電流には3つの活性化ゲート”m”と一つの不活性化ゲート”h”を仮定し、m3hで表すことができるとした。このHodgkin-Huxley方程式により、イカの巨大軸索の活動電位と、それに伴うカリウムイオンとナトリウムイオンのコンダクタンス変化を正確に再現することができた。膜電位の変化を感知するための機構として、細胞膜を横切って動く電荷”ゲーティングチャージ”の存在が予想された。
70年代に入り、イオン電流に先んじて流れるゲート電流が実際に記録された。80年代に入り、イオンチャネル分子が実際にクローニングされ、その後電位依存性カリウムチャネルが実際に四量体であることが明らかとなり、Hodgkin-Huxley方程式で記載されたカリウムイオン電流のモデルが、四量体構造に由来するものであることが明確に示された。また四番目の膜貫通セグメント(S4)には3アミノ酸おきに正電荷を持つアミノ酸(アルギニンまたはリジン)が配置されていることがわかった。このS4セグメントこそが膜電位センサーであり、アルギニン(リジン)残基が電場内を動く際に生じるのがゲーティング電流であることが明らかになった。
さらに2000年代に入り、電位依存性カリウムチャネルの結晶構造が明らかになると、膜電位センサードメイン構造がポアドメイン構造とは独立なユニットとして働いているイメージがより鮮明になった(図1)。
ゲートが開く前の膜電位センサーの動き
電位依存性チャネルの膜電位センサードメインは1番目から4番目までの4本の膜貫通セグメント(S1~S4)から構成されているが、その中心的な役割は正電荷を複数持つS4セグメントであると考えられている。細胞膜が脱分極することで、膜電位の変化を感じたS4セグメントが細胞外側に向かって動くと考えられている。その際のS4セグメント中のアルギニン(リジン)残基の動きが、ゲート電流として計測できる。4つのサブユニットのそれぞれの膜電位センサードメインは独立に動くと考えられている。すべての膜電位センサーが細胞外側に動いた後、最後の開状態へのステップとして漸くイオンチャネルのゲートが開くと考えられている。
イオンチャネルゲートの開口
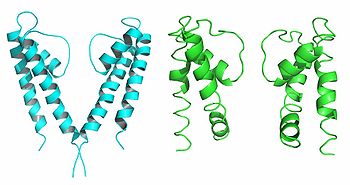
2つのサブユニットのみ表示している。
膜電位センサー自体はあくまでゲートの開閉を制御しているものであり、実際に開閉するゲートはポアドメインのS6セグメントに存在していると考えられている。原核生物の2回膜貫通型カリウムチャネルKcsAの結晶構造は閉状態だと考えられている。S6セグメントに相当するM2へリックスは細胞内側で束ねられており、"ゲート"は閉じている[2] (図2左)。
一方原核生物由来のカルシウム活性化カリウムチャネルMthKの構造は開状態であると考えられている。MthKではM2へリックスが大きく開いており、ゲートを担うへリックス(S6またはM2)がダイナミックに動くことで開閉することを示唆している[3](図2右)。
さらにKcsAチャネル蛋白一分子に付加した金結晶のX線回折像の解析により、M2へリックスがダイナミックに動く様子がリアルタイムで捉えられている[4]。哺乳類の電位依存性カリウムチャネルとしてはKv1.2チャネルの構造が明らかになっているが、これは開状態であると考えられる[5][6]。閉状態の結晶構造は未だ得られていないが、膜電位センサーの動きがS4-S5リンカーを介してS6セグメントに伝わり、ゲートであるS6セグメントがやはりダイナミックに開閉すると考えられている[6][7]。
その他の電位依存性チャネルのゲート
いくつかの電位依存性チャネルでは開状態にはいった後、閉状態とは異なる”不活性化”と呼ばれる状態に入り、イオンを通さなくなる。Hodgkin-Huxley方程式における”h”ゲートのように、不活性化にはS6ゲートとは異なる別のゲートが想定されている。Shakerチャネルと呼ばれる電位依存性カリウムチャネルには、細胞内N末端領域に"ボール"構造を持ち、これがポアを細胞内側から塞ぐことで不活性化を起こす[8]。また少なくとも一部のカリウムチャネルではイオン選択性フィルターがゲートとして働くと考えられている。
リガンド依存性チャネルのゲート
リガンド依存性チャネルには、5量体のニコチン性アセチルコリン受容体などのCys-loop受容体ファミリー、4量体のイオンチャネル型グルタミン酸受容体ファミリー、3量体のATP(P2X)受容体ファミリーなどが存在する。細胞外領域にあるリガンド結合部位と、膜貫通領域のイオン透過路であるポアドメインを持つ。リガンドが受容体に結合すると、細胞外領域に構造変化が生じ、その変化がポアドメインに伝わって、ゲートが開閉すると考えられる。
関連項目
参考文献
- ↑
HODGKIN, A.L., & HUXLEY, A.F. (1952).
A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of physiology, 117(4), 500-44. [PubMed:12991237] [PMC] [WorldCat] [DOI] - ↑
Doyle, D.A., Morais Cabral, J., Pfuetzner, R.A., Kuo, A., Gulbis, J.M., Cohen, S.L., ..., & MacKinnon, R. (1998).
The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science (New York, N.Y.), 280(5360), 69-77. [PubMed:9525859] [WorldCat] [DOI] - ↑
Jiang, Y., Lee, A., Chen, J., Cadene, M., Chait, B.T., & MacKinnon, R. (2002).
The open pore conformation of potassium channels. Nature, 417(6888), 523-6. [PubMed:12037560] [WorldCat] [DOI] - ↑
Shimizu, H., Iwamoto, M., Konno, T., Nihei, A., Sasaki, Y.C., & Oiki, S. (2008).
Global twisting motion of single molecular KcsA potassium channel upon gating. Cell, 132(1), 67-78. [PubMed:18191221] [WorldCat] [DOI] - ↑
Long, S.B., Campbell, E.B., & Mackinnon, R. (2005).
Voltage sensor of Kv1.2: structural basis of electromechanical coupling. Science (New York, N.Y.), 309(5736), 903-8. [PubMed:16002579] [WorldCat] [DOI] - ↑ 6.0 6.1
Long, S.B., Campbell, E.B., & Mackinnon, R. (2005).
Crystal structure of a mammalian voltage-dependent Shaker family K+ channel. Science (New York, N.Y.), 309(5736), 897-903. [PubMed:16002581] [WorldCat] [DOI] - ↑
Pathak, M.M., Yarov-Yarovoy, V., Agarwal, G., Roux, B., Barth, P., Kohout, S., ..., & Isacoff, E.Y. (2007).
Closing in on the resting state of the Shaker K(+) channel. Neuron, 56(1), 124-40. [PubMed:17920020] [WorldCat] [DOI] - ↑
Hoshi, T., Zagotta, W.N., & Aldrich, R.W. (1990).
Biophysical and molecular mechanisms of Shaker potassium channel inactivation. Science (New York, N.Y.), 250(4980), 533-8. [PubMed:2122519] [WorldCat] [DOI]