「血液脳関門」の版間の差分
細 →実験手法 |
Masanoritachikawa (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の32版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">立川 正憲、[http://researchmap.jp/read0152088 内田 康雄]、[http://researchmap.jp/read0184908 寺崎 哲也]</font><br> | <font size="+1">立川 正憲、[http://researchmap.jp/read0152088 内田 康雄]、[http://researchmap.jp/read0184908 寺崎 哲也]</font><br> | ||
''東北大学 大学院薬学研究科 生命薬科学専攻 生命解析学講座 薬物送達学分野''<br> | ''東北大学 大学院薬学研究科 生命薬科学専攻 生命解析学講座 薬物送達学分野''<br> | ||
DOI XXXX/XXXX 原稿受付日:2013年3月11日 原稿完成日:2015年2月日<br> | |||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | 担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | ||
</div> | </div> | ||
英語名:Blood-brain barrier 独:Blut-Hirn-Schranke 仏:barrière hémato-encéphalique 英略称:BBB | |||
同義語:脳毛細血管、脳血管関門 | 同義語:脳毛細血管、脳血管関門 | ||
{{box|text= | {{box|text= | ||
血液脳関門(Blood-brain barrier, BBB)の解剖学的実体は[[wikipedia:ja:脳毛細血管|脳毛細血管]]であり、[[脳室周囲器官]]を除いては、[[wikipedia:ja:内皮細胞|内皮細胞]]同士が[[密着結合]]で連結している。当初BBBは、この構造的特徴によって、細胞間隙を介した非特異的な中枢への侵入や、脳内産生物質の流出を阻止している物理的障壁と考えられてきた。しかし現在では、BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるという新たな概念が確立している。BBBには、多様な[[トランスポーター]]や[[受容体]]が内皮細胞の脳血液側と脳側の[[細胞膜]]に極性をもって発現し、協奏的に働くことによって、循環血液と脳実質間でのベクトル輸送を厳密に制御している。中枢作用薬の開発には、良好な脳移行性を持った候補化合物の選択が必要であり、ヒトBBBの解明が不可欠である。近年、「機能タンパク質の絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)」によって、[[wikipedia:ja:ヒト|ヒト]]、[[wikipedia:ja:サル|サル]]、[[wikipedia:ja:マウス|マウス]]のBBBにおけるトランスポーター・受容体の質的及び量的な種差が解明された。BBB研究は、[[wikipedia:ja:げっ歯類|げっ歯類]]を中心とした発現の有無、BBBを透過するか否かといった定性的解析から、発現量、透過速度、輸送速度およびヒト-動物間の種差や正常-病態間の差などに基づく定量的解析へと大きく舵を切りつつある。 | 血液脳関門(Blood-brain barrier, BBB)の解剖学的実体は[[wikipedia:ja:脳毛細血管|脳毛細血管]]であり、[[脳室周囲器官]]を除いては、[[wikipedia:ja:内皮細胞|内皮細胞]]同士が[[密着結合]]で連結している。当初BBBは、この構造的特徴によって、細胞間隙を介した非特異的な中枢への侵入や、脳内産生物質の流出を阻止している物理的障壁と考えられてきた。しかし現在では、BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるという新たな概念が確立している。BBBには、多様な[[トランスポーター]]や[[受容体]]が内皮細胞の脳血液側と脳側の[[細胞膜]]に極性をもって発現し、協奏的に働くことによって、循環血液と脳実質間でのベクトル輸送を厳密に制御している。中枢作用薬の開発には、良好な脳移行性を持った候補化合物の選択が必要であり、ヒトBBBの解明が不可欠である。近年、「機能タンパク質の絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)」によって、[[wikipedia:ja:ヒト|ヒト]]、[[wikipedia:ja:サル|サル]]、[[wikipedia:ja:マウス|マウス]]のBBBにおけるトランスポーター・受容体の質的及び量的な種差が解明された。BBB研究は、[[wikipedia:ja:げっ歯類|げっ歯類]]を中心とした発現の有無、BBBを透過するか否かといった定性的解析から、発現量、透過速度、輸送速度およびヒト-動物間の種差や正常-病態間の差などに基づく定量的解析へと大きく舵を切りつつある。 | ||
}} | }} | ||
== 歴史 == | == 歴史 == | ||
その後、弟子の[[wikipedia:de:Edwin Goldman|Edwin Goldman]]が、[[wikipedia:Trypan_blue|トリパンブルー]] | 細菌学者[[wikipedia:Paul Ehrlich|Paul Ehrlich]]は当時流行り始めた生体染色色素に興味を持ち、生きた[[wikipedia:ja:ウサギ|ウサギ]]の血管内に色素を注射したところ、多くの臓器の組織染色に成功したが、中枢神経だけが染色できないことに気付いた。1885年に、この結果を「脳組織は染色色素を吸着する化学成分が欠乏している」と解釈した論文を発表した<ref>'''Ehrlich P.'''<br>Das Sauerstoff-Bedurfnis des Organismus: eine farbenanalytisch Studie<br>''Berlin: Hirschward'':1885</ref>。 | ||
その後、弟子の[[wikipedia:de:Edwin Goldman|Edwin Goldman]]が、[[wikipedia:Trypan_blue|トリパンブルー]](酸性色素)を脳室内に投与したところ、中枢神経は染まるが他の末梢臓器は染まらないことを見出した。Goldmanは、この結果を「中枢組織は染色し難い性質を持つという解釈は誤りで、脳は血管との間に色素を隔離する特性を有している」と解釈し、1913年に” Blut-Gehirn-Schranke”仮説を提唱した<ref>'''Goldman E.E.'''<br>Vitalfarbung am Zentralnervensystem<br>''Berlin: Eimer'':1993</ref>。この史実に基づき、「血液脳関門(Blood-Brain Barrier, BBB)の概念の提唱者はPaul Ehrlichである」と多くの教科書に書かれている。 | |||
一方、[[wikipedia:Humphrey Ridley|Humphrey Ridley]]は、Ehrlichの実験から190年も遡った1695年に著書"The Anatomy of the Brain"<ref>'''Ridley H.'''<br>The Anatomy of the Brain<br>''London: Printers to the Royal Society'':1695</ref>を発表し、その中で「[[wikipedia:ja:水銀|水銀]]を血液内に投与すると、神経組織へ移行せずに血管内に留まっている。その原因は脳血管の密着性が、他の血管と大きく異なるからである。」と述べている。この歴史的発見を無視する訳にはいかない。「血液脳関門の最初の発見は、1695年、英国人の生理学者Humphrey Ridleyである」<ref><pubmed> 21349150 </pubmed></ref>という説に教科書を訂正する必要がある。 | 一方、[[wikipedia:Humphrey Ridley|Humphrey Ridley]]は、Ehrlichの実験から190年も遡った1695年に著書"The Anatomy of the Brain"<ref>'''Ridley H.'''<br>The Anatomy of the Brain<br>''London: Printers to the Royal Society'':1695</ref>を発表し、その中で「[[wikipedia:ja:水銀|水銀]]を血液内に投与すると、神経組織へ移行せずに血管内に留まっている。その原因は脳血管の密着性が、他の血管と大きく異なるからである。」と述べている。この歴史的発見を無視する訳にはいかない。「血液脳関門の最初の発見は、1695年、英国人の生理学者Humphrey Ridleyである」<ref><pubmed> 21349150 </pubmed></ref>という説に教科書を訂正する必要がある。 | ||
[[Image:Tachikawa fig 1.jpg|thumb|400px|'''図1.血液脳関門(Blood-brain barrier, BBB)の解剖学的実体''']] | |||
このように320年前に英国で始まった血液脳関門の研究は、当初、「血液と脳を隔てる単なる物理的障壁」と考えられてきた。 しかし近年では、分子生物学や、''in vitro''モデル細胞株の樹立など細胞生物的な手法の導入によって、BBBの機能は分子レベルでの解明が飛躍的に進んでいる。 | |||
現在では、BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるという新たな概念へと塗り替えられている<ref name="ref1"><pubmed> 17619998 </pubmed></ref>。このBBBの機能は、薬という異物の脳移行を制限することから、中枢作用薬の開発成功率を大幅に下げる一因と位置づけられている。特に、[[wikipedia:ja:がん細胞|がん細胞]]において[[wikipedia:ja:Multiple drug resistance#Neoplastic_resistance|抗がん剤耐性因子]]として同定された[[P-糖タンパク]]([[P-glycoprotein]]/[[P-gp]]/[[ABCB1]]/[[MDR1]]/[[mdr1a]])が、「脳血管内皮細胞でエネルギーを消費して薬物を排出するポンプとして働いていること」を見出し、それまでの「400Daの分子篩説」<ref><pubmed> 7392035 </pubmed></ref>あるいは600Daの分子篩説」<ref><pubmed> 7765071 </pubmed></ref>に対して「能動的排出輸送担体説」<ref><pubmed> 1357522 </pubmed></ref>を提唱したことは、血液脳関門研究の歴史において重要な意義がある。その後、P-糖タンパク[[遺伝子欠損マウス]]を用いた研究によって<ref><pubmed> 7910522 </pubmed></ref>その排出輸送機能の生理的な重要性や薬物動態における重要性が明らかになった。 | |||
現在では、BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるという新たな概念へと塗り替えられている<ref name="ref1"><pubmed> 17619998 </pubmed></ref>。このBBBの機能は、薬という異物の脳移行を制限することから、中枢作用薬の開発成功率を大幅に下げる一因と位置づけられている。特に、[[wikipedia:ja:がん細胞|がん細胞]]において[[wikipedia:ja:Multiple drug resistance#Neoplastic_resistance|抗がん剤耐性因子]]として同定された[[P-糖タンパク]]([[P-glycoprotein]]/[[P-gp]]/[[ABCB1]]/[[MDR1]]/[[mdr1a]])が、「脳血管内皮細胞でエネルギーを消費して薬物を排出するポンプとして働いていること」を見出し、それまでの「400Daの分子篩説」<ref><pubmed> 7392035 </pubmed></ref> | |||
その後、P-糖タンパク以外に[[乳癌耐性タンパク質]]([[Breast Cancer Resistance Protein]], [[BCRP]]/[[ABCG2]]/[[MXR]]/[[ABCP]])<ref><pubmed> 15805252 </pubmed></ref> <ref><pubmed> 12438926 </pubmed></ref> <ref><pubmed> 15255930 </pubmed></ref> <ref name="ref112"><pubmed>16181433</pubmed></ref>や[[Multidrug Resistance-associated Protein 4]] ([[MRP4]]/[[ABCC4]])<ref><pubmed> 15218051 </pubmed></ref> <ref><pubmed> 19029202 </pubmed></ref> <ref><pubmed> 20194529 </pubmed></ref>が、薬物や内因性物質などの排出ポンプとして重要な働きを担っていることが明らかになった。その他にもBBBに発現して物質輸送を担う多様なトランスポーターや受容体の分子レベルでの同定が進み、脳機能を支援・防御する動的インターフェースの一躍を担っていることが明らかにされ<ref name="ref1" />、BBBの受容体を標的とした薬物送達システムの開発も進んだ<ref><pubmed> 22929442 </pubmed></ref>。 | その後、P-糖タンパク以外に[[乳癌耐性タンパク質]]([[Breast Cancer Resistance Protein]], [[BCRP]]/[[ABCG2]]/[[MXR]]/[[ABCP]])<ref><pubmed> 15805252 </pubmed></ref> <ref><pubmed> 12438926 </pubmed></ref> <ref><pubmed> 15255930 </pubmed></ref> <ref name="ref112"><pubmed>16181433</pubmed></ref>や[[Multidrug Resistance-associated Protein 4]] ([[MRP4]]/[[ABCC4]])<ref><pubmed> 15218051 </pubmed></ref> <ref><pubmed> 19029202 </pubmed></ref> <ref><pubmed> 20194529 </pubmed></ref>が、薬物や内因性物質などの排出ポンプとして重要な働きを担っていることが明らかになった。その他にもBBBに発現して物質輸送を担う多様なトランスポーターや受容体の分子レベルでの同定が進み、脳機能を支援・防御する動的インターフェースの一躍を担っていることが明らかにされ<ref name="ref1" />、BBBの受容体を標的とした薬物送達システムの開発も進んだ<ref><pubmed> 22929442 </pubmed></ref>。 | ||
そして今、寺崎らが2008年に開発した機能性タンパク質の標的絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)<ref name="ref2"><pubmed> 18219561 </pubmed></ref> <ref name="ref7"><pubmed> 21560129 </pubmed></ref>によって、BBBに発現するトランスポーターの定量アトラスが、マウス<ref name="ref2" /> <ref name="ref4"><pubmed> 22401960 </pubmed></ref>、サル<ref name="ref5"><pubmed> 21254069 </pubmed></ref>、ヒト<ref name="ref6"><pubmed> 21291474 </pubmed></ref> | そして今、寺崎らが2008年に開発した機能性タンパク質の標的絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)<ref name="ref2"><pubmed> 18219561 </pubmed></ref> <ref name="ref7"><pubmed> 21560129 </pubmed></ref>によって、BBBに発現するトランスポーターの定量アトラスが、マウス<ref name="ref2" /> <ref name="ref4"><pubmed> 22401960 </pubmed></ref>、サル<ref name="ref5"><pubmed> 21254069 </pubmed></ref>、ヒト<ref name="ref6"><pubmed> 21291474 </pubmed></ref>で完成し、これらの定量情報を基にBBBのヒトと動物との種差が解明された。さらに、BBBにおけるトランスポーターの発現量と''in vitro''で計測可能な単分子活性を基にしたBBB物質輸送の再構築法<ref name="ref8"><pubmed> 21828264 </pubmed></ref>の開発が進んでおり、ヒトBBBにおける薬物を含めた物質輸送の予測系の基盤技術が構築されつつある。 | ||
== 構造と役割 == | == 構造と役割 == | ||
[[Image:Tachikawa fig 2.jpg|thumb|600px|'''図2.血液脳関門(Blood-brain barrier, BBB)における物質輸送システム'''<br>SLCトランスポーター, Solute carrierファミリートランスポーター ; ABCトランスポーター, ATP-binding cassetteトランスポーター]] | |||
脳は、高度な神経活動のためシナプス周辺の環境が、BBBによって厳密に制御されている。BBBの解剖学的実体は脳毛細血管であり、内皮細胞同士が密着結合(tight junction)で連結している (図1)。密着結合構成タンパク質には、[[クローディン]]、[[オクルディン]]などが知られている。一部の内皮細胞には、[[周皮細胞]](pericyte)が接着し、その大部分を[[星状膠細胞]]の足突起が覆っている (図1)。このようなBBBの構造的特徴によって、血液構成成分や投与薬物の内皮細胞間隙を介した非特異的な中枢神経への侵入や、脳内産生物質の流出を阻止している。 | |||
ただし例外として、脳室周囲器官と呼ばれる、[[終板血管器官]]、[[脳弓下器官]]、[[交連下器官]]、[[視床下部]][[正中隆起]]、[[松果体]]、[[下垂体後葉]]、[[最終野]]などの領域では、毛細血管内皮細胞が密着結合で連結していないため、末梢血管と同様に血液とこれらの組織間の物質の移動は比較的自由である。これは、Goldmanがトリパンブルーを血管内に投与した実験において、一部の脳内部位が染色された要因であった可能性が高い。 | ただし例外として、脳室周囲器官と呼ばれる、[[終板血管器官]]、[[脳弓下器官]]、[[交連下器官]]、[[視床下部]][[正中隆起]]、[[松果体]]、[[下垂体後葉]]、[[最終野]]などの領域では、毛細血管内皮細胞が密着結合で連結していないため、末梢血管と同様に血液とこれらの組織間の物質の移動は比較的自由である。これは、Goldmanがトリパンブルーを血管内に投与した実験において、一部の脳内部位が染色された要因であった可能性が高い。 | ||
| 44行目: | 42行目: | ||
血液と脳実質細胞間液の物質交換は、様々な輸送システムによって制御されている (図2)。この輸送系の分子的実体は、多様なトランスポーターや受容体、及びその複合体であり、脳毛細血管内皮細胞の脳血液側と脳側の細胞膜に極性をもって発現する。トランスポーターは、脳血液側と脳側の細胞膜のどちらか一方又は、両方の細胞膜に局在し、細胞外から細胞内、又は細胞内から細胞外へ、特定の基質を輸送する能力を有している。 | 血液と脳実質細胞間液の物質交換は、様々な輸送システムによって制御されている (図2)。この輸送系の分子的実体は、多様なトランスポーターや受容体、及びその複合体であり、脳毛細血管内皮細胞の脳血液側と脳側の細胞膜に極性をもって発現する。トランスポーターは、脳血液側と脳側の細胞膜のどちらか一方又は、両方の細胞膜に局在し、細胞外から細胞内、又は細胞内から細胞外へ、特定の基質を輸送する能力を有している。 | ||
トランスポーターは、大きく2つのファミリーに分類される。1つは、[[ATP-binding cassette transporter|ATP-binding cassette (ABC) transporter]] | トランスポーターは、大きく2つのファミリーに分類される。1つは、[[ATP-binding cassette transporter|ATP-binding cassette (ABC) transporter]]ファミリーで、ATPの加水分解エネルギーを直接利用して、主に細胞内から細胞外への輸送を担う。 もう1つは、[[solute carrier ファミリー|solute carrier (SLC)ファミリー]]で、エネルギーを消費しないで濃度勾配に従って下り坂輸送を行う[[促進拡散]]や、無機イオンや有機イオンの濃度勾配を利用して、濃度勾配に逆らった基質輸送を行う[[2次性能動輸送]]に関与する。受容体は[[トランスサイトーシス]]によって、リガンドを輸送する機能を有している。これらのトランスポーターや受容体が協同的に働くことによって、循環血液から脳への供給方向及び、脳から循環血液への排出方向の物質のベクトル輸送を厳密に制御している。 | ||
== 内因性物質の輸送システム == | == 内因性物質の輸送システム == | ||
図3- | 図3(a)-(c)に、主にげっ歯類で明らかにされているBBBにおける内因性物質の輸送システムをまとめた<ref name="ref1" /> <ref name="ref3"><pubmed> 23399670 </pubmed></ref>。 | ||
===供給輸送系=== | ===供給輸送系=== | ||
BBB供給輸送系の最も重要な役割の一つは、[[Image:tachikawa_fig3a.jpg|thumb|1000px|'''図3a.血液脳関門(Blood-brain barrier, BBB)における内因性物質輸送システム(循環血液から脳への供給輸送)'''<br>]]エネルギー源となる[[wikipedia:ja:グルコース|グルコース]]や[[wikipedia:ja:乳酸|乳酸]]及びタンパク質や神経伝達物質の原料となる[[wikipedia:ja:アミノ酸|アミノ酸]]の循環血液から脳への供給である。[[グルコーストランスポーター 1]] ([[GLUT1]]/[[SLC2A1]])は、促進拡散型のトランスポーターで、脳毛細血管内皮細胞の両側の細胞膜に局在し、循環血液中から脳方向へのグルコースの供給輸送を担う。この他、[[モノカルボン酸トランスポーター]] ([[MCT1]]/[[SLC16A1]]) は、乳酸などの[[wikipedia:ja:ケトン体|ケトン体]]エネルギー源の供給に関与し、[[L型アミノ酸トランスポーター]]([[LAT1]]/[[SLC7A5]])は、[[4F2抗原重鎖]] ([[4F2hc]], [[CD98]]/[[SLC3A2]])とヘテロダイマーを形成して、主に[[wikipedia:ja:チロシン|チロシン]]や[[wikipedia:ja:フェニルアラニン|フェニルアラニン]]などの大型の中性アミノ酸を脳内に供給する役割を果たす。この他に、エネルギー貯蔵物質[[wikipedia:ja:クレアチン|クレアチン]]、浸透圧調節物質[[wikipedia:ja:タウリン|タウリン]]の輸送系などが知られている。インスリン受容体やトランスフェリン受容体は、受容体介在型トランスサイトーシス経路として、ぞれぞれインスリンやトランスフェリンを、循環血液から脳へ供給する役割を担う。近年では、これらの受容体介在型トランスサイトーシス経路を利用して、抗ヒト受容体モノクローナル抗体とタンパク質医薬品とのキメラタンパク質を脳へ効率的にデリバリーする研究が行われている<ref><pubmed> 22929442 </pubmed></ref>。 | |||
===排出輸送系=== | |||
BBB排出輸送系の主要な役割は、[[Image:tachikawa_fig3b.jpg|thumb|1000px|'''図3b.血液脳関門(Blood-brain barrier, BBB)における内因性物質輸送システム(脳から循環血液への排出輸送)'''<br>]]脳内で産生される神経伝達物質、メディエーターや代謝物の循環血液中へのくみ出しであり、SLCファミリーである神経伝達物質トランスポーター、[[アミノ酸トランスポーター]]、[[有機アニオントランスポーター]]や、[[ABCトランスポーター]]ファミリーである[[MRP4]]などがそれぞれ関与している。これらの輸送系は、脳細胞間隙中の神経伝達物質の第二のクリアランス機構や、脳内不要物質の脳内蓄積を防止する機構として、機能している。このほかにBBBには、脳内の免疫グロブリンIgGや心房性ナトリウム利尿ペプチドを血液方向へトランスサイトーシスによって排出輸送する輸送機構として、それぞれneonatal Fc receptor (FcRn)<ref><pubmed> 11240028 </pubmed></ref>及びnatriuretic peptide receptor (Npr-C))<ref><pubmed> 20628403 </pubmed></ref>が役割を果たしていることが知られている。さらに、BBBには、[[アルツハイマー病]]で脳内に蓄積する[[β-アミロイド]](1-40)の排出輸送系が存在する<ref><pubmed> 17908238 </pubmed></ref> <ref><pubmed> 16926058 </pubmed></ref> <ref><pubmed> 20367755 </pubmed></ref>。この分子的実体には、P-糖タンパク<ref><pubmed> 16239972 </pubmed></ref>、BCRP<ref><pubmed> 19403814 </pubmed></ref>、[[lipoprotein receptor related protein-1]]([[LRP-1]]) <ref><pubmed> 11120756 </pubmed></ref>など諸説あるが、現時点で結論が出ていない。 | |||
[[Image:tachikawa_fig3b.jpg|thumb| | [[Image:tachikawa_fig3c.jpg|800px|'''図3c.血液脳関門(Blood-brain barrier, BBB)における内因性ペプチド・タンパク質輸送系'''<br>]] | ||
== 薬物の輸送システム == | |||
[[Image: | 図3(d)に、BBBにおける薬物の輸送システムをまとめた<ref name="ref1" /> <ref name="ref3" />。、[[Image:tachikawa_fig3d.jpg|thumb|1000px|'''図3d.血液脳関門(Blood-brain barrier, BBB)における薬物輸送システム'''<br>]] | ||
脂質二重膜で構成される細胞膜は、脂溶性の物質はBBBを透過しやすいとされる。しかし、脳毛細血管内皮細胞の血液側膜に局在するP-糖タンパクやBCRPは広範な基質認識性を示す。これらの基質となる物質は、内皮細胞内に侵入した際に速やかに細胞外へ排出輸送されるため、循環血液から脳への移行性が著しく制限される。中枢作用薬の開発段階においてP-糖タンパクやBCRPの基質となるか否かは脳移行性を予測する重要な指標となる。 | 脂質二重膜で構成される細胞膜は、脂溶性の物質はBBBを透過しやすいとされる。しかし、脳毛細血管内皮細胞の血液側膜に局在するP-糖タンパクやBCRPは広範な基質認識性を示す。これらの基質となる物質は、内皮細胞内に侵入した際に速やかに細胞外へ排出輸送されるため、循環血液から脳への移行性が著しく制限される。中枢作用薬の開発段階においてP-糖タンパクやBCRPの基質となるか否かは脳移行性を予測する重要な指標となる。 | ||
| 80行目: | 72行目: | ||
#単離脳毛細血管や''in vitro'' BBBモデルとして脳毛細血管内皮細胞株を樹立して、詳細な輸送特性(基質の親和性、駆動力、基質選択性)を解析し、トランスポーターを同定する方法。既知のトランスポーターの特性と一致しない場合は、遺伝子クローニングを行う方法。 | #単離脳毛細血管や''in vitro'' BBBモデルとして脳毛細血管内皮細胞株を樹立して、詳細な輸送特性(基質の親和性、駆動力、基質選択性)を解析し、トランスポーターを同定する方法。既知のトランスポーターの特性と一致しない場合は、遺伝子クローニングを行う方法。 | ||
#トランスポーター発現系を用いて、''in vivo''解析系や''in vitro''解析で得られた輸送特性と一致することを実証する方法。新たなトランスポーター輸送機能の解明のために、新規基質をスクリーニングする方法。 | #トランスポーター発現系を用いて、''in vivo''解析系や''in vitro''解析で得られた輸送特性と一致することを実証する方法。新たなトランスポーター輸送機能の解明のために、新規基質をスクリーニングする方法。 | ||
#RT-PCR法や''in situ '' | #RT-PCR法や''in situ ''hybridization法を用いたmRNAレベルか、抗体を用いたウエスタンブロット法及び免疫染色法を用いたタンパク質レベルでの発現局在解析。 | ||
#[[QTAP]]の手法を用いて、BBBトランスポーターの定量的アトラスを作成。絶対定量値と単分子活性を基に、ヒト''in vivo'' BBBにおける物質透過速度を予測する方法 (後述)。 | #[[QTAP]]の手法を用いて、BBBトランスポーターの定量的アトラスを作成。絶対定量値と単分子活性を基に、ヒト''in vivo'' BBBにおける物質透過速度を予測する方法 (後述)。 | ||
| 109行目: | 101行目: | ||
|- | |- | ||
| [[脳微小透析法]]<br>(Brain microdialysis法)<ref name="ref103"><pubmed>1681528</pubmed></ref> | | [[脳微小透析法]]<br>(Brain microdialysis法)<ref name="ref103"><pubmed>1681528</pubmed></ref> | ||
| げっ歯類<br> | | げっ歯類<br>霊長類にも応用可能 | ||
| 循環血液から脳方向/脳から循環血液方向のinflux及びefflux輸送速度を解析、脳細胞間隙中のタンパク非結合形濃度の算出が可能 | | 循環血液から脳方向/脳から循環血液方向のinflux及びefflux輸送速度を解析、脳細胞間隙中のタンパク非結合形濃度の算出が可能 | ||
|- | |- | ||
| 120行目: | 112行目: | ||
| ヒト''in vivo'' BBB輸送解析が可能 | | ヒト''in vivo'' BBB輸送解析が可能 | ||
|- | |- | ||
| [[ | | [[Positoron emission tomography]] ([[PET]]) | ||
| げっ歯類<br>霊長類、ヒト | | げっ歯類<br>霊長類、ヒト | ||
| 循環血液から脳方向のinflux輸送速度を解析<br>ヒト''in vivo'' BBB輸送解析が可能 | | 循環血液から脳方向のinflux輸送速度を解析<br>ヒト''in vivo'' BBB輸送解析が可能 | ||
| 142行目: | 134行目: | ||
| 細胞ロット間の差を最小限にでき、輸送特性の詳細な解析が可能 | | 細胞ロット間の差を最小限にでき、輸送特性の詳細な解析が可能 | ||
|- | |- | ||
| | | 多能性幹細胞からの分化誘導細胞<ref name="ref110"><pubmed>22729031</pubmed></ref> | ||
| ヒト | | ヒト | ||
| [[アストロサイト]]との共培養によって、強固な密着結合が形成可能であり、経細胞輸送解析に有用 | | [[アストロサイト]]との共培養によって、強固な密着結合が形成可能であり、経細胞輸送解析に有用 | ||
| 171行目: | 163行目: | ||
== 動物種差 == | == 動物種差 == | ||
[[Image:Tachikawa fig 4.jpg|thumb|350px|''' | [[Image:Tachikawa fig 4.jpg|thumb|350px|'''図4.血液脳関門における輸送担体のタンパク質発現量の種差'''<br>A. ヒトBBBとddyマウスBBBにおけるタンパク質発現量の比較。B. ヒトBBBとカニクイザルBBBにおけるタンパク質発現量の比較。タンパク質発現量は、mean ±S.D.でプロットした。赤字, 薬物トランスポーター; 青, 内因性物質のトランスポーター; 緑, その他。 <ref name="ref2" /> <ref name="ref5" /> <ref name="ref6"/> <ref name="ref7"/>のデータを基に作成)]] | ||
PET, SPECTおよびMRIなどのイメージング技術を利用することによって、ヒトのBBBにおける物質の透過速度やトランスポーターの輸送活性が測定され、ヒトと実験動物の間の違いが定量的に解析されている。合成可能なリガンド数が少ないこと、特定のトランスポーターだけに輸送される物質がほとんどないことから、現在、一部の化合物やトランスポーターを対象とした解析に限られている。一方、寺崎らが開発した「機能性分子のタンパク質絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP) | PET, SPECTおよびMRIなどのイメージング技術を利用することによって、ヒトのBBBにおける物質の透過速度やトランスポーターの輸送活性が測定され、ヒトと実験動物の間の違いが定量的に解析されている。合成可能なリガンド数が少ないこと、特定のトランスポーターだけに輸送される物質がほとんどないことから、現在、一部の化合物やトランスポーターを対象とした解析に限られている。一方、寺崎らが開発した「機能性分子のタンパク質絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)」によって、ヒト、サル、マウスのBBBにおける複数のトランスポーターのタンパク質発現量が解明された(図4)<ref name="ref2" /> <ref name="ref4" /> <ref name="ref5" /> <ref name="ref6" />。これら2つの手法によって、ヒト血液脳関門研究およびヒト-動物間の種差研究は、発現の有無、BBBを透過する・しないなどといった定性的解析から、発現量(mol)、透過速度、輸送速度およびその差などに基づく定量的解析へと大きく舵を切りつつある。 | ||
===P-糖タンパク=== | ===P-糖タンパク=== | ||
Syvänenらは、P-糖タンパクの基質である[<sup>11</sup>C]GR205171と[<sup>18</sup>F]Altanserinの脳への移行性(脳対血漿中薬物濃度比、Kp brain)は、齧歯類と比較してヒトではそれぞれ4.5倍および8.6倍大きいことを報告している<ref><pubmed> 19047468 </pubmed></ref>。従って、ヒトBBBにおけるP-糖タンパクの薬物排出機能は齧歯類と比較して小さいことが示唆されている。ヒトの脳毛細血管におけるP-糖タンパクのタンパク質発現量はマウスに比べて2.33倍小さいことから( | Syvänenらは、P-糖タンパクの基質である[<sup>11</sup>C]GR205171と[<sup>18</sup>F]Altanserinの脳への移行性(脳対血漿中薬物濃度比、Kp brain)は、齧歯類と比較してヒトではそれぞれ4.5倍および8.6倍大きいことを報告している<ref><pubmed> 19047468 </pubmed></ref>。従って、ヒトBBBにおけるP-糖タンパクの薬物排出機能は齧歯類と比較して小さいことが示唆されている。ヒトの脳毛細血管におけるP-糖タンパクのタンパク質発現量はマウスに比べて2.33倍小さいことから(図4)<ref name="ref6" />、ヒトではP-糖タンパクの発現量の低下に伴ってP-糖タンパクの排出機能が低下していることが示唆される。一方、[[wikipedia:ja:カニクイザル|カニクイザル]]のP-糖タンパクのタンパク質発現量はヒトと有意な差はなかった。 | ||
=== 乳癌耐性タンパク質=== | === 乳癌耐性タンパク質=== | ||
これまでのげっ歯類を用いた研究から、BBBの薬物トランスポーターの中で、P-糖タンパクが輸送機能及び発現量ともに最大であることが示されてきた。しかし、ヒトの脳毛細血管では、乳癌耐性タンパク質(BCRP)のタンパク質発現量がP-糖タンパクに比べてやや大きいことが示された( | これまでのげっ歯類を用いた研究から、BBBの薬物トランスポーターの中で、P-糖タンパクが輸送機能及び発現量ともに最大であることが示されてきた。しかし、ヒトの脳毛細血管では、乳癌耐性タンパク質(BCRP)のタンパク質発現量がP-糖タンパクに比べてやや大きいことが示された(図4)<ref name="ref6" />。従って、げっ歯類に比べて、ヒトのBBBでは薬物排出へのBCRPの寄与が大きいことを推察される。 | ||
=== 有機アニオントランスポーター群 === | === 有機アニオントランスポーター群 === | ||
MRP4、[[OAT3]]、[[OATP1A2]]、[[OATP2B1]]および[[oatp1a4]]など、脳毛細血管内皮細胞に発現することが報告されている有機アニオントランスポーターについて、輸送活性の種差はまだ明かとなっていないが、タンパク質発現量の種差の程度が解明されている( | MRP4、[[OAT3]]、[[OATP1A2]]、[[OATP2B1]]および[[oatp1a4]]など、脳毛細血管内皮細胞に発現することが報告されている有機アニオントランスポーターについて、輸送活性の種差はまだ明かとなっていないが、タンパク質発現量の種差の程度が解明されている(図4)<ref name="ref6" />。ヒト脳毛細血管におけるMRP4の発現量は、カニクイザルと比べて有意な差はないが、マウスに比べて有意に8.15倍小さい。ヒトのOAT3の発現量は、マウスの5.66倍以下である。さらに、ヒトのOATP1A2およびOATP2B1の発現量は、マウスのoatp1a4の発現量に比べて、それぞれ3.04倍以下および6.26倍以下である。従って、マウスに比べて、ヒトではMRP4、OAT3、OATP1A2およびOATP2B1を介した有機アニオン性物質の輸送は制限されていることが示唆されている。 | ||
=== グルコース輸送 === | === グルコース輸送 === | ||
ヒトにおいてBBBを介した脳へのグルコース供給速度の最大値は0.4–2.0 μmol/min/g brainであり、げっ歯類(1.42 μmol/min/g brain)と同程度であることが報告されている<ref><pubmed> 8621747 </pubmed></ref> <ref><pubmed> 6361813 </pubmed></ref>。この報告に一致して、脳へのグルコース供給を担う[[GLUT1]]のタンパク質発現量に顕著な種差はない( | ヒトにおいてBBBを介した脳へのグルコース供給速度の最大値は0.4–2.0 μmol/min/g brainであり、げっ歯類(1.42 μmol/min/g brain)と同程度であることが報告されている<ref><pubmed> 8621747 </pubmed></ref> <ref><pubmed> 6361813 </pubmed></ref>。この報告に一致して、脳へのグルコース供給を担う[[GLUT1]]のタンパク質発現量に顕著な種差はない(図4))<ref name="ref6" /> BBBにおいて、GLUT1に加えてGLUT3の発現も認められている。タンパク質発現量に顕著な種差があるが、GLUT1に比べて絶対量が極めて小さいため(図4)、その種差はBBBにおけるグルコース供給速度に影響しないと考えられる。 | ||
=== アミノ酸輸送 === | === アミノ酸輸送 === | ||
ヒト脳毛細血管におけるLAT1および4f2hcのタンパク質発現量はともに、マウスに比べて5倍小さい( | ヒト脳毛細血管におけるLAT1および4f2hcのタンパク質発現量はともに、マウスに比べて5倍小さい(図4)。L-[1-<sup>11</sup>C][[ロイシン]]とthree-compartment modelを用いたPET解析によって、ヒトの脳内のタンパク質合成速度(0.345-0.614 nmol/min/g)は、げっ歯類(3.38 nmol/min/g)に比べて顕著に小さいことが報告されている<ref><pubmed> 2786885 </pubmed></ref>。脳内タンパク質合成は、脳内のアミノ酸濃度によって影響され、アミノ酸濃度はBBBを介したアミノ酸供給速度に依存している<ref><pubmed> 833603 </pubmed></ref> <ref><pubmed> 7929 </pubmed></ref>。従って、ヒトBBBではLAT1および4f2hcの発現量の低下に伴って、アミノ酸供給速度がげっ歯類に比べて小さいことが示唆される。 | ||
== トランスポーターの輸送活性の再構築法 == | == トランスポーターの輸送活性の再構築法 == | ||
トランスポーターの輸送活性を構成する個々の要素(分子数、1分子あたりの輸送活性)を''in vitro''実験等で解明し、それらのデータを統合することによって''in vivo''のトランスポーターの輸送活性を解析する手法である。イメージング技術と異なり、ヒトにプローブ化合物を投与することなく、ヒトBBBにおけるトランスポーターの輸送活性を解析することが理論的に可能であり、現在、この実現を目指している。 | |||
理論的に、全てのトランスポーターに適用可能であり、有用な解析手法として期待されている。[[Image:Tachikawa fig 5.jpg|thumb|800px|'''図5.血液脳関門におけるトランスポーターの輸送活性の再構築'''<br>Kp brain ratioは、P-糖タンパク遺伝子欠損マウスにおける脳対血漿中薬物濃度比(Kp brain)を野生型マウスのKp brainで除した値として定義され、in vivoのBBBのmdr1a輸送活性を表す。<ref name="ref8"/>のデータを基に作成)]] トランスポーターの輸送活性は、トランスポーター1分子あたりの輸送活性と分子数(タンパク質発現量, mol)の積に分解できる(図5)。従って、トランスポーター1分子あたりの輸送活性を''in vitro''実験によって測定し、ヒト死後脳から単離した脳毛細血管におけるトランスポーターのタンパク質発現量と統合することによって、''in vivo''のヒトBBBにおける輸送活性を再構築できる。この考え方を実証するために、マウスP-糖タンパク発現細胞単層膜で測定したP-糖タンパクの輸送活性をそのP-糖タンパク発現量で除することによってP-糖タンパク1分子あたりの輸送活性を算出した。これをマウス脳毛細血管におけるP-糖タンパク発現量と統合することによって、BBBのP-糖タンパク輸送活性を再構築した。その結果、異なる輸送活性を示す全11基質について再構築された輸送活性は実測値と良好に一致した(図5)<ref name="ref8" /> 。このように、''in vivo''のBBBにおける輸送活性を再構築できることが実験的に証明されている。この再構築の考え方をヒトに適用し、ヒトのトランスポーターの発現培養細胞における1分子輸送活性およびヒト脳毛細血管における発現量を測定することによって、ヒトBBBにおける種々のトランスポーターの輸送活性を解析できるようになると考えられている。 | |||
==関連項目== | ==関連項目== | ||
グリア細胞、脳脊髄液、アルツハイマー病、細胞膜、アストロサイト、トランスポーター、受容体 | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2015年2月16日 (月) 13:19時点における版
立川 正憲、内田 康雄、寺崎 哲也
東北大学 大学院薬学研究科 生命薬科学専攻 生命解析学講座 薬物送達学分野
DOI XXXX/XXXX 原稿受付日:2013年3月11日 原稿完成日:2015年2月日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名:Blood-brain barrier 独:Blut-Hirn-Schranke 仏:barrière hémato-encéphalique 英略称:BBB 同義語:脳毛細血管、脳血管関門
血液脳関門(Blood-brain barrier, BBB)の解剖学的実体は脳毛細血管であり、脳室周囲器官を除いては、内皮細胞同士が密着結合で連結している。当初BBBは、この構造的特徴によって、細胞間隙を介した非特異的な中枢への侵入や、脳内産生物質の流出を阻止している物理的障壁と考えられてきた。しかし現在では、BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるという新たな概念が確立している。BBBには、多様なトランスポーターや受容体が内皮細胞の脳血液側と脳側の細胞膜に極性をもって発現し、協奏的に働くことによって、循環血液と脳実質間でのベクトル輸送を厳密に制御している。中枢作用薬の開発には、良好な脳移行性を持った候補化合物の選択が必要であり、ヒトBBBの解明が不可欠である。近年、「機能タンパク質の絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)」によって、ヒト、サル、マウスのBBBにおけるトランスポーター・受容体の質的及び量的な種差が解明された。BBB研究は、げっ歯類を中心とした発現の有無、BBBを透過するか否かといった定性的解析から、発現量、透過速度、輸送速度およびヒト-動物間の種差や正常-病態間の差などに基づく定量的解析へと大きく舵を切りつつある。
歴史
細菌学者Paul Ehrlichは当時流行り始めた生体染色色素に興味を持ち、生きたウサギの血管内に色素を注射したところ、多くの臓器の組織染色に成功したが、中枢神経だけが染色できないことに気付いた。1885年に、この結果を「脳組織は染色色素を吸着する化学成分が欠乏している」と解釈した論文を発表した[1]。
その後、弟子のEdwin Goldmanが、トリパンブルー(酸性色素)を脳室内に投与したところ、中枢神経は染まるが他の末梢臓器は染まらないことを見出した。Goldmanは、この結果を「中枢組織は染色し難い性質を持つという解釈は誤りで、脳は血管との間に色素を隔離する特性を有している」と解釈し、1913年に” Blut-Gehirn-Schranke”仮説を提唱した[2]。この史実に基づき、「血液脳関門(Blood-Brain Barrier, BBB)の概念の提唱者はPaul Ehrlichである」と多くの教科書に書かれている。
一方、Humphrey Ridleyは、Ehrlichの実験から190年も遡った1695年に著書"The Anatomy of the Brain"[3]を発表し、その中で「水銀を血液内に投与すると、神経組織へ移行せずに血管内に留まっている。その原因は脳血管の密着性が、他の血管と大きく異なるからである。」と述べている。この歴史的発見を無視する訳にはいかない。「血液脳関門の最初の発見は、1695年、英国人の生理学者Humphrey Ridleyである」[4]という説に教科書を訂正する必要がある。
このように320年前に英国で始まった血液脳関門の研究は、当初、「血液と脳を隔てる単なる物理的障壁」と考えられてきた。 しかし近年では、分子生物学や、in vitroモデル細胞株の樹立など細胞生物的な手法の導入によって、BBBの機能は分子レベルでの解明が飛躍的に進んでいる。
現在では、BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるという新たな概念へと塗り替えられている[5]。このBBBの機能は、薬という異物の脳移行を制限することから、中枢作用薬の開発成功率を大幅に下げる一因と位置づけられている。特に、がん細胞において抗がん剤耐性因子として同定されたP-糖タンパク(P-glycoprotein/P-gp/ABCB1/MDR1/mdr1a)が、「脳血管内皮細胞でエネルギーを消費して薬物を排出するポンプとして働いていること」を見出し、それまでの「400Daの分子篩説」[6]あるいは600Daの分子篩説」[7]に対して「能動的排出輸送担体説」[8]を提唱したことは、血液脳関門研究の歴史において重要な意義がある。その後、P-糖タンパク遺伝子欠損マウスを用いた研究によって[9]その排出輸送機能の生理的な重要性や薬物動態における重要性が明らかになった。
その後、P-糖タンパク以外に乳癌耐性タンパク質(Breast Cancer Resistance Protein, BCRP/ABCG2/MXR/ABCP)[10] [11] [12] [13]やMultidrug Resistance-associated Protein 4 (MRP4/ABCC4)[14] [15] [16]が、薬物や内因性物質などの排出ポンプとして重要な働きを担っていることが明らかになった。その他にもBBBに発現して物質輸送を担う多様なトランスポーターや受容体の分子レベルでの同定が進み、脳機能を支援・防御する動的インターフェースの一躍を担っていることが明らかにされ[5]、BBBの受容体を標的とした薬物送達システムの開発も進んだ[17]。
そして今、寺崎らが2008年に開発した機能性タンパク質の標的絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)[18] [19]によって、BBBに発現するトランスポーターの定量アトラスが、マウス[18] [20]、サル[21]、ヒト[22]で完成し、これらの定量情報を基にBBBのヒトと動物との種差が解明された。さらに、BBBにおけるトランスポーターの発現量とin vitroで計測可能な単分子活性を基にしたBBB物質輸送の再構築法[23]の開発が進んでおり、ヒトBBBにおける薬物を含めた物質輸送の予測系の基盤技術が構築されつつある。
構造と役割
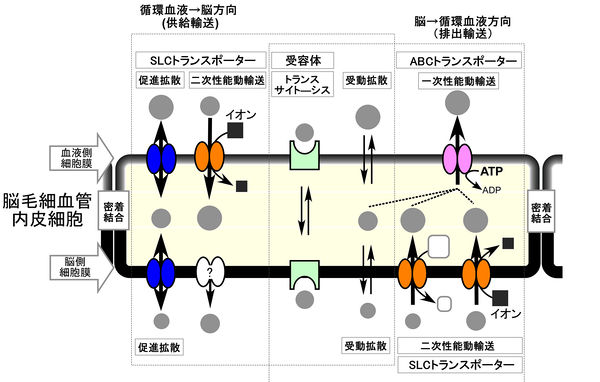
SLCトランスポーター, Solute carrierファミリートランスポーター ; ABCトランスポーター, ATP-binding cassetteトランスポーター
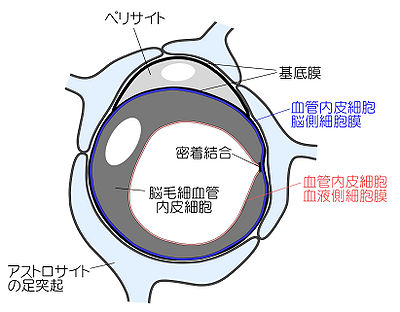
脳は、高度な神経活動のためシナプス周辺の環境が、BBBによって厳密に制御されている。BBBの解剖学的実体は脳毛細血管であり、内皮細胞同士が密着結合(tight junction)で連結している (図1)。密着結合構成タンパク質には、クローディン、オクルディンなどが知られている。一部の内皮細胞には、周皮細胞(pericyte)が接着し、その大部分を星状膠細胞の足突起が覆っている (図1)。このようなBBBの構造的特徴によって、血液構成成分や投与薬物の内皮細胞間隙を介した非特異的な中枢神経への侵入や、脳内産生物質の流出を阻止している。
ただし例外として、脳室周囲器官と呼ばれる、終板血管器官、脳弓下器官、交連下器官、視床下部正中隆起、松果体、下垂体後葉、最終野などの領域では、毛細血管内皮細胞が密着結合で連結していないため、末梢血管と同様に血液とこれらの組織間の物質の移動は比較的自由である。これは、Goldmanがトリパンブルーを血管内に投与した実験において、一部の脳内部位が染色された要因であった可能性が高い。
ヒトの脳毛細血管の全長は約650km、表面積は約9m2である一方、全脳に占める脳毛細血管内皮細胞の容積はわずか0.1%である。脳の毛細血管は平均40µmの間隔で網目状に張り巡らされていることから、分子量数百程度の物質は脳毛細血管を通過後、速やかに拡散して、脳実質細胞に到達可能である。BBBを透過した物質の脳実質組織内での移動は、拡散律速であり脳脊髄液中への移行は制限されている。しかし、脳実質内には脳脊髄液へ向かう速い細胞間液の流れがあることが報告されており、その流れに乗ると、数分から数十分で脊髄液へ達する可能性がある[24]。
血液と脳実質細胞間液の物質交換は、様々な輸送システムによって制御されている (図2)。この輸送系の分子的実体は、多様なトランスポーターや受容体、及びその複合体であり、脳毛細血管内皮細胞の脳血液側と脳側の細胞膜に極性をもって発現する。トランスポーターは、脳血液側と脳側の細胞膜のどちらか一方又は、両方の細胞膜に局在し、細胞外から細胞内、又は細胞内から細胞外へ、特定の基質を輸送する能力を有している。
トランスポーターは、大きく2つのファミリーに分類される。1つは、ATP-binding cassette (ABC) transporterファミリーで、ATPの加水分解エネルギーを直接利用して、主に細胞内から細胞外への輸送を担う。 もう1つは、solute carrier (SLC)ファミリーで、エネルギーを消費しないで濃度勾配に従って下り坂輸送を行う促進拡散や、無機イオンや有機イオンの濃度勾配を利用して、濃度勾配に逆らった基質輸送を行う2次性能動輸送に関与する。受容体はトランスサイトーシスによって、リガンドを輸送する機能を有している。これらのトランスポーターや受容体が協同的に働くことによって、循環血液から脳への供給方向及び、脳から循環血液への排出方向の物質のベクトル輸送を厳密に制御している。
内因性物質の輸送システム
図3(a)-(c)に、主にげっ歯類で明らかにされているBBBにおける内因性物質の輸送システムをまとめた[5] [25]。
供給輸送系
BBB供給輸送系の最も重要な役割の一つは、
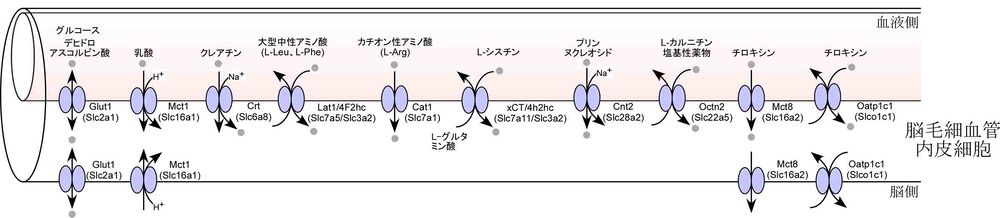
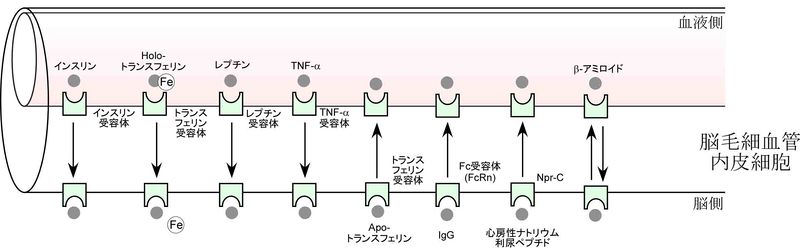
エネルギー源となるグルコースや乳酸及びタンパク質や神経伝達物質の原料となるアミノ酸の循環血液から脳への供給である。グルコーストランスポーター 1 (GLUT1/SLC2A1)は、促進拡散型のトランスポーターで、脳毛細血管内皮細胞の両側の細胞膜に局在し、循環血液中から脳方向へのグルコースの供給輸送を担う。この他、モノカルボン酸トランスポーター (MCT1/SLC16A1) は、乳酸などのケトン体エネルギー源の供給に関与し、L型アミノ酸トランスポーター(LAT1/SLC7A5)は、4F2抗原重鎖 (4F2hc, CD98/SLC3A2)とヘテロダイマーを形成して、主にチロシンやフェニルアラニンなどの大型の中性アミノ酸を脳内に供給する役割を果たす。この他に、エネルギー貯蔵物質クレアチン、浸透圧調節物質タウリンの輸送系などが知られている。インスリン受容体やトランスフェリン受容体は、受容体介在型トランスサイトーシス経路として、ぞれぞれインスリンやトランスフェリンを、循環血液から脳へ供給する役割を担う。近年では、これらの受容体介在型トランスサイトーシス経路を利用して、抗ヒト受容体モノクローナル抗体とタンパク質医薬品とのキメラタンパク質を脳へ効率的にデリバリーする研究が行われている[26]。
排出輸送系
BBB排出輸送系の主要な役割は、
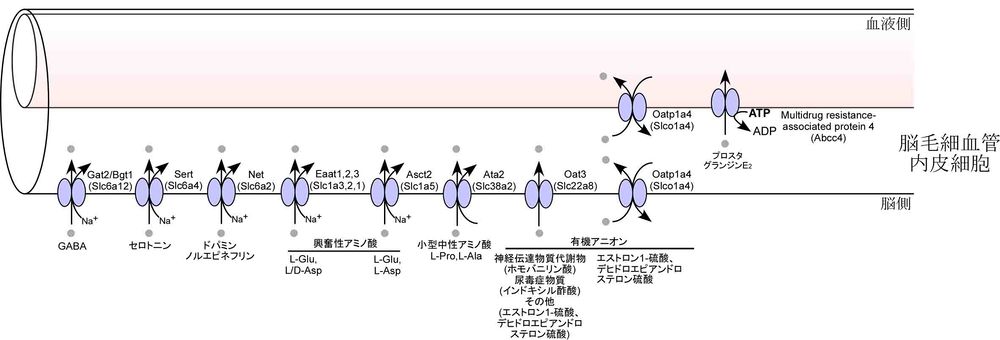
脳内で産生される神経伝達物質、メディエーターや代謝物の循環血液中へのくみ出しであり、SLCファミリーである神経伝達物質トランスポーター、アミノ酸トランスポーター、有機アニオントランスポーターや、ABCトランスポーターファミリーであるMRP4などがそれぞれ関与している。これらの輸送系は、脳細胞間隙中の神経伝達物質の第二のクリアランス機構や、脳内不要物質の脳内蓄積を防止する機構として、機能している。このほかにBBBには、脳内の免疫グロブリンIgGや心房性ナトリウム利尿ペプチドを血液方向へトランスサイトーシスによって排出輸送する輸送機構として、それぞれneonatal Fc receptor (FcRn)[27]及びnatriuretic peptide receptor (Npr-C))[28]が役割を果たしていることが知られている。さらに、BBBには、アルツハイマー病で脳内に蓄積するβ-アミロイド(1-40)の排出輸送系が存在する[29] [30] [31]。この分子的実体には、P-糖タンパク[32]、BCRP[33]、lipoprotein receptor related protein-1(LRP-1) [34]など諸説あるが、現時点で結論が出ていない。
薬物の輸送システム
図3(d)に、BBBにおける薬物の輸送システムをまとめた[5] [25]。、
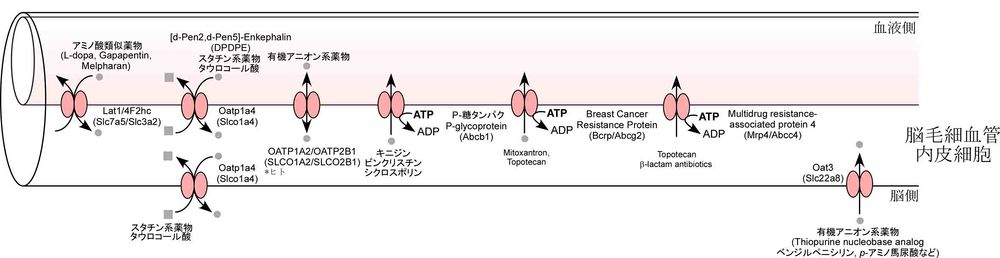
脂質二重膜で構成される細胞膜は、脂溶性の物質はBBBを透過しやすいとされる。しかし、脳毛細血管内皮細胞の血液側膜に局在するP-糖タンパクやBCRPは広範な基質認識性を示す。これらの基質となる物質は、内皮細胞内に侵入した際に速やかに細胞外へ排出輸送されるため、循環血液から脳への移行性が著しく制限される。中枢作用薬の開発段階においてP-糖タンパクやBCRPの基質となるか否かは脳移行性を予測する重要な指標となる。
さらに、内因性代謝物質の排出輸送にも関与するOAT3やMRP4は、比較的水溶性の高いアニオン性薬物の脳内移行性を制限している。これらのトランスポーターを介した内因性物質と薬物間の相互作用が起こると、内因性物質の脳内挙動が変化し、副作用に繋がる可能性がある。脳移行性の優れた中枢作用薬の開発に当たっては、排出輸送に関与するトランスポーターの高親和性基質にならないことが望まれている。
一方、供給輸送に関与するBBBのトランスポーターを利用して、内因性物質類似の薬物を脳に輸送させる試みもなされている。例えば、パーキンソン病治療薬であるL-ドーパはL-チロシンに構造が類似しており、LAT1を介して脳内に輸送される。これまで知られている脳内移行性の高い薬物の多くは有機カチオン性物質であり、BBBには未同定の有機カチオントランスポーターの存在が示唆されている[25]。
実験手法
表1に、BBB研究で用いられる実験手法をまとめた。BBBにおける輸送システムを解明する研究は、functional genomicsを背景に、多様な実験手法が開発されたことで飛躍的に進んだ。主な研究手法は、以下の様に大別される。詳細は、総説[35]を参照されたい。
- 主にげっ歯類で開発されたin vivo解析系を用いて、循環血液から脳方向及び脳から循環血液方向の物質輸送を速度論的に解析する方法。
- 単離脳毛細血管やin vitro BBBモデルとして脳毛細血管内皮細胞株を樹立して、詳細な輸送特性(基質の親和性、駆動力、基質選択性)を解析し、トランスポーターを同定する方法。既知のトランスポーターの特性と一致しない場合は、遺伝子クローニングを行う方法。
- トランスポーター発現系を用いて、in vivo解析系やin vitro解析で得られた輸送特性と一致することを実証する方法。新たなトランスポーター輸送機能の解明のために、新規基質をスクリーニングする方法。
- RT-PCR法やin situ hybridization法を用いたmRNAレベルか、抗体を用いたウエスタンブロット法及び免疫染色法を用いたタンパク質レベルでの発現局在解析。
- QTAPの手法を用いて、BBBトランスポーターの定量的アトラスを作成。絶対定量値と単分子活性を基に、ヒトin vivo BBBにおける物質透過速度を予測する方法 (後述)。
| 実験手法 | 応用事例 | 解析内容 |
| In vivo BBB輸送解析法 | ||
| 静脈内投与法 (Integration plot法) |
げっ歯類 | 循環血液から脳方向のinflux輸送速度を解析 |
| 脳灌流法 (In situ brain perfusion法)[36] |
げっ歯類 | 血液から脳方向のinflux輸送速度を解析 |
| Brain Uptake Index(BUI)法[37] | げっ歯類 | 血液から脳方向のinflux輸送速度を解析 |
| Brain Efflux Index(BEI)法[38] | げっ歯類 | 脳から循環血液方向のefflux輸送速度を解析 |
| 脳微小透析法 (Brain microdialysis法)[39] |
げっ歯類 霊長類にも応用可能 |
循環血液から脳方向/脳から循環血液方向のinflux及びefflux輸送速度を解析、脳細胞間隙中のタンパク非結合形濃度の算出が可能 |
| 定量オートラジオグラフィー | げっ歯類 | 脳部位ごとの物質分布の定量化が可能 |
| Magnetic resonance imaging (MRI) | げっ歯類 霊長類、ヒト |
ヒトin vivo BBB輸送解析が可能 |
| Positoron emission tomography (PET) | げっ歯類 霊長類、ヒト |
循環血液から脳方向のinflux輸送速度を解析 ヒトin vivo BBB輸送解析が可能 |
| In vitro BBB輸送解析法 | ||
| 単離脳毛細血管 (Capillary depletion法)[40] |
げっ歯類 霊長類、ヒト |
脳組織から簡便に毛細血管画分を単離できる 輸送実験や発現解析に利用可能 |
| Magnetic cell sorting (MACS)[41] |
げっ歯類 | 単離脳血管から、高純度脳毛細血管内皮細胞を単離できる、収率は低いが、RT-PCRによるmRNAレベルでの発現解析可能 |
| 初代培養細胞[42] | げっ歯類 | 脳毛細血管内皮細胞の単離培養が可能 |
| 条件的不死化細胞[43] [44] [45] | げっ歯類、ヒト | 細胞ロット間の差を最小限にでき、輸送特性の詳細な解析が可能 |
| 多能性幹細胞からの分化誘導細胞[46] | ヒト | アストロサイトとの共培養によって、強固な密着結合が形成可能であり、経細胞輸送解析に有用 |
| トランスポーター強制発現系[47] | げっ歯類、ヒト | ヒト遺伝子発現系を用いて、ヒトトランスポーターの機能解析ができる。標的定量プロテオミクスで、トランスポーターの発現量を計測することによって、単分子あたりの輸送活性を算出。 |
| トランスポーター/受容体のBBB発現局在性解析 | ||
| RT-PCR/イムノブロット | げっ歯類 ヒト |
mRNAレベルの発現検出 |
| In situハイブリダイゼーション[13] | げっ歯類 ヒト |
mRNAレベルの発現検出、脳部位の判別可能 |
| 免疫染色法、免疫電子顕微鏡法[13] | げっ歯類 ヒト |
抗体を用いて脳毛細血管における発現解析、脳毛細血管内皮細胞の脳側膜、血液側膜の判別が可能、特異性の高い抗体が必要 |
| 標的絶対定量プロテオミクス (Quantitative Targeted Absolute Proteomics, QTAP)[18] |
げっ歯類 ヒト |
脳毛細血管に発現するタンパク質の絶対発現量を取得できる。抗体を用いずに、アミノ酸配列情報から定量系の確立が可能。In vitro輸送実験輸送解析系との組み合わせによって、in vivo BBB輸送の予測が理論的に可能。 |
動物種差
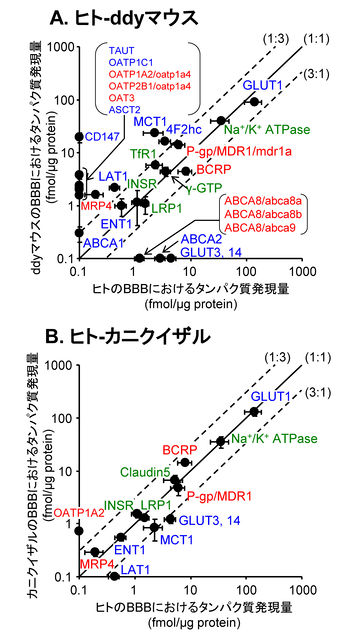
A. ヒトBBBとddyマウスBBBにおけるタンパク質発現量の比較。B. ヒトBBBとカニクイザルBBBにおけるタンパク質発現量の比較。タンパク質発現量は、mean ±S.D.でプロットした。赤字, 薬物トランスポーター; 青, 内因性物質のトランスポーター; 緑, その他。 [18] [21] [22] [19]のデータを基に作成)
PET, SPECTおよびMRIなどのイメージング技術を利用することによって、ヒトのBBBにおける物質の透過速度やトランスポーターの輸送活性が測定され、ヒトと実験動物の間の違いが定量的に解析されている。合成可能なリガンド数が少ないこと、特定のトランスポーターだけに輸送される物質がほとんどないことから、現在、一部の化合物やトランスポーターを対象とした解析に限られている。一方、寺崎らが開発した「機能性分子のタンパク質絶対定量法(Quantitative Targeted Absolute Proteomics (QTAP)」によって、ヒト、サル、マウスのBBBにおける複数のトランスポーターのタンパク質発現量が解明された(図4)[18] [20] [21] [22]。これら2つの手法によって、ヒト血液脳関門研究およびヒト-動物間の種差研究は、発現の有無、BBBを透過する・しないなどといった定性的解析から、発現量(mol)、透過速度、輸送速度およびその差などに基づく定量的解析へと大きく舵を切りつつある。
P-糖タンパク
Syvänenらは、P-糖タンパクの基質である[11C]GR205171と[18F]Altanserinの脳への移行性(脳対血漿中薬物濃度比、Kp brain)は、齧歯類と比較してヒトではそれぞれ4.5倍および8.6倍大きいことを報告している[48]。従って、ヒトBBBにおけるP-糖タンパクの薬物排出機能は齧歯類と比較して小さいことが示唆されている。ヒトの脳毛細血管におけるP-糖タンパクのタンパク質発現量はマウスに比べて2.33倍小さいことから(図4)[22]、ヒトではP-糖タンパクの発現量の低下に伴ってP-糖タンパクの排出機能が低下していることが示唆される。一方、カニクイザルのP-糖タンパクのタンパク質発現量はヒトと有意な差はなかった。
乳癌耐性タンパク質
これまでのげっ歯類を用いた研究から、BBBの薬物トランスポーターの中で、P-糖タンパクが輸送機能及び発現量ともに最大であることが示されてきた。しかし、ヒトの脳毛細血管では、乳癌耐性タンパク質(BCRP)のタンパク質発現量がP-糖タンパクに比べてやや大きいことが示された(図4)[22]。従って、げっ歯類に比べて、ヒトのBBBでは薬物排出へのBCRPの寄与が大きいことを推察される。
有機アニオントランスポーター群
MRP4、OAT3、OATP1A2、OATP2B1およびoatp1a4など、脳毛細血管内皮細胞に発現することが報告されている有機アニオントランスポーターについて、輸送活性の種差はまだ明かとなっていないが、タンパク質発現量の種差の程度が解明されている(図4)[22]。ヒト脳毛細血管におけるMRP4の発現量は、カニクイザルと比べて有意な差はないが、マウスに比べて有意に8.15倍小さい。ヒトのOAT3の発現量は、マウスの5.66倍以下である。さらに、ヒトのOATP1A2およびOATP2B1の発現量は、マウスのoatp1a4の発現量に比べて、それぞれ3.04倍以下および6.26倍以下である。従って、マウスに比べて、ヒトではMRP4、OAT3、OATP1A2およびOATP2B1を介した有機アニオン性物質の輸送は制限されていることが示唆されている。
グルコース輸送
ヒトにおいてBBBを介した脳へのグルコース供給速度の最大値は0.4–2.0 μmol/min/g brainであり、げっ歯類(1.42 μmol/min/g brain)と同程度であることが報告されている[49] [50]。この報告に一致して、脳へのグルコース供給を担うGLUT1のタンパク質発現量に顕著な種差はない(図4))[22] BBBにおいて、GLUT1に加えてGLUT3の発現も認められている。タンパク質発現量に顕著な種差があるが、GLUT1に比べて絶対量が極めて小さいため(図4)、その種差はBBBにおけるグルコース供給速度に影響しないと考えられる。
アミノ酸輸送
ヒト脳毛細血管におけるLAT1および4f2hcのタンパク質発現量はともに、マウスに比べて5倍小さい(図4)。L-[1-11C]ロイシンとthree-compartment modelを用いたPET解析によって、ヒトの脳内のタンパク質合成速度(0.345-0.614 nmol/min/g)は、げっ歯類(3.38 nmol/min/g)に比べて顕著に小さいことが報告されている[51]。脳内タンパク質合成は、脳内のアミノ酸濃度によって影響され、アミノ酸濃度はBBBを介したアミノ酸供給速度に依存している[52] [53]。従って、ヒトBBBではLAT1および4f2hcの発現量の低下に伴って、アミノ酸供給速度がげっ歯類に比べて小さいことが示唆される。
トランスポーターの輸送活性の再構築法
トランスポーターの輸送活性を構成する個々の要素(分子数、1分子あたりの輸送活性)をin vitro実験等で解明し、それらのデータを統合することによってin vivoのトランスポーターの輸送活性を解析する手法である。イメージング技術と異なり、ヒトにプローブ化合物を投与することなく、ヒトBBBにおけるトランスポーターの輸送活性を解析することが理論的に可能であり、現在、この実現を目指している。
理論的に、全てのトランスポーターに適用可能であり、有用な解析手法として期待されている。
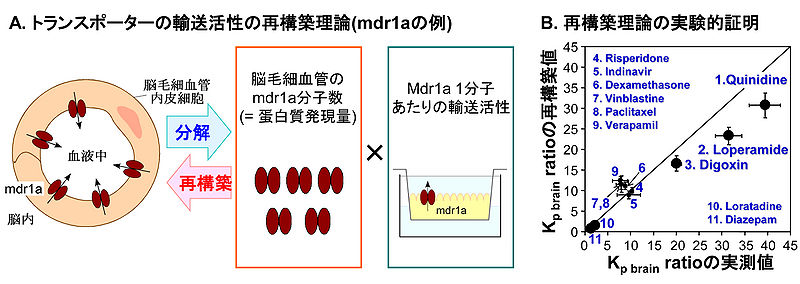
Kp brain ratioは、P-糖タンパク遺伝子欠損マウスにおける脳対血漿中薬物濃度比(Kp brain)を野生型マウスのKp brainで除した値として定義され、in vivoのBBBのmdr1a輸送活性を表す。[23]のデータを基に作成)
トランスポーターの輸送活性は、トランスポーター1分子あたりの輸送活性と分子数(タンパク質発現量, mol)の積に分解できる(図5)。従って、トランスポーター1分子あたりの輸送活性をin vitro実験によって測定し、ヒト死後脳から単離した脳毛細血管におけるトランスポーターのタンパク質発現量と統合することによって、in vivoのヒトBBBにおける輸送活性を再構築できる。この考え方を実証するために、マウスP-糖タンパク発現細胞単層膜で測定したP-糖タンパクの輸送活性をそのP-糖タンパク発現量で除することによってP-糖タンパク1分子あたりの輸送活性を算出した。これをマウス脳毛細血管におけるP-糖タンパク発現量と統合することによって、BBBのP-糖タンパク輸送活性を再構築した。その結果、異なる輸送活性を示す全11基質について再構築された輸送活性は実測値と良好に一致した(図5)[23] 。このように、in vivoのBBBにおける輸送活性を再構築できることが実験的に証明されている。この再構築の考え方をヒトに適用し、ヒトのトランスポーターの発現培養細胞における1分子輸送活性およびヒト脳毛細血管における発現量を測定することによって、ヒトBBBにおける種々のトランスポーターの輸送活性を解析できるようになると考えられている。
関連項目
グリア細胞、脳脊髄液、アルツハイマー病、細胞膜、アストロサイト、トランスポーター、受容体
参考文献
- ↑ Ehrlich P.
Das Sauerstoff-Bedurfnis des Organismus: eine farbenanalytisch Studie
Berlin: Hirschward:1885 - ↑ Goldman E.E.
Vitalfarbung am Zentralnervensystem
Berlin: Eimer:1993 - ↑ Ridley H.
The Anatomy of the Brain
London: Printers to the Royal Society:1695 - ↑
Liddelow, S.A. (2011).
Fluids and barriers of the CNS: a historical viewpoint. Fluids and barriers of the CNS, 8(1), 2. [PubMed:21349150] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3
Ohtsuki, S., & Terasaki, T. (2007).
Contribution of carrier-mediated transport systems to the blood-brain barrier as a supporting and protecting interface for the brain; importance for CNS drug discovery and development. Pharmaceutical research, 24(9), 1745-58. [PubMed:17619998] [WorldCat] [DOI] - ↑
Levin, V.A. (1980).
Relationship of octanol/water partition coefficient and molecular weight to rat brain capillary permeability. Journal of medicinal chemistry, 23(6), 682-4. [PubMed:7392035] [WorldCat] [DOI] - ↑
Pardridge, W.M. (1994).
New approaches to drug delivery through the blood-brain barrier. Trends in biotechnology, 12(6), 239-45. [PubMed:7765071] [WorldCat] [DOI] - ↑
Tsuji, A., Terasaki, T., Takabatake, Y., Tenda, Y., Tamai, I., Yamashima, T., ..., & Yamashita, J. (1992).
P-glycoprotein as the drug efflux pump in primary cultured bovine brain capillary endothelial cells. Life sciences, 51(18), 1427-37. [PubMed:1357522] [WorldCat] [DOI] - ↑
Schinkel, A.H., Smit, J.J., van Tellingen, O., Beijnen, J.H., Wagenaar, E., van Deemter, L., ..., & te Riele, H.P. (1994).
Disruption of the mouse mdr1a P-glycoprotein gene leads to a deficiency in the blood-brain barrier and to increased sensitivity to drugs. Cell, 77(4), 491-502. [PubMed:7910522] [WorldCat] [DOI] - ↑
Breedveld, P., Pluim, D., Cipriani, G., Wielinga, P., van Tellingen, O., Schinkel, A.H., & Schellens, J.H. (2005).
The effect of Bcrp1 (Abcg2) on the in vivo pharmacokinetics and brain penetration of imatinib mesylate (Gleevec): implications for the use of breast cancer resistance protein and P-glycoprotein inhibitors to enable the brain penetration of imatinib in patients. Cancer research, 65(7), 2577-82. [PubMed:15805252] [WorldCat] [DOI] - ↑
Cooray, H.C., Blackmore, C.G., Maskell, L., & Barrand, M.A. (2002).
Localisation of breast cancer resistance protein in microvessel endothelium of human brain. Neuroreport, 13(16), 2059-63. [PubMed:12438926] [WorldCat] [DOI] - ↑
Hori, S., Ohtsuki, S., Tachikawa, M., Kimura, N., Kondo, T., Watanabe, M., ..., & Terasaki, T. (2004).
Functional expression of rat ABCG2 on the luminal side of brain capillaries and its enhancement by astrocyte-derived soluble factor(s). Journal of neurochemistry, 90(3), 526-36. [PubMed:15255930] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Tachikawa, M., Watanabe, M., Hori, S., Fukaya, M., Ohtsuki, S., Asashima, T., & Terasaki, T. (2005).
Distinct spatio-temporal expression of ABCA and ABCG transporters in the developing and adult mouse brain. Journal of neurochemistry, 95(1), 294-304. [PubMed:16181433] [WorldCat] [DOI] - ↑
Zhang, Y., Schuetz, J.D., Elmquist, W.F., & Miller, D.W. (2004).
Plasma membrane localization of multidrug resistance-associated protein homologs in brain capillary endothelial cells. The Journal of pharmacology and experimental therapeutics, 311(2), 449-55. [PubMed:15218051] [WorldCat] [DOI] - ↑
Ose, A., Ito, M., Kusuhara, H., Yamatsugu, K., Kanai, M., Shibasaki, M., ..., & Sugiyama, Y. (2009).
Limited brain distribution of [3R,4R,5S]-4-acetamido-5-amino-3-(1-ethylpropoxy)-1-cyclohexene-1-carboxylate phosphate (Ro 64-0802), a pharmacologically active form of oseltamivir, by active efflux across the blood-brain barrier mediated by organic anion transporter 3 (Oat3/Slc22a8) and multidrug resistance-associated protein 4 (Mrp4/Abcc4). Drug metabolism and disposition: the biological fate of chemicals, 37(2), 315-21. [PubMed:19029202] [WorldCat] [DOI] - ↑
Akanuma, S., Hosoya, K., Ito, S., Tachikawa, M., Terasaki, T., & Ohtsuki, S. (2010).
Involvement of multidrug resistance-associated protein 4 in efflux transport of prostaglandin E(2) across mouse blood-brain barrier and its inhibition by intravenous administration of cephalosporins. The Journal of pharmacology and experimental therapeutics, 333(3), 912-9. [PubMed:20194529] [WorldCat] [DOI] - ↑
Pardridge, W.M. (2012).
Drug transport across the blood-brain barrier. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 32(11), 1959-72. [PubMed:22929442] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1 18.2 18.3 18.4
Kamiie, J., Ohtsuki, S., Iwase, R., Ohmine, K., Katsukura, Y., Yanai, K., ..., & Terasaki, T. (2008).
Quantitative atlas of membrane transporter proteins: development and application of a highly sensitive simultaneous LC/MS/MS method combined with novel in-silico peptide selection criteria. Pharmaceutical research, 25(6), 1469-83. [PubMed:18219561] [WorldCat] [DOI] - ↑ 19.0 19.1
Ohtsuki, S., Uchida, Y., Kubo, Y., & Terasaki, T. (2011).
Quantitative targeted absolute proteomics-based ADME research as a new path to drug discovery and development: methodology, advantages, strategy, and prospects. Journal of pharmaceutical sciences, 100(9), 3547-59. [PubMed:21560129] [WorldCat] [DOI] - ↑ 20.0 20.1
Agarwal, S., Uchida, Y., Mittapalli, R.K., Sane, R., Terasaki, T., & Elmquist, W.F. (2012).
Quantitative proteomics of transporter expression in brain capillary endothelial cells isolated from P-glycoprotein (P-gp), breast cancer resistance protein (Bcrp), and P-gp/Bcrp knockout mice. Drug metabolism and disposition: the biological fate of chemicals, 40(6), 1164-9. [PubMed:22401960] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2
Ito, K., Uchida, Y., Ohtsuki, S., Aizawa, S., Kawakami, H., Katsukura, Y., ..., & Terasaki, T. (2011).
Quantitative membrane protein expression at the blood-brain barrier of adult and younger cynomolgus monkeys. Journal of pharmaceutical sciences, 100(9), 3939-50. [PubMed:21254069] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2 22.3 22.4 22.5 22.6
Uchida, Y., Ohtsuki, S., Katsukura, Y., Ikeda, C., Suzuki, T., Kamiie, J., & Terasaki, T. (2011).
Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of neurochemistry, 117(2), 333-45. [PubMed:21291474] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2
Uchida, Y., Ohtsuki, S., Kamiie, J., & Terasaki, T. (2011).
Blood-brain barrier (BBB) pharmacoproteomics: reconstruction of in vivo brain distribution of 11 P-glycoprotein substrates based on the BBB transporter protein concentration, in vitro intrinsic transport activity, and unbound fraction in plasma and brain in mice. The Journal of pharmacology and experimental therapeutics, 339(2), 579-88. [PubMed:21828264] [WorldCat] [DOI] - ↑
Hladky, S.B., & Barrand, M.A. (2014).
Mechanisms of fluid movement into, through and out of the brain: evaluation of the evidence. Fluids and barriers of the CNS, 11(1), 26. [PubMed:25678956] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2
Tachikawa, M., Uchida, Y., & Terasaki, T. (2013).
[Multi-disciplinary research approaches on the brain barrier transport system, a dynamic interface]. Brain and nerve = Shinkei kenkyu no shinpo, 65(2), 121-36. [PubMed:23399670] [WorldCat] - ↑
Pardridge, W.M. (2012).
Drug transport across the blood-brain barrier. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 32(11), 1959-72. [PubMed:22929442] [PMC] [WorldCat] [DOI] - ↑
Zhang, Y., & Pardridge, W.M. (2001).
Mediated efflux of IgG molecules from brain to blood across the blood-brain barrier. Journal of neuroimmunology, 114(1-2), 168-72. [PubMed:11240028] [WorldCat] [DOI] - ↑
Ito, S., Ohtsuki, S., Katsukura, Y., Funaki, M., Koitabashi, Y., Sugino, A., ..., & Terasaki, T. (2011).
Atrial natriuretic peptide is eliminated from the brain by natriuretic peptide receptor-C-mediated brain-to-blood efflux transport at the blood-brain barrier. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 31(2), 457-66. [PubMed:20628403] [PMC] [WorldCat] [DOI] - ↑
Ito, S., Ohtsuki, S., Kamiie, J., Nezu, Y., & Terasaki, T. (2007).
Cerebral clearance of human amyloid-beta peptide (1-40) across the blood-brain barrier is reduced by self-aggregation and formation of low-density lipoprotein receptor-related protein-1 ligand complexes. Journal of neurochemistry, 103(6), 2482-90. [PubMed:17908238] [WorldCat] [DOI] - ↑
Ito, S., Ohtsuki, S., & Terasaki, T. (2006).
Functional characterization of the brain-to-blood efflux clearance of human amyloid-beta peptide (1-40) across the rat blood-brain barrier. Neuroscience research, 56(3), 246-52. [PubMed:16926058] [WorldCat] [DOI] - ↑
Ito, S., Ueno, T., Ohtsuki, S., & Terasaki, T. (2010).
Lack of brain-to-blood efflux transport activity of low-density lipoprotein receptor-related protein-1 (LRP-1) for amyloid-beta peptide(1-40) in mouse: involvement of an LRP-1-independent pathway. Journal of neurochemistry, 113(5), 1356-63. [PubMed:20367755] [WorldCat] [DOI] - ↑
Cirrito, J.R., Deane, R., Fagan, A.M., Spinner, M.L., Parsadanian, M., Finn, M.B., ..., & Holtzman, D.M. (2005).
P-glycoprotein deficiency at the blood-brain barrier increases amyloid-beta deposition in an Alzheimer disease mouse model. The Journal of clinical investigation, 115(11), 3285-90. [PubMed:16239972] [PMC] [WorldCat] [DOI] - ↑
Xiong, H., Callaghan, D., Jones, A., Bai, J., Rasquinha, I., Smith, C., ..., & Zhang, W. (2009).
ABCG2 is upregulated in Alzheimer's brain with cerebral amyloid angiopathy and may act as a gatekeeper at the blood-brain barrier for Abeta(1-40) peptides. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(17), 5463-75. [PubMed:19403814] [PMC] [WorldCat] [DOI] - ↑
Shibata, M., Yamada, S., Kumar, S.R., Calero, M., Bading, J., Frangione, B., ..., & Zlokovic, B.V. (2000).
Clearance of Alzheimer's amyloid-ss(1-40) peptide from brain by LDL receptor-related protein-1 at the blood-brain barrier. The Journal of clinical investigation, 106(12), 1489-99. [PubMed:11120756] [PMC] [WorldCat] [DOI] - ↑ 寺崎哲也、大槻純男、上家潤一
3. 薬効組織(脳、腫瘍)への輸送特性の評価 1) 血液脳関門の透過性の評価 7:170-177 遺伝子医学MOOK 最新創薬学2007,
メディカル ドゥ:2007 - ↑
Smith, Q.R., & Allen, D.D. (2003).
In situ brain perfusion technique. Methods in molecular medicine, 89, 209-18. [PubMed:12958422] [WorldCat] [DOI] - ↑
Terasaki, T., & Pardridge, W.M. (1988).
Restricted transport of 3'-azido-3'-deoxythymidine and dideoxynucleosides through the blood-brain barrier. The Journal of infectious diseases, 158(3), 630-2. [PubMed:2842410] [WorldCat] [DOI] - ↑
Kakee, A., Terasaki, T., & Sugiyama, Y. (1996).
Brain efflux index as a novel method of analyzing efflux transport at the blood-brain barrier. The Journal of pharmacology and experimental therapeutics, 277(3), 1550-9. [PubMed:8667222] [WorldCat] - ↑
Terasaki, T., Deguchi, Y., Sato, H., Hirai, K., & Tsuji, A. (1991).
In vivo transport of a dynorphin-like analgesic peptide, E-2078, through the blood-brain barrier: an application of brain microdialysis. Pharmaceutical research, 8(7), 815-20. [PubMed:1681528] [WorldCat] [DOI] - ↑
Shimura, T., Tabata, S., Ohnishi, T., Terasaki, T., & Tsuji, A. (1991).
Transport mechanism of a new behaviorally highly potent adrenocorticotropic hormone (ACTH) analog, ebiratide, through the blood-brain barrier. The Journal of pharmacology and experimental therapeutics, 258(2), 459-65. [PubMed:1650827] [WorldCat] - ↑
Ohtsuki, S., Yamaguchi, H., Asashima, T., & Terasaki, T. (2007).
Establishing a method to isolate rat brain capillary endothelial cells by magnetic cell sorting and dominant mRNA expression of multidrug resistance-associated protein 1 and 4 in highly purified rat brain capillary endothelial cells. Pharmaceutical research, 24(4), 688-94. [PubMed:17318419] [WorldCat] [DOI] - ↑
Audus, K.L., & Borchardt, R.T. (1986).
Characteristics of the large neutral amino acid transport system of bovine brain microvessel endothelial cell monolayers. Journal of neurochemistry, 47(2), 484-8. [PubMed:3734791] [WorldCat] [DOI] - ↑
Hosoya, K., Tetsuka, K., Nagase, K., Tomi, M., Saeki, S., Ohtsuki, S., ..., & Terasaki, T. (2000).
Conditionally immortalized brain capillary endothelial cell lines established from a transgenic mouse harboring temperature-sensitive simian virus 40 large T-antigen gene. AAPS pharmSci, 2(3), E27. [PubMed:11741243] [PMC] [WorldCat] [DOI] - ↑
Hosoya, K.I., Takashima, T., Tetsuka, K., Nagura, T., Ohtsuki, S., Takanaga, H., ..., & Terasaki, T. (2000).
mRna expression and transport characterization of conditionally immortalized rat brain capillary endothelial cell lines; a new in vitro BBB model for drug targeting. Journal of drug targeting, 8(6), 357-70. [PubMed:11328662] [WorldCat] [DOI] - ↑
Terasaki, T., Ohtsuki, S., Hori, S., Takanaga, H., Nakashima, E., & Hosoya, K. (2003).
New approaches to in vitro models of blood-brain barrier drug transport. Drug discovery today, 8(20), 944-54. [PubMed:14554158] [WorldCat] [DOI] - ↑
Lippmann, E.S., Azarin, S.M., Kay, J.E., Nessler, R.A., Wilson, H.K., Al-Ahmad, A., ..., & Shusta, E.V. (2012).
Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature biotechnology, 30(8), 783-91. [PubMed:22729031] [PMC] [WorldCat] [DOI] - ↑
Yamazaki, M., Neway, W.E., Ohe, T., Chen, I., Rowe, J.F., Hochman, J.H., ..., & Lin, J.H. (2001).
In vitro substrate identification studies for p-glycoprotein-mediated transport: species difference and predictability of in vivo results. The Journal of pharmacology and experimental therapeutics, 296(3), 723-35. [PubMed:11181899] [WorldCat] - ↑
Syvänen, S., Lindhe, O., Palner, M., Kornum, B.R., Rahman, O., Långström, B., ..., & Hammarlund-Udenaes, M. (2009).
Species differences in blood-brain barrier transport of three positron emission tomography radioligands with emphasis on P-glycoprotein transport. Drug metabolism and disposition: the biological fate of chemicals, 37(3), 635-43. [PubMed:19047468] [WorldCat] [DOI] - ↑
Gruetter, R., Novotny, E.J., Boulware, S.D., Rothman, D.L., & Shulman, R.G. (1996).
1H NMR studies of glucose transport in the human brain. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 16(3), 427-38. [PubMed:8621747] [WorldCat] [DOI] - ↑
Pardridge, W.M. (1983).
Brain metabolism: a perspective from the blood-brain barrier. Physiological reviews, 63(4), 1481-535. [PubMed:6361813] [WorldCat] [DOI] - ↑
Hawkins, R.A., Huang, S.C., Barrio, J.R., Keen, R.E., Feng, D., Mazziotta, J.C., & Phelps, M.E. (1989).
Estimation of local cerebral protein synthesis rates with L-[1-11C]leucine and PET: methods, model, and results in animals and humans. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 9(4), 446-60. [PubMed:2786885] [WorldCat] [DOI] - ↑
Pardridge, W.M., & Oldendorf, W.H. (1977).
Transport of metabolic substrates through the blood-brain barrier. Journal of neurochemistry, 28(1), 5-12. [PubMed:833603] [WorldCat] [DOI] - ↑
Pratt, O.E. (1976).
The transport of metabolizable substances into the living brain. Advances in experimental medicine and biology, 69, 55-75. [PubMed:7929] [WorldCat] [DOI]