「機能獲得実験」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (他の1人の利用者による、間の14版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0204069 平林 敬浩]、[http://researchmap.jp/read0076409 八木 健]</font><br> | <font size="+1">[http://researchmap.jp/read0204069 平林 敬浩]、[http://researchmap.jp/read0076409 八木 健]</font><br> | ||
''大阪大学 大学院生命機能研究科''<br> | ''大阪大学 大学院生命機能研究科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2013年2月12日 原稿完成日:2013年月日<br> | ||
担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 23行目: | 23行目: | ||
=== 導入する遺伝子 === | === 導入する遺伝子 === | ||
[[Image:機能獲得実験.jpg|thumb|300px|''' | [[Image:機能獲得実験.jpg|thumb|300px|'''図.発現量を増加させる外来遺伝子の構造''']] | ||
この外来遺伝子は遺伝子発現制御するプロモーター配列の下流に目的の遺伝子、さらに[[wikipedia:ja:polyA付加配列|polyA付加配列]] | この外来遺伝子は遺伝子発現制御するプロモーター配列の下流に目的の遺伝子、さらに[[wikipedia:ja:polyA付加配列|polyA付加配列]]という構造をもつものが一般的である(図)。この外来遺伝子を構築する際、どのプロモーター配列を選択するかにより目的遺伝子の発現部位、発現時期、発現量が決まる。 | ||
=== 導入方法 === | === 導入方法 === | ||
| 48行目: | 48行目: | ||
目的のタンパク質が局在の変化がその機能が増強する場合、そのタンパク質の局在を強制的に変化させる変異を導入することで機能を増強することが出来る。リン酸化酵素[[AKT]]は細胞膜へ移行することで活性化すると考えられているが[[ミリストイル化]]配列を付加したAKTは恒常的に活性化する<ref><pubmed> 10467260 </pubmed></ref> | 目的のタンパク質が局在の変化がその機能が増強する場合、そのタンパク質の局在を強制的に変化させる変異を導入することで機能を増強することが出来る。リン酸化酵素[[AKT]]は細胞膜へ移行することで活性化すると考えられているが[[ミリストイル化]]配列を付加したAKTは恒常的に活性化する<ref><pubmed> 10467260 </pubmed></ref> | ||
=== 阻害ドメインの欠失 === | ===阻害ドメインの欠失=== | ||
==関連項目== | ==関連項目== | ||
2016年4月6日 (水) 15:56時点における版
平林 敬浩、八木 健
大阪大学 大学院生命機能研究科
DOI:10.14931/bsd.2182 原稿受付日:2013年2月12日 原稿完成日:2013年月日
担当編集委員:上口 裕之(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:gain of function
ある遺伝子の機能を調べる際にその遺伝子の機能や発現量を増強させることで機能を類推する実験手法を機能獲得実験という。
機能獲得実験とは
ある遺伝子の機能を調べる際にその遺伝子の機能・発現量を増強させて得られた表現型から機能解析する実験手法。逆に遺伝子の機能や発現量を減弱させる実験は機能欠失実験と呼ばれる。 また、機能欠失実験によって得られた表現型を機能獲得実験により正常な表現型に回復させる実験を特にrescue実験と呼ぶ
遺伝子導入による発現量の増加
動物個体あるいは細胞に外来遺伝子を導入することで任意の遺伝子
発現量を増加させることができる。外来遺伝子を導入した動物個体はトランスジェニック動物と呼ばれ現在ではあらゆる動物種で作製が可能となっている。
導入する遺伝子
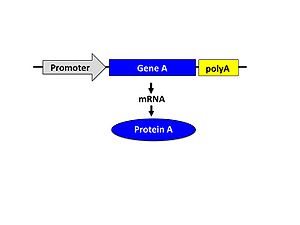
この外来遺伝子は遺伝子発現制御するプロモーター配列の下流に目的の遺伝子、さらにpolyA付加配列という構造をもつものが一般的である(図)。この外来遺伝子を構築する際、どのプロモーター配列を選択するかにより目的遺伝子の発現部位、発現時期、発現量が決まる。
導入方法
現在では遺伝子の導入方法として主に以下の方法が用いられている。
- リン酸カルシウム法
導入する遺伝子 (DNA)とリン酸カルシウムを混和することで形成された不溶性複合体を細胞表面に吸着させ、細胞の食作用などを利用して細胞内に遺伝子を導入する方法。操作が簡便で特殊な装置を必要としない。 - リポフェクション法
正に荷電している脂質からなる脂質二重膜小胞(リポソーム)と負に荷電している遺伝子は電気的に複合体を形成する。これらを負に荷電している細胞膜と融合、あるいは細胞の食作用などにより細胞に取り込まれる。リン酸カルシウム法と同様に特殊な装置を必要とぜず、また各社から試薬が市販されているため培養細胞では広く用いられている。 - エレクトロポレーション法
高電圧パルスを細胞に与えることで細胞膜構造に小孔をあけ、遺伝子を導入する方法。遺伝子導入効率は比較的高い反面、細胞生存率は低い。 - パーティクルガン法
金などの高比重かつ化学的に安定な金属粒子を導入したい遺伝子でコーティングしたものを高圧ガスで射出し細胞内に物理的に導入する方法。ジーンガンとも呼ばれる。 - ウイルスベクター法
目的の遺伝子を組み込んだウイルスを細胞に感染させることで遺伝子を導入する方法。現在では主に、アデノウイルスベクター、アデノ随伴ウイルスベクターの他、感染した細胞内で逆転写されて細胞ゲノムにに組み込まれるレトロウイルスベクター、レンチウイルスベクターなどが使用されている。 - マイクロインジェクション法
微細なガラス管をを介し細胞に直接遺伝子を導入する方法。個々の細胞に対して操作が必要であるため対象とする細胞数に制限が生じるが、導入効率が高いためトランスジェニック動物作製時においては本法で受精卵に遺伝子を導入するのが一般的である。
機能の増強
アミノ酸置換による疑似リン酸化
目的のタンパク質が持つアミノ酸がリン酸化されることでその機能が増強する場合、そのアミノ酸をグルタミン酸, またはアスパラギン酸に置換した変異体を発現することで恒常的なリン酸化状態を擬似的に再現できる場合がある。これはリン酸化アミノ酸が水溶液中では負電荷をもつが、グルタミン酸、アスパラギン酸などの酸性アミノ酸も負電荷をもつためである。例えば、リン酸化酵素MAP kinase kinase (MKK)はSer218およびSer222は上流のRaf1/MAP KKKによりリン酸化されることで活性化するが、これらのセリン残基をグルタミン酸に置換したMAPKK変異体は恒常的に活性を持つ[1]。
局在の変化
目的のタンパク質が局在の変化がその機能が増強する場合、そのタンパク質の局在を強制的に変化させる変異を導入することで機能を増強することが出来る。リン酸化酵素AKTは細胞膜へ移行することで活性化すると考えられているがミリストイル化配列を付加したAKTは恒常的に活性化する[2]
阻害ドメインの欠失
関連項目
参考文献
- ↑
Brunet, A., Pagès, G., & Pouysségur, J. (1994).
Constitutively active mutants of MAP kinase kinase (MEK1) induce growth factor-relaxation and oncogenicity when expressed in fibroblasts. Oncogene, 9(11), 3379-87. [PubMed:7936666] [WorldCat] - ↑
Goswami, R., Kilkus, J., Dawson, S.A., & Dawson, G. (1999).
Overexpression of Akt (protein kinase B) confers protection against apoptosis and prevents formation of ceramide in response to pro-apoptotic stimuli. Journal of neuroscience research, 57(6), 884-93. [PubMed:10467260] [WorldCat]