「性腺刺激ホルモン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の2版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0007804 岡良隆]</font><br> | <font size="+1">[http://researchmap.jp/read0007804 岡良隆]</font><br> | ||
''東京大学大学院理学系研究科生物科学専攻''<br> | ''東京大学大学院理学系研究科生物科学専攻''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年6月9日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | 担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | ||
</div> | </div> | ||
| 13行目: | 13行目: | ||
==ファミリーと構造== | ==ファミリーと構造== | ||
[[image:性腺刺激ホルモン1.png|thumb|350px|'''図1.視床下部GnRHニューロンと脳下垂体ゴナドトロフ''' | [[image:性腺刺激ホルモン1.png|thumb|350px|'''図1.視床下部GnRHニューロンと脳下垂体ゴナドトロフ''']] | ||
性腺刺激ホルモンは、一般に[[黄体形成ホルモン]](luteinizing hormone: LH)と[[濾胞刺激ホルモン]](または[[卵胞刺激ホルモン]]、[[follicle stimulating hormone]]: [[FSH]])の2種類よりなることが知られている。両者共に、αサブユニットとβサブユニットの2つのサブユニットが[[wj:非共有結合|非共有結合]]によりヘテロ2量体を形成することにより作られており、糖を20%前後含む[[wj:糖タンパク質|糖タンパク質]]である。 | 性腺刺激ホルモンは、一般に[[黄体形成ホルモン]](luteinizing hormone: LH)と[[濾胞刺激ホルモン]](または[[卵胞刺激ホルモン]]、[[follicle stimulating hormone]]: [[FSH]])の2種類よりなることが知られている。両者共に、αサブユニットとβサブユニットの2つのサブユニットが[[wj:非共有結合|非共有結合]]によりヘテロ2量体を形成することにより作られており、糖を20%前後含む[[wj:糖タンパク質|糖タンパク質]]である。 | ||
| 28行目: | 28行目: | ||
LHとFSHに対する受容体はいずれも[[Gタンパク質共役型受容体]]であり、典型的な7回膜貫通型受容体タンパク質からなる。さらに、上述したように、LH、FSHと共通した性質をもつ糖タンパク質ホルモンであるTSHの受容体と合わせて、これら糖タンパク質ホルモンの受容体は、共通して、大きな細胞外領域をもつことも知られているが、3種の異なるリガンドを認識する細胞外領域についての研究も進んでいる。 | LHとFSHに対する受容体はいずれも[[Gタンパク質共役型受容体]]であり、典型的な7回膜貫通型受容体タンパク質からなる。さらに、上述したように、LH、FSHと共通した性質をもつ糖タンパク質ホルモンであるTSHの受容体と合わせて、これら糖タンパク質ホルモンの受容体は、共通して、大きな細胞外領域をもつことも知られているが、3種の異なるリガンドを認識する細胞外領域についての研究も進んでいる。 | ||
一方、いずれの受容体も[[ | 一方、いずれの受容体も[[三量体Gタンパク質|G<sub>s</sub>]]よりなる[[三量体Gタンパク質]]に共役していて、ホルモンが受容体に結合することによりG<sub>s</sub>の活性化が[[アデニル酸シクラーゼ]]の活性化を引き起こし、[[wj:細胞質|細胞質]]中の[[サイクリックAMP]](cAMP)濃度が上昇することが知られている。さらには、この下流で[[cAMP依存性キナーゼ]]([[PKA]])の活性化を伴うことも知られている。 | ||
===生殖腺に対する作用=== | ===生殖腺に対する作用=== | ||
上述したように、LHとFSHは、それぞれ、主に[[ヒト]]における作用という観点から「黄体形成ホルモン」「濾胞刺激ホルモン」と呼ばれているが、LHは主に[[精巣]]では[[wj:間質ライディヒ細胞|間質ライディヒ細胞]]の[[アンドロゲン]][[分泌]]を刺激し、[[卵巣]]では[[wj:排卵|排卵]]を促すはたらきをもち、FSHは精巣では精子形成に、卵巣では主に | 上述したように、LHとFSHは、それぞれ、主に[[ヒト]]における作用という観点から「黄体形成ホルモン」「濾胞刺激ホルモン」と呼ばれているが、LHは主に[[精巣]]では[[wj:間質ライディヒ細胞|間質ライディヒ細胞]]の[[アンドロゲン]][[分泌]]を刺激し、[[卵巣]]では[[wj:排卵|排卵]]を促すはたらきをもち、FSHは精巣では精子形成に、卵巣では主に[wj:ろ胞|ろ胞]]の発達に対して作用があると考えられてきた。 つまり、これらの生殖腺組織にはLH受容体やFSH受容体がそれぞれの組織の特異的な細胞に発現しているのだが、それぞれの細胞における受容体活性化以降の下流の細胞内情報伝達系のシグナル経路については、様々な研究がなされている。 | ||
一方で、cAMP-PKA系の活性化以降のシグナル経路や、これとは異なるシグナル経路の存在、さらには様々なシグナル経路のクロストーク、細胞に特異的な生理作用の発現機構等については未解明の点も多く、今後の研究が待たれる。この辺の事情については既に詳細なレビューがあるので、文献<ref>'''Funzicker-Dunn, M., and Mayo, K.,'''<br>Gonadotropin signaling in the ovary. <br>In: Konobil and Neill’s Physiology of Reproduction, Third Edtion ed. by J.D. Neil<br>2006: pp. 547-592.</ref>を参照していただきたい。 | 一方で、cAMP-PKA系の活性化以降のシグナル経路や、これとは異なるシグナル経路の存在、さらには様々なシグナル経路のクロストーク、細胞に特異的な生理作用の発現機構等については未解明の点も多く、今後の研究が待たれる。この辺の事情については既に詳細なレビューがあるので、文献<ref>'''Funzicker-Dunn, M., and Mayo, K.,'''<br>Gonadotropin signaling in the ovary. <br>In: Konobil and Neill’s Physiology of Reproduction, Third Edtion ed. by J.D. Neil<br>2006: pp. 547-592.</ref>を参照していただきたい。 | ||
| 52行目: | 52行目: | ||
向下垂体ホルモンとしてのGnRHペプチドを産生する視床下部GnRHニューロンは、[[ラット]]・マウスをはじめとするほ乳類の実験動物では、細胞体が10ミクロン前後しかない上に、数少ないニューロンが散在的に[[視索前野]]に分布しているため、ごく最近まで、その神経生理学的な記録や解析はほとんどされていなかった<ref name=ref7 />。ところが、1999年以降立て続けにGnRHニューロンが[[GFP]]標識された[[トランスジェニックマウス]]やラットが作成され、脳[[スライス標本|スライス]]を用いて単一GnRHニューロンの神経生理学的な解析が可能になった<ref name=ref8><pubmed>10066257</pubmed></ref> <ref name=ref9><pubmed>10614664 </pubmed></ref> <ref name=ref10><pubmed>12960038</pubmed></ref> <ref name=ref11><pubmed> 14617578</pubmed></ref>。しかしながら、[[トランスジェニックマウス]]や[[ラット]]の脳を用いてGnRHニューロンの電気生理学的解析も、脳を薄く切った脳スライスを用いた実験しかできないため、実際に脳内で単一のGnRHニューロンの電気活動が排卵周期に一致して変動するのかどうかについては不明である。 | 向下垂体ホルモンとしてのGnRHペプチドを産生する視床下部GnRHニューロンは、[[ラット]]・マウスをはじめとするほ乳類の実験動物では、細胞体が10ミクロン前後しかない上に、数少ないニューロンが散在的に[[視索前野]]に分布しているため、ごく最近まで、その神経生理学的な記録や解析はほとんどされていなかった<ref name=ref7 />。ところが、1999年以降立て続けにGnRHニューロンが[[GFP]]標識された[[トランスジェニックマウス]]やラットが作成され、脳[[スライス標本|スライス]]を用いて単一GnRHニューロンの神経生理学的な解析が可能になった<ref name=ref8><pubmed>10066257</pubmed></ref> <ref name=ref9><pubmed>10614664 </pubmed></ref> <ref name=ref10><pubmed>12960038</pubmed></ref> <ref name=ref11><pubmed> 14617578</pubmed></ref>。しかしながら、[[トランスジェニックマウス]]や[[ラット]]の脳を用いてGnRHニューロンの電気生理学的解析も、脳を薄く切った脳スライスを用いた実験しかできないため、実際に脳内で単一のGnRHニューロンの電気活動が排卵周期に一致して変動するのかどうかについては不明である。 | ||
これに対して、小型で透明性の高い脳をもち、長日条件を[[模倣]]した光周期条件で飼育すると毎日規則的に産卵をするメダカを用いた研究が最近可能になった<ref name=ref12><pubmed>16293668</pubmed></ref> <ref name=ref13><pubmed>22544888</pubmed></ref> | これに対して、小型で透明性の高い脳をもち、長日条件を[[模倣]]した光周期条件で飼育すると毎日規則的に産卵をするメダカを用いた研究が最近可能になった<ref name=ref12><pubmed>16293668</pubmed></ref> <ref name=ref13><pubmed>22544888</pubmed></ref>。メダカなどの非ほ乳類ではGnRHニューロンの細胞体は視索前野(POA)とよばれる脳部位に存在し、真骨魚類では直接下垂体前葉に投射軸索投射する(図1右図)。したがって、GnRHニューロンをGFP標識すると、メダカでは細胞体から[[樹状突起]]、[[軸索]]、そして脳下垂体内の[[軸索終末]]までの全てを、生きたまま取りだした丸ごとの脳(全脳''in vitro''標本)を[[蛍光顕微鏡]]観察することで見ることができる(図2)。 | ||
この脳標本では、GnRHニューロンに対して[[シナプス]]入力する神経回路も生きたままの状態で保って、電気生理学的解析を行うことが可能である。こうした特長を活かして、Karigoらは、1日1回の排卵周期に対応するようなGnRHニューロンの自発的な活動電位発火の頻度の周期的変動を見出した<ref name=ref13 />。ほ乳類などではこのような実験は物理的に行い難いのだが、おそらく、個々のGnRHニューロンの活動は、動物の排卵周期に応じたような周期的な変動を示していると想像される。 | この脳標本では、GnRHニューロンに対して[[シナプス]]入力する神経回路も生きたままの状態で保って、電気生理学的解析を行うことが可能である。こうした特長を活かして、Karigoらは、1日1回の排卵周期に対応するようなGnRHニューロンの自発的な活動電位発火の頻度の周期的変動を見出した<ref name=ref13 />。ほ乳類などではこのような実験は物理的に行い難いのだが、おそらく、個々のGnRHニューロンの活動は、動物の排卵周期に応じたような周期的な変動を示していると想像される。 | ||
2017年1月8日 (日) 19:25時点における版
岡良隆
東京大学大学院理学系研究科生物科学専攻
DOI:10.14931/bsd.7164 原稿受付日:2016年6月9日 原稿完成日:2016年月日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名:gonadotropic hormones (gonadotropins), gonadotrophic hormones (Gonadotrophins); 英国式ではhを入れ、米国式では入れない 独:Gonadotropine 仏:gonadotrop(h)ines
繁殖期を迎えた脊椎動物の性腺(生殖腺)は、日長や温度などに依存して発達し、雌雄それぞれの配偶子(卵と精子)を形成すると共に、雌は卵巣から雄は精巣から、それぞれの性ホルモン(雌は主にエストロジェン、雄は主にアンドロジェン)を分泌するようになる。この時、性腺の発達は、脳の情報処理システムが外界の環境の情報を適切に処理し、それを主に視床下部ニューロンに伝え、さらにその情報を脳下垂体という脳と内分泌系のインターフェースに伝えて、脳下垂体ホルモンを放出させ、末梢の生殖腺を刺激することにより始まる。この時に脳下垂体から放出され、生殖腺を刺激するタンパク質ホルモンを性腺刺激ホルモン(=医学・農学用語;動物学用語では、生殖腺刺激ホルモン)とよぶ。
ファミリーと構造
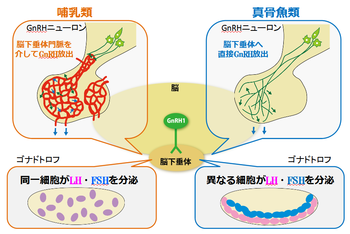
性腺刺激ホルモンは、一般に黄体形成ホルモン(luteinizing hormone: LH)と濾胞刺激ホルモン(または卵胞刺激ホルモン、follicle stimulating hormone: FSH)の2種類よりなることが知られている。両者共に、αサブユニットとβサブユニットの2つのサブユニットが非共有結合によりヘテロ2量体を形成することにより作られており、糖を20%前後含む糖タンパク質である。
2種の性腺刺激ホルモンの他にも、甲状腺刺激ホルモン(thyroid stimulating hormone: TSH)がある。興味あることに、これら3種類の糖タンパク質ホルモンのαサブユニットは、実は共通したタンパク質であり、それぞれのホルモンの特性(受容体との結合特性や生理活性)は、2量体を形成するβサブユニットにより決定されている。このことは、ヤツメウナギなどの円口類以外のいわゆる顎口類においては、報告されているすべての動物が保有しており、脊椎動物の生殖を制御するホルモンに共通する基本的な仕組みのひとつである。
発現
性腺刺激ホルモンは脳下垂体に発現する。歴史的には、性腺刺激ホルモン産生細胞(ゴナドトロフ)は、色素による脳下垂体細胞の分類からは、塩基性色素に好染する好塩基性細胞として分類されていた。
興味深いことに、ほ乳類などではLHとFSHを産生する細胞が同一であるが、真骨魚類などではLH産生細胞とFSH産生細胞が別の細胞になっていて、脳下垂体中の分布も明瞭に異なっている。また、真骨魚類では、性腺刺激ホルモン産生細胞以外の脳下垂体ホルモン産生細胞も比較的整然と分布域がコンパートメント化されている。さらに、性腺刺激ホルモン放出ホルモン (GnRH)ニューロン(後述)が脳下垂体に直接軸索投射していて、脳下垂体と脳の機能的関係を保ったまま全脳 in vitro標本を用いた解析も可能なため、脳下垂体細胞の脳による制御の研究を行うには大変適している(図1)。
機能
受容体
LHとFSHに対する受容体はいずれもGタンパク質共役型受容体であり、典型的な7回膜貫通型受容体タンパク質からなる。さらに、上述したように、LH、FSHと共通した性質をもつ糖タンパク質ホルモンであるTSHの受容体と合わせて、これら糖タンパク質ホルモンの受容体は、共通して、大きな細胞外領域をもつことも知られているが、3種の異なるリガンドを認識する細胞外領域についての研究も進んでいる。
一方、いずれの受容体もGsよりなる三量体Gタンパク質に共役していて、ホルモンが受容体に結合することによりGsの活性化がアデニル酸シクラーゼの活性化を引き起こし、細胞質中のサイクリックAMP(cAMP)濃度が上昇することが知られている。さらには、この下流でcAMP依存性キナーゼ(PKA)の活性化を伴うことも知られている。
生殖腺に対する作用
上述したように、LHとFSHは、それぞれ、主にヒトにおける作用という観点から「黄体形成ホルモン」「濾胞刺激ホルモン」と呼ばれているが、LHは主に精巣では間質ライディヒ細胞のアンドロゲン分泌を刺激し、卵巣では排卵を促すはたらきをもち、FSHは精巣では精子形成に、卵巣では主に[wj:ろ胞|ろ胞]]の発達に対して作用があると考えられてきた。 つまり、これらの生殖腺組織にはLH受容体やFSH受容体がそれぞれの組織の特異的な細胞に発現しているのだが、それぞれの細胞における受容体活性化以降の下流の細胞内情報伝達系のシグナル経路については、様々な研究がなされている。
一方で、cAMP-PKA系の活性化以降のシグナル経路や、これとは異なるシグナル経路の存在、さらには様々なシグナル経路のクロストーク、細胞に特異的な生理作用の発現機構等については未解明の点も多く、今後の研究が待たれる。この辺の事情については既に詳細なレビューがあるので、文献[1]を参照していただきたい。
さらに、ほ乳類においては、LHの血中レベルが数10分ないし数時間の周期でパルス状に変動する、いわゆるパルス状分泌という現象が知られており、このパルス頻度が性腺の活動を制御していると考えられている。一方で、雌の排卵前の特定の時期には一過性のLHの大量放出(サージ状放出とよばれる)が起き、これが排卵の引き金になることが多くの動物種で知られている。このように、LHはほ乳類においては、パルスとサージという異なる分泌パターンを介して、性腺の活動と排卵の両者を調節しているらしい。最近の、マウスを用いたLHやFSHの遺伝子ノックアウト動物の解析から、LHやFSHの機能に関しては、さらに理解が進んできている[2] [3]。
しかしながら、ほ乳類以外の脊椎動物においては、こうした解析がこれまでほとんど行われてこず、LHやFSHの生理作用や調節機構がほ乳類と共通しているかどうかについては不明であった。ごく最近になって、TALENやCRISPRなどの、いわゆるゲノム編集技術の目覚ましい発展により、ゼブラフィッシュ[4]やメダカ[5]などの小型動物を使って遺伝子ノックアウト動物の作成が比較的容易にできるようになり、ほ乳類以外の脊椎動物におけるLHやFSHの機能も詳細に解析できるようになりつつある。それらの結果からは、おおまかにいって、雌ではFSHは卵胞発育過程を促し、LHは排卵の引き金を引く、という機能の分業が行われているらしく、真骨魚類とは進化の過程が大きく異なるほ乳類では、LHのパルス状分泌という現象が見られるようになったために、後期卵胞発育の過程が、LHによって、環境要因による微妙な調節を受けられるようになったのではないかと考えられる[3]。
中枢神経系による性腺刺激ホルモンの調節
[6]を改変
生殖をはじめとする体の自律的な機能が脳下垂体から分泌されるホルモンによって調節され、その脳下垂体ホルモンが、脳の視床下部に存在する因子によって制御されているという考えは、1970年代までに既に生まれていたようである。そのような背景の中、1977年に、ギルマンらの研究グループとシャリーらの研究グループが熾烈な戦いの後に、両者ほぼ同時期に、視床下部に存在する、そのような機能をもつ因子を発見し、ノーベル医学生理学賞を受賞した。
このような因子のうち生殖の中枢制御を担うものは10個のアミノ酸からなるペプチドホルモンであり、性腺刺激ホルモン放出ホルモンとよばれた(特に、LH放出を促進する機能に注目して、当時はLHRHとよばれた;RHはreleasing hormone=放出ホルモンの略)。その後、LHRHはFSHの放出も促進するのではないかという実験的な証拠から、GnRH(gonadotropin-releasing hormone)とよばれるようになった。
GnRHは視床下部GnRHニューロンで産生され、脳底の正中隆起とよばれる部位の脳下垂体門脈血中に放出され、脳下垂体前葉に運ばれて性腺刺激ホルモン放出を促進する、いわゆる向下垂体ホルモン(hypophysiotropic hormone)のひとつとしてほ乳類で最初に発見された(図1左図参照)。
なお、このホルモンの発見の後に、1990年代から免疫組織化学およびIn situハイブリダイゼーション法 (ISH)を用いた形態学的な研究がなされ、脊椎動物脳内では、形態的・機能的に異なる3つのGnRH神経系が存在しているという基本的コンセンサスが得られている(「性行動の神経回路」参照)[7] [8] [9]。
向下垂体ホルモンとしてのGnRHペプチドを産生する視床下部GnRHニューロンは、ラット・マウスをはじめとするほ乳類の実験動物では、細胞体が10ミクロン前後しかない上に、数少ないニューロンが散在的に視索前野に分布しているため、ごく最近まで、その神経生理学的な記録や解析はほとんどされていなかった[9]。ところが、1999年以降立て続けにGnRHニューロンがGFP標識されたトランスジェニックマウスやラットが作成され、脳スライスを用いて単一GnRHニューロンの神経生理学的な解析が可能になった[10] [11] [12] [13]。しかしながら、トランスジェニックマウスやラットの脳を用いてGnRHニューロンの電気生理学的解析も、脳を薄く切った脳スライスを用いた実験しかできないため、実際に脳内で単一のGnRHニューロンの電気活動が排卵周期に一致して変動するのかどうかについては不明である。
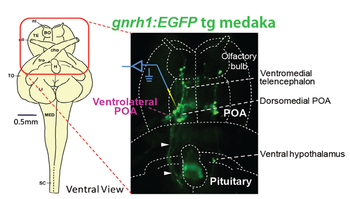
これに対して、小型で透明性の高い脳をもち、長日条件を模倣した光周期条件で飼育すると毎日規則的に産卵をするメダカを用いた研究が最近可能になった[6] [14]。メダカなどの非ほ乳類ではGnRHニューロンの細胞体は視索前野(POA)とよばれる脳部位に存在し、真骨魚類では直接下垂体前葉に投射軸索投射する(図1右図)。したがって、GnRHニューロンをGFP標識すると、メダカでは細胞体から樹状突起、軸索、そして脳下垂体内の軸索終末までの全てを、生きたまま取りだした丸ごとの脳(全脳in vitro標本)を蛍光顕微鏡観察することで見ることができる(図2)。
この脳標本では、GnRHニューロンに対してシナプス入力する神経回路も生きたままの状態で保って、電気生理学的解析を行うことが可能である。こうした特長を活かして、Karigoらは、1日1回の排卵周期に対応するようなGnRHニューロンの自発的な活動電位発火の頻度の周期的変動を見出した[14]。ほ乳類などではこのような実験は物理的に行い難いのだが、おそらく、個々のGnRHニューロンの活動は、動物の排卵周期に応じたような周期的な変動を示していると想像される。
GnRHニューロンの周期的な活動の変動がどのような脳内機構により生じるのかについては現在まだ不明だが、メダカの全脳in vitro標本を用いて各種の遺伝学的ツールと生理学的解析結果を、マウス・ラットなどにおける解析結果と合わせて考慮することにより、今後、性腺刺激ホルモン分泌の中枢制御に関する、脊椎動物を通じて共通したしくみの理解が深まるものと期待される。
関連項目
参考文献
- ↑ Funzicker-Dunn, M., and Mayo, K.,
Gonadotropin signaling in the ovary.
In: Konobil and Neill’s Physiology of Reproduction, Third Edtion ed. by J.D. Neil
2006: pp. 547-592. - ↑
Ma, X., Dong, Y., Matzuk, M.M., & Kumar, T.R. (2004).
Targeted disruption of luteinizing hormone beta-subunit leads to hypogonadism, defects in gonadal steroidogenesis, and infertility. Proceedings of the National Academy of Sciences of the United States of America, 101(49), 17294-9. [PubMed:15569941] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Kumar, T.R., Wang, Y., Lu, N., & Matzuk, M.M. (1997).
Follicle stimulating hormone is required for ovarian follicle maturation but not male fertility. Nature genetics, 15(2), 201-4. [PubMed:9020850] [WorldCat] [DOI] - ↑
Zhang, Z., Lau, S.W., Zhang, L., & Ge, W. (2015).
Disruption of Zebrafish Follicle-Stimulating Hormone Receptor (fshr) But Not Luteinizing Hormone Receptor (lhcgr) Gene by TALEN Leads to Failed Follicle Activation in Females Followed by Sexual Reversal to Males. Endocrinology, 156(10), 3747-62. [PubMed:25993524] [WorldCat] [DOI] - ↑
Takahashi, A., Kanda, S., Abe, T., & Oka, Y. (2016).
Evolution of the Hypothalamic-Pituitary-Gonadal Axis Regulation in Vertebrates Revealed by Knockout Medaka. Endocrinology, 157(10), 3994-4002. [PubMed:27560548] [WorldCat] [DOI] - ↑ 6.0 6.1
Okubo, K., Sakai, F., Lau, E.L., Yoshizaki, G., Takeuchi, Y., Naruse, K., ..., & Nagahama, Y. (2006).
Forebrain gonadotropin-releasing hormone neuronal development: insights from transgenic medaka and the relevance to X-linked Kallmann syndrome. Endocrinology, 147(3), 1076-84. [PubMed:16293668] [WorldCat] [DOI] - ↑ 岡良隆
環境に適応した行動を発言させる脊椎動物神経系・内分泌系のしくみ
in 行動とコミュニケーション, 岡・蟻川, Editors.
シリーズ21世紀の動物科学: 東京. p. 197-226. 1998 - ↑
Yamamoto, N., Oka, Y., Amano, M., Aida, K., Hasegawa, Y., & Kawashima, S. (1995).
Multiple gonadotropin-releasing hormone (GnRH)-immunoreactive systems in the brain of the dwarf gourami, Colisa lalia: immunohistochemistry and radioimmunoassay. The Journal of comparative neurology, 355(3), 354-68. [PubMed:7636018] [WorldCat] [DOI] - ↑ 9.0 9.1 T. Karigo, and Y. Oka
Frontiers in Endocrinology “Biology of Gonadotropin-Releasing Hormone Neurons”
4, 177. 2013 (Article 177, 1-10) - ↑
Spergel, D.J., Krüth, U., Hanley, D.F., Sprengel, R., & Seeburg, P.H. (1999).
GABA- and glutamate-activated channels in green fluorescent protein-tagged gonadotropin-releasing hormone neurons in transgenic mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(6), 2037-50. [PubMed:10066257] [PMC] [WorldCat] - ↑
Suter, K.J., Song, W.J., Sampson, T.L., Wuarin, J.P., Saunders, J.T., Dudek, F.E., & Moenter, S.M. (2000).
Genetic targeting of green fluorescent protein to gonadotropin-releasing hormone neurons: characterization of whole-cell electrophysiological properties and morphology. Endocrinology, 141(1), 412-9. [PubMed:10614664] [WorldCat] [DOI] - ↑
Kato, M., Ui-Tei, K., Watanabe, M., & Sakuma, Y. (2003).
Characterization of voltage-gated calcium currents in gonadotropin-releasing hormone neurons tagged with green fluorescent protein in rats. Endocrinology, 144(11), 5118-25. [PubMed:12960038] [WorldCat] [DOI] - ↑
Han, S.K., Todman, M.G., & Herbison, A.E. (2004).
Endogenous GABA release inhibits the firing of adult gonadotropin-releasing hormone neurons. Endocrinology, 145(2), 495-9. [PubMed:14617578] [WorldCat] [DOI] - ↑ 14.0 14.1
Karigo, T., Kanda, S., Takahashi, A., Abe, H., Okubo, K., & Oka, Y. (2012).
Time-of-day-dependent changes in GnRH1 neuronal activities and gonadotropin mRNA expression in a daily spawning fish, medaka. Endocrinology, 153(7), 3394-404. [PubMed:22544888] [WorldCat] [DOI]