「SYNGAP1関連知的障害」の版間の差分
細編集の要約なし |
細 →疫学 |
||
| (同じ利用者による、間の1版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">荒木 陽一、Richard L. Huganir</font><br> | <font size="+1">荒木 陽一、Richard L. Huganir</font><br> | ||
''Johns Hopkins University School of Medicine''<br> | ''Johns Hopkins University School of Medicine''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2019年10月8日 原稿完成日:2019年10月XX日<br> | ||
担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](独立行政法人理化学研究所 脳神経科学研究センター)<br> | 担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](独立行政法人理化学研究所 脳神経科学研究センター)<br> | ||
</div> | </div> | ||
| 14行目: | 14行目: | ||
==イントロダクション== | ==イントロダクション== | ||
[[ファイル:Syngap Fig3.png|サムネイル|'''図. SynGAPの発達障害との関連'''<br>知的障害、自閉症などの発達障害において、SYNGAP1の変異が高頻度に見出されている。遺伝子の構造と、見つかった変異の一例を示す。]] | [[ファイル:Syngap Fig3.png|サムネイル|'''図. SynGAPの発達障害との関連'''<br>知的障害、自閉症などの発達障害において、SYNGAP1の変異が高頻度に見出されている。遺伝子の構造と、見つかった変異の一例を示す。]] | ||
知的障害のうち、6番染色体短腕上の遺伝子SYNGAP1の変異によるものを、特にSYNGAP1関連知的障害(知的障害5型、MRD5)として分類している([https://www.omim.org/entry/612621 OMIM #612621])。2009年にJacques L. Michaudのグループにより初めて報告された<ref name=Hamdan2009><pubmed>19196676</pubmed></ref> 。 | |||
イギリスにおける大規模調査によると、全発達障害症例のうち約0.75%程度にSYNGAP1の変異が認められる。この頻度は、ARID1B、[[SCN2A]]、ANKRD11に次ぎ全遺伝子中4番目に多い<ref name=UK-DDD-study2015><pubmed>25533962</pubmed></ref> 。浸透度は100%で、病的変異(ナンセンス変異、ミスセンス変異、スプライス部位変異)を有するSYNGAP1を1コピー持った個人は必ず発症する('''図''')。 | |||
==症状== | ==症状== | ||
発達の遅れと知的障害(中程度から高度)(100%) | 発達の遅れと知的障害(中程度から高度)(100%)に加え、てんかん(発作起始は全般性で、頻度の高い順にミオクロニー発作、非定型欠神発作、強直性間代発作等)(84%)、斜視(約60%)、自閉症(約50%)を併発する。男女比はほぼ同数、てんかんの発症年齢 平均3.5歳、確定診断時の年齢 平均5.5歳と報告されている<ref name=Holder2019><pubmed>30789692</pubmed></ref><ref name=Vlaskamp2019><pubmed>30541864</pubmed></ref> 。 | ||
MRD5で併発するてんかんは、特徴的(発作起始は全般性で、頻度の高い順にミオクロニー発作、非定型欠神発作、強直性間代発作等)で、下記の診断が付加されることがある <ref name=Carvill2013><pubmed>23708187</pubmed></ref><ref name=Jimenez-Gomez2019><pubmed>31395010</pubmed></ref><ref name=Vlaskamp2019><pubmed>30541864</pubmed></ref> 。 | |||
* | *ミオクロニー脱力発作を伴うてんかん(Doose症候群; [http://www.nanbyou.or.jp/entry/4418 指定難病143]) | ||
* | *ドラべ症候群([http://www.nanbyou.or.jp/entry/4744 指定難病140]) | ||
低筋力であり、座位獲得は平均12-13か月齢、歩行開始は平均26か月齢である。言語は全般的に遅れる。初めての発語は平均38か月齢、1/ | 低筋力であり、座位獲得は平均12-13か月齢、歩行開始は平均26か月齢である。言語は全般的に遅れる。初めての発語は平均38か月齢、1/3は5歳で無発語である。発語できるようになる場合、英語圏では4-5語の文章を話せることもある。その他、衝動性亢進、感覚情報処理変化(痛みへの高い耐性等)などが報告されている<ref name=Jimenez-Gomez2019><pubmed>31395010</pubmed></ref> 。 | ||
予後については、不明な点が多い。ヨーロッパでは31歳でのMRD5生存例が報告されており<ref name=Prchalova2017><pubmed>28576131</pubmed></ref> | 予後については、不明な点が多い。ヨーロッパでは31歳でのMRD5生存例が報告されており<ref name=Prchalova2017><pubmed>28576131</pubmed></ref> 、成人期を過ぎての生存が可能であることを示唆している。エクソーム解析が臨床検査としては未だ一般には用いられておらず、成人期の患者の中に、この疾患を持つ者がどの程度いるのかは不明である。 | ||
==診断== | ==診断== | ||
診断は、発達障害、知的障害を持つ発端者のエクソーム解析または染色体マイクロアレイ(CMA)等により、次のことが発見された時に確定される。 | |||
*SYNGAP1遺伝子の病的変異(1コピー、ヘテロ変異)(頻度 約89%)<ref name=Hamdan2009><pubmed>19196676</pubmed></ref> | *SYNGAP1遺伝子の病的変異(1コピー、ヘテロ変異)(頻度 約89%)<ref name=Hamdan2009><pubmed>19196676</pubmed></ref> | ||
| 37行目: | 37行目: | ||
または | または | ||
*6p21.32領域(SYNGAP1を含む) | *6p21.32領域(SYNGAP1を含む)の微小欠失(頻度 約11%)<ref name=Writzl2013><pubmed>23687080</pubmed></ref> | ||
==遺伝== | ==遺伝== | ||
理論的には、常染色体優性遺伝であるが、これまでのところ多くの症例は、''de novo''(新規に発生した)変異によるものと考えられている<ref name=Hamdan2009><pubmed>19196676</pubmed></ref> 。これまでに1例のみ、親の生殖細胞モザイクにより(モザイクにより親の表現型は軽微)、子に遺伝した例が知られる<ref name=Berryer2013><pubmed>23161826</pubmed></ref> 。 | |||
アメリカでは、家族計画に際し、MRD5患者や患者の家族には、遺伝子カウンセリング(リスクの説明、代替オプションの説明等)を早期に行うことが勧められている<ref name=Holder2019><pubmed>30789692</pubmed></ref> 。 | |||
==疫学== | ==疫学== | ||
SYNGAP1のハプロ不全 (~50%欠失, loss of function)によるとされる<ref name=Clement2012><pubmed>23141534</pubmed></ref><ref name=Hamdan2009><pubmed>19196676</pubmed></ref> 。発達障害症例において機能獲得型などの変異は確認されていない。 | |||
SYNGAP1は、他のSYNGAPファミリー分子( | SYNGAP1は、他のSYNGAPファミリー分子(DABIP2, RASAL2, RASAL3)の中に中枢系での機能を補償できる分子がないこと<ref name=King2013><pubmed>23443682</pubmed></ref>、変異が入り機能欠失した場合の結果がシナプス強度調節機構の破綻<ref name=Kim2003><pubmed>12598599</pubmed></ref><ref name=Komiyama2002><pubmed>12427827</pubmed></ref>など比較的重大なことなどからか、その変異は発達障害のなかでも高頻度で存在しており、もっともよく見いだされる遺伝子変異の1つ(約0.75%; 7/931)とされる<ref name=UK-DDD-study2015></ref>。 | ||
その他の小規模報告でも、数%を占めるとされ、たとえば2009年の初報告では、コントロール群475例にSYNGAP1変異が認められないなか、小児の器質的原因を同定できない知的障害患者(NSID)群94症例中3例(約3%)にSYNGAP1変異が見いだされている<ref name=Hamdan2009><pubmed>19196676</pubmed></ref> 。 | その他の小規模報告でも、数%を占めるとされ、たとえば2009年の初報告では、コントロール群475例にSYNGAP1変異が認められないなか、小児の器質的原因を同定できない知的障害患者(NSID)群94症例中3例(約3%)にSYNGAP1変異が見いだされている<ref name=Hamdan2009><pubmed>19196676</pubmed></ref> 。 | ||
| 54行目: | 54行目: | ||
根本的な治療のために、さまざまなアプローチが検討されている。 | 根本的な治療のために、さまざまなアプローチが検討されている。 | ||
対処療法として、てんかんのコントロールには、抗けいれん薬でカンナビジオールであるエピディオレクスが良いとされているが、本邦では未承認である。 | |||
他の抗けいれん薬である(欠神発作、強直性間代発作両方に有用な)ラモトリギン、バルプロ酸ナトリウム、クロバザム、クロナゼパムなどの投与でコントロールできる症例も多い(約50%)とされている<ref group=脚注>MRD5への抗けいれん薬使用のガイドラインは未確立であり、基本的にはてんかんの型に応じた抗けいれん薬を投与する。</ref>。残りは、薬剤抵抗性とされる。エトスクシミド、ペランパネルは症例数が少なく結論は出ていないが、単剤投与では無効例が多い<ref name=Jimenez-Gomez2019><pubmed>31395010</pubmed></ref> 。知的障害の予後は、てんかんがコントロールできなかった期間に反比例することが多いとされていることからも<ref name=Liu2003><pubmed>12601699</pubmed></ref> 、早期のてんかんのコントロールすることが重要と考えられる。 | |||
他の発達障害、自閉症に施されるような介助方法、たとえば適切な行動介助療法による介助が有用な場合も多い。食事の経口摂取が困難な場合、経鼻胃管や胃ろう栄養法が必要とされる場合もある。いずれにせよ、てんかんのコントロール、行動上の問題への適切な介助、発達や教育上への必要な介助について、患者のQOLを最大化するよう、小児精神科医のもと適切にモニターしフォローアップしていくことが重要とされる<ref name=Holder2019><pubmed>30789692</pubmed></ref> 。 | |||
==その他== | ==その他== | ||
2019年10月25日 (金) 21:01時点における版
荒木 陽一、Richard L. Huganir
Johns Hopkins University School of Medicine
DOI:10.14931/bsd.8001 原稿受付日:2019年10月8日 原稿完成日:2019年10月XX日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳神経科学研究センター)
同義語:知的障害5型、精神遅滞5型
英語名称:SYNGAP1-related intellectual disability; mental retardation, autosomal dominant 5
英語略称:MRD5
発達障害の一類型である知的障害のうち、6番染色体短腕上の遺伝子SYNGAP1の変異、機能欠失によるものを、特にSYNGAP1関連知的障害(知的障害5型)として分類している。症状は、知的障害や発達の遅れに加え、自閉症やてんかんなどを併発しやすい。また、低筋力、嚥下障害、衝動性亢進、感覚情報処理の変化(痛みへの高い耐性)などを合併しやすい等、独自の経過をたどることが知られている。
イントロダクション
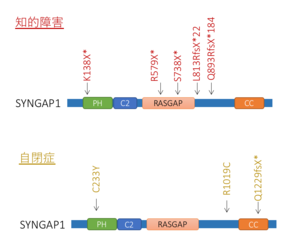
知的障害、自閉症などの発達障害において、SYNGAP1の変異が高頻度に見出されている。遺伝子の構造と、見つかった変異の一例を示す。
知的障害のうち、6番染色体短腕上の遺伝子SYNGAP1の変異によるものを、特にSYNGAP1関連知的障害(知的障害5型、MRD5)として分類している(OMIM #612621)。2009年にJacques L. Michaudのグループにより初めて報告された[1] 。
イギリスにおける大規模調査によると、全発達障害症例のうち約0.75%程度にSYNGAP1の変異が認められる。この頻度は、ARID1B、SCN2A、ANKRD11に次ぎ全遺伝子中4番目に多い[2] 。浸透度は100%で、病的変異(ナンセンス変異、ミスセンス変異、スプライス部位変異)を有するSYNGAP1を1コピー持った個人は必ず発症する(図)。
症状
発達の遅れと知的障害(中程度から高度)(100%)に加え、てんかん(発作起始は全般性で、頻度の高い順にミオクロニー発作、非定型欠神発作、強直性間代発作等)(84%)、斜視(約60%)、自閉症(約50%)を併発する。男女比はほぼ同数、てんかんの発症年齢 平均3.5歳、確定診断時の年齢 平均5.5歳と報告されている[3][4] 。
MRD5で併発するてんかんは、特徴的(発作起始は全般性で、頻度の高い順にミオクロニー発作、非定型欠神発作、強直性間代発作等)で、下記の診断が付加されることがある [5][6][4] 。
低筋力であり、座位獲得は平均12-13か月齢、歩行開始は平均26か月齢である。言語は全般的に遅れる。初めての発語は平均38か月齢、1/3は5歳で無発語である。発語できるようになる場合、英語圏では4-5語の文章を話せることもある。その他、衝動性亢進、感覚情報処理変化(痛みへの高い耐性等)などが報告されている[6] 。
予後については、不明な点が多い。ヨーロッパでは31歳でのMRD5生存例が報告されており[7] 、成人期を過ぎての生存が可能であることを示唆している。エクソーム解析が臨床検査としては未だ一般には用いられておらず、成人期の患者の中に、この疾患を持つ者がどの程度いるのかは不明である。
診断
診断は、発達障害、知的障害を持つ発端者のエクソーム解析または染色体マイクロアレイ(CMA)等により、次のことが発見された時に確定される。
- SYNGAP1遺伝子の病的変異(1コピー、ヘテロ変異)(頻度 約89%)[1]
または
- 6p21.32領域(SYNGAP1を含む)の微小欠失(頻度 約11%)[8]
遺伝
理論的には、常染色体優性遺伝であるが、これまでのところ多くの症例は、de novo(新規に発生した)変異によるものと考えられている[1] 。これまでに1例のみ、親の生殖細胞モザイクにより(モザイクにより親の表現型は軽微)、子に遺伝した例が知られる[9] 。
アメリカでは、家族計画に際し、MRD5患者や患者の家族には、遺伝子カウンセリング(リスクの説明、代替オプションの説明等)を早期に行うことが勧められている[3] 。
疫学
SYNGAP1のハプロ不全 (~50%欠失, loss of function)によるとされる[10][1] 。発達障害症例において機能獲得型などの変異は確認されていない。
SYNGAP1は、他のSYNGAPファミリー分子(DABIP2, RASAL2, RASAL3)の中に中枢系での機能を補償できる分子がないこと[11]、変異が入り機能欠失した場合の結果がシナプス強度調節機構の破綻[12][13]など比較的重大なことなどからか、その変異は発達障害のなかでも高頻度で存在しており、もっともよく見いだされる遺伝子変異の1つ(約0.75%; 7/931)とされる[2]。
その他の小規模報告でも、数%を占めるとされ、たとえば2009年の初報告では、コントロール群475例にSYNGAP1変異が認められないなか、小児の器質的原因を同定できない知的障害患者(NSID)群94症例中3例(約3%)にSYNGAP1変異が見いだされている[1] 。
治療
根本的な治療のために、さまざまなアプローチが検討されている。
対処療法として、てんかんのコントロールには、抗けいれん薬でカンナビジオールであるエピディオレクスが良いとされているが、本邦では未承認である。
他の抗けいれん薬である(欠神発作、強直性間代発作両方に有用な)ラモトリギン、バルプロ酸ナトリウム、クロバザム、クロナゼパムなどの投与でコントロールできる症例も多い(約50%)とされている[脚注 1]。残りは、薬剤抵抗性とされる。エトスクシミド、ペランパネルは症例数が少なく結論は出ていないが、単剤投与では無効例が多い[6] 。知的障害の予後は、てんかんがコントロールできなかった期間に反比例することが多いとされていることからも[14] 、早期のてんかんのコントロールすることが重要と考えられる。
他の発達障害、自閉症に施されるような介助方法、たとえば適切な行動介助療法による介助が有用な場合も多い。食事の経口摂取が困難な場合、経鼻胃管や胃ろう栄養法が必要とされる場合もある。いずれにせよ、てんかんのコントロール、行動上の問題への適切な介助、発達や教育上への必要な介助について、患者のQOLを最大化するよう、小児精神科医のもと適切にモニターしフォローアップしていくことが重要とされる[3] 。
その他
SYNGAP1変異が、小児の器質的原因を同定できない知的障害患者(NSID)のうち約3%(94例中3例)に見出されるという報告もあるが[1]、確定診断にはコストのかかる臨床エクソーム解析、染色体マイクロアレイ等が必要な疾患ゆえ、現在報告されている実症例は少なく、情報も極めて少ない。
そのため、アメリカではSYNGAP1家族会が設立され、患者同士での情報共有がはかられている。また隔年開催の大会では患者、臨床、基礎研究者の間で活発な意見交換がなされている。
関連項目
脚注
- ↑ MRD5への抗けいれん薬使用のガイドラインは未確立であり、基本的にはてんかんの型に応じた抗けいれん薬を投与する。
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5
Hamdan, F.F., Gauthier, J., Spiegelman, D., Noreau, A., Yang, Y., Pellerin, S., ..., & Synapse to Disease Group (2009).
Mutations in SYNGAP1 in autosomal nonsyndromic mental retardation. The New England journal of medicine, 360(6), 599-605. [PubMed:19196676] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Deciphering Developmental Disorders Study (2015).
Large-scale discovery of novel genetic causes of developmental disorders. Nature, 519(7542), 223-8. [PubMed:25533962] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Holder, J.L., Hamdan, F.F., & Michaud, J.L. (1993-2019).
SYNGAP1-Related Intellectual Disability. In Adam, M.P., Ardinger, H.H., Pagon, R.A., Wallace, S.E., Bean, L.J.H., Stephens, K., & Amemiya, A. (Eds.), GeneReviews®. Seattle (WA): University of Washington, Seattle. [PubMed:30789692] - ↑ 4.0 4.1
Vlaskamp, D.R.M., Shaw, B.J., Burgess, R., Mei, D., Montomoli, M., Xie, H., ..., & Scheffer, I.E. (2019).
SYNGAP1 encephalopathy: A distinctive generalized developmental and epileptic encephalopathy. Neurology, 92(2), e96-e107. [PubMed:30541864] [PMC] [WorldCat] [DOI] - ↑
Carvill, G.L., Heavin, S.B., Yendle, S.C., McMahon, J.M., O'Roak, B.J., Cook, J., ..., & Mefford, H.C. (2013).
Targeted resequencing in epileptic encephalopathies identifies de novo mutations in CHD2 and SYNGAP1. Nature genetics, 45(7), 825-30. [PubMed:23708187] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Jimenez-Gomez, A., Niu, S., Andujar-Perez, F., McQuade, E.A., Balasa, A., Huss, D., ..., & Holder, J.L. (2019).
Phenotypic characterization of individuals with SYNGAP1 pathogenic variants reveals a potential correlation between posterior dominant rhythm and developmental progression. Journal of neurodevelopmental disorders, 11(1), 18. [PubMed:31395010] [PMC] [WorldCat] [DOI] - ↑
Prchalova, D., Havlovicova, M., Sterbova, K., Stranecky, V., Hancarova, M., & Sedlacek, Z. (2017).
Analysis of 31-year-old patient with SYNGAP1 gene defect points to importance of variants in broader splice regions and reveals developmental trajectory of SYNGAP1-associated phenotype: case report. BMC medical genetics, 18(1), 62. [PubMed:28576131] [PMC] [WorldCat] [DOI] - ↑
Writzl, K., & Knegt, A.C. (2013).
6p21.3 microdeletion involving the SYNGAP1 gene in a patient with intellectual disability, seizures, and severe speech impairment. American journal of medical genetics. Part A, 161A(7), 1682-5. [PubMed:23687080] [WorldCat] [DOI] - ↑
Berryer, M.H., Hamdan, F.F., Klitten, L.L., Møller, R.S., Carmant, L., Schwartzentruber, J., ..., & Di Cristo, G. (2013).
Mutations in SYNGAP1 cause intellectual disability, autism, and a specific form of epilepsy by inducing haploinsufficiency. Human mutation, 34(2), 385-94. [PubMed:23161826] [WorldCat] [DOI] - ↑
Clement, J.P., Aceti, M., Creson, T.K., Ozkan, E.D., Shi, Y., Reish, N.J., ..., & Rumbaugh, G. (2012).
Pathogenic SYNGAP1 mutations impair cognitive development by disrupting maturation of dendritic spine synapses. Cell, 151(4), 709-723. [PubMed:23141534] [PMC] [WorldCat] [DOI] - ↑
King, P.D., Lubeck, B.A., & Lapinski, P.E. (2013).
Nonredundant functions for Ras GTPase-activating proteins in tissue homeostasis. Science signaling, 6(264), re1. [PubMed:23443682] [PMC] [WorldCat] [DOI] - ↑
Kim, J.H., Lee, H.K., Takamiya, K., & Huganir, R.L. (2003).
The role of synaptic GTPase-activating protein in neuronal development and synaptic plasticity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(4), 1119-24. [PubMed:12598599] [PMC] [WorldCat] - ↑
Komiyama, N.H., Watabe, A.M., Carlisle, H.J., Porter, K., Charlesworth, P., Monti, J., ..., & Grant, S.G. (2002).
SynGAP regulates ERK/MAPK signaling, synaptic plasticity, and learning in the complex with postsynaptic density 95 and NMDA receptor. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(22), 9721-32. [PubMed:12427827] [PMC] [WorldCat] - ↑
Liu, R.S., Lemieux, L., Bell, G.S., Hammers, A., Sisodiya, S.M., Bartlett, P.A., ..., & Duncan, J.S. (2003).
Progressive neocortical damage in epilepsy. Annals of neurology, 53(3), 312-24. [PubMed:12601699] [WorldCat] [DOI]