「Eph受容体」の版間の差分
タグ: 取り消し |
Tadashinomura (トーク | 投稿記録) 細編集の要約なし |
||
| (4人の利用者による、間の31版が非表示) | |||
| 1行目: | 1行目: | ||
膜貫通型の受容体型チロシンキナーゼの1種であり、エフリン (ephrin) と呼ばれる細胞膜に存在するリガンドと結合することによって細胞内にシグナルを伝達する。 Eph-ephrinのシグナルは細胞増殖、細胞移動、神経軸索ガイダンス、シナプス可塑性といった様々な現象に関与しており、脊椎動物および無脊椎動物の中枢神経系の発生と発達過程において重要な役割を果たしている。 | |||
<br> | |||
[[Image:Structure of Eph receptors.jpg| | [[Image:Structure of Eph receptors.jpg|Eph受容体のタンパク構造の模式図。]]<br> | ||
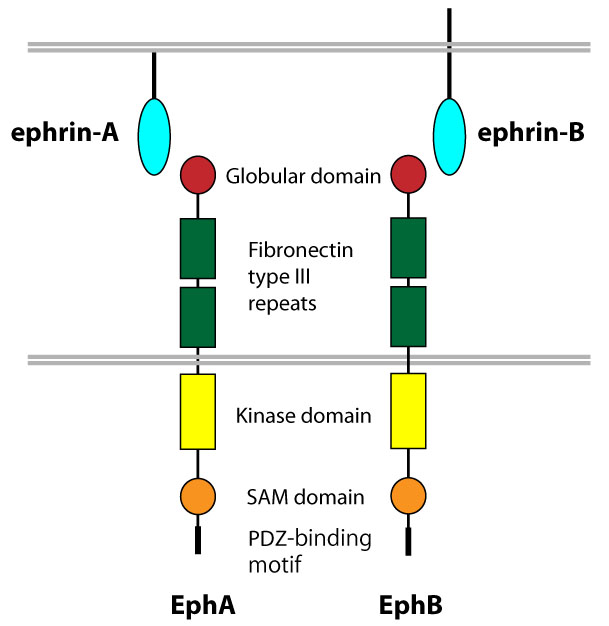
図:Eph受容体とephrinリガンドの構造。 | |||
【名称の由来】<br>Ephは、Erythropoietin-producing hepatocellular carcinoma に発現する受容体型チロシンキナーゼをスクリーニングする過程で同定されたタンパク質である<sup>1</sup>。当初、それぞれのEph受容体は同定された生物種によって別々の名称で呼ばれていたが、Eph nomenclature committee により名称が統一された<sup>2</sup>。 | |||
<br>【Eph 受容体の構造とサブファミリー 】<br>Eph 受容体は、そのアミノ酸配列及びとリガンドとの親和性の違いにより、EphAとEphB の2つのサブクラスに分類されている。脊椎動物において、EphA サブクラスは現在10種類 (EphA1~A10)、 EphB サブクラスは6種類同定されている (EphB1~B6)。EphA、EphB はそれぞれエフリン A (ephrin-A) とエフリン B (ephrin-B) と呼ばれる細胞膜上のリガンドとほぼ選択的に結合するが、 近年 EphA4 および EphB2 がそれぞれ ephrin-B3、 ephrin-A5と結合することも報告されている<sup>3</sup>。 | |||
<br>【Eph受容体シグナルの細胞生物学的機能】<br>Eph 受容体が細胞内にシグナルを伝達するためには、エフリンリガンドとの結合に加えて細胞膜上で受容体同士がお互いに結合すること (clustering) が必要である。Eph 受容体は、その細胞内領域にチロシンキナーゼドメイン、SAM ドメイン、 PDZ 結合モチーフを有している。リガンドの結合により、膜貫通領域の近傍に位置するチロシンとセリンがリン酸化され、チロシンキナーゼドメインが活性化されることで、下流分子にシグナルを伝達する。Eph 受容体は様々な細胞内シグナル系を制御しているが、特に Ras/Rho ファミリーの低分子量Gタンパク質を介したシグナルは、アクチンフィラメントの構築を制御し、細胞の形態変化や接着性の低下、あるいは亢進を誘導する。 こうした Eph 受容体を介した細胞特性の変化は、細胞の移動や突起の伸張、また細胞選別といった基本的な発生現象において極めて重要な役割を担っている。Eph受容体を介して、受容体を発現する細胞に伝達されるシグナルを正方向性シグナル (forward signal)、またエフリンリガンドを介してリガンド発現細胞に伝達されるシグナルを逆方向性シグナル (reverse signal) と呼んでいる<sup>3,4,5</sup>。 | |||
<br> 【Eph受容体の中枢神経系における機能】<br>中枢神経系の発生・発達過程において、Eph受容体を介したシグナルは特に、初期中枢神経系の領域化における組織境界の形成、 神経前駆細胞の増殖と細胞死、神経軸索ガイダンスといった現象に深く関与している。また生後・成体脳では、シナプス形成の制御や神経幹細胞の増殖と分化にも重要な役割を果たしている。 | |||
<br>・中枢神経系の領域化における組織境界の形成<br>発生中の後脳胞では、Eph受容体とエフリンリガンドがロンボメアと呼ばれる後脳胞の分節構造に特異的に発現しており、ロンボメアを構成する組織境界の確立に機能している。また各ロンボメアに由来する神経堤細胞の移動にもEph受容体とエフリンシグナルが関与している<sup>6</sup>。 | |||
<br>・胎生期神経前駆細胞の増殖および細胞死の制御<br>Eph受容体とエフリンリガンドは胎生期の神経上皮細胞(神経前駆細胞)に発現しており、特にEphA4とephrin-B1を介したシグナルは神経前駆細胞の増殖を正に制御している<sup>7</sup>。また胎生期の大脳皮質原基において、EphA7とephrin-A5 を介したシグナルは細胞死を亢進させる<sup>8</sup>。 | |||
<br>・神経細胞移動と軸索ガイダンス制御<br>Eph受容体とエフリンリガンドを介したシグナルは、 視神経や聴神経、前交連、脳梁、中脳被蓋から線条体への繊維投射、視床皮質路、皮質脊髄路といった様々な神経軸索の伸張と経路選択、標的領域への投射を制御している。軸索ガイダンスにおいては、Eph受容体を発現する軸索がエフリンリガンドを発現する標的に到達した際、軸索が反発する、いわゆる接触依存性の反発因子として機能する場合が多い。軸索を伸張させる組織と標的組織において受容体とリガンドの発現量に勾配がある場合、 Eph受容体を介したシグナルは位置特異的な神経投射(トポグラフィックマップ)の形成に重要な役割を果たしている<sup>9</sup>。 | |||
<br>・シナプス形成と可塑性制御<br>樹状突起の発達過程において、EphB2受容体が樹状突起に集積し、突起進展と維持に必須の役割を果たしている。またエフリンリガンドも樹状突起に局在しており、特に ephrin-B1、ephirin-B3を介したシグナルが海馬神経細胞のスパインの成熟や後シナプス構造の形成を制御し、シナプス可塑性の維持に重要な役割を果たしている<sup>10,11</sup>。 | |||
<br>・成体神経幹細胞の増殖・分化制御<br>Eph受容体とエフリンリガンドは成体脳に存在する神経幹細胞とニッチ細胞にも発現している。成体側脳室壁では、 EphA7受容体が上衣細胞に発現し、神経幹細胞および前駆細胞に発現しているephrin-A2 リガンドを介した逆方向性シグナルにより細胞増殖を負に制御している<sup>12</sup>。またアストロサイトおよび移動中のニューロブラストに発現しているEphBおよびephrin-B受容体が、神経幹細胞の増殖とニューロブラストの移動様式を制御している<sup>13</sup>。さらに成体海馬歯状回においては、 神経前駆細胞に発現するEphB1および EphB2 が、前駆細胞の増殖と移動、突起進展を制御していることが報告されている<sup>14</sup>。 | |||
<br> | |||
参考文献 | |||
< | 1. Hirai, H., Maru, Y., Hagiwara, K., Nishida, J. & Takaku, F. '''A novel putative tyrosine kinase receptor encoded by the eph gene.''' ''Science:''1987, 238, 1717-1720.<br>2. Eph Nomenclature Committee. '''Unified nomenclature for Eph family receptors and thier ligands, the ephrins. '''''Cell: ''1997, 90, 403-404.<br>3. Murai, K. K. & Pasquale, E. B. ''''Eph'ective signaling: forward, reverse and crosstalk.'''''J Cell Sci: ''2003, 116, 2823-2832.<br>'''''4. Holland, S. J. et al. '''Juxtamembrane tyrosine residues couple the Eph family receptor EphB2/Nuk to specific SH2 domain proteins in neuronal cells.'''''EMBO J:'' ''1997, 16, 3877-3888.'''''<i><br></i>'''5. Frisen, J., Holmberg, J. & Barbacid, M. '''Ephrins and their Eph receptors: multitalented directors of embryonic development. '''''EMBO J: 1999'', 18, 5159-5165.'''''<br>'''''6. Cooke, J. E. & Moens, C. B. '''Boundary formation in the hindbrain: Eph only it were simple. '''''Trends Neurosci.: ''2002. ''25, 260-267.'''''<i><br></i>'''7. North, H. A. et al. '''Promotion of proliferation in the developing cerebral cortex by EphA4 forward signaling. '''''Development: ''2009, 136, 2467-2476.<br>8. Depaepe, V. et al. '''Ephrin signalling controls brain size by regulating apoptosis of neural progenitors. '''''Nature: ''2005, 435, 1244-1250.<br>9. Frisen, J. & Barbacid, M. '''Genetic analysis of the role of Eph receptors in the development of the mammalian nervous system. '''''Cell Tissue Res:'' 1997, 290, 209-215.<br>10. Henkemeyer, M., Itkis, O. S., Ngo, M., Hickmott, P. W. & Ethell, I. M. '''Multiple EphB receptor tyrosine kinases shape dendritic spines in the hippocampus.''' ''J Cell Biol.:''2003, 163, 1313-1326.<br>11. Henkemeyer, M. & Frisen, J. '''Eph receptors tingle the spine. '''''Neuron:'' 2001, 31, 876-877.<br>12. Holmberg, J. et al. '''Ephrin-A2 reverse signaling negatively regulates neural progenitor proliferation and neurogenesis. '''''Genes Dev.: ''2005, 19, 462-471.<br>13. Conover, J. C. et al. '''Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone.''' ''Nat Neurosci.: ''2000, 3, 1091-1097.<br>14. Chumley, M. J., Catchpole, T., Silvany, R. E., Kernie, S. G. & Henkemeyer, M. '''EphB receptors regulate stem/progenitor cell proliferation, migration, and polarity during hippocampal neurogenesis. '''''J Neurosci.: ''2007. 27, 13481-13490. | ||
<br> | |||
(執筆担当者:野村真、編集担当者:大隅典子) | |||
2012年3月26日 (月) 18:34時点における版
膜貫通型の受容体型チロシンキナーゼの1種であり、エフリン (ephrin) と呼ばれる細胞膜に存在するリガンドと結合することによって細胞内にシグナルを伝達する。 Eph-ephrinのシグナルは細胞増殖、細胞移動、神経軸索ガイダンス、シナプス可塑性といった様々な現象に関与しており、脊椎動物および無脊椎動物の中枢神経系の発生と発達過程において重要な役割を果たしている。
図:Eph受容体とephrinリガンドの構造。
【名称の由来】
Ephは、Erythropoietin-producing hepatocellular carcinoma に発現する受容体型チロシンキナーゼをスクリーニングする過程で同定されたタンパク質である1。当初、それぞれのEph受容体は同定された生物種によって別々の名称で呼ばれていたが、Eph nomenclature committee により名称が統一された2。
【Eph 受容体の構造とサブファミリー 】
Eph 受容体は、そのアミノ酸配列及びとリガンドとの親和性の違いにより、EphAとEphB の2つのサブクラスに分類されている。脊椎動物において、EphA サブクラスは現在10種類 (EphA1~A10)、 EphB サブクラスは6種類同定されている (EphB1~B6)。EphA、EphB はそれぞれエフリン A (ephrin-A) とエフリン B (ephrin-B) と呼ばれる細胞膜上のリガンドとほぼ選択的に結合するが、 近年 EphA4 および EphB2 がそれぞれ ephrin-B3、 ephrin-A5と結合することも報告されている3。
【Eph受容体シグナルの細胞生物学的機能】
Eph 受容体が細胞内にシグナルを伝達するためには、エフリンリガンドとの結合に加えて細胞膜上で受容体同士がお互いに結合すること (clustering) が必要である。Eph 受容体は、その細胞内領域にチロシンキナーゼドメイン、SAM ドメイン、 PDZ 結合モチーフを有している。リガンドの結合により、膜貫通領域の近傍に位置するチロシンとセリンがリン酸化され、チロシンキナーゼドメインが活性化されることで、下流分子にシグナルを伝達する。Eph 受容体は様々な細胞内シグナル系を制御しているが、特に Ras/Rho ファミリーの低分子量Gタンパク質を介したシグナルは、アクチンフィラメントの構築を制御し、細胞の形態変化や接着性の低下、あるいは亢進を誘導する。 こうした Eph 受容体を介した細胞特性の変化は、細胞の移動や突起の伸張、また細胞選別といった基本的な発生現象において極めて重要な役割を担っている。Eph受容体を介して、受容体を発現する細胞に伝達されるシグナルを正方向性シグナル (forward signal)、またエフリンリガンドを介してリガンド発現細胞に伝達されるシグナルを逆方向性シグナル (reverse signal) と呼んでいる3,4,5。
【Eph受容体の中枢神経系における機能】
中枢神経系の発生・発達過程において、Eph受容体を介したシグナルは特に、初期中枢神経系の領域化における組織境界の形成、 神経前駆細胞の増殖と細胞死、神経軸索ガイダンスといった現象に深く関与している。また生後・成体脳では、シナプス形成の制御や神経幹細胞の増殖と分化にも重要な役割を果たしている。
・中枢神経系の領域化における組織境界の形成
発生中の後脳胞では、Eph受容体とエフリンリガンドがロンボメアと呼ばれる後脳胞の分節構造に特異的に発現しており、ロンボメアを構成する組織境界の確立に機能している。また各ロンボメアに由来する神経堤細胞の移動にもEph受容体とエフリンシグナルが関与している6。
・胎生期神経前駆細胞の増殖および細胞死の制御
Eph受容体とエフリンリガンドは胎生期の神経上皮細胞(神経前駆細胞)に発現しており、特にEphA4とephrin-B1を介したシグナルは神経前駆細胞の増殖を正に制御している7。また胎生期の大脳皮質原基において、EphA7とephrin-A5 を介したシグナルは細胞死を亢進させる8。
・神経細胞移動と軸索ガイダンス制御
Eph受容体とエフリンリガンドを介したシグナルは、 視神経や聴神経、前交連、脳梁、中脳被蓋から線条体への繊維投射、視床皮質路、皮質脊髄路といった様々な神経軸索の伸張と経路選択、標的領域への投射を制御している。軸索ガイダンスにおいては、Eph受容体を発現する軸索がエフリンリガンドを発現する標的に到達した際、軸索が反発する、いわゆる接触依存性の反発因子として機能する場合が多い。軸索を伸張させる組織と標的組織において受容体とリガンドの発現量に勾配がある場合、 Eph受容体を介したシグナルは位置特異的な神経投射(トポグラフィックマップ)の形成に重要な役割を果たしている9。
・シナプス形成と可塑性制御
樹状突起の発達過程において、EphB2受容体が樹状突起に集積し、突起進展と維持に必須の役割を果たしている。またエフリンリガンドも樹状突起に局在しており、特に ephrin-B1、ephirin-B3を介したシグナルが海馬神経細胞のスパインの成熟や後シナプス構造の形成を制御し、シナプス可塑性の維持に重要な役割を果たしている10,11。
・成体神経幹細胞の増殖・分化制御
Eph受容体とエフリンリガンドは成体脳に存在する神経幹細胞とニッチ細胞にも発現している。成体側脳室壁では、 EphA7受容体が上衣細胞に発現し、神経幹細胞および前駆細胞に発現しているephrin-A2 リガンドを介した逆方向性シグナルにより細胞増殖を負に制御している12。またアストロサイトおよび移動中のニューロブラストに発現しているEphBおよびephrin-B受容体が、神経幹細胞の増殖とニューロブラストの移動様式を制御している13。さらに成体海馬歯状回においては、 神経前駆細胞に発現するEphB1および EphB2 が、前駆細胞の増殖と移動、突起進展を制御していることが報告されている14。
参考文献
1. Hirai, H., Maru, Y., Hagiwara, K., Nishida, J. & Takaku, F. A novel putative tyrosine kinase receptor encoded by the eph gene. Science:1987, 238, 1717-1720.
2. Eph Nomenclature Committee. Unified nomenclature for Eph family receptors and thier ligands, the ephrins. Cell: 1997, 90, 403-404.
3. Murai, K. K. & Pasquale, E. B. ''Eph'ective signaling: forward, reverse and crosstalk.J Cell Sci: 2003, 116, 2823-2832.
4. Holland, S. J. et al. Juxtamembrane tyrosine residues couple the Eph family receptor EphB2/Nuk to specific SH2 domain proteins in neuronal cells.EMBO J: 1997, 16, 3877-3888.
5. Frisen, J., Holmberg, J. & Barbacid, M. Ephrins and their Eph receptors: multitalented directors of embryonic development. EMBO J: 1999, 18, 5159-5165.
6. Cooke, J. E. & Moens, C. B. Boundary formation in the hindbrain: Eph only it were simple. Trends Neurosci.: 2002. 25, 260-267.
7. North, H. A. et al. Promotion of proliferation in the developing cerebral cortex by EphA4 forward signaling. Development: 2009, 136, 2467-2476.
8. Depaepe, V. et al. Ephrin signalling controls brain size by regulating apoptosis of neural progenitors. Nature: 2005, 435, 1244-1250.
9. Frisen, J. & Barbacid, M. Genetic analysis of the role of Eph receptors in the development of the mammalian nervous system. Cell Tissue Res: 1997, 290, 209-215.
10. Henkemeyer, M., Itkis, O. S., Ngo, M., Hickmott, P. W. & Ethell, I. M. Multiple EphB receptor tyrosine kinases shape dendritic spines in the hippocampus. J Cell Biol.:2003, 163, 1313-1326.
11. Henkemeyer, M. & Frisen, J. Eph receptors tingle the spine. Neuron: 2001, 31, 876-877.
12. Holmberg, J. et al. Ephrin-A2 reverse signaling negatively regulates neural progenitor proliferation and neurogenesis. Genes Dev.: 2005, 19, 462-471.
13. Conover, J. C. et al. Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone. Nat Neurosci.: 2000, 3, 1091-1097.
14. Chumley, M. J., Catchpole, T., Silvany, R. E., Kernie, S. G. & Henkemeyer, M. EphB receptors regulate stem/progenitor cell proliferation, migration, and polarity during hippocampal neurogenesis. J Neurosci.: 2007. 27, 13481-13490.
(執筆担当者:野村真、編集担当者:大隅典子)