「セロトニン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (他の1人の利用者による、間の1版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/kkatsutky 小林 克典]</font><br> | <font size="+1">[http://researchmap.jp/kkatsutky 小林 克典]</font><br> | ||
''日本医科大学 薬理学講座''<br> | ''日本医科大学 薬理学講座''<br> | ||
DOI:<selfdoi /> 原稿受付日:2012年2月15日 原稿完成日:2012年2月15日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 91行目: | 91行目: | ||
イオンの[[電気化学的勾配]]によって駆動される12回膜貫通型の[[細胞膜]]上のトランスポーターで、セロトニン神経や血小板に発現している。血小板にはセロトニン産生酵素はほとんど無く、血小板内のセロトニンはトランスポーターによって血中から取り込まれたものである<ref name="ref2" />。細胞外のNa<sup>+</sup>、Cl<sup>-</sup>と共にセロトニンが細胞内に輸送され、細胞内のK<sup>+</sup>が逆向きに輸送される。K<sup>+</sup>は輸送に必須ではないが、輸送速度を上昇させる<ref><pubmed> 489585 </pubmed></ref>。セロトニントランスポーターを阻害すると細胞外のセロトニンの基底濃度が上昇し、さらに一時的にセロトニン濃度が上昇した際にその回復が遅くなるため、標的細胞に対するセロトニンの作用が増強される<ref><pubmed> 12151556 </pubmed></ref> <ref><pubmed> 14530210 </pubmed></ref>。[[抗うつ薬]]などの[[向精神薬]]にはセロトニントランスポーターの阻害作用を持つものが多い。 | イオンの[[電気化学的勾配]]によって駆動される12回膜貫通型の[[細胞膜]]上のトランスポーターで、セロトニン神経や血小板に発現している。血小板にはセロトニン産生酵素はほとんど無く、血小板内のセロトニンはトランスポーターによって血中から取り込まれたものである<ref name="ref2" />。細胞外のNa<sup>+</sup>、Cl<sup>-</sup>と共にセロトニンが細胞内に輸送され、細胞内のK<sup>+</sup>が逆向きに輸送される。K<sup>+</sup>は輸送に必須ではないが、輸送速度を上昇させる<ref><pubmed> 489585 </pubmed></ref>。セロトニントランスポーターを阻害すると細胞外のセロトニンの基底濃度が上昇し、さらに一時的にセロトニン濃度が上昇した際にその回復が遅くなるため、標的細胞に対するセロトニンの作用が増強される<ref><pubmed> 12151556 </pubmed></ref> <ref><pubmed> 14530210 </pubmed></ref>。[[抗うつ薬]]などの[[向精神薬]]にはセロトニントランスポーターの阻害作用を持つものが多い。 | ||
== | == 受容体 == | ||
5-HT<sub>1</sub>から5-HT<sub>7</sub>の7種類のサブファミリーからなり、14個のサブタイプが存在する<ref name="ref13"><pubmed> 10462127 </pubmed></ref> <ref name="ref14"><pubmed> 18615128 </pubmed></ref> <ref name="ref15"><pubmed> 18676031 </pubmed></ref> <ref name="ref16"><pubmed> 20945968 </pubmed></ref>。イオンチャネル型の5-HT<sub>3</sub>を除いて他は全て[[GTP結合蛋白質]]に共役する受容体であり、[[遅いシナプス後電位|遅い膜電位変化]]や[[シナプス伝達]]の修飾に関与する。脳には全ての受容体が発現している。 | 5-HT<sub>1</sub>から5-HT<sub>7</sub>の7種類のサブファミリーからなり、14個のサブタイプが存在する<ref name="ref13"><pubmed> 10462127 </pubmed></ref> <ref name="ref14"><pubmed> 18615128 </pubmed></ref> <ref name="ref15"><pubmed> 18676031 </pubmed></ref> <ref name="ref16"><pubmed> 20945968 </pubmed></ref>。イオンチャネル型の5-HT<sub>3</sub>を除いて他は全て[[GTP結合蛋白質]]に共役する受容体であり、[[遅いシナプス後電位|遅い膜電位変化]]や[[シナプス伝達]]の修飾に関与する。脳には全ての受容体が発現している。 | ||
2020年1月13日 (月) 21:57時点における最新版
小林 克典
日本医科大学 薬理学講座
DOI:10.14931/bsd.580 原稿受付日:2012年2月15日 原稿完成日:2012年2月15日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
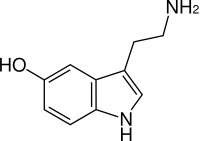
| セロトニン | |
|---|---|
| |
| |
| |
5-Hydroxytryptamine or | |
別称 5-Hydroxytryptamine, 5-HT, Enteramine; Thrombocytin, 3-(β-Aminoethyl)-5-hydroxyindole, Thrombotonin | |
| Identifiers | |
| 50-67-9 | |
| ChEBI | |
| ChEMBL | ChEMBL39 |
| ChemSpider | 5013 |
| |
| 5 | |
| Jmol-3D images | Image |
| KEGG | C00780 |
| MeSH | Serotonin |
| PubChem | 5202 |
| |
| UNII | 333DO1RDJY |
| Properties | |
| Molar mass | 176.215 g/mol |
| Appearance | White powder |
| Melting point | 121–122° C (ligroin) [1] |
| Boiling point | |
| slightly soluble | |
| Dipole moment | 2.98 D |
| 危険性 | |
| MSDS | External MSDS |
| 半数致死量 LD50 | 750 mg/kg (subcutaneous, rat),[4] 4500 mg/kg (intraperitoneal, rat),[5] 60 mg/kg (oral, rat) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
英語名:serotonin、5-hydroxytryptamine 独:Serotonin、仏:sérotonine 英略語:5-HT
生理活性アミンの一種で、中枢神経系の伝達物質として働く。脳機能の調節において重要な役割を果たすと考えられているが、生体内の大部分(~95%)のセロトニンは末梢に存在し[6] [7]、血管収縮、腸管蠕動運動、血小板凝縮などの調節因子として末梢でも多様な作用を持つ。生体内のセロトニンは必須アミノ酸のトリプトファンから合成され、小胞モノアミントランスポーターによって細胞内の小胞に取り込まれる。開口放出によって細胞外に放出されたセロトニンは標的細胞の受容体を活性化してその効果を発揮し、セロトニントランスポーターによって細胞内に取り込まれる。
生合成
生体内のセロトニンは、トリプトファンからトリプトファン水酸化酵素(tryptophan hydoxylase、TPH)、芳香族L-アミノ酸脱炭酸酵素(aromatic L-amino acid decarboxylase、AADC)による二段階の酵素反応によって合成される。
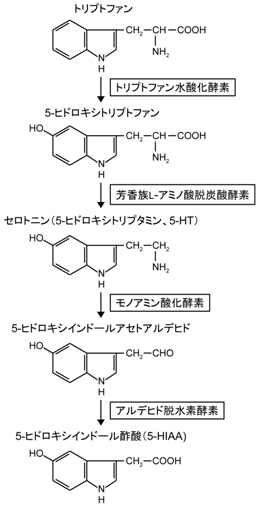
AADCはドーパミンの生合成経路でも機能する。TPHはセロトニン合成の律速酵素で、TPH1とTPH2の二種類のアイソフォームが存在する。TPH1は腸クロム親和性細胞などの主に末梢のセロトニン産生細胞に、TPH2は主に中枢のセロトニン神経系の細胞に発現する。TPH1欠損マウスでは血中のセロトニン濃度が約95%低下し、TPH2欠損マウスでは中枢神経系のセロトニン含量が約95%低下し、末梢と中枢におけるそれぞれの酵素の重要性を示している。しかし、TPH1とTPH2の両方を欠損するマウスでも血中、中枢ともに数%のセロトニンは残存する[8]。TPHはテトラヒドロビオプテリン(Tetrahydrobiopterin、BH4)を補因子とし、BH4の欠乏はセロトニンの欠乏を伴う。BH4はドーパミン生合成に必要なチロシン水酸化酵素や一酸化窒素合成酵素の補因子としても働き、セロトニンやドーパミンの放出に影響を及ぼすことも示されている[9]。
代謝
セロトニンはモノアミン酸化酵素(monoamine oxidase、MAO)、さらにアルデヒド脱水素酵素によって代謝されて5-ヒドロキシインドール酢酸(5-hydroxyindoleacetic acid、5-HIAA)を生じる。5-HIAAの脳脊髄液中濃度が中枢セロトニン含量の間接的な指標としてしばしば用いられるが、セロトニン代謝が変化した場合、セロトニンと5-HIAA濃度は逆方向に変化するため、5-HIAA濃度はセロトニン濃度を必ずしも反映しない。MAOにはMAOAとMAOBのアイソザイムが存在し、セロトニンは主にMAOAによって代謝される[10]。大部分のMAOAはミトコンドリアの外膜に局在しており[11]、グリア細胞にも発現が見られる[12]。基質特異性から予想される局在とは異なり、セロトニン神経には主にMAOBが発現しておりMAOAの発現は非常に少ない[10] [12]。しかし、MAOA欠損マウスでは脳のセロトニン含量が増え[13]、MAOB欠損マウスではそのような変化は生じないため[14]、MAOAが脳内のセロトニン代謝に重要であることは間違いない。
セロトニントランスポーター
イオンの電気化学的勾配によって駆動される12回膜貫通型の細胞膜上のトランスポーターで、セロトニン神経や血小板に発現している。血小板にはセロトニン産生酵素はほとんど無く、血小板内のセロトニンはトランスポーターによって血中から取り込まれたものである[7]。細胞外のNa+、Cl-と共にセロトニンが細胞内に輸送され、細胞内のK+が逆向きに輸送される。K+は輸送に必須ではないが、輸送速度を上昇させる[15]。セロトニントランスポーターを阻害すると細胞外のセロトニンの基底濃度が上昇し、さらに一時的にセロトニン濃度が上昇した際にその回復が遅くなるため、標的細胞に対するセロトニンの作用が増強される[16] [17]。抗うつ薬などの向精神薬にはセロトニントランスポーターの阻害作用を持つものが多い。
受容体
5-HT1から5-HT7の7種類のサブファミリーからなり、14個のサブタイプが存在する[18] [19] [20] [21]。イオンチャネル型の5-HT3を除いて他は全てGTP結合蛋白質に共役する受容体であり、遅い膜電位変化やシナプス伝達の修飾に関与する。脳には全ての受容体が発現している。
5-HT1受容体
5-HT1A、5-HT1B、5-HT1D、5-HT1E、5-HT1Fの5個のサブタイプが存在する。5-HT1Cは5-HT2Cに再分類されたため存在しない。主な細胞内シグナル経路はGi/oを介したcAMP濃度の低下で、ホスホリパーゼC(PLC)や[[Na+/H+交換輸送体]]など他のシグナル経路も活性化し得る[20]。5-HT1A受容体はセロトニン受容体の中で最も広く発現しており、受容体活性化によって細胞膜の過分極を引き起こす。しかし、この過分極は主にGタンパク質共役型内向き整流性カリウムの活性化によるもので、cAMPには依存しない[19]。グルタミン酸作動性の興奮性シナプス伝達、GABA作動性の抑制シナプス伝達を共に抑制し、自己受容体としてセロトニン神経の活動に負のフィードバックをかける[20] [21]。5-HT1B受容体も自己受容体としてセロトニンの放出を抑制するほか、グルタミン酸、GABA、ドーパミン、アセチルコリンなどの放出を抑制する[21]。
5-HT2受容体
5-HT2A、5-HT2B、5-HT2Cの3個のサブタイプがあり、Gq/11を介してPLCを活性化する。5-HT2A受容体は中枢神経系に広く分布しており、活性化によってカリウムコンダクタンスの低下を伴う脱分極を生じ[18]、自発性シナプス応答の頻度上昇を引き起こす[22]。また、グルタミン酸作動性シナプス伝達を増強[19]又は抑制する[23]。5-HT2C受容体はRNAエディテイングを受けるため、15-20のアイソフォームを持つ。このRNAエディテイングはPLCに対する5-HT2Cのリガンド非依存性のconstituvie activityに影響を及ぼす[20]。
5-HT3受容体
イオンチャネル型の受容体で5-HT3A、5-HT3B、5-HT3C、5-HT3D、5-HT3Eの5個のサブユニットを持つ。二価のカルシウムイオンを含む陽イオンに対する透過性を持ち、受容体活性化によって脱分極を生じる。単独で機能的なチャネルを構成できるのは5-HT3Aのみで、5-HT3Bの存在によってチャネルのキネティクス、薬理学的特性、イオン透過性が変化する[24] [25]。速いシナプス伝達を担うほか、シナプス修飾にも関与する[26]。興奮性シナプス伝達を抑制し[27]、抑制性シナプス伝達を増強[28]又は抑制する[27]。
5-HT4受容体
Gsに共役し、cAMP濃度を上昇させる。リガンド非依存性のconstitutive activityを持ち、多くの(~10)スプライシングバリアントが存在する。受容体活性化によって活動電位後の過分極の抑制と脱分極を生じる。活動電位後の過分極の抑制はcAMP上昇によるカルシウム依存性カリウムコンダクタンスの抑制による[29]。グルタミン酸作動性シナプス伝達を抑制[19]又は増強し[30]、海馬、扁桃体においてシナプス伝達の長期増強を促進する[31]。PKAを介してGABAA受容体を修飾し[19]、自発性抑制性シナプス応答を活動依存的に二方向性に変化させる[32]。
5-HT5受容体
Gi/oに共役し、cAMP濃度を低下させる。ラット、マウスでは5-HT5A、5-HT5Bの2個のサブタイプが存在するが、ヒトでは5-HT5Aのみが発現している[33]。
5-HT6受容体
Gsに共役し、cAMP濃度を上昇させる。受容体活性化によってグルタミン酸作動性シナプス伝達を抑制する[34]。
5-HT7受容体
Gsに共役し、cAMP濃度を上昇させる。Ih(過分極によって活性化される陽イオン電流)を増加させて脱分極を生じる[35]。
中枢における生理機能
セロトニンを放出する神経細胞は脳全体に投射しており、そのためセロトニンが関与すると考えられている脳機能は多岐にわたる(セロトニン神経系の項目で詳述)。セロトニンは成熟脳機能のみならず、神経系の発達にも関与することが示されており、発達期にセロトニンレベルを変化させると体性感覚野の形態異常などが生じる[36]。中枢セロトニンレベルが5%以下に低下しているTPH2ノックアウトマウスやTPH1とTPH2のダブルノックアウトマウスなどでも脳形態に大きな変化はないため、セロトニンは神経発達に必須ではなく調節的に働くと考えられる。残存する数%のセロトニン又は母体由来のセロトニンが初期発達においては充分な役割を果たす可能性もある。
精神疾患との関連
セロトニントランスポーターやセロトニン代謝酵素の阻害薬、セロトニン受容体拮抗能を持つ薬物が精神疾患の治療薬として用いられており(セロトニン神経系、抗うつ薬、抗精神病薬などの項目を参照)、セロトニン神経系の何らかの異常が精神疾患に関与すると考えられている。特にうつ病との関連も知られているが、その詳細は明らかではない。古典的なセロトニン仮説では脳内セロトニンレベルの低下、もしくはセロトニン神経系の機能低下がうつ病の原因とされたが、それを支持する直接的な証拠はない[37]。トリプトファンの欠乏によって実験的に一過性のセロトニンレベルの低下を生じさせても健常者の被験者では気分の変化は生じない。一方で、うつ病の罹患歴のある被験者では抑うつ気分が生じる。従って、うつ病に伴ってセロトニン神経系に変化が生じる可能性はあるが、それが疾患の原因もしくは病態基盤に関与するかどうかは不明である。うつ病に限らず、精神疾患におけるセロトニン系の異常の可能性は、病態生理学的事実よりも主に治療薬の作用部位に基づいて推測されたものであり、病態仮説の域を出るものではない。
関連項目
参考文献
- ↑ Pietra, S.
Farmaco Edizione Scientifica: 1958, 13:75–9 - ↑ Calculated using Advanced Chemistry Development (ACD/Labs) Software V11.02 (©1994–2011 ACD/Labs)
- ↑
Mazák, K., Dóczy, V., Kökösi, J., & Noszál, B. (2009).
Proton speciation and microspeciation of serotonin and 5-hydroxytryptophan. Chemistry & biodiversity, 6(4), 578-90. [PubMed:19353542] [WorldCat] [DOI] - ↑ Erspamer, Vittorio
Ricerca Scientifica 1952, 22:694–702 - ↑
Tammisto, T. (1968).
Increased toxicity of 5-hydroxytryptamine by ethanol in rats and mice. Annales medicinae experimentalis et biologiae Fenniae, 46(3), 382-4. [PubMed:5734241] [WorldCat] - ↑
Gershon, M.D., & Tack, J. (2007).
The serotonin signaling system: from basic understanding to drug development for functional GI disorders. Gastroenterology, 132(1), 397-414. [PubMed:17241888] [WorldCat] [DOI] - ↑ 7.0 7.1
Mohammad-Zadeh, L.F., Moses, L., & Gwaltney-Brant, S.M. (2008).
Serotonin: a review. Journal of veterinary pharmacology and therapeutics, 31(3), 187-99. [PubMed:18471139] [WorldCat] [DOI] - ↑
Savelieva, K.V., Zhao, S., Pogorelov, V.M., Rajan, I., Yang, Q., Cullinan, E., & Lanthorn, T.H. (2008).
Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants. PloS one, 3(10), e3301. [PubMed:18923670] [PMC] [WorldCat] [DOI] - ↑
Werner, E.R., Blau, N., & Thöny, B. (2011).
Tetrahydrobiopterin: biochemistry and pathophysiology. The Biochemical journal, 438(3), 397-414. [PubMed:21867484] [WorldCat] [DOI] - ↑ 10.0 10.1
Shih, J.C., Chen, K., & Ridd, M.J. (1999).
Monoamine oxidase: from genes to behavior. Annual review of neuroscience, 22, 197-217. [PubMed:10202537] [PMC] [WorldCat] [DOI] - ↑
Westlund, K.N., Krakower, T.J., Kwan, S.W., & Abell, C.W. (1993).
Intracellular distribution of monoamine oxidase A in selected regions of rat and monkey brain and spinal cord. Brain research, 612(1-2), 221-30. [PubMed:8330200] [WorldCat] [DOI] - ↑ 12.0 12.1
Westlund, K.N., Denney, R.M., Rose, R.M., & Abell, C.W. (1988).
Localization of distinct monoamine oxidase A and monoamine oxidase B cell populations in human brainstem. Neuroscience, 25(2), 439-56. [PubMed:3399053] [WorldCat] [DOI] - ↑
Cases, O., Seif, I., Grimsby, J., Gaspar, P., Chen, K., Pournin, S., ..., & Shih, J.C. (1995).
Aggressive behavior and altered amounts of brain serotonin and norepinephrine in mice lacking MAOA. Science (New York, N.Y.), 268(5218), 1763-6. [PubMed:7792602] [PMC] [WorldCat] [DOI] - ↑
Grimsby, J., Toth, M., Chen, K., Kumazawa, T., Klaidman, L., Adams, J.D., ..., & Shih, J.C. (1997).
Increased stress response and beta-phenylethylamine in MAOB-deficient mice. Nature genetics, 17(2), 206-10. [PubMed:9326944] [WorldCat] [DOI] - ↑
Nelson, P.J., & Rudnick, G. (1979).
Coupling between platelet 5-hydroxytryptamine and potassium transport. The Journal of biological chemistry, 254(20), 10084-9. [PubMed:489585] [WorldCat] - ↑
Benmansour, S., Owens, W.A., Cecchi, M., Morilak, D.A., & Frazer, A. (2002).
Serotonin clearance in vivo is altered to a greater extent by antidepressant-induced downregulation of the serotonin transporter than by acute blockade of this transporter. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(15), 6766-72. [PubMed:12151556] [PMC] [WorldCat] [DOI] - ↑
David, D.J., Bourin, M., Jego, G., Przybylski, C., Jolliet, P., & Gardier, A.M. (2003).
Effects of acute treatment with paroxetine, citalopram and venlafaxine in vivo on noradrenaline and serotonin outflow: a microdialysis study in Swiss mice. British journal of pharmacology, 140(6), 1128-36. [PubMed:14530210] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Barnes, N.M., & Sharp, T. (1999).
A review of central 5-HT receptors and their function. Neuropharmacology, 38(8), 1083-152. [PubMed:10462127] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2 19.3 19.4
Ciranna, L. (2006).
Serotonin as a modulator of glutamate- and GABA-mediated neurotransmission: implications in physiological functions and in pathology. Current neuropharmacology, 4(2), 101-14. [PubMed:18615128] [PMC] [WorldCat] - ↑ 20.0 20.1 20.2 20.3
Millan, M.J., Marin, P., Bockaert, J., & Mannoury la Cour, C. (2008).
Signaling at G-protein-coupled serotonin receptors: recent advances and future research directions. Trends in pharmacological sciences, 29(9), 454-64. [PubMed:18676031] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2
Pytliak, M., Vargová, V., Mechírová, V., & Felšöci, M. (2011).
Serotonin receptors - from molecular biology to clinical applications. Physiological research, 60(1), 15-25. [PubMed:20945968] [WorldCat] - ↑
Zhou, F.M., & Hablitz, J.J. (1999).
Activation of serotonin receptors modulates synaptic transmission in rat cerebral cortex. Journal of neurophysiology, 82(6), 2989-99. [PubMed:10601434] [WorldCat] [DOI] - ↑
Troca-Marín, J.A., & Geijo-Barrientos, E. (2010).
Inhibition by 5-HT of the synaptic responses evoked by callosal fibers on cortical neurons in the mouse. Pflugers Archiv : European journal of physiology, 460(6), 1073-85. [PubMed:20838806] [WorldCat] [DOI] - ↑
Dubin, A.E., Huvar, R., D'Andrea, M.R., Pyati, J., Zhu, J.Y., Joy, K.C., ..., & Erlander, M.G. (1999).
The pharmacological and functional characteristics of the serotonin 5-HT(3A) receptor are specifically modified by a 5-HT(3B) receptor subunit. The Journal of biological chemistry, 274(43), 30799-810. [PubMed:10521471] [WorldCat] [DOI] - ↑
Barnes, N.M., Hales, T.G., Lummis, S.C., & Peters, J.A. (2009).
The 5-HT3 receptor--the relationship between structure and function. Neuropharmacology, 56(1), 273-84. [PubMed:18761359] [PMC] [WorldCat] [DOI] - ↑
van Hooft, J.A., & Vijverberg, H.P. (2000).
5-HT(3) receptors and neurotransmitter release in the CNS: a nerve ending story? Trends in neurosciences, 23(12), 605-10. [PubMed:11137150] [WorldCat] [DOI] - ↑ 27.0 27.1
Glaum, S.R., Brooks, P.A., Spyer, K.M., & Miller, R.J. (1992).
5-Hydroxytryptamine-3 receptors modulate synaptic activity in the rat nucleus tractus solitarius in vitro. Brain research, 589(1), 62-8. [PubMed:1422823] [WorldCat] [DOI] - ↑
Fukushima, T., Ohtsubo, T., Tsuda, M., Yanagawa, Y., & Hori, Y. (2009).
Facilitatory actions of serotonin type 3 receptors on GABAergic inhibitory synaptic transmission in the spinal superficial dorsal horn. Journal of neurophysiology, 102(3), 1459-71. [PubMed:19369358] [WorldCat] [DOI] - ↑
Torres, G.E., Chaput, Y., & Andrade, R. (1995).
Cyclic AMP and protein kinase A mediate 5-hydroxytryptamine type 4 receptor regulation of calcium-activated potassium current in adult hippocampal neurons. Molecular pharmacology, 47(1), 191-7. [PubMed:7838128] [WorldCat] - ↑
Kobayashi, K., Ikeda, Y., Haneda, E., & Suzuki, H. (2008).
Chronic fluoxetine bidirectionally modulates potentiating effects of serotonin on the hippocampal mossy fiber synaptic transmission. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(24), 6272-80. [PubMed:18550770] [PMC] [WorldCat] [DOI] - ↑
King, M.V., Marsden, C.A., & Fone, K.C. (2008).
A role for the 5-HT(1A), 5-HT4 and 5-HT6 receptors in learning and memory. Trends in pharmacological sciences, 29(9), 482-92. [PubMed:19086256] [WorldCat] [DOI] - ↑
Cai, X., Flores-Hernandez, J., Feng, J., & Yan, Z. (2002).
Activity-dependent bidirectional regulation of GABA(A) receptor channels by the 5-HT(4) receptor-mediated signalling in rat prefrontal cortical pyramidal neurons. The Journal of physiology, 540(Pt 3), 743-59. [PubMed:11986365] [PMC] [WorldCat] [DOI] - ↑
Nelson, D.L. (2004).
5-HT5 receptors. Current drug targets. CNS and neurological disorders, 3(1), 53-8. [PubMed:14965244] [WorldCat] - ↑
Tassone, A., Madeo, G., Schirinzi, T., Vita, D., Puglisi, F., Ponterio, G., ..., & Bonsi, P. (2011).
Activation of 5-HT6 receptors inhibits corticostriatal glutamatergic transmission. Neuropharmacology, 61(4), 632-7. [PubMed:21619890] [WorldCat] [DOI] - ↑
Chapin, E.M., & Andrade, R. (2001).
A 5-HT(7) receptor-mediated depolarization in the anterodorsal thalamus. II. Involvement of the hyperpolarization-activated current I(h). The Journal of pharmacology and experimental therapeutics, 297(1), 403-9. [PubMed:11259569] [WorldCat] - ↑
Daubert, E.A., & Condron, B.G. (2010).
Serotonin: a regulator of neuronal morphology and circuitry. Trends in neurosciences, 33(9), 424-34. [PubMed:20561690] [PMC] [WorldCat] [DOI] - ↑
Cowen, P.J. (2008).
Serotonin and depression: pathophysiological mechanism or marketing myth? Trends in pharmacological sciences, 29(9), 433-6. [PubMed:18585794] [WorldCat] [DOI]