海馬
石塚 典生
公益財団法人 東京都医学総合研究所 運動感覚研究分野・学習記憶プロジェクト
DOI:10.14931/bsd.2829 原稿受付日:2012年11月28日 原稿完成日:2013年1月23日 更新日:2014年6月24日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
羅、英:hippocampus
Wikipediaより。
海馬とは
側脳室下角底部に隆起する大脳皮質を両側合わせて肉眼的に見ると、ギリシャ神話に登場する海神ポセイドンがまたがる海馬の前肢の形に似ていることからイタリア・ボロ−ニャの解剖学者 Giulio Cesare Arantio (1587) はHippocampus(海馬)と命名した。側脳室下角前方へ膨らんだ部分を海馬足(pes hippocampi)とよぶ。魚類のタツノオトシゴもhippocampus と呼ばれるが、脳部位の海馬とは独立して神話の海馬から連想して命名されたという[1]。海馬の別称として、Ram's Horn(羊の角、Winslow, 1732)、Cornu Ammonis (エジプトの太陽神アモン神の角、de Garengeot, 1742)などがある。Arantio 自身、hippocampusとは別にvermis bombycinus(蚕)とも呼んだ。和名の海馬は、Zeepaard(蘭)、Seepferd(独)、sea-horse (英)からの訳である。
アンモン角の内側面は、まるで小児の歯のような隆起が一列に並んでおり、歯状回と呼ばれる。この構造を初めて図示・記載したのはTarin (1750)という。歯状回はもともとは海馬の付属物とされていたようで、Vicq d'Azyr は「襞彫り様の、あるいは鋸歯状に凹みを成す内縁」と記述した。これをDöllinger (1814) がgezähnte Leiste(歯状縁) と呼び、Meckel (1817)がfascia dentataとラテン名に訳して使用した。歯状回は、古くは鋸歯状体、海馬歯状膜などとも呼ばれた。
海馬台は、歯状回内側から嗅脳溝方向へ続く皮質部分を言うが、人脳ではアンモン角を下方から支える土台を成すので、Unterlage des Ammonshorns(subiculum cornu ammonis)と命名された(Burdach、1822)。和名では海馬台(あるいは海馬支脚)と呼ばれる。ちなみに、この皮質部分は、表層部に神経線維が多く、脳表面が白く見えるので白色皮質といわれる。表層部を白網状質(substantia reticularis alba Arnoldi)という。
海馬の構造と機能についての詳細は文献[2] [3] [4] [5](英文)、文献[6] [7] [8] [9] [10](和文)、池谷によるwebsite “海馬”を究める、東京都神経科学総合研究所websiteを参照。
解剖
内部構造
大脳皮質は神経細胞の細胞構築により、前頭領域、後頭領域など11の領域 (Area) に大別され、嗅脳溝より内側部分は海馬領域と呼ばれる[11]。海馬領域中、海馬に連続する領域で海馬溝から嗅脳溝(後方では側副溝)との間は海馬傍回(gyrus parahippocampalis)と呼ばれ、海馬台前野、嗅内野 (area entorhinalis)、嗅脳溝周囲野の三領野に区分される。ちなみに、この脳回は、以前は海馬回(gyrus hippocampalis)と呼ばれた。
入力線維
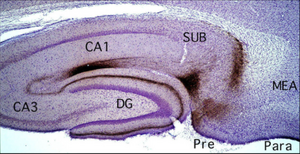
焦茶色に見えるのが、標識された軸索の終末
海馬体への入力路としては、1)嗅内野からの貫通線維束(図2)、2)内側中隔核、乳頭体上核、青斑核、縫線核から上行してくる脳弓、および3)反対側CA3と歯状回門からの交連線維が通る腹側海馬交連がある。貫通線維束は大脳皮質から記憶の元となる情報を運び、交連線維は海馬内情報処理回路の一部を担い、上行性入力は海馬体内部回路の活動を修飾する。皮質性の貫通線維束とCA3線維はグルタミン酸、内側中隔核線維はアセチルコリンと GABA、乳頭体上核線維はドーパミン、青斑核線維はアドレナリン、縫線核線維はセロトニン、そして、反対側の歯状回多形細胞からの線維はGABAを伝達物質としている。
貫通線維束は海馬台錐体細胞層を貫いて分子層へ出て、海馬台(SUB)、アンモン角、歯状回(DG)の分子層に同時に投射する。内側嗅内野(MEA)へ白インゲン豆レクチン(PHA-L)を注入し、取り込んだ細胞から海馬体各領域への軸索投射および終末分布を可視化した像を図2に示す。嗅内野II層からは歯状回とCA3 へ投射し、外側嗅内野(LEA)からの線維が分子層の表層部分に、内側嗅内野(MEA)からの線維がより深い部分に分布する。III 層からはCA1 と海馬台の分子層および海馬台の最深層に両側性に投射があり、MEAからの投射線維はCA1の近位部(CA3に近い側)と海馬台の遠位部(前海馬台Preに近い側)に終止し、LEAからの投射線維はCA1の遠位部と海馬台の近位部に終止する。したがって、歯状回顆粒細胞とCA3錐体細胞は一様にMEA、LEA両領域からの情報を受けるのに対し、CA1と海馬台錐体細胞は、近位部・遠位部によってMEAのみ、あるいはLEAのみの情報を受ける。他の皮質入力としては、サルでは嗅周皮質や前頭葉からCA1への入力の報告もあるが、ラットではあまり見られない。
内部回路
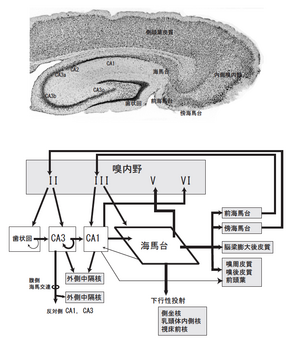
文献[9]より改変
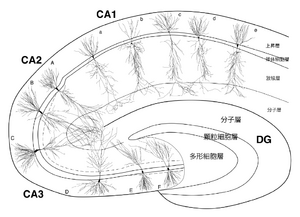
文献[12]より改変
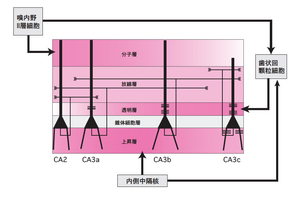
文献[8]より改変
他の皮質領域と同様に、海馬体にも興奮性の結合と抑制性の結合が存在する(図3)。興奮性ニューロンの概数は、SDラットで、歯状回顆粒細胞が100万、CA3錐体細胞が33万、CA1錐体細胞が42万、海馬台錐体細胞が13万という。ヒトでは歯状回顆粒細胞が880万、CA3錐体細胞が232万、CA1錐体細胞が472万である。抑制性細胞の数はよくわかっていない。
歯状回
分子層、顆粒細胞層、多形細胞層よりなる。横断面では、顆粒細胞層がCA3錐体細胞層を挟むように「つ」の字形を示し、開いた部分を門(hilus)という。歯状回には興奮性細胞として顆粒細胞と苔状細胞があり、多形細胞層には多種の抑制性細胞がある。歯状回細胞の投射はすべて歯状回とCA3領域にとどまる。顆粒細胞は苔状線維によって苔状細胞とCA3錐体細胞に結合する。苔状線維終末は大きく、両種細胞の樹状突起基部にある棘状瘤(thorny excrescence) を包み囲むシナプスを作っている。苔状線維は、海馬長軸(中隔側頭葉軸)に直交する比較的幅の狭い(600 μm程度)領域内(ラメラ)を走行するが、CA3の遠位側に向かうほど長軸方向に広がる。歯状回門には歯状回を長軸方向に結合する興奮性及び抑制性と考えられる細胞が存在する。興奮性と考えられる苔状細胞の軸索は、起始部位から長軸方向に約1mm以上離れたレベルの歯状回分子層へ投射する。他方、抑制性と考えられる歯状回門の細胞は、起始細胞より長軸方向の前後にそれぞれ400μm以内のレベルの歯状回門および分子層に分布し、歯状回顆粒細胞と結合する。つまり、あるレベルの歯状回顆粒細胞が興奮すると、長軸方向に400 μm以内のレベルではネガティブフィードバックがかかり、それより遠位ではポジティブフィードバックがかかる結合構造になっている。
海馬(アンモン角)
領域区分
組織学的な領域区分としては、Cajalはアンモン角の上部(背側部)に位置する小錐体細胞群をregio superieur、下方の大錐体細胞群をregio inferieurと区分したが、現在ではLorente de Nó(1934)[13]の区分CA1〜CA4領域(CAはCornu Ammonis に由来する)が一般に用いられることが多い(図3)。CA1が小錐体細胞、CA2〜CA4が大錐体細胞にあたる。CA2は苔状線維を受ける棘状瘤を持たない大錐体細胞群をさす。CA4は歯状回に陥入した門 (hilus) と呼ばれる部分に位置する大錐体細胞群で、霊長類やネコで顕著だが、齧歯類ではCA4の細胞塊は見られず、CA3錐体細胞に似た大型の細胞(苔状細胞)が散在するにとどまる。アンモン角には脳軟膜から脳室方向に分子層、放線層、透明層、錐体細胞層、上昇層が識別される。透明層は苔状線維の走行部位で、CA2、CA1ではこれを欠く。アンモン角の脳室面には、海馬領域への入出力線維からなる海馬白板があり、海馬上縁では海馬采となり上方で脳弓へ連続する。
CA3
CA3への入力は、分子層に貫通線維、透明層に苔状線維、上昇層に内側中隔核からの線維、放線層と上昇層にCA3の連合線維と交連線維が終止する。乳頭体上核からの線維はCA2、CA3a の上昇層に多く終止する。樹状突起の総長と各層へ分布する部分突起長は細胞体の位置によって連続的に異なる(図4、細胞A-F)。総長は約7.5mm(CA3c:歯状回側細胞F)から18.0 mm(CA3a:CA1側細胞B)である。CA2錐体細胞は分子層への樹状突起分布量が多く、嗅内野入力を最大に受容しているが、透明層を欠くから顆粒細胞からの情報を受けない(図4、細胞A)。これの対極にあるCA3cでは嗅内野入力の受容が最小で、分子層に全く突起を分布しないCA3c細胞(図4、細胞F)もある。そして、歯状回顆粒細胞からの入力はCA3cが最大に受ける。基底樹状突起長は、海馬采付着部 の細胞で最大で、CA1と歯状回の双方向へ向け漸減する。上昇層へは内側中隔核入力と同時に同側・対側のCA3錐体細胞からの投射があり、基底樹状突起長と入力の関係が一意には定まらない。放線層では、樹状突起部分長に各亜区分間の顕著な差は見られない。これらの終止の濃淡を様相を模式的に図5に示す。
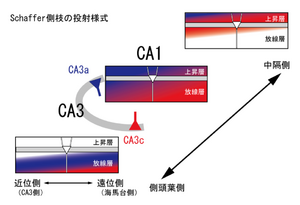
CA3 錐体細胞の出力は両側性で、Schaffer側枝によってCA1放線層と上昇層へ投射するとともに、CA3領域へも連合性側枝を分布する[14]。 CA3cからは歯状回門へも少量の分布がある。さらに、両側性に外側中隔核に投射するが、海馬台や嗅内野には投射しない。Schaffer側枝は海馬長軸方向に5 mm以上にわたり投射し(海馬の全長は約8 mm)、CA3錐体細胞の細胞体の位置や投射レベルによってCA1への終止部位が連続的・段階的に変化する(図6)。第一に、CA3cからは中隔方向へ投射が多く、軸索は主に放線層に分布して頂上樹状突起に終止する。反対に、CA3aからは側頭葉方向へ投射が多く、軸索は主に上昇層に分布し、基底樹状突起に終止する割合が多い。第二に、投射レベルが中隔側に行くほど終止部位がCA1近位部(CA3側)かつ海馬白板側に移行し、樹状突起の下方に終止するのに対し、投射レベルが側頭葉側ほどCA1遠位部(海馬台側)かつ放線層浅層へ終止する。CA3内の連合性軸索側枝は、CA3c錐体細胞ではCA3c域に限局して終止するのに対し、CA3a錐体細胞の軸索は横断面上でもCA3領域内に広く分布している。長軸方向の分布では、終止部位の頂上・基底方向への変移もCA1への投射様式と同様に見られる。
CA1
CA1錐体細胞の軸索側枝は、上昇層には若干の終末分布があるが、放線層へは投射しない。また長軸方向へはほとんど投射せず、CA1錐体細胞間には連合性結合がほとんどない。終末は、錐体細胞層下部に位置する抑制性の籠細胞への終止が考えられる。CA1錐体細胞の樹状突起長は平均13.4mmである。樹状突起にある棘(スパイン)の分布密度は部分によって異なり、太い突起ではシャフトに棘が隠れるため、棘の総数を正確に数えることは困難であるが、層毎の棘分布密度と樹状突起の部分長から棘の総数を推定すると、1個のCA1錐体細胞は少なくも約15,000の棘を持つ。そして、約10%が分子層にある。樹状突起のシャフトに終わる抑制性シナプスの数は未だ概算されていない。
CA1錐体細胞からは、海馬台錐体細胞層の浅層2/3と分子層に投射し、錐体細胞層深層へは終止しない。また、CA1近位部は海馬台遠位部へ、CA1遠位部は隣接する海馬台近位部へ投射する。CA1錐体細胞の軸索はCA3や歯状回へは投射しないが、抑制性細胞ではCA3や歯状回門に軸索を分布する細胞もあるという。
CA1から海馬体以外への出力としては、同側の外側中隔核、嗅内野VI層、前頭前野への投射があるが、中隔側坐核には投射しない。嗅内野投射では、CA1遠位部からLEA、近位部からMEAという局所対応が見られる。
出力
文献[9]より改変
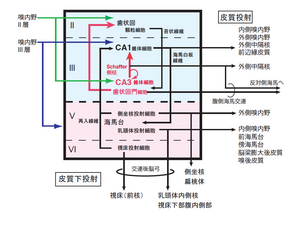
歯状回細胞、およびアンモン角錐体細胞の出力は皮質性投射であるのに対し、海馬台錐体細胞は皮質性投射に加えて皮質下(線条体、視床、視床下部、乳頭体)に投射する(図3,7)。海馬台錐体細胞層には、皮質下に投射する中隔側坐核(線条体)投射細胞、乳頭体内側核投射細胞、視床腹側前核投射細胞が、錐体細胞層の表層から深層へと層状に分布しており、大脳皮質V・VI層に見られる皮質下投射細胞の深浅配列順序と同じである[15]。
海馬台からの皮質性投射は、ラットでは、嗅内野、嗅周皮質(近位部からのみ)、前海馬台、傍海馬台、顆粒性脳梁膨大後部皮質、前頭前野などへの投射がある。これらの投射は主に線条体投射細胞や乳頭体投射細胞から起こる。嗅内野へは、主にV, VI層に終止し、海馬台の近位部(CA1側)がLEAへ、遠位部がMEA内側部へ投射する。前海馬台、傍海馬台への投射にも局所対応結合が見られる。また、錐体細胞層の深部からはCA1へ戻る投射(再入線維:re-entrant fiber)がある。
層構造
大脳皮質のそれぞれの領野は一般にVI層構造をとるとされ、各層は特異的な出力投射様式を示す[16]。II層は同側性に近位への皮質投射、III層は遠位への皮質投射で交連性投射を含む、IV層は視床特異核からの入力を受け顆粒上層(II、 III層)へ軸索を送る、V層は視床下部、脳幹、脊髄への下行性投射の起始部、VI層は主に視床への投射部位である。これに対して、海馬体に属する歯状回、アンモン角、海馬台は、それぞれが独立した皮質領域と考えられ、単純な層構造を示す皮質と考えられてきた。しかしながら、海馬体の各領域と大脳皮質各層の主に出力様式から見た神経結合を比較して見ると、歯状回は大脳皮質のII層、アンモン角(CA1~CA4)はIII層、海馬台はV-VI層に相当すると考える事ができる。したがって、海馬体全体で大脳皮質の一領野を構成しているといえる(図8)。IV層は体性感覚野、聴覚野、視覚野などの感覚皮質で特に発達しており、視床特異核からの入力を受ける顆粒細胞からなる層であり、もともと側頭葉ではほとんど発達しておらず、海馬体でもこれを欠く。
機能
青は大脳皮質領域、ピンクは皮質下領域の出力先、橙色は皮質下領域からの入力路
海馬は大辺縁葉(le grand lobe linbique, Broca)[17]の一部を構成し、嗅脳に隣接するからか、20世紀中頃まで嗅覚機能に関与すると考えられていた。しかしBrodal[18]は、これまでの神経結合の所見を検討して、海馬嗅覚皮質説に疑問を示した。嗅球から海馬への一ないし二シナプス性入力は、現在の解剖・生理実験でも否定的所見が多い。近年、嗅覚の一次中枢としては、前頭葉下面後部にある梨状葉皮質(pyriform cortex)、嗅結節、扁桃体周囲皮質などが同定されている。
海馬が知的機能や記憶に関与するとの示唆は、Brown とSchäfer (1888)の実験に見られる[19]。海馬を含む側頭葉内側部を両側性に傷害したアカゲザルでは、凶暴だった性格がおとなしくなった。視・聴・触・味・嗅覚の感覚それ自体には異常を認めないが、音や見える物の意味が理解できない。見慣れた物を与えても、はじめて接する物のごとく口にいれたり、嗅いだりして確かめ、しばらくして同じ物を与えてもやはり同様の行動を何回もくりかえした。Klüver とBucy (1939)はアカゲザルの海馬・鈎の両側切除術によって、思考脱線、精神盲(視覚失認)、易馴応性、性欲亢進などの症状が起こることを観察し[20]、Brown らの所見を追認した。
ヒトでは、Bechterew (1899)、Grünthal (1947)[21]、GleesとGriffith (1952)ら[22]が、近時記憶に著しい障害のあった患者の脳を死後剖検し、両側の海馬や海馬傍回に器質性病変のあることを報告した。そして、ScovilleとMilner (1957)が難治性てんかん患者の治療目的で、両側側頭葉内側部(扁桃体、海馬傍回、海馬前方2/3 )の切除術を行ったところ、強度の順行性記憶障害を惹起したことを報告した[23]。患者らは知能指数にはまったく問題がみられないが、術後の事象の記憶が全然できない。人の顔や名前は全く記憶することができず、受けた指示の内容だけでなく指示されたことも覚えていない。また術前3年までぐらいの逆行性健忘も見られた。一方、数年より以前の事象は思い出すことが可能で、以来、海馬が近時記憶と長期記憶の形成(記銘)の部位として注目されるようになった。
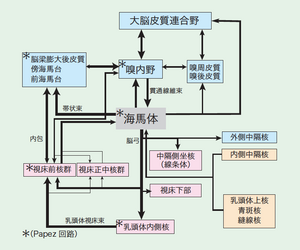
記憶機能には記銘(つくる)、貯蔵(しまう)、想起(とりだす)の過程があり、それぞれの記憶過程には、これを司る特異的脳部位があると考えられる。大脳皮質連合野で分析された種々の情報は、嗅周皮質と嗅内野で混合され、嗅内野から貫通線維束として海馬体に入る(図8)。海馬の中に入ってきた信号は、すでに視覚、聴覚といった感覚種(modality)が曖昧な超感覚種の信号という[24]。これらの情報は海馬体の内部回路により信号処理され、脳弓によって皮質下構造(視床前核、視床下部、乳頭体、中隔側坐核)へ出力されるとともに、複数の投射経路によって嗅内野へ帰還する。そして、嗅内野から大脳皮質へ信号が運ばれ、記憶として貯蔵されると考えられる。海馬の中では感覚種は識別されなくなっているといわれるが、特定の場所に来たときに特別に反応する細胞(場所細胞: Place cells)が見つかっている。海馬の外では、前海馬台には頭部の方向選択制にかかわる細胞(head-direction cells)や空間上の規則正しいスポットに来たときに特別に反応する細胞(グリッド細胞:Grid cells)などが見つかっている。
前述の難治性てんかんの治療で両側海馬体を除去した症例(患者HMなど)や一時的心停止後にCA1細胞が特異的に脱落した症例(患者RB)では、遠い過去の記憶の想起は可能だが、顕著な順行性健忘(記銘障害)が見られた。アルツハイマー病では早期に記銘障害が出現することが特徴で、まず嗅内野、海馬台、CA1に変性が見られる。他方、乳頭体変性をきたすコルサコフ症候群や間脳性の傷害では、順行性健忘に加えて逆行性健忘(想起障害)も見られる。さらに、大脳皮質の広範囲に変性が見られる老人性痴呆では、全般的な記憶の破壊が見られる。また、エピソード形成(記憶事象の順序立て)や想起には海馬—脳弓—乳頭体—乳頭体視床束 (Vicq d'Azyr束) —視床前核—帯状回—海馬と続くPapez 回路や前頭葉の関与が考えられている(Squier, 1987)。Papez (1937) は、もともとは情動発現を司る部位として視床下部を、情動経験の部位として大脳半球内側皮質(帯状回、海馬)と視床を推定し、この回路は情動に関与すると考えたが、実はこれが記憶に密接に関与する回路であることがわかってきた。
記憶の形成には神経回路の機能的強化であるシナプスの長期増強(long term potentiation, LTP) の現象が起こり、後に構造変化が起こるとされている。
関連項目
外部リンク
- 池谷による 海馬を究める
- 東京都神経科学総合研究所
参考文献
- ↑ 小川鼎三
医学用語の起こり
東京書籍 1983, p100 - ↑ Amaral DG, Insausti R.
Hippocampal formation. In: Paxinos G, editor. The Human Nervous System.
San Diego: Academic Press. pp. 711-755. 1990. - ↑ Amaral DG, Witter MP.
Hippocampal formation. Paxinos G, ed. "The Rat Nervous System".
San Diego: Academic Press. pp. 443-493. 1995. - ↑
Freund, T.F., & Buzsáki, G. (1996).
Interneurons of the hippocampus. Hippocampus, 6(4), 347-470. [PubMed:8915675] [WorldCat] [DOI] - ↑ Gloor P
The Temporal Lobe and Limbic System.
Oxford University Press, New York, 1997 - ↑ 石塚典生
海馬の細胞構築と神経結合
神経進歩 38:5-22 (1994) - ↑ 石塚典生
海馬の構造と線維連絡
脳と神経 50:881-892 (1998) - ↑ 8.0 8.1 石塚典生
記憶のしくみ 解剖学的面から
CLINICAL NEUROSCIENCE 16:130-134 (1998) - ↑ 9.0 9.1 9.2 石塚典生
大脳辺縁系の神経結合と細胞構築
神経進歩 50:7-17 (2006) - ↑ 石塚典生
海馬領域における縦走性線維投射
BRAIN and NERVE 60:737-745 (2008) - ↑ Korbinian Brodmann
Vergleichende Lokalisationslehre der Grosshirnrinde in ihren Prinzipien dargestellt auf Grund des Zellenbaues
Johann Ambrosius Barth Verlag, Leipzig, 1909 - ↑
Ishizuka, N., Cowan, W.M., & Amaral, D.G. (1995).
A quantitative analysis of the dendritic organization of pyramidal cells in the rat hippocampus. The Journal of comparative neurology, 362(1), 17-45. [PubMed:8576427] [WorldCat] [DOI] - ↑ Lorente De Nó, R
Studies on the structure of the cerebral cortex. Continuation of the study of the ammonic system.
J. Psychol. Neurol. 46: 113–177, (1934) - ↑
Ishizuka, N., Weber, J., & Amaral, D.G. (1990).
Organization of intrahippocampal projections originating from CA3 pyramidal cells in the rat. The Journal of comparative neurology, 295(4), 580-623. [PubMed:2358523] [WorldCat] [DOI] - ↑
Ishizuka, N. (2001).
Laminar organization of the pyramidal cell layer of the subiculum in the rat. The Journal of comparative neurology, 435(1), 89-110. [PubMed:11370013] [WorldCat] [DOI] - ↑ Ishizuka N
Structural organization of the efferent channels of the subiculum.
In: Limbic and Association Cortical Systems – Basic, Clinical and Computational Aspects.
Eds by Ono T, Matsumoto G, Linas RR, Berthoz A, Norgrren R, Nishijo H and Tamura R.
Elsevier, Amsterdam p.121-129 (2003). International Congress Series 1250. - ↑ Paul Broca
Localisations des fonctions cérébrales. Siège de la faculté du langage articulé.
Bulletin de la Société d’Anthropologie 4: 200–208, 1863. - ↑
BRODAL, A. (1947).
The hippocampus and the sense of smell; a review. Brain : a journal of neurology, 70(Pt 2), 179-222. [PubMed:20261820] [WorldCat] [DOI] - ↑ Brown, S. and Schäfer, E.A.
An investigation into the functions of the occipital temporal lobes of the monkey's brain.
Phil. Trans. R. Soc. Lond. B 179, 303-327 - ↑
Klüver, H., & Bucy, P.C. (1997).
Preliminary analysis of functions of the temporal lobes in monkeys. 1939. The Journal of neuropsychiatry and clinical neurosciences, 9(4), 606-20. [PubMed:9447506] [WorldCat] [DOI] - ↑ Grünthal, E.
Über das klinische Bild nach umschriebenen beiderseitigem Ausfall der Ammonshornrinde.
Monatsschr. Psychiat. Neurol., 113, 1-16, 1947 - ↑
GLEES, P., & GRIFFITH, H.B. (1952).
Bilateral destruction of the hippocampus (cornu ammonis) in a case of dementia. Monatsschrift fur Psychiatrie und Neurologie, 123(4-5), 193-204. [PubMed:14947832] [WorldCat] - ↑
SCOVILLE, W.B., & MILNER, B. (1957).
Loss of recent memory after bilateral hippocampal lesions. Journal of neurology, neurosurgery, and psychiatry, 20(1), 11-21. [PubMed:13406589] [PMC] [WorldCat] [DOI] - ↑
Jones, E.G., & Powell, T.P. (1970).
An anatomical study of converging sensory pathways within the cerebral cortex of the monkey. Brain : a journal of neurology, 93(4), 793-820. [PubMed:4992433] [WorldCat] [DOI]