「抗てんかん薬」の版間の差分
細 →作用機序 |
細 →作用機序 |
||
| (同じ利用者による、間の1版が非表示) | |||
| 24行目: | 24行目: | ||
[[ファイル:Takeyama Fig 1.png|サムネイル|右|400px|'''図1. 抗てんかん薬の主な作用機序'''<br>[[AMPA]]: [[α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸]] ([[α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid]]); [[GABA]]: [[γ-アミノブチル酸]] ([[γ-aminobutyric acid]]); [[NMDA]]: [[N-メチル-D-アスパラギン酸]] ([[N-methyl-D-aspartate]]), [[SV2A]]: [[シナプス小胞タンパク質2A]] ([[synaptic vesicle glycoprotein 2A]])。文献<ref name=ref2 />より修正の上、引用。]] | [[ファイル:Takeyama Fig 1.png|サムネイル|右|400px|'''図1. 抗てんかん薬の主な作用機序'''<br>[[AMPA]]: [[α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸]] ([[α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid]]); [[GABA]]: [[γ-アミノブチル酸]] ([[γ-aminobutyric acid]]); [[NMDA]]: [[N-メチル-D-アスパラギン酸]] ([[N-methyl-D-aspartate]]), [[SV2A]]: [[シナプス小胞タンパク質2A]] ([[synaptic vesicle glycoprotein 2A]])。文献<ref name=ref2 />より修正の上、引用。]] | ||
== 作用機序 == | == 作用機序 == | ||
抗てんかん薬は、[[イオンチャネル]]に対して影響を与え、神経細胞の過剰興奮を抑制することでその発作抑制効果を発揮していると考えられている。その作用点は大きく7つが現在挙げられている。'''図1'''に、抗てんかん薬の主な作用機序を示す<ref name=ref2>'''吉村元、松本理器'''<br>てんかんの新規治療薬<br>Annual Review神経2018 中外医学社、2018</ref>。'''表1'''に主要な薬剤とイオンチャネルの関係で、比較的よくわかっているものを、'''表2'''に抗てんかん薬の作用点による効果の特徴をまとめた<ref name=ref3>'''兼本浩祐'''<br>てんかん学ハンドブック 第3版<br>医学書院, 2012</ref>。 | 抗てんかん薬は、[[イオンチャネル]]に対して影響を与え、神経細胞の過剰興奮を抑制することでその発作抑制効果を発揮していると考えられている。その作用点は大きく7つが現在挙げられている。'''図1.'''に、抗てんかん薬の主な作用機序を示す<ref name=ref2>'''吉村元、松本理器'''<br>てんかんの新規治療薬<br>Annual Review神経2018 中外医学社、2018</ref>。'''表1.'''に主要な薬剤とイオンチャネルの関係で、比較的よくわかっているものを、'''表2.'''に抗てんかん薬の作用点による効果の特徴をまとめた<ref name=ref3>'''兼本浩祐'''<br>てんかん学ハンドブック 第3版<br>医学書院, 2012</ref>。 | ||
抗てんかん薬の効果は、'''表1'''に整理したように、作用点との関連で、①[[電位依存性イオンチャネル]]、②[[リガンド依存性イオンチャネル|リガンド(配位子)依存性イオンチャネル]]、③[[GABA]]代謝阻害、④[[シナプス小胞タンパク質2A]]([[synaptic vesicle glycoprotein 2A]]、[[SV2A]])、の4つの大きなグループに分けて考えると理解しやすい。なお、リガンド依存性イオンチャネルとは、細胞膜に置かれた受容体の一種で、情報伝達物質が結合する(配位される)ことで機能するイオンチャネルのことである。 | 抗てんかん薬の効果は、'''表1.'''に整理したように、作用点との関連で、①[[電位依存性イオンチャネル]]、②[[リガンド依存性イオンチャネル|リガンド(配位子)依存性イオンチャネル]]、③[[GABA]]代謝阻害、④[[シナプス小胞タンパク質2A]]([[synaptic vesicle glycoprotein 2A]]、[[SV2A]])、の4つの大きなグループに分けて考えると理解しやすい。なお、リガンド依存性イオンチャネルとは、細胞膜に置かれた受容体の一種で、情報伝達物質が結合する(配位される)ことで機能するイオンチャネルのことである。 | ||
[[選択的ナトリウムチャネル阻害薬|選択的ナトリウム(Na<sup>+</sup>)チャネル阻害薬]]、[[選択的高電位活性型カルシウムチャネル阻害薬|選択的高電位活性型(非T型)カルシウム(Ca<sup>2+</sup>)チャネル阻害薬]]、[[選択的GABA代謝阻害薬]]は、いずれも[[焦点性てんかん]]に選択的に有効であるが、一方で[[特発性全般てんかん]]群を悪化させる場合がある。対照的に、[[選択的低電位活性型カルシウムチャネル阻害薬|選択的低電位活性型(T型)カルシウムチャネル阻害薬]]は、[[欠神発作]]あるいは[[欠神脱力発作]]といった特発性の[[全般発作]]に選択的に有効性を示す。抗[[グルタミン酸受容体]]作用をもつ薬剤([[トピラマート]]、[[ラモトリギン]]、[[バルプロ酸ナトリウム]]、[[ペランパネル]])、シナプス小胞タンパク質2Aに作用するとされる[[レベチラセタ]]や、[[ナトリウムチャネル|Na<sup>+</sup>チャネル]]阻害作用と抗[[T型カルシウムチャネル|低電位活性型(T型)カルシウムチャネル]]阻害作用を有する[[ゾニサミド]]は、抗[[焦点起始発作]]([[部分発作]])と抗[[全般起始発作]]([[全般発作]])作用を併せもち、広域スペクトラムの抗てんかん薬と位置づけられる。 | [[選択的ナトリウムチャネル阻害薬|選択的ナトリウム(Na<sup>+</sup>)チャネル阻害薬]]、[[選択的高電位活性型カルシウムチャネル阻害薬|選択的高電位活性型(非T型)カルシウム(Ca<sup>2+</sup>)チャネル阻害薬]]、[[選択的GABA代謝阻害薬]]は、いずれも[[焦点性てんかん]]に選択的に有効であるが、一方で[[特発性全般てんかん]]群を悪化させる場合がある。対照的に、[[選択的低電位活性型カルシウムチャネル阻害薬|選択的低電位活性型(T型)カルシウムチャネル阻害薬]]は、[[欠神発作]]あるいは[[欠神脱力発作]]といった特発性の[[全般発作]]に選択的に有効性を示す。抗[[グルタミン酸受容体]]作用をもつ薬剤([[トピラマート]]、[[ラモトリギン]]、[[バルプロ酸ナトリウム]]、[[ペランパネル]])、シナプス小胞タンパク質2Aに作用するとされる[[レベチラセタ]]や、[[ナトリウムチャネル|Na<sup>+</sup>チャネル]]阻害作用と抗[[T型カルシウムチャネル|低電位活性型(T型)カルシウムチャネル]]阻害作用を有する[[ゾニサミド]]は、抗[[焦点起始発作]]([[部分発作]])と抗[[全般起始発作]]([[全般発作]])作用を併せもち、広域スペクトラムの抗てんかん薬と位置づけられる。 | ||
2020年4月3日 (金) 11:54時点における版
武山博文
京都大学大学院医学研究科 呼吸管理睡眠制御学講座
宇佐美清英
京都大学大学院医学研究科 てんかん・運動異常生理学講座
松本理器
神戸大学大学院医学研究科 内科学講座 脳神経内科学分野
DOI:10.14931/bsd.9067 原稿受付日:2020年4月1日 原稿完成日:2020年4月2日
担当編集委員:漆谷 真(滋賀医科大学 内科学講座 脳神経内科)
英:antiepileptic drug 独:Antiepileptikum 仏:antiépileptiques
抗てんかん薬は、てんかんの病態を治癒に導くものではないが、てんかん発作の消失ないし頻度減少や、発作症状の程度の軽減などといった、発作抑制効果を患者にもたらす。抗てんかん薬の効果は、作用点との関連で、①電位依存性イオンチャネル、②リガンド(配位子)依存性イオンチャネル(細胞膜に置かれた受容体の一種で、情報伝達物質が結合、すなわち配位することで機能するイオンチャネル)、③GABA代謝阻害、④シナプス小胞蛋白2A、の4つの大きなグループに分けられる。抗てんかん薬治療は単剤治療を原則とする。単剤治療で約半数の患者の発作が抑制される。単剤で発作の抑制が不良な場合、合理的多剤併用療法を行う。てんかん患者のうち 約30%は、既存の抗てんかん薬を組み合わせても発作抑制効果が不十分な薬剤抵抗性てんかんと言われている。薬剤抵抗性てんかんに対しては、薬物療法の再検討、およびてんかん外科(てんかん焦点切除術、脳梁離断術、迷走神経刺激療法など)などの他の治療法を検討する。自己免疫介在性の病態であれば免疫療法が奏功する。
抗てんかん薬とは
てんかん(癲癇)は、脳内の神経細胞の異常な電気的興奮に伴ってけいれんや意識障害などが発作的に起こる慢性的な疾患である(脳科学辞典「てんかん」の項目も参照)。有病率は一般に人口の0.5 ~ 1.0 %とされており、近年の我が国での健康保険組合の診療報酬情報の分析に基づく疫学研究でも、患者数は人口1000人あたり7.24人(人口の約0.7 %)と推計され[1]、頻度の高い神経疾患の一つである。
抗てんかん薬は、てんかんの病態を治癒に導くものではないが、てんかん発作の消失ないし頻度減少や、発作症状の程度の軽減などといった、発作抑制効果を患者にもたらす。
てんかん薬物治療においては、単剤治療を原則に、合理的多剤投与が行われている。しかし、てんかん患者のうち 約30%は、既存の抗てんかん薬を組み合わせても発作抑制効果が不十分な難治性てんかんと言われている。
ここでは、抗てんかん薬の代表的な薬剤とその作用機序、我が国での臨床における現状、抗てんかん薬治療の戦略に焦点を当てて概説し、個々の抗てんかん薬については詳述しない。
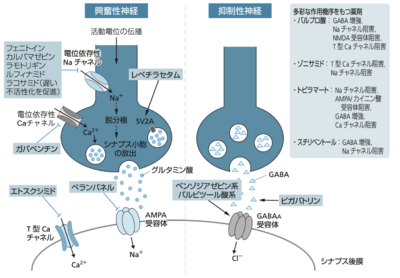
AMPA: α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸 (α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid); GABA: γ-アミノブチル酸 (γ-aminobutyric acid); NMDA: N-メチル-D-アスパラギン酸 (N-methyl-D-aspartate), SV2A: シナプス小胞タンパク質2A (synaptic vesicle glycoprotein 2A)。文献[2]より修正の上、引用。
作用機序
抗てんかん薬は、イオンチャネルに対して影響を与え、神経細胞の過剰興奮を抑制することでその発作抑制効果を発揮していると考えられている。その作用点は大きく7つが現在挙げられている。図1.に、抗てんかん薬の主な作用機序を示す[2]。表1.に主要な薬剤とイオンチャネルの関係で、比較的よくわかっているものを、表2.に抗てんかん薬の作用点による効果の特徴をまとめた[3]。
抗てんかん薬の効果は、表1.に整理したように、作用点との関連で、①電位依存性イオンチャネル、②リガンド(配位子)依存性イオンチャネル、③GABA代謝阻害、④シナプス小胞タンパク質2A(synaptic vesicle glycoprotein 2A、SV2A)、の4つの大きなグループに分けて考えると理解しやすい。なお、リガンド依存性イオンチャネルとは、細胞膜に置かれた受容体の一種で、情報伝達物質が結合する(配位される)ことで機能するイオンチャネルのことである。
選択的ナトリウム(Na+)チャネル阻害薬、選択的高電位活性型(非T型)カルシウム(Ca2+)チャネル阻害薬、選択的GABA代謝阻害薬は、いずれも焦点性てんかんに選択的に有効であるが、一方で特発性全般てんかん群を悪化させる場合がある。対照的に、選択的低電位活性型(T型)カルシウムチャネル阻害薬は、欠神発作あるいは欠神脱力発作といった特発性の全般発作に選択的に有効性を示す。抗グルタミン酸受容体作用をもつ薬剤(トピラマート、ラモトリギン、バルプロ酸ナトリウム、ペランパネル)、シナプス小胞タンパク質2Aに作用するとされるレベチラセタや、Na+チャネル阻害作用と抗低電位活性型(T型)カルシウムチャネル阻害作用を有するゾニサミドは、抗焦点起始発作(部分発作)と抗全般起始発作(全般発作)作用を併せもち、広域スペクトラムの抗てんかん薬と位置づけられる。
| 電位依存性イオンチャネル | リガンド依存性イオンチャネル | GABA代謝阻害 | シナプス小胞タンパク質2A | ||||
|---|---|---|---|---|---|---|---|
| Na+チャネル | 高電位活性型(非T型)Ca2+チャネル | 低電位活性型(T型)Ca2+チャネル | グルタミン酸受容体 | GABAA受容体 | |||
| カルバマゼピン | ◎ | ||||||
| オクスカルバマゼピン | ◎ | ||||||
| フェニトイン | ◎ | ||||||
| ガバペンチン | ◯ | ± | |||||
| ビガバトリン | ◎ | ||||||
| ラモトリギン | ◎ | ◯ | ◯*1 | ||||
| トピラマート | ◯ | ◯ | ◯*2 | ◯ | |||
| ペランパネル | ◎*2 | ||||||
| ゾニサミド | ◎ | ◯ | |||||
| バルプロ酸ナトリウム | ◯ | ◯ | ◯*3 | ◯ | |||
| ラコサミド | ◎ | ||||||
| レベチラセタム | ± | ± | ◎ | ||||
| フェノバルビタール | ± | ± | ◎ | ||||
| ベンゾジアゼピン系(ジアゼパム、クロナゼパム、クロバザムなど) | ◎ | ||||||
| エトスクシミド | ◎ | ||||||
*1 グルタミン酸の神経末端からの放出障害。 *2 AMPA型グルタミン酸受容体阻害。 *3 NMDA型グルタミン酸受容体阻害。
◎は主要な作用。±は補助的に作用している可能性あり。◯はその中間。
| 作用点 | 薬剤名 | 効果の特徴 |
|---|---|---|
| 選択的Na+チャネル阻害薬 | カルバマゼピン、フェニトイン | 選択的抗焦点性てんかん薬(特発性全般てんかん群は悪化させる可能性あり) |
| 選択的高電位活性型(非T型)Ca2+チャネル阻害薬 | ガバペンチン | |
| 選択的GABA代謝阻害薬 | ビガバトリン | |
| 複数の作用点をもつ薬剤 (初めの4つは抗グルタミン酸受容体作用あり) |
トピラマート、ラモトリギン、バルプロ酸ナトリウム、ペランパネル、ゾニサミド | 広域スペクトラム抗てんかん薬 |
| 選択的シナプス小胞タンパク質作用薬 | レベチラセタム | |
| 選択的GABAA受容体活性化薬 | フェノバルビタール、ベンゾジアゼピン系 | 全般的中枢神経抑制薬(高次脳機能の抑制を伴う) |
| 低電位活性型(T型)Ca2+チャネル阻害薬 | エトスクシミド、バルプロ酸ナトリウム | 抗欠神発作薬 |
我が国での臨床における現状
日本では、1989年発売のゾニサミド以降、長らく抗てんかん薬の開発は行われていなかったが、2000年にクロバザムが発売された。その後、いわゆる新規抗てんかん薬と呼ばれるガバペンチン(2006年)、トピラマート(2007年)、ラモトリギン(2008年)、レベチラセタム(2010年)の4剤が相次いで上市されたことから、てんかん治療の選択肢は格段に広がった[6]。
その後も、希少疾患であるDravet症候群に対するスチリペントールや、Lennox-Gastaut症候群に対するルフィナミドが発売され、2016年にはペランパネル、ビガバトリン、ラコサミド、オクスカルバゼピンの4剤が製造承認を受け、欧米でのガイドラインに沿った治療が行える環境となってきた(現在の日本のガイドラインは、[4]を参照)。
また、欧米のてんかん重積状態の治療ガイドラインなどにおいて、第1選択薬としてあげられているロラゼパム静注製剤が、2019年2月に製造承認を受けた。
治療の戦略
抗てんかん薬治療は単剤治療を原則とする。単剤治療で約半数の患者の発作が抑制される。単剤療法として承認されている主な抗てんかん薬は、カルバマゼピン、バルプロ酸ナトリウム、フェニトイン、クロナゼパム、ゾニサミド、フェノバルビタール、レベチラセタム、ラモトリギン、ラコサミド、ペランパネル(2020年2月時点)が挙げられる。焦点てんかんでみられる焦点起始発作(部分発作)では、カルバマゼピン、ラモトリギン、レベチラセタム、次いでゾニサミド、トピラマートが第一選択薬とされる。全般てんかんの強直間代発作ではバルプロ酸ナトリウム、欠神発作ではバルプロ酸ナトリウム、エトスクシミド、ミオクロニー発作ではバルプロ酸ナトリウム、クロナゼパムが第一選択薬とされる[4]。ただし、バルプロ酸ナトリウムには二分脊椎を含む催奇形性や胎児のIQ低下の可能性が知られており、妊娠の可能性のある女性への投与は避ける必要がある。その場合、催奇形性の低いラモトリギンなどが推奨される。
単剤で発作の抑制が不良な場合、合理的多剤併用療法を行う。合理的多剤併用療法とは、現在の使用薬とは異なる作用機序あるいは多くの作用機序を持つ薬剤の追加、副作用プロファイルが重ならない組み合わせ、相互作用が少ない組み合わせを考慮した併用療法のことである。そのてんかんに対し適切とされる抗てんかん薬を単剤あるいは多剤併用で副作用がない範囲の十分な血中濃度で2剤試みても一定期間(1年以上もしくは治療前の最長発作間隔の3倍以上の長いほう)発作を抑制できないてんかんを、薬剤抵抗性てんかんとよぶ(国際抗てんかん連盟が提唱する定義)。
薬剤抵抗性てんかんに対しては、薬物療法の再検討(診断、薬剤選択、投与量、薬理動態に基づく抗てんかん薬の使用など)、およびてんかん外科(てんかん焦点切除術、脳梁離断術、迷走神経刺激療法など)などの他の治療法を検討する[4]。
自己免疫介在性の病態であれば免疫療法(免疫グロブリン静注療法、ステロイド、免疫抑制剤など)が奏功する場合が多い[7][8]。
関連項目
参考文献
- ↑ 厚生労働科学研究費補助金(障害者対策総合研究事業)総合研究
「てんかんの有病率等に関する疫学研究及び診療実態の分析と治療体制の整備に関する研究」報告書
研究代表者 大槻泰介 国立精神・神経医療研究センター てんかんセンター長, 2016 - ↑ 2.0 2.1 吉村元、松本理器
てんかんの新規治療薬
Annual Review神経2018 中外医学社、2018 - ↑ 3.0 3.1 3.2 兼本浩祐
てんかん学ハンドブック 第3版
医学書院, 2012 - ↑ 4.0 4.1 4.2 4.3 4.4 日本神経学会監修「てんかん診療ガイドライン」委員会編集
てんかん診療ガイドライン2018<
医学書院, 2018 [1] - ↑ 大野行弘、松本理器
臨床薬学テキストシリーズ:神経・筋・精神・麻酔・鎮痛. 第1章 神経・筋疾患. B 疾患各論 ①てんかん. p 34-46.
中川書店) - ↑ 矢野育子、池田昭夫
新薬展望2017:第Ⅲ部 治療における最近の新薬の位置付け<薬効別>〜新薬の広場〜 抗てんかん薬
医薬ジャーナル 53,S-1, 2017 - ↑
Kanazawa, K., Matsumoto, R., Shimotake, A., Kinoshita, M., Otsuka, A., Watanabe, O., ..., & Ikeda, A. (2014).
Persistent frequent subclinical seizures and memory impairment after clinical remission in smoldering limbic encephalitis. Epileptic disorders : international epilepsy journal with videotape, 16(3), 312-7. [PubMed:25036726] [WorldCat] [DOI] - ↑ 坂本光弘、松本理器、十川純平、端祐一郎、武山博文、小林勝哉、下竹昭寛、近藤誉之、高橋良輔、池田昭夫
自己免疫性てんかんにおける診断アルゴリズムの提唱とその有用性の予備的検討
臨床神経学 2018;58:609-616.