「皮質板」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の2版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[https://researchmap.jp/okay 岡 雄一郎]、[http://researchmap.jp/read0185568 佐藤 真]</font><br> | <font size="+1">[https://researchmap.jp/okay 岡 雄一郎]<sup>1, 2</sup>、[http://researchmap.jp/read0185568 佐藤 真]<sup>1, 2</sup></font><br> | ||
''大阪大学医学系研究科 | ''1. 大阪大学医学系研究科 解剖学講座(神経機能形態学)/2. 大阪大学医学系研究科 連合小児発達学研究科 こころの発達神経科学講座(分子生物遺伝学)''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2013年3月27日 原稿完成日:2013年9月2日<br> | ||
担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | 担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | ||
</div> | </div> | ||
| 8行目: | 8行目: | ||
英語名:cortical plate | 英語名:cortical plate | ||
{{box|text= | {{box|text= | ||
皮質板は大脳皮質の発生期に脳室帯および脳室下帯の前駆細胞から分化した神経細胞が法線方向(放射状)に移動して辺縁帯とサブプレートの間に形成する層であり、将来の大脳皮質6層構造のうち第II層から第VI層になる部位である。放射状グリア細胞から伸びる放射状グリア線維(radial glial fiber)が法線方向に貫いていて、移動中の神経細胞の足場となっている。大脳基底核原基産生されるGABA作動性介在神経細胞(ヒトを含む霊長類では脳室帯で産生されるものも含む)や、アストロサイト、オリゴデンドロサイト、ミクログリアなどのグリア細胞も進入してくる。成体の大脳皮質では皮質板という言葉は使われないが、いつの時期までを皮質板と呼ぶのかははっきりしない。 | |||
}} | |||
== 皮質板形成の流れ == | == 皮質板形成の流れ == | ||
2021年6月30日 (水) 08:43時点における版
岡 雄一郎1, 2、佐藤 真1, 2
1. 大阪大学医学系研究科 解剖学講座(神経機能形態学)/2. 大阪大学医学系研究科 連合小児発達学研究科 こころの発達神経科学講座(分子生物遺伝学)
DOI:10.14931/bsd.3245 原稿受付日:2013年3月27日 原稿完成日:2013年9月2日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:cortical plate
皮質板は大脳皮質の発生期に脳室帯および脳室下帯の前駆細胞から分化した神経細胞が法線方向(放射状)に移動して辺縁帯とサブプレートの間に形成する層であり、将来の大脳皮質6層構造のうち第II層から第VI層になる部位である。放射状グリア細胞から伸びる放射状グリア線維(radial glial fiber)が法線方向に貫いていて、移動中の神経細胞の足場となっている。大脳基底核原基産生されるGABA作動性介在神経細胞(ヒトを含む霊長類では脳室帯で産生されるものも含む)や、アストロサイト、オリゴデンドロサイト、ミクログリアなどのグリア細胞も進入してくる。成体の大脳皮質では皮質板という言葉は使われないが、いつの時期までを皮質板と呼ぶのかははっきりしない。
皮質板形成の流れ
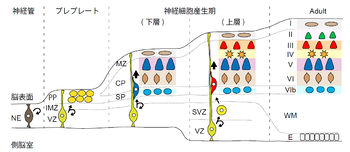
初期の神経管では神経上皮細胞(neuroepithelial cell)が側脳室(lateral ventricle)の拡大に伴って脳室面(ventricular surface)において対称分裂を繰り返して増殖しているが、神経細胞の産生が始まる時期になると放射状グリア細胞(radial glial cells)が現れ、これが非対称分裂を行って自身と神経細胞を産生する。(つまり、放射状グリア細胞は神経幹細胞 neural stem cellsである。)産生された神経細胞(主にグルタミン酸作動性神経細胞、ヒトではGABA作動性神経細胞の一部も含むとされる)は脳室面から中間層(intermediate zone)を通って皮質の表面に向かって放射状に移動する(radial migration)。最初に産生される神経細胞は脳室帯に重層するプレプレート (preplate、原子網状層 primordial plexiform zone)を形成する。
その後に産生された神経細胞が同様に法線方向(放射状)に移動してプレプレートに侵入すると、プレプレートは上層の辺縁帯と下層のサブプレートに分かれ、移動してきた神経細胞はこれら2層の間で皮質板を形成する。その後も神経細胞の産生は続くが、皮質板内では、早く産生された神経細胞がより下層(深層)を占め、後から産生された神経細胞はすでに皮質板内に存在する神経細胞を追い抜いてより上層(浅層)に分布する(インサイドアウト・パターン)ので、分化した神経細胞としては、最初は将来VI層になる細胞だけが存在し、次第により浅層の神経細胞が加わって厚みを増していく(図参照)。
ただし、よくある大脳皮質の発達のモデル図にはあまり描かれていないが、大脳皮質の形成期にはサブプレートと成熟した神経細胞の間に、移動中の未成熟な細胞のかなり厚い層が存在している[1]。また発生後期には神経細胞の産生が終わり、アストロサイト (astrocyte、アストログリア astroglia、星状膠細胞)が産生され、やはり法線方向に移動して皮質板に加わる。
法線方向の細胞移動と層構造の形成
法線方向(放射状)の細胞移動に関しては、放射状グリア細胞が重要な役割を果たしている。放射状グリア細胞は神経幹細胞として神経細胞(およびアストロサイト)を産生すると同時に、脳室帯にある細胞体から皮質表面の辺縁帯にまで届く放射状グリア線維(radial glial fiber)を伸ばしており、産生された神経細胞はこの線維を伝って法線方向に移動する(glia-guided locomotion)。
脳室帯で産生された神経細胞は中間層では多極性の形態を示すが、突起の一つで放射状グリア線維を掴むと双極性に形態を変化させ、線維を伝って皮質板へと移動する。
皮質板では先に到着している神経細胞を追い越し、その時点での皮質板の最上層に到達すると線維から離れ、terminal translocationにより最終的な分布位置に移動する。皮質板の最上層には成熟しきっていないNeuN陰性の神経細胞の層(primitive cortical zone, PCZ [1])があり、放射状グリア線維を辿ってきた神経細胞はPCZに入る直前で一旦停止し、leading process(radial migrationを始める際に放射状グリア線維を掴んだ突起)の先端に発現するインテグリンが辺縁帯の細胞外マトリクス中のフィブロネクチンと結合すると、放射状グリア線維から離れてterminal translocationによりPCZ内に入り[2]、最終的な分化のステップを経て各層に特徴的な形態と遺伝子発現を獲得する。PCZ内へ進入する際に、すでに分化を終えた早生まれの神経細胞よりも上層に出るので、結果としてインサイドアウト・パターンが形成される(上図参照)。
層構造形成の分子機構
皮質板内の層構造の形成にはいくつかの因子の関与が知られており、その変異マウスでは層構造に異常が認められる[3]。
リーリン
辺縁帯のCajal-Retzius細胞から分泌されるリーリン (Reelin)の変異体あるreelerマウス[4]では、早生まれの細胞を追い抜けず、サブプレートの下に神経細胞が滞留して層構造が逆転したような異所性の皮質板を形成する。E14.5以降のサブプレートと第VI層に発現するSox5のノックアウトマウス[5][6]でも、サブプレートの神経細胞が辺縁帯から離れずその下に神経細胞が滞留する。しかし、この異所性に形成される皮質板の層構造はreelerマウスのそれとは異なっている。即ち、第V,VI層は上下が逆転するものの、第II-IV層の神経細胞は先に生まれた神経細胞を追い越して上層に進むので、上からII,III,IV,VI,Vという順になる。このマウスでは層形成の異常に伴って神経回路形成にも異常が認められる。即ち、第VI層及びサブプレートから出る皮質視床路の軸索は誤って視床下部に投射し、また、第V層由来の皮質橋路および皮質脊髄路は形成されない。
Tbr1
皮質視床路を形成する第VI層とサブプレートの神経細胞に発現するTbr1のノックアウトマウスでは、第V層の神経細胞はほとんどサブプレートを越えて広く皮質板全体に分布する一方、第II-IV層、および第VI層の神経細胞の中にはサブプレートを越えずにその下に滞留するものもある[7][8]。
Satb2
皮質間回路を形成する第II-V層の神経細胞に発現するSatb2のノックアウトマウスでは、第V,VI層の神経細胞は正常に皮質板へ移動するのに対し、第II-IV層の神経細胞の移動は速度が遅くなるが[9][10]、生後7日目ごろには正常な位置に達する[10][11]。
Pou3f2/3
第II-V層の投射神経細胞には発現するPou3f2 (Brn2)およびPou3f3 (Brn1)のダブル・ノックアウト(DKO)マウスでは、第VI層の細胞は正常にサブプレートを越えて皮質板に達するものの、第II-V層の神経細胞はサブプレートを越えられない[12][13]。Pou3f2/3の下流で細胞移動を制御するシグナルに関与すると考えられている経路としては、CDK5とIL12Aのシグナル経路とReelinとDab1の経路がある。DKOマウスの表現型はCDK5シグナルを阻害した場合の異常とよく似ており[14][15]、またPOU3F2はIl12aおよびcdk5r2両遺伝子のプロモータ領域に直接結合することが示されている[12]。DKOマウスにおいて、Dab1の発現はE15.5以降に減少することがわかっており、上層の神経細胞の移動に異常があることと良く一致している[13]。
GABA作動性神経細胞
一方、GABA作動性の介在神経細胞は新皮質になる領域(pallium)の外側にあるsubpallium、特にmedial ganglionic eminence (MGE)で産生され、接線方向に移動して(tangential migration、水平移動)、新皮質領域に到達する(ヒトではGABA作動性神経細胞の一部は脳室帯由来とされている)。水平移動は主として辺縁帯、中間帯、脳室下帯で起こり、その後、斜行、あるいは法線方向に移動して皮質板に進入する(編集コメント:この点模式図があればと思います)。マウスにおいて、新皮質領域まで到達したGAD65陽性細胞のうち皮質板に存在するものの割合は E14.5では数%であるが、E18.5には40%程度まで増える[16]。
最近、GABA作動性介在神経細胞のサブタイプであるシャンデリア細胞(chandelier cells)が側脳室のventral germinal zoneに存在するNkx2.1陽性細胞から由来することが明らかになった[17]。
介在神経細胞の皮質板内の層分布はその産生された領域と時期に依存する[18]。また、介在神経細胞のradial migrationはReelinのシグナルには依存しないことが分かっている[19]。
第V層の神経細胞の分化と軸索投射のマスター遺伝子の一つと考えられているFezf2のノックアウトマウスでは、脳室帯由来の神経細胞の層構造は正常である[20][21]が、ソマトスタチン陽性およびパルブアルブミン陽性の介在神経細胞が第V層で特異的に減少していた[22]。このことから、すでに形成された興奮性神経細胞の層構造に依存して介在神経細胞の層分布が決定される可能性が指摘されている。
関連項目
参考文献
- ↑ 1.0 1.1
Sekine, K., Honda, T., Kawauchi, T., Kubo, K., & Nakajima, K. (2011).
The outermost region of the developing cortical plate is crucial for both the switch of the radial migration mode and the Dab1-dependent "inside-out" lamination in the neocortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(25), 9426-39. [PubMed:21697392] [PMC] [WorldCat] [DOI] - ↑
Sekine, K., Kawauchi, T., Kubo, K., Honda, T., Herz, J., Hattori, M., ..., & Nakajima, K. (2012).
Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrin α5β1. Neuron, 76(2), 353-69. [PubMed:23083738] [PMC] [WorldCat] [DOI] - ↑
Kwan, K.Y., Sestan, N., & Anton, E.S. (2012).
Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development (Cambridge, England), 139(9), 1535-46. [PubMed:22492350] [PMC] [WorldCat] [DOI] - ↑
Pinto-Lord, M.C., Evrard, P., & Caviness, V.S. (1982).
Obstructed neuronal migration along radial glial fibers in the neocortex of the reeler mouse: a Golgi-EM analysis. Brain research, 256(4), 379-93. [PubMed:7127145] [WorldCat] [DOI] - ↑
Kwan, K.Y., Lam, M.M., Krsnik, Z., Kawasawa, Y.I., Lefebvre, V., & Sestan, N. (2008).
SOX5 postmitotically regulates migration, postmigratory differentiation, and projections of subplate and deep-layer neocortical neurons. Proceedings of the National Academy of Sciences of the United States of America, 105(41), 16021-6. [PubMed:18840685] [PMC] [WorldCat] [DOI] - ↑
Lai, T., Jabaudon, D., Molyneaux, B.J., Azim, E., Arlotta, P., Menezes, J.R., & Macklis, J.D. (2008).
SOX5 controls the sequential generation of distinct corticofugal neuron subtypes. Neuron, 57(2), 232-47. [PubMed:18215621] [WorldCat] [DOI] - ↑
Hevner, R.F., Shi, L., Justice, N., Hsueh, Y., Sheng, M., Smiga, S., ..., & Rubenstein, J.L. (2001).
Tbr1 regulates differentiation of the preplate and layer 6. Neuron, 29(2), 353-66. [PubMed:11239428] [WorldCat] [DOI] - ↑
Han, W., Kwan, K.Y., Shim, S., Lam, M.M., Shin, Y., Xu, X., ..., & Sestan, N. (2011).
TBR1 directly represses Fezf2 to control the laminar origin and development of the corticospinal tract. Proceedings of the National Academy of Sciences of the United States of America, 108(7), 3041-6. [PubMed:21285371] [PMC] [WorldCat] [DOI] - ↑
Alcamo, E.A., Chirivella, L., Dautzenberg, M., Dobreva, G., Fariñas, I., Grosschedl, R., & McConnell, S.K. (2008).
Satb2 regulates callosal projection neuron identity in the developing cerebral cortex. Neuron, 57(3), 364-77. [PubMed:18255030] [WorldCat] [DOI] - ↑ 10.0 10.1
Britanova, O., de Juan Romero, C., Cheung, A., Kwan, K.Y., Schwark, M., Gyorgy, A., ..., & Tarabykin, V. (2008).
Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron, 57(3), 378-92. [PubMed:18255031] [WorldCat] [DOI] - ↑
Zhang, L., Song, N.N., Chen, J.Y., Huang, Y., Li, H., & Ding, Y.Q. (2012).
Satb2 is required for dendritic arborization and soma spacing in mouse cerebral cortex. Cerebral cortex (New York, N.Y. : 1991), 22(7), 1510-9. [PubMed:21885532] [WorldCat] [DOI] - ↑ 12.0 12.1
McEvilly, R.J., de Diaz, M.O., Schonemann, M.D., Hooshmand, F., & Rosenfeld, M.G. (2002).
Transcriptional regulation of cortical neuron migration by POU domain factors. Science (New York, N.Y.), 295(5559), 1528-32. [PubMed:11859196] [WorldCat] [DOI] - ↑ 13.0 13.1
Sugitani, Y., Nakai, S., Minowa, O., Nishi, M., Jishage, K., Kawano, H., ..., & Noda, T. (2002).
Brn-1 and Brn-2 share crucial roles in the production and positioning of mouse neocortical neurons. Genes & development, 16(14), 1760-5. [PubMed:12130536] [PMC] [WorldCat] [DOI] - ↑
Gilmore, E.C., Ohshima, T., Goffinet, A.M., Kulkarni, A.B., & Herrup, K. (1998).
Cyclin-dependent kinase 5-deficient mice demonstrate novel developmental arrest in cerebral cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(16), 6370-7. [PubMed:9698328] [PMC] [WorldCat] - ↑
Ko, J., Humbert, S., Bronson, R.T., Takahashi, S., Kulkarni, A.B., Li, E., & Tsai, L.H. (2001).
p35 and p39 are essential for cyclin-dependent kinase 5 function during neurodevelopment. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(17), 6758-71. [PubMed:11517264] [PMC] [WorldCat] - ↑
López-Bendito, G., Sánchez-Alcañiz, J.A., Pla, R., Borrell, V., Picó, E., Valdeolmillos, M., & Marín, O. (2008).
Chemokine signaling controls intracortical migration and final distribution of GABAergic interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(7), 1613-24. [PubMed:18272682] [PMC] [WorldCat] [DOI] - ↑
Taniguchi, H., Lu, J., & Huang, Z.J. (2013).
The spatial and temporal origin of chandelier cells in mouse neocortex. Science (New York, N.Y.), 339(6115), 70-4. [PubMed:23180771] [PMC] [WorldCat] [DOI] - ↑
Miyoshi, G., & Fishell, G. (2011).
GABAergic interneuron lineages selectively sort into specific cortical layers during early postnatal development. Cerebral cortex (New York, N.Y. : 1991), 21(4), 845-52. [PubMed:20732898] [PMC] [WorldCat] [DOI] - ↑
Pla, R., Borrell, V., Flames, N., & Marín, O. (2006).
Layer acquisition by cortical GABAergic interneurons is independent of Reelin signaling. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(26), 6924-34. [PubMed:16807322] [PMC] [WorldCat] [DOI] - ↑
Chen, B., Schaevitz, L.R., & McConnell, S.K. (2005).
Fezl regulates the differentiation and axon targeting of layer 5 subcortical projection neurons in cerebral cortex. Proceedings of the National Academy of Sciences of the United States of America, 102(47), 17184-9. [PubMed:16284245] [PMC] [WorldCat] [DOI] - ↑
Molyneaux, B.J., Arlotta, P., Hirata, T., Hibi, M., & Macklis, J.D. (2005).
Fezl is required for the birth and specification of corticospinal motor neurons. Neuron, 47(6), 817-31. [PubMed:16157277] [WorldCat] [DOI] - ↑
Lodato, S., Rouaux, C., Quast, K.B., Jantrachotechatchawan, C., Studer, M., Hensch, T.K., & Arlotta, P. (2011).
Excitatory projection neuron subtypes control the distribution of local inhibitory interneurons in the cerebral cortex. Neuron, 69(4), 763-79. [PubMed:21338885] [PMC] [WorldCat] [DOI]