「モノアシルグリセロールリパーゼ」の版間の差分
| (同じ利用者による、間の4版が非表示) | |||
| 1行目: | 1行目: | ||
少作隆子(北陸大学 医療保健学部 理学療法学科) | |||
橋本谷祐輝(同志社大学大学院 脳科学研究科 シナプス分子機能部門) | |||
英:monoacylglycerol lipase | 英:monoacylglycerol lipase | ||
英略語:MGL | 英略語:MGL | ||
{{box|text= モノアシルグリセロールリパーゼは、モノアシルグリセロールの長鎖脂肪酸を加水分解する酵素である。最初は、脂肪の分解に必要な酵素として注目された。その後、神経調節因子として働くエンドカンナビノイドの1つ2-AG(2-arachidonylglycerol)を分解する主要な酵素であることが判明した。2-AGはシナプス後ニューロンから放出され、シナプス前終末のCB1受容体に作用し神経伝達物質の放出を抑制する。このようなエンドカンナビノイドを介するシナプス伝達の調節(カンナビノイド系)は記憶・学習、不安、痛みなど様々な脳機能に関与している。また、MGLが2-AGを分解するとアラキドン酸が放出されることから、プロスタグランジンの生合成にも関与することが明らかとなった。よって、MGLはカンナビノイド系およびプロスタグランジ系の働きに影響をおよぼす可能性があり、MGLをターゲットとした治療薬の開発が進められている。}} | {{box|text= モノアシルグリセロールリパーゼは、モノアシルグリセロールの長鎖脂肪酸を加水分解する酵素である。最初は、脂肪の分解に必要な酵素として注目された。その後、神経調節因子として働くエンドカンナビノイドの1つ2-AG(2-arachidonylglycerol)を分解する主要な酵素であることが判明した。2-AGはシナプス後ニューロンから放出され、シナプス前終末のCB1受容体に作用し神経伝達物質の放出を抑制する。このようなエンドカンナビノイドを介するシナプス伝達の調節(カンナビノイド系)は記憶・学習、不安、痛みなど様々な脳機能に関与している。また、MGLが2-AGを分解するとアラキドン酸が放出されることから、プロスタグランジンの生合成にも関与することが明らかとなった。よって、MGLはカンナビノイド系およびプロスタグランジ系の働きに影響をおよぼす可能性があり、MGLをターゲットとした治療薬の開発が進められている。}} | ||
| 17行目: | 10行目: | ||
[[ファイル:Shosaku MGL Fig2.png|サムネイル|'''図2. 2-AGの生合成経路およびMGLによる分解''']] | [[ファイル:Shosaku MGL Fig2.png|サムネイル|'''図2. 2-AGの生合成経路およびMGLによる分解''']] | ||
[[ファイル:Shosaku MGL Fig3.png|サムネイル|'''図3. プロスタグランジンの生合成''']] | [[ファイル:Shosaku MGL Fig3.png|サムネイル|'''図3. プロスタグランジンの生合成''']] | ||
モノアシルグリセロールリパーゼの研究は、最初は脂肪の分解に必要な酵素として注目されたことに始まる('''図1''')。空腹時には動物はエネルギー源として脂肪を利用する。この時に脂肪組織ではトリアシルグリセロール(triacylglycerol:TG)の脂肪酸が切り離されジアシルグルセロール(diacylglycerol:DG)、モノアシルグリセロール(monoacylglycerol; MG)となり、最終的にはグリセロールと脂肪酸にまで分解される。この最終段階に働くMGを分解する酵素の同定が試みられた。Tornqvistらは1976年にラットの脂肪組織よりMGを加水分解する酵素MGLの抽出に成功した<ref name=Tornqvist1976><pubmed>1249056</pubmed></ref>。彼らはSDSゲル電気泳動の結果より分子量は32900と推定し、基質特異性としては、TGやDGには作用せずMG特異性が高いこと、MGであれば脂肪酸の結合位置がグリセロールのどの位置であっても分解できることを報告した。同グループは1997年にマウス脂肪組織のcDNAライブラリーからMGLをクローニングし、そのアミノ酸配列を特定した<ref name=Karlsson1997><pubmed>9341166</pubmed></ref>。また、MGLのmRNAの発現を調べ、MGLは脂肪組織のみならず脳を含む全身の組織で普遍的に発現されている酵素であることを明らかにした。同グループは2001年にはヒトのMGLのアミノ酸配列の特定にも成功した<ref name=Karlsson2001><pubmed>11470505</pubmed></ref>。 | |||
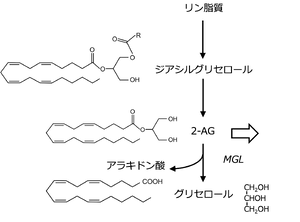
MGLはその後カンナビノイド研究において注目を集めることとなった('''図2''')。カンナビノイド(cannabinoid)とは、大麻(学名はCannabis sativa)に含まれる精神神経作用を引き起こす物質およびその類似物質を合わせた総称名である。1964年に大麻に含まれる有効成分としてTHC(Δ9-tetrahydrocannabinol)が同定され、THCが結合する受容体(カンナビノイド受容体)として1990年にCB1受容体、1993年にはCB2受容体のアミノ酸配列が特定された。1992年にはカンナビノイド受容体の内因性リガンド(エンドカンナビノイド)としてアナンダミド(N-arachidonoylethanolamide)が、1995年には2-AG(2-arachidonylglycerol)が発見された。その後、エンドカンナビノイドの生合成および分解に関与する酵素群('''図2''')が次々と特定され、それと並行しエンドカンナビノイドの生理的役割(カンナビノイド系)が次第に明らかとなった<ref name=Kano2009><pubmed>19126760</pubmed></ref>。この一連の研究の中で、2-AGの分解酵素としてのMGLの重要性が報告された。Piomelliらのグループが、2002年にラットのMGLのアミノ酸配列を特定するとともに、MGLが2-AGの分解の主要な酵素であることを証明した<ref name=Dinh2002><pubmed>12136125</pubmed></ref>。 | |||
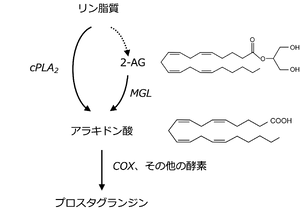
MGLはさらにプロスタグランジンの生合成にも関与することが報告され、注目を集めた('''図3''')。プロスタグランジンの生合成に必要な遊離アラキドン酸を供給する経路としては、それまでは細胞膜リン脂質から脂肪酸鎖を遊離させる細胞質型ホスホリパーゼA2(cPLA2)を介する経路が重要と考えられていた。しかし2011年にNomuraとCravattらは、脳においては遊離アラキドン酸の産生にはPLA2よりもMGLを介した経路が主に働いていることを明らかにした<ref name=Nomura2011><pubmed>22021672</pubmed></ref>。 | |||
このようにMGLは脂肪の分解のみならずエンドカンナビノイド2-AGの分解やプロスタグランジンの生合成にも関与している。よってMGLに作用する薬剤はカンナビノイド系およびプロスタグランジ系を介して生理機能や病態生理機能に影響をおよぼす可能性があり、MGLをターゲットとした治療薬の開発が進められている<ref name=Chen2023><pubmed>36966972</pubmed></ref><ref name=Maccarrone2023><pubmed>37164640</pubmed></ref>。 | このようにMGLは脂肪の分解のみならずエンドカンナビノイド2-AGの分解やプロスタグランジンの生合成にも関与している。よってMGLに作用する薬剤はカンナビノイド系およびプロスタグランジ系を介して生理機能や病態生理機能に影響をおよぼす可能性があり、MGLをターゲットとした治療薬の開発が進められている<ref name=Chen2023><pubmed>36966972</pubmed></ref><ref name=Maccarrone2023><pubmed>37164640</pubmed></ref>。 | ||
== 構造 == | == 構造 == | ||
アミノ酸303個(ラット)<ref name=Dinh2002><pubmed>12136125</pubmed></ref> | アミノ酸303個(ラット)<ref name=Dinh2002><pubmed>12136125</pubmed></ref>から成る、活性部位にセリン残基があるserine hydrolaseスーパーファミリーに属する酵素である。またその2次構造からは、βシートの周りをαヘリックスが取り囲むα/β hydrolaseスーパーファミリーに属する酵素でもある<ref name=Karlsson1997><pubmed>9341166</pubmed></ref><ref name=Scalvini2016><pubmed>26216043</pubmed></ref>。MGLをコードする遺伝子MGLLは、ヒトでは3番目の染色体、マウスでは6番目の染色体に位置している。マウスおよびラットでは、触媒三残基はセリン(122番目)、アスパラギン酸(239番目)、ヒスチジン(269番目)と推定されている。MGLのアミノ酸配列はラットとマウス間では92%、ラット/マウスとヒト間では84%の同一性がみられる<ref name=Scalvini2016><pubmed>26216043</pubmed></ref>。MGLの基質特異性およびMGL阻害剤の作用機序の解明のため、MGLの結晶化および三次元構造の解析が精力的に進められている<ref name=Labar2010><pubmed>19957260</pubmed></ref>。 | ||
== サブファミリー == | == サブファミリー == | ||
MGLのサブファミリーは知られていない。しかし、ウエスタンブロッティングでは組織によりタンパク質のバンドが2本みられる場合があり、組織依存的なsplice variantがある可能性が示唆されている<ref name=Dinh2002><pubmed>12136125</pubmed></ref>。 | |||
== 組織および細胞内分布 == | == 組織および細胞内分布 == | ||
MGLは全身の組織(脂肪組織、脳、肺、腎臓、心臓、脾臓、卵巣、精巣、骨格筋、肝臓、副腎など)に広く分布している。脳内でも大脳皮質、海馬、視床、小脳、線条体など広範に分布し、細胞タイプとしてはニューロンのみならずアストロサイトやオリゴデンドロサイトにも発現している<ref name=Baggelaar2017><pubmed>28106377</pubmed></ref><ref name=Dinh2002><pubmed>12136125</pubmed></ref><ref name=Viader2016><pubmed>26779719</pubmed></ref>。ニューロンでは主にシナプス前終末に分布している<ref name=Gulyas2004><pubmed>15233753</pubmed></ref><ref name=Kano2009><pubmed>19126760</pubmed></ref>。 | |||
== 機能 == | == 機能 == | ||
=== 分子機能 === | === 分子機能 === | ||
MGの長鎖脂肪酸を加水分解する酵素で、酵素番号はEC 3.1.1.23、系統名はglycerol-ester acylhydrolaseである。他の名称としてはmonoacylglycerolipase, monoglyceride lipase, monoglyceride hydrolase, monoacylglycerol hydrolase, monoglyceridyllipase, monoglyceridaseなどがある。 | |||
基質特異性としては、TGやDGには作用せずMG特異性が高いこと、MGであれば脂肪酸の長さや飽和度は関係せず、脂肪酸の結合位置がグリセロールのどの位置であっても分解できることが報告されている<ref name=Vandevoorde2005><pubmed>16181610</pubmed></ref>。 | 基質特異性としては、TGやDGには作用せずMG特異性が高いこと、MGであれば脂肪酸の長さや飽和度は関係せず、脂肪酸の結合位置がグリセロールのどの位置であっても分解できることが報告されている<ref name=Vandevoorde2005><pubmed>16181610</pubmed></ref>。 | ||
阻害剤としては、最初にURB602 <ref name=Hohmann2005><pubmed>15973410</pubmed></ref> とURB754<ref name=Makara2005><pubmed>16116451</pubmed></ref>(但しURB754のMGL阻害作用はその後否定された<ref name=Hashimotodani2007><pubmed>17267577</pubmed></ref><ref name=Saario2006><pubmed>16931330</pubmed></ref>)が、次に選択性がより高く低濃度で有効なJZL184<ref name=Long2009><pubmed>19635411</pubmed></ref>が報告され、多くの動物実験で使用された。その後、KML29、MJN110、JW651、Lu AG06466(またはABX-1431)などのさらに改良されたMGL阻害剤が次々と報告され、動物実験のみならず、一部は人を対象とした臨床研究においても使用されている<ref name=Deng2020><pubmed>32322464</pubmed></ref><ref name=Scalvini2016><pubmed>26216043</pubmed></ref><ref name=Zhao2024><pubmed>38882045</pubmed></ref>。 | |||
=== 個体での機能 === | === 個体での機能 === | ||
==== 細胞に蓄積された脂肪の分解 ==== | ==== 細胞に蓄積された脂肪の分解 ==== | ||
脂肪細胞など細胞内にTGを貯蔵している細胞においては、空腹時などにはTGが分解されDGを経てMGが蓄積する。MGLはそれをさらに脂肪酸とグリセロールにまで分解する。 | |||
==== エンドカンナビノイド2-AGの分解 ==== | ==== エンドカンナビノイド2-AGの分解 ==== | ||
神経活動により細胞内Ca2+濃度上昇やGq/11共役型受容体の活性化が起こると、それぞれ単独または両者の相乗効果により2-AGが生成され細胞外に放出される<ref name=Hashimotodani2005><pubmed>15664177</pubmed></ref>('''図4''')。生合成に関与する酵素であるホスホリパーゼCβ(PLCβ)やジアシルグリセロールリパーゼα(DGLα)はシナプス後側にあり、2-AGはシナプス後ニューロンより放出される。放出された2-AGはシナプス前終末のCB1受容体に結合し神経伝達物質の放出を抑制する。このような2-AGによるシナプス伝達調節機構は脳の多くの領域でみられ、記憶・学習、不安、痛みなど様々な脳機能に関与している。2-AGには、伝達物質の放出抑制およびその他のメカニズムを介して、脳を保護する作用もある。さらに、2-AGはCB2受容体にも作用する。CB2受容体は主にマクロファージなどの免疫系の細胞に多く発現されており、2-AGはCB2受容体を介して免疫系にも影響をおよぼす。 | |||
2- | 2-AGを不活性化させる経路としては、加水分解経路と酸化経路がある。加水分解経路として最も重要なものがMGLである<ref name=Dinh2002><pubmed>12136125</pubmed></ref><ref name=Dinh2004><pubmed>15272052</pubmed></ref><ref name=Vandevoorde2007><pubmed>17712823</pubmed></ref> 。MGLは脳ではシナプス前終末に多く存在し('''図4''')、その活性は2-AGシグナルの作用時間および作用強度に大きな影響をおよぼす<ref name=Hashimotodani2007><pubmed>17267577</pubmed></ref><ref name=Tanimura2012><pubmed>22783023</pubmed></ref>。MGL以外の加水分解酵素としてはα/β-hydrolase domain-containing 6(ABHD6)やABHD12 などがある<ref name=Blankman2007><pubmed>18096503</pubmed></ref><ref name=Dinh2004><pubmed>15272052</pubmed></ref><ref name=Muccioli2007><pubmed>17360910</pubmed></ref><ref name=Saario2004><pubmed>15013854</pubmed></ref>。脳での2-AGの加水分解に対する寄与率を調べた研究では、MGLが85%で、ABHD6とABHD12を合わせて15%と報告されている<ref name=Blankman2007><pubmed>18096503</pubmed></ref>。また、この論文では3つの2-AG加水分解酵素の細胞内局在に違いがあることから、3つの酵素がそれぞれ異なる2-AGプールに作用する可能性が示唆されている。酸化経路を担う酵素としてはシクロオキシゲナーゼ(COX)-2やリポキシゲナーゼ(LOX)があり、それによりプロスタグランジンE2グリセロールエステル(PGE2-G)、12-ヒドロキシエイコサテトラエン酸グリセロールエステル(12-HETE-G)、15-ヒドロキシエイコサテトラエン酸グリセロールエステル(15-HETE-G)などの新たなシグナルが生成される<ref name=Maccarrone2023><pubmed>37164640</pubmed></ref><ref name=Vandevoorde2007><pubmed>17712823</pubmed></ref>。 | ||
==== プロスタグランジンの生合成 ==== | ==== プロスタグランジンの生合成 ==== | ||
プロスタグランジンは多様な生理機能、病態生理機能に関わっている。その生合成に必要な遊離アラキドン酸を供給する経路としては、cPLA2を介する経路とMGLを介する経路がある。どの経路がより重要であるのかは組織あるいは細胞の種類により異なり、脳においてはMGLの経路が重要であると考えられている<ref name=Nomura2011><pubmed>22021672</pubmed></ref> | プロスタグランジンは多様な生理機能、病態生理機能に関わっている。その生合成に必要な遊離アラキドン酸を供給する経路としては、cPLA2を介する経路とMGLを介する経路がある。どの経路がより重要であるのかは組織あるいは細胞の種類により異なり、脳においてはMGLの経路が重要であると考えられている<ref name=Nomura2011><pubmed>22021672</pubmed></ref>。リポ多糖類(LPS)投与による発熱モデルを用い、LPSにより誘発される視床下部でのプロスタグランジンE2の生成や発熱にはMGLが必要であることが証明された<ref name=Kita2015><pubmed>26196692</pubmed></ref>。 | ||
== 疾患との関わり == | == 疾患との関わり == | ||
| 63行目: | 51行目: | ||
=== 鎮痛作用、脳保護作用、神経変性疾患の症状軽減作用 === | === 鎮痛作用、脳保護作用、神経変性疾患の症状軽減作用 === | ||
動物実験においては、MGL阻害剤の投与により、鎮痛作用<ref name=Hohmann2005><pubmed>15973410</pubmed></ref><ref name=Kinsey2009><pubmed>19502530</pubmed></ref>や脳保護作用<ref name=Arimura2024><pubmed>39570850</pubmed></ref>、およびパーキンソン病<ref name=Nomura2010><pubmed>20079333</pubmed></ref>、アルツハイマー病<ref name=Chen2012><pubmed>23122958</pubmed></ref>、多発性硬化症<ref name=Hernandez-Torres2014><pubmed>25298214</pubmed></ref>などの神経変性疾患の症状を軽減する作用があることが報告されている。その作用機序については、多くの仮説が提唱されてはいるものの、まだ全貌解明には至っていない。MGL阻害剤の鎮痛作用については、CB1受容体を介した中脳水道周囲灰白質からの下行性痛覚抑制系の活性化の関与が示唆されている<ref name=Hohmann2005><pubmed>15973410</pubmed></ref><ref name=Lau2014><pubmed>25064178</pubmed></ref>。脳保護作用や神経変性疾患の症状軽減作用については、CB1受容体を介する興奮性伝達物質グルタミン酸の過剰な放出の抑制が関与する可能性が報告されている<ref name=Monory2006><pubmed>16908411</pubmed></ref>。また、ミクログリアのCB2受容体の活性化や、アラキドン酸やプロスタグランジンの減少による炎症の軽減などが関与する可能性も考えられる<ref name=Chen2023><pubmed>36966972</pubmed></ref>。 | |||
一方、人を対象とした臨床試験においては、期待されるような改善効果はまだ得られていない。最も研究が進んでいる薬の1つはLu-AG06466(別名はABX-1431) | 一方、人を対象とした臨床試験においては、期待されるような改善効果はまだ得られていない。最も研究が進んでいる薬の1つはLu-AG06466(別名はABX-1431 )であり、臨床試験第1相を終え第2相に進んだものもある。対象疾患としては、トゥレット症候群、心的外傷後ストレス障害、多発性硬化症などである<ref name=Maccarrone2023><pubmed>37164640</pubmed></ref>。しかし、トゥレット症候群に対するLu-AG06466の効果が調べられた研究において、短期間の投与の効果を調べた第1相試験では改善効果がみられたものの、12週間の長期投与の効果を調べた第2相試験では効果がみられなかったことが報告されている<ref name=Muller-Vahl2021><pubmed>34117788</pubmed></ref><ref name=Muller-Vahl2022><pubmed>34847610</pubmed></ref>。 | ||
=== 抗がん作用 === | === 抗がん作用 === | ||
動物実験において、カンナビノイドに抗がん作用があることが報告されている。そこで、カンナビノイドを直接投与する方法の他に、MGLの阻害により生体内のカンナビノイド濃度を高める方法が試みられるようになった。動物実験では、MGL欠損マウスではガンの増殖が促進される<ref name=Liu2018><pubmed>29348400</pubmed></ref>などの矛盾する結果もあるものの、MGL阻害剤(主にJZL184を使用)に抗がん作用があることを示す論文は多い<ref name=Ramer2021><pubmed>34830856</pubmed></ref>。その作用機序としては、2-AGによるカンナビノイド受容体の活性化を介するものの他に、MGL阻害剤によりガンを促進させる作用のある脂肪酸が減少することが関与する可能性も指摘されている<ref name=Nomura2011><pubmed>22021672</pubmed></ref><ref name=Ramer2021><pubmed>34830856</pubmed></ref>。 | 動物実験において、カンナビノイドに抗がん作用があることが報告されている。そこで、カンナビノイドを直接投与する方法の他に、MGLの阻害により生体内のカンナビノイド濃度を高める方法が試みられるようになった。動物実験では、MGL欠損マウスではガンの増殖が促進される<ref name=Liu2018><pubmed>29348400</pubmed></ref>などの矛盾する結果もあるものの、MGL阻害剤(主にJZL184を使用)に抗がん作用があることを示す論文は多い<ref name=Ramer2021><pubmed>34830856</pubmed></ref>。その作用機序としては、2-AGによるカンナビノイド受容体の活性化を介するものの他に、MGL阻害剤によりガンを促進させる作用のある脂肪酸が減少することが関与する可能性も指摘されている<ref name=Nomura2011><pubmed>22021672</pubmed></ref><ref name=Ramer2021><pubmed>34830856</pubmed></ref>。 | ||
ヒトのガン細胞のMGL活性と生存率との関係を調べた研究は多いが、一致した結果は得られていない<ref name=Ramer2021><pubmed>34830856</pubmed></ref>。 | |||
=== 抗不安作用 === | === 抗不安作用 === | ||
カンナビノイド系はCB1受容体を介して扁桃体活動に影響を及ぼし、不安の調節に関与していると考えられており<ref name=Viveros2005><pubmed>15927244</pubmed></ref>、カンナビノイド受容体やエンドカンナビノイド分解酵素に作用する薬剤の抗不安作用が調べられてきた<ref name=Zhao2024><pubmed>38882045</pubmed></ref>。動物実験では、アナンダミドの分解酵素であるFAAH(fatty acid amide hydrolase)の阻害剤および2-AG分解酵素MGLの阻害剤の両方について、抗不安作用があることが報告されている。FAAH阻害剤については人を対象とした臨床研究の第2相段階に進んでいるものもあるが、MGL阻害剤はまだ臨床研究には至っていない。 | |||
=== 問題点および将来の展望 === | === 問題点および将来の展望 === | ||
カンナビノイド系を活性化させる目的でMGL阻害剤を使用する場合は注意が必要である。MGLが阻害されると、2- | カンナビノイド系を活性化させる目的でMGL阻害剤を使用する場合は注意が必要である。MGLが阻害されると、2-AG濃度は上昇しCB1受容体を介する作用は亢進すると期待される。しかしそれが長期間続くとCB1受容体の脱感作あるいは発現量の低下が起こり、結果としてカンナビノイド系は機能しなくなる可能性がある。例えば、MGL欠損動物ではCB1受容体の脱感作によりカンナビノイド系によるシナプス可塑性が障害されることが報告されている<ref name=Maccarrone2023><pubmed>37164640</pubmed></ref><ref name=Petrenko2014><pubmed>24906199</pubmed></ref><ref name=Schlosburg2010><pubmed>20729846</pubmed></ref>。これらの問題を回避するため、作用が可逆的なものや血液脳関門を通らずに末梢でのみ作用するものなど、新しいMGL阻害剤の開発が今も進められている<ref name=Gil-Ordonez2018><pubmed>30059673</pubmed></ref><ref name=Hao2024><pubmed>38428273</pubmed></ref>。 | ||
== 関連用語 == | == 関連用語 == | ||
2025年4月8日 (火) 21:36時点における版
少作隆子(北陸大学 医療保健学部 理学療法学科) 橋本谷祐輝(同志社大学大学院 脳科学研究科 シナプス分子機能部門)
英:monoacylglycerol lipase 英略語:MGL
モノアシルグリセロールリパーゼは、モノアシルグリセロールの長鎖脂肪酸を加水分解する酵素である。最初は、脂肪の分解に必要な酵素として注目された。その後、神経調節因子として働くエンドカンナビノイドの1つ2-AG(2-arachidonylglycerol)を分解する主要な酵素であることが判明した。2-AGはシナプス後ニューロンから放出され、シナプス前終末のCB1受容体に作用し神経伝達物質の放出を抑制する。このようなエンドカンナビノイドを介するシナプス伝達の調節(カンナビノイド系)は記憶・学習、不安、痛みなど様々な脳機能に関与している。また、MGLが2-AGを分解するとアラキドン酸が放出されることから、プロスタグランジンの生合成にも関与することが明らかとなった。よって、MGLはカンナビノイド系およびプロスタグランジ系の働きに影響をおよぼす可能性があり、MGLをターゲットとした治療薬の開発が進められている。
イントロダクション
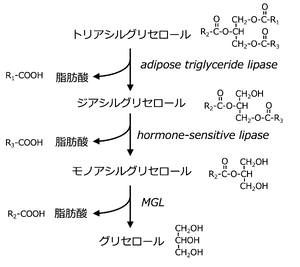
モノアシルグリセロールリパーゼの研究は、最初は脂肪の分解に必要な酵素として注目されたことに始まる(図1)。空腹時には動物はエネルギー源として脂肪を利用する。この時に脂肪組織ではトリアシルグリセロール(triacylglycerol:TG)の脂肪酸が切り離されジアシルグルセロール(diacylglycerol:DG)、モノアシルグリセロール(monoacylglycerol; MG)となり、最終的にはグリセロールと脂肪酸にまで分解される。この最終段階に働くMGを分解する酵素の同定が試みられた。Tornqvistらは1976年にラットの脂肪組織よりMGを加水分解する酵素MGLの抽出に成功した[1]。彼らはSDSゲル電気泳動の結果より分子量は32900と推定し、基質特異性としては、TGやDGには作用せずMG特異性が高いこと、MGであれば脂肪酸の結合位置がグリセロールのどの位置であっても分解できることを報告した。同グループは1997年にマウス脂肪組織のcDNAライブラリーからMGLをクローニングし、そのアミノ酸配列を特定した[2]。また、MGLのmRNAの発現を調べ、MGLは脂肪組織のみならず脳を含む全身の組織で普遍的に発現されている酵素であることを明らかにした。同グループは2001年にはヒトのMGLのアミノ酸配列の特定にも成功した[3]。
MGLはその後カンナビノイド研究において注目を集めることとなった(図2)。カンナビノイド(cannabinoid)とは、大麻(学名はCannabis sativa)に含まれる精神神経作用を引き起こす物質およびその類似物質を合わせた総称名である。1964年に大麻に含まれる有効成分としてTHC(Δ9-tetrahydrocannabinol)が同定され、THCが結合する受容体(カンナビノイド受容体)として1990年にCB1受容体、1993年にはCB2受容体のアミノ酸配列が特定された。1992年にはカンナビノイド受容体の内因性リガンド(エンドカンナビノイド)としてアナンダミド(N-arachidonoylethanolamide)が、1995年には2-AG(2-arachidonylglycerol)が発見された。その後、エンドカンナビノイドの生合成および分解に関与する酵素群(図2)が次々と特定され、それと並行しエンドカンナビノイドの生理的役割(カンナビノイド系)が次第に明らかとなった[4]。この一連の研究の中で、2-AGの分解酵素としてのMGLの重要性が報告された。Piomelliらのグループが、2002年にラットのMGLのアミノ酸配列を特定するとともに、MGLが2-AGの分解の主要な酵素であることを証明した[5]。
MGLはさらにプロスタグランジンの生合成にも関与することが報告され、注目を集めた(図3)。プロスタグランジンの生合成に必要な遊離アラキドン酸を供給する経路としては、それまでは細胞膜リン脂質から脂肪酸鎖を遊離させる細胞質型ホスホリパーゼA2(cPLA2)を介する経路が重要と考えられていた。しかし2011年にNomuraとCravattらは、脳においては遊離アラキドン酸の産生にはPLA2よりもMGLを介した経路が主に働いていることを明らかにした[6]。
このようにMGLは脂肪の分解のみならずエンドカンナビノイド2-AGの分解やプロスタグランジンの生合成にも関与している。よってMGLに作用する薬剤はカンナビノイド系およびプロスタグランジ系を介して生理機能や病態生理機能に影響をおよぼす可能性があり、MGLをターゲットとした治療薬の開発が進められている[7][8]。
構造
アミノ酸303個(ラット)[5]から成る、活性部位にセリン残基があるserine hydrolaseスーパーファミリーに属する酵素である。またその2次構造からは、βシートの周りをαヘリックスが取り囲むα/β hydrolaseスーパーファミリーに属する酵素でもある[2][9]。MGLをコードする遺伝子MGLLは、ヒトでは3番目の染色体、マウスでは6番目の染色体に位置している。マウスおよびラットでは、触媒三残基はセリン(122番目)、アスパラギン酸(239番目)、ヒスチジン(269番目)と推定されている。MGLのアミノ酸配列はラットとマウス間では92%、ラット/マウスとヒト間では84%の同一性がみられる[9]。MGLの基質特異性およびMGL阻害剤の作用機序の解明のため、MGLの結晶化および三次元構造の解析が精力的に進められている[10]。
サブファミリー
MGLのサブファミリーは知られていない。しかし、ウエスタンブロッティングでは組織によりタンパク質のバンドが2本みられる場合があり、組織依存的なsplice variantがある可能性が示唆されている[5]。
組織および細胞内分布
MGLは全身の組織(脂肪組織、脳、肺、腎臓、心臓、脾臓、卵巣、精巣、骨格筋、肝臓、副腎など)に広く分布している。脳内でも大脳皮質、海馬、視床、小脳、線条体など広範に分布し、細胞タイプとしてはニューロンのみならずアストロサイトやオリゴデンドロサイトにも発現している[11][5][12]。ニューロンでは主にシナプス前終末に分布している[13][4]。
機能
分子機能
MGの長鎖脂肪酸を加水分解する酵素で、酵素番号はEC 3.1.1.23、系統名はglycerol-ester acylhydrolaseである。他の名称としてはmonoacylglycerolipase, monoglyceride lipase, monoglyceride hydrolase, monoacylglycerol hydrolase, monoglyceridyllipase, monoglyceridaseなどがある。
基質特異性としては、TGやDGには作用せずMG特異性が高いこと、MGであれば脂肪酸の長さや飽和度は関係せず、脂肪酸の結合位置がグリセロールのどの位置であっても分解できることが報告されている[14]。
阻害剤としては、最初にURB602 [15] とURB754[16](但しURB754のMGL阻害作用はその後否定された[17][18])が、次に選択性がより高く低濃度で有効なJZL184[19]が報告され、多くの動物実験で使用された。その後、KML29、MJN110、JW651、Lu AG06466(またはABX-1431)などのさらに改良されたMGL阻害剤が次々と報告され、動物実験のみならず、一部は人を対象とした臨床研究においても使用されている[20][9][21]。
個体での機能
細胞に蓄積された脂肪の分解
脂肪細胞など細胞内にTGを貯蔵している細胞においては、空腹時などにはTGが分解されDGを経てMGが蓄積する。MGLはそれをさらに脂肪酸とグリセロールにまで分解する。
エンドカンナビノイド2-AGの分解
神経活動により細胞内Ca2+濃度上昇やGq/11共役型受容体の活性化が起こると、それぞれ単独または両者の相乗効果により2-AGが生成され細胞外に放出される[22](図4)。生合成に関与する酵素であるホスホリパーゼCβ(PLCβ)やジアシルグリセロールリパーゼα(DGLα)はシナプス後側にあり、2-AGはシナプス後ニューロンより放出される。放出された2-AGはシナプス前終末のCB1受容体に結合し神経伝達物質の放出を抑制する。このような2-AGによるシナプス伝達調節機構は脳の多くの領域でみられ、記憶・学習、不安、痛みなど様々な脳機能に関与している。2-AGには、伝達物質の放出抑制およびその他のメカニズムを介して、脳を保護する作用もある。さらに、2-AGはCB2受容体にも作用する。CB2受容体は主にマクロファージなどの免疫系の細胞に多く発現されており、2-AGはCB2受容体を介して免疫系にも影響をおよぼす。
2-AGを不活性化させる経路としては、加水分解経路と酸化経路がある。加水分解経路として最も重要なものがMGLである[5][23][24] 。MGLは脳ではシナプス前終末に多く存在し(図4)、その活性は2-AGシグナルの作用時間および作用強度に大きな影響をおよぼす[17][25]。MGL以外の加水分解酵素としてはα/β-hydrolase domain-containing 6(ABHD6)やABHD12 などがある[26][23][27][28]。脳での2-AGの加水分解に対する寄与率を調べた研究では、MGLが85%で、ABHD6とABHD12を合わせて15%と報告されている[26]。また、この論文では3つの2-AG加水分解酵素の細胞内局在に違いがあることから、3つの酵素がそれぞれ異なる2-AGプールに作用する可能性が示唆されている。酸化経路を担う酵素としてはシクロオキシゲナーゼ(COX)-2やリポキシゲナーゼ(LOX)があり、それによりプロスタグランジンE2グリセロールエステル(PGE2-G)、12-ヒドロキシエイコサテトラエン酸グリセロールエステル(12-HETE-G)、15-ヒドロキシエイコサテトラエン酸グリセロールエステル(15-HETE-G)などの新たなシグナルが生成される[8][24]。
プロスタグランジンの生合成
プロスタグランジンは多様な生理機能、病態生理機能に関わっている。その生合成に必要な遊離アラキドン酸を供給する経路としては、cPLA2を介する経路とMGLを介する経路がある。どの経路がより重要であるのかは組織あるいは細胞の種類により異なり、脳においてはMGLの経路が重要であると考えられている[6]。リポ多糖類(LPS)投与による発熱モデルを用い、LPSにより誘発される視床下部でのプロスタグランジンE2の生成や発熱にはMGLが必要であることが証明された[29]。
疾患との関わり
MGLをターゲットとした治療薬の開発が進んでいる。研究の多くはまだ動物実験段階であるが、一部は人を対象とした臨床研究に進んでいる。MGLを阻害するとカンナビノイド系とプロスタグラン系の両方が影響を受けるが、どちらがより影響を受けるのかは組織あるいは部位により異なる[30]。
鎮痛作用、脳保護作用、神経変性疾患の症状軽減作用
動物実験においては、MGL阻害剤の投与により、鎮痛作用[15][31]や脳保護作用[32]、およびパーキンソン病[33]、アルツハイマー病[34]、多発性硬化症[35]などの神経変性疾患の症状を軽減する作用があることが報告されている。その作用機序については、多くの仮説が提唱されてはいるものの、まだ全貌解明には至っていない。MGL阻害剤の鎮痛作用については、CB1受容体を介した中脳水道周囲灰白質からの下行性痛覚抑制系の活性化の関与が示唆されている[15][36]。脳保護作用や神経変性疾患の症状軽減作用については、CB1受容体を介する興奮性伝達物質グルタミン酸の過剰な放出の抑制が関与する可能性が報告されている[37]。また、ミクログリアのCB2受容体の活性化や、アラキドン酸やプロスタグランジンの減少による炎症の軽減などが関与する可能性も考えられる[7]。
一方、人を対象とした臨床試験においては、期待されるような改善効果はまだ得られていない。最も研究が進んでいる薬の1つはLu-AG06466(別名はABX-1431 )であり、臨床試験第1相を終え第2相に進んだものもある。対象疾患としては、トゥレット症候群、心的外傷後ストレス障害、多発性硬化症などである[8]。しかし、トゥレット症候群に対するLu-AG06466の効果が調べられた研究において、短期間の投与の効果を調べた第1相試験では改善効果がみられたものの、12週間の長期投与の効果を調べた第2相試験では効果がみられなかったことが報告されている[38][39]。
抗がん作用
動物実験において、カンナビノイドに抗がん作用があることが報告されている。そこで、カンナビノイドを直接投与する方法の他に、MGLの阻害により生体内のカンナビノイド濃度を高める方法が試みられるようになった。動物実験では、MGL欠損マウスではガンの増殖が促進される[40]などの矛盾する結果もあるものの、MGL阻害剤(主にJZL184を使用)に抗がん作用があることを示す論文は多い[41]。その作用機序としては、2-AGによるカンナビノイド受容体の活性化を介するものの他に、MGL阻害剤によりガンを促進させる作用のある脂肪酸が減少することが関与する可能性も指摘されている[6][41]。 ヒトのガン細胞のMGL活性と生存率との関係を調べた研究は多いが、一致した結果は得られていない[41]。
抗不安作用
カンナビノイド系はCB1受容体を介して扁桃体活動に影響を及ぼし、不安の調節に関与していると考えられており[42]、カンナビノイド受容体やエンドカンナビノイド分解酵素に作用する薬剤の抗不安作用が調べられてきた[21]。動物実験では、アナンダミドの分解酵素であるFAAH(fatty acid amide hydrolase)の阻害剤および2-AG分解酵素MGLの阻害剤の両方について、抗不安作用があることが報告されている。FAAH阻害剤については人を対象とした臨床研究の第2相段階に進んでいるものもあるが、MGL阻害剤はまだ臨床研究には至っていない。
問題点および将来の展望
カンナビノイド系を活性化させる目的でMGL阻害剤を使用する場合は注意が必要である。MGLが阻害されると、2-AG濃度は上昇しCB1受容体を介する作用は亢進すると期待される。しかしそれが長期間続くとCB1受容体の脱感作あるいは発現量の低下が起こり、結果としてカンナビノイド系は機能しなくなる可能性がある。例えば、MGL欠損動物ではCB1受容体の脱感作によりカンナビノイド系によるシナプス可塑性が障害されることが報告されている[8][43][44]。これらの問題を回避するため、作用が可逆的なものや血液脳関門を通らずに末梢でのみ作用するものなど、新しいMGL阻害剤の開発が今も進められている[45][46]。
関連用語
参考文献
- ↑
Tornqvist, H., & Belfrage, P. (1976).
Purification and some properties of a monoacylglycerol-hydrolyzing enzyme of rat adipose tissue. The Journal of biological chemistry, 251(3), 813-9. [PubMed:1249056] [WorldCat] - ↑ 2.0 2.1
Karlsson, M., Contreras, J.A., Hellman, U., Tornqvist, H., & Holm, C. (1997).
cDNA cloning, tissue distribution, and identification of the catalytic triad of monoglyceride lipase. Evolutionary relationship to esterases, lysophospholipases, and haloperoxidases. The Journal of biological chemistry, 272(43), 27218-23. [PubMed:9341166] [WorldCat] [DOI] - ↑
Karlsson, M., Reue, K., Xia, Y.R., Lusis, A.J., Langin, D., Tornqvist, H., & Holm, C. (2001).
Exon-intron organization and chromosomal localization of the mouse monoglyceride lipase gene. Gene, 272(1-2), 11-8. [PubMed:11470505] [WorldCat] [DOI] - ↑ 4.0 4.1
Kano, M., Ohno-Shosaku, T., Hashimotodani, Y., Uchigashima, M., & Watanabe, M. (2009).
Endocannabinoid-mediated control of synaptic transmission. Physiological reviews, 89(1), 309-80. [PubMed:19126760] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4
Dinh, T.P., Carpenter, D., Leslie, F.M., Freund, T.F., Katona, I., Sensi, S.L., ..., & Piomelli, D. (2002).
Brain monoglyceride lipase participating in endocannabinoid inactivation. Proceedings of the National Academy of Sciences of the United States of America, 99(16), 10819-24. [PubMed:12136125] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Nomura, D.K., Morrison, B.E., Blankman, J.L., Long, J.Z., Kinsey, S.G., Marcondes, M.C., ..., & Cravatt, B.F. (2011).
Endocannabinoid hydrolysis generates brain prostaglandins that promote neuroinflammation. Science (New York, N.Y.), 334(6057), 809-13. [PubMed:22021672] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Chen, C. (2023).
Inhibiting degradation of 2-arachidonoylglycerol as a therapeutic strategy for neurodegenerative diseases. Pharmacology & therapeutics, 244, 108394. [PubMed:36966972] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Maccarrone, M., Di Marzo, V., Gertsch, J., Grether, U., Howlett, A.C., Hua, T., ..., & van der Stelt, M. (2023).
Goods and Bads of the Endocannabinoid System as a Therapeutic Target: Lessons Learned after 30 Years. Pharmacological reviews, 75(5), 885-958. [PubMed:37164640] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Scalvini, L., Piomelli, D., & Mor, M. (2016).
Monoglyceride lipase: Structure and inhibitors. Chemistry and physics of lipids, 197, 13-24. [PubMed:26216043] [PMC] [WorldCat] [DOI] - ↑
Labar, G., Bauvois, C., Borel, F., Ferrer, J.L., Wouters, J., & Lambert, D.M. (2010).
Crystal structure of the human monoacylglycerol lipase, a key actor in endocannabinoid signaling. Chembiochem : a European journal of chemical biology, 11(2), 218-27. [PubMed:19957260] [WorldCat] [DOI] - ↑
Baggelaar, M.P., van Esbroeck, A.C., van Rooden, E.J., Florea, B.I., Overkleeft, H.S., Marsicano, G., ..., & van der Stelt, M. (2017).
Chemical Proteomics Maps Brain Region Specific Activity of Endocannabinoid Hydrolases. ACS chemical biology, 12(3), 852-861. [PubMed:28106377] [WorldCat] [DOI] - ↑
Viader, A., Ogasawara, D., Joslyn, C.M., Sanchez-Alavez, M., Mori, S., Nguyen, W., ..., & Cravatt, B.F. (2016).
A chemical proteomic atlas of brain serine hydrolases identifies cell type-specific pathways regulating neuroinflammation. eLife, 5, e12345. [PubMed:26779719] [PMC] [WorldCat] [DOI] - ↑
Gulyas, A.I., Cravatt, B.F., Bracey, M.H., Dinh, T.P., Piomelli, D., Boscia, F., & Freund, T.F. (2004).
Segregation of two endocannabinoid-hydrolyzing enzymes into pre- and postsynaptic compartments in the rat hippocampus, cerebellum and amygdala. The European journal of neuroscience, 20(2), 441-58. [PubMed:15233753] [WorldCat] [DOI] - ↑
Vandevoorde, S., Saha, B., Mahadevan, A., Razdan, R.K., Pertwee, R.G., Martin, B.R., & Fowler, C.J. (2005).
Influence of the degree of unsaturation of the acyl side chain upon the interaction of analogues of 1-arachidonoylglycerol with monoacylglycerol lipase and fatty acid amide hydrolase. Biochemical and biophysical research communications, 337(1), 104-9. [PubMed:16181610] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
Hohmann, A.G., Suplita, R.L., Bolton, N.M., Neely, M.H., Fegley, D., Mangieri, R., ..., & Piomelli, D. (2005).
An endocannabinoid mechanism for stress-induced analgesia. Nature, 435(7045), 1108-12. [PubMed:15973410] [WorldCat] [DOI] - ↑
Makara, J.K., Mor, M., Fegley, D., Szabó, S.I., Kathuria, S., Astarita, G., ..., & Piomelli, D. (2005).
Selective inhibition of 2-AG hydrolysis enhances endocannabinoid signaling in hippocampus. Nature neuroscience, 8(9), 1139-41. [PubMed:16116451] [WorldCat] [DOI] - ↑ 17.0 17.1
Hashimotodani, Y., Ohno-Shosaku, T., & Kano, M. (2007).
Presynaptic monoacylglycerol lipase activity determines basal endocannabinoid tone and terminates retrograde endocannabinoid signaling in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(5), 1211-9. [PubMed:17267577] [PMC] [WorldCat] [DOI] - ↑
Saario, S.M., Palomäki, V., Lehtonen, M., Nevalainen, T., Järvinen, T., & Laitinen, J.T. (2006).
URB754 has no effect on the hydrolysis or signaling capacity of 2-AG in the rat brain. Chemistry & biology, 13(8), 811-4. [PubMed:16931330] [WorldCat] [DOI] - ↑
Long, J.Z., Nomura, D.K., & Cravatt, B.F. (2009).
Characterization of monoacylglycerol lipase inhibition reveals differences in central and peripheral endocannabinoid metabolism. Chemistry & biology, 16(7), 744-53. [PubMed:19635411] [PMC] [WorldCat] [DOI] - ↑
Deng, H., & Li, W. (2020).
Monoacylglycerol lipase inhibitors: modulators for lipid metabolism in cancer malignancy, neurological and metabolic disorders. Acta pharmaceutica Sinica. B, 10(4), 582-602. [PubMed:32322464] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Zhao, H., Liu, Y., Cai, N., Liao, X., Tang, L., & Wang, Y. (2024).
Endocannabinoid Hydrolase Inhibitors: Potential Novel Anxiolytic Drugs. Drug design, development and therapy, 18, 2143-2167. [PubMed:38882045] [PMC] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., Tsubokawa, H., Ogata, H., Emoto, K., Maejima, T., ..., & Kano, M. (2005).
Phospholipase Cbeta serves as a coincidence detector through its Ca2+ dependency for triggering retrograde endocannabinoid signal. Neuron, 45(2), 257-68. [PubMed:15664177] [WorldCat] [DOI] - ↑ 23.0 23.1
Dinh, T.P., Kathuria, S., & Piomelli, D. (2004).
RNA interference suggests a primary role for monoacylglycerol lipase in the degradation of the endocannabinoid 2-arachidonoylglycerol. Molecular pharmacology, 66(5), 1260-4. [PubMed:15272052] [WorldCat] [DOI] - ↑ 24.0 24.1
Vandevoorde, S., & Lambert, D.M. (2007).
The multiple pathways of endocannabinoid metabolism: a zoom out. Chemistry & biodiversity, 4(8), 1858-81. [PubMed:17712823] [WorldCat] [DOI] - ↑
Tanimura, A., Uchigashima, M., Yamazaki, M., Uesaka, N., Mikuni, T., Abe, M., ..., & Kano, M. (2012).
Synapse type-independent degradation of the endocannabinoid 2-arachidonoylglycerol after retrograde synaptic suppression. Proceedings of the National Academy of Sciences of the United States of America, 109(30), 12195-200. [PubMed:22783023] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Blankman, J.L., Simon, G.M., & Cravatt, B.F. (2007).
A comprehensive profile of brain enzymes that hydrolyze the endocannabinoid 2-arachidonoylglycerol. Chemistry & biology, 14(12), 1347-56. [PubMed:18096503] [PMC] [WorldCat] [DOI] - ↑
Muccioli, G.G., Xu, C., Odah, E., Cudaback, E., Cisneros, J.A., Lambert, D.M., ..., & Stella, N. (2007).
Identification of a novel endocannabinoid-hydrolyzing enzyme expressed by microglial cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(11), 2883-9. [PubMed:17360910] [PMC] [WorldCat] [DOI] - ↑
Saario, S.M., Savinainen, J.R., Laitinen, J.T., Järvinen, T., & Niemi, R. (2004).
Monoglyceride lipase-like enzymatic activity is responsible for hydrolysis of 2-arachidonoylglycerol in rat cerebellar membranes. Biochemical pharmacology, 67(7), 1381-7. [PubMed:15013854] [WorldCat] [DOI] - ↑
Kita, Y., Yoshida, K., Tokuoka, S.M., Hamano, F., Yamazaki, M., Sakimura, K., ..., & Shimizu, T. (2015).
Fever Is Mediated by Conversion of Endocannabinoid 2-Arachidonoylglycerol to Prostaglandin E2. PloS one, 10(7), e0133663. [PubMed:26196692] [PMC] [WorldCat] [DOI] - ↑
Martínez-Torres, S., Cutando, L., Pastor, A., Kato, A., Sakimura, K., de la Torre, R., ..., & Ozaita, A. (2019).
Monoacylglycerol lipase blockade impairs fine motor coordination and triggers cerebellar neuroinflammation through cyclooxygenase-2. Brain, behavior, and immunity, 81, 399-409. [PubMed:31251974] [WorldCat] [DOI] - ↑
Kinsey, S.G., Long, J.Z., O'Neal, S.T., Abdullah, R.A., Poklis, J.L., Boger, D.L., ..., & Lichtman, A.H. (2009).
Blockade of endocannabinoid-degrading enzymes attenuates neuropathic pain. The Journal of pharmacology and experimental therapeutics, 330(3), 902-10. [PubMed:19502530] [PMC] [WorldCat] [DOI] - ↑
Arimura, N., Maeda, C., Aoyama, K., Yamaguchi, N., Sugiura, A., Takahashi, Y., ..., & Tanaka, M. (2024).
Compound 4f, a novel brain-penetrant reversible monoacylglycerol inhibitor, ameliorates neuroinflammation, neuronal cell loss, and cognitive impairment in mice with kainic acid-induced neurodegeneration. PloS one, 19(11), e0312090. [PubMed:39570850] [PMC] [WorldCat] [DOI] - ↑
Nomura, D.K., Long, J.Z., Niessen, S., Hoover, H.S., Ng, S.W., & Cravatt, B.F. (2010).
Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis. Cell, 140(1), 49-61. [PubMed:20079333] [PMC] [WorldCat] [DOI] - ↑
Chen, R., Zhang, J., Wu, Y., Wang, D., Feng, G., Tang, Y.P., ..., & Chen, C. (2012).
Monoacylglycerol lipase is a therapeutic target for Alzheimer's disease. Cell reports, 2(5), 1329-39. [PubMed:23122958] [PMC] [WorldCat] [DOI] - ↑
Hernández-Torres, G., Cipriano, M., Hedén, E., Björklund, E., Canales, Á., Zian, D., ..., & López-Rodríguez, M.L. (2014).
A reversible and selective inhibitor of monoacylglycerol lipase ameliorates multiple sclerosis. Angewandte Chemie (International ed. in English), 53(50), 13765-70. [PubMed:25298214] [WorldCat] [DOI] - ↑
Lau, B.K., & Vaughan, C.W. (2014).
Descending modulation of pain: the GABA disinhibition hypothesis of analgesia. Current opinion in neurobiology, 29, 159-64. [PubMed:25064178] [WorldCat] [DOI] - ↑
Monory, K., Massa, F., Egertová, M., Eder, M., Blaudzun, H., Westenbroek, R., ..., & Lutz, B. (2006).
The endocannabinoid system controls key epileptogenic circuits in the hippocampus. Neuron, 51(4), 455-66. [PubMed:16908411] [PMC] [WorldCat] [DOI] - ↑
Müller-Vahl, K.R., Fremer, C., Beals, C., Ivkovic, J., Loft, H., & Schindler, C. (2021).
Monoacylglycerol Lipase Inhibition in Tourette Syndrome: A 12-Week, Randomized, Controlled Study. Movement disorders : official journal of the Movement Disorder Society, 36(10), 2413-2418. [PubMed:34117788] [WorldCat] [DOI] - ↑
Müller-Vahl, K.R., Fremer, C., Beals, C., Ivkovic, J., Loft, H., & Schindler, C. (2022).
Endocannabinoid Modulation Using Monoacylglycerol Lipase Inhibition in Tourette Syndrome: A Phase 1 Randomized, Placebo-Controlled Study. Pharmacopsychiatry, 55(3), 148-156. [PubMed:34847610] [PMC] [WorldCat] [DOI] - ↑
Liu, R., Wang, X., Curtiss, C., Landas, S., Rong, R., Sheikh, M.S., & Huang, Y. (2018).
Monoglyceride lipase gene knockout in mice leads to increased incidence of lung adenocarcinoma. Cell death & disease, 9(2), 36. [PubMed:29348400] [PMC] [WorldCat] [DOI] - ↑ 41.0 41.1 41.2
Ramer, R., Wittig, F., & Hinz, B. (2021).
The Endocannabinoid System as a Pharmacological Target for New Cancer Therapies. Cancers, 13(22). [PubMed:34830856] [PMC] [WorldCat] [DOI] - ↑
Viveros, M.P., Marco, E.M., & File, S.E. (2005).
Endocannabinoid system and stress and anxiety responses. Pharmacology, biochemistry, and behavior, 81(2), 331-42. [PubMed:15927244] [WorldCat] [DOI] - ↑
Petrenko, A.B., Yamazaki, M., Sakimura, K., Kano, M., & Baba, H. (2014).
Augmented tonic pain-related behavior in knockout mice lacking monoacylglycerol lipase, a major degrading enzyme for the endocannabinoid 2-arachidonoylglycerol. Behavioural brain research, 271, 51-8. [PubMed:24906199] [WorldCat] [DOI] - ↑
Schlosburg, J.E., Blankman, J.L., Long, J.Z., Nomura, D.K., Pan, B., Kinsey, S.G., ..., & Cravatt, B.F. (2010).
Chronic monoacylglycerol lipase blockade causes functional antagonism of the endocannabinoid system. Nature neuroscience, 13(9), 1113-9. [PubMed:20729846] [PMC] [WorldCat] [DOI] - ↑
Gil-Ordóñez, A., Martín-Fontecha, M., Ortega-Gutiérrez, S., & López-Rodríguez, M.L. (2018).
Monoacylglycerol lipase (MAGL) as a promising therapeutic target. Biochemical pharmacology, 157, 18-32. [PubMed:30059673] [WorldCat] [DOI] - ↑
Hao, Q., Shi, J., Zhang, Z., Yang, G., Zhi, Y., Wang, K., ..., & Wang, J. (2024).
Discovery of a novel class of reversible monoacylglycerol lipase inhibitors for potential treatment of depression. European journal of medicinal chemistry, 268, 116285. [PubMed:38428273] [WorldCat] [DOI]