「サイクリックGMP依存性タンパク質リン酸化酵素」の版間の差分
細 →構造 |
|||
| 11行目: | 11行目: | ||
== 構造 == | == 構造 == | ||
PKGは、活性化を制御する[[調節ドメイン]]と、[[基質]]の[[リン酸化]]を担う[[触媒ドメイン]]から構成される('''図1''')。調節ドメインには、cGMPとの結合により構造変化を引き起こす2つの[[環状ヌクレオチド結合部位]](CNB-AとCNB-B)が存在する。このうちCNB-AにはcGMPおよび[[cAMP]]の両方が結合するが、CNB-BはcGMPに対しcAMPの200-500倍高い選択性を有する<ref name=Huang2014><pubmed>24239458</pubmed></ref><ref name=Kim2021><pubmed>33271627</pubmed></ref>1,2。また、cGMPの親和性は、PKG I ではCNB-AのほうがBよりも約10倍親和性が高いが、PKG IIではほぼ同じである2。同領域には[[自己阻害ドメイン]](Autoinhibition domain)が含まれ、CNBへのcGMPの結合によってこの[自己阻害]]が解除され、触媒ドメインの活性化が引き起こされる<ref name=Sharma2022><pubmed>35929723</pubmed></ref>3。触媒ドメインには基質認識部位と[[ATP]]結合ポケットがあり、基質認識部位によって認識されたセリン/スレオニン残基にATPからリン酸基を転移する。 | |||
PKGのN末端には[[ロイシンジッパー]](Leucine zipper)と呼ばれる二量体化ドメインがあり、これによってホモ二量体を形成する<ref name=Wolfertstetter2013><pubmed>24275951</pubmed></ref>4。二量体化はPKGの構造安定化および基質への結合効率に寄与している。また、PKG IIのN末端ドメインは[[ミリストイル化]]シグナルを有するため、PKG IIは細胞膜に局在する<ref name=Vaandrager1996><pubmed>8636133</pubmed></ref>5。 | |||
== ファミリー == | == ファミリー == | ||
2025年4月23日 (水) 09:19時点における版
英語名:cGMP-dependent protein kinaseまたはProtein kinase G, PKG
cGMP依存性タンパク質リン酸化酵素(PKG)は、環状グアノシン一リン酸(cGMP)に依存して活性化されるセリン/スレオニン特異的タンパク質リン酸化酵素のひとつで、心血管系、神経系、消化管、骨組織など多くの器官において、細胞内シグナル伝達の重要な調節因子として機能するタンパク質である。
cGMP依存性タンパク質リン酸化酵素とは
cGMP依存性タンパク質リン酸化酵素(PKG)は、環状グアノシン一リン酸(cyclic GMP, cGMP)によって活性化されるセリン/スレオニン特異的タンパク質リン酸化酵素であり、細胞内シグナル伝達の重要な制御因子として機能する。PKGはPKG I(IαおよびIβ)とPKG IIのアイソフォームに分類され、それぞれ異なる組織に特異的に発現する。活性化は、可溶性グアニル酸シクラーゼ(soluble guanylate cyclase, sGC)または膜結合型グアニル酸シクラーゼ(particulate guanylate cyclase, pGC)によるcGMP産生により引き起こされる。主な機能として、血管平滑筋弛緩、心筋の拍動調節、上皮細胞からの分泌制御、骨形成、神経可塑性の調節などがあり、細胞質および細胞膜近傍における多様なシグナル調節に関与している。
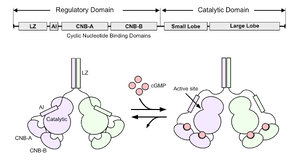
A. PKG Iのドメイン構造。LZ: leucine zipper, AI: autoinhibitory domain.
B. PKGの活性化機構。サイクリックヌクレオチド結合ドメイン(CNB)へのcGMPの結合により自己抑制ドメイン(AI)が触媒ドメインから外れ、PKGが活性化する。
構造
PKGは、活性化を制御する調節ドメインと、基質のリン酸化を担う触媒ドメインから構成される(図1)。調節ドメインには、cGMPとの結合により構造変化を引き起こす2つの環状ヌクレオチド結合部位(CNB-AとCNB-B)が存在する。このうちCNB-AにはcGMPおよびcAMPの両方が結合するが、CNB-BはcGMPに対しcAMPの200-500倍高い選択性を有する[1][2]1,2。また、cGMPの親和性は、PKG I ではCNB-AのほうがBよりも約10倍親和性が高いが、PKG IIではほぼ同じである2。同領域には自己阻害ドメイン(Autoinhibition domain)が含まれ、CNBへのcGMPの結合によってこの[自己阻害]]が解除され、触媒ドメインの活性化が引き起こされる[3]3。触媒ドメインには基質認識部位とATP結合ポケットがあり、基質認識部位によって認識されたセリン/スレオニン残基にATPからリン酸基を転移する。
PKGのN末端にはロイシンジッパー(Leucine zipper)と呼ばれる二量体化ドメインがあり、これによってホモ二量体を形成する[4]4。二量体化はPKGの構造安定化および基質への結合効率に寄与している。また、PKG IIのN末端ドメインはミリストイル化シグナルを有するため、PKG IIは細胞膜に局在する[5]5。
ファミリー
PKGにはPKG IおよびIIの2つのアイソフォームが存在し、PKG Iはさらに選択的スプライシングによりIαとIβに分岐する。PKG Iβは、Iαに比べて約10倍高いcGMP濃度で活性化されるため、細胞内cGMP濃度の変動に対する感受性が異なる[6][7]6,7。PKG IとIIの全体のアミノ酸配列相同性は約75%と高く、ドメインごとに見ると、調節ドメインでは約60%、触媒ドメインでは約85%の相同性を示す。特に触媒ドメインは高度に保存されており、両アイソフォームに共通する基質認識とリン酸化機能を反映している。
発現
組織分布
PKGはアイソフォームごとに異なる組織分布を示しており、機能分化と密接に関係している。
| アイソフォーム | 主な発現部位 | 機能の例 |
|---|---|---|
| PKG Iα | 血管平滑筋や心筋 | 筋細胞の弛緩や拍動調節 |
| PKG Iβ | 神経細胞や腎臓 | 情報伝達やイオン恒常性 |
| PKG II | 腸管上皮細胞、骨細胞、脳 | 上皮分泌や骨形成、神経可塑性 |
細胞内分布
PKG Iは主に細胞質に分布するのに対し、PKG IIはN末端のミリストイル化により細胞膜に局在化し、膜近傍の標的分子に対して効率的に作用できるように適応している。
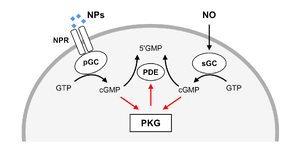
活性化・不活性化機構
PKGは、グアニル酸シクラーゼ(GC)によってグアノシン三リン酸(GTP)から産生されたcGMPによって活性化する。グアニル酸シクラーゼには、可溶性型(soluble GC, sGC)と膜結合型(particulate GC, pGC)の2種があり、それぞれ一酸化窒素(NO)およびナトリウム利尿ペプチド(NP)によって活性化される(図2)。cGMPは環状ヌクレオチドホスホジエステラーゼ(phosphodiesterase, PDE)によってグアノシン一リン酸(GMP)へと加水分解される。活性化されたPKGはPDEをリン酸化して活性化し、cGMPの分解を促進する。これにより、PKG活性が細胞内cGMP濃度を自ら低下させるネガティブフィードバック機構を構成する[8]8。一方、PKG IはN末端の自己阻害部位に自己リン酸化部位を持ち、自己リン酸化によって酵素活性を高める[9]9。これは、PKG Iの活性を持続させるポジティブフィードバック機構と考えられる。
NO-sGC経路
sGCはアルギニンを原料として一酸化窒素合成酵素(Nitric oxide synthase, NOS)によって産生されたNOを受容し、cGMPを産生する。この経路によって産生されたcGMPはPKG Iを活性化する[10]10。NOは膜透過性をもつガス状の二次メッセンジャー分子であり、産生した細胞から周辺細胞へと拡散することで同期的なPKG活性を誘導する。またニトロシル化等によってタンパク質の翻訳後修飾を引き起こす(脳科学辞典の一酸化窒素の項目へリンク)。神経細胞では、産生細胞に順向性に働くとともに、シナプス後細胞からシナプス前終末へと逆行性シグナルとして機能し、シナプス後細胞の活性に応じた前終末内PKG活性制御に寄与する[11]11。
NP-pGC経路
pGCはナトリウム利尿ペプチド(Natriuretic peptide, NP)の受容体であり、これにNPが結合することでcGMPが産生される[12]12。NPには心房型(Atrial NP, ANP)、脳型(Brain NP, BNP)、C型(C-type NP, CNP)の3種が存在し、ANPとBNPはそれぞれ主に心臓の心房と心室の筋細胞によって、CNPは主に血管内皮細胞で生産される[13]13。
基質と機能
PKGはセリン/スレオニン残基特異的タンパク質リン酸化酵素であり、細胞内のさまざまなタンパク質をリン酸化し、多岐にわたる生理機能を調節する。以下に、脳神経細胞など各身体部位における代表的な基質タンパク質とその役割について述べる。
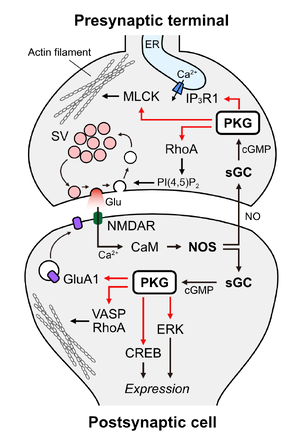
神経
神経細胞においてPKGは、シナプス前終末とシナプス後細胞で異なる機構を介して機能しており、それぞれ神経伝達の即時的な調整と、受容体発現や構造可塑性といった長期的な変化に寄与している。シナプス前終末ではPKG IがNO/cGMPシグナルを介してシナプス小胞の再利用や放出効率を調節し、シナプス後細胞ではPKG IIを中心に受容体リン酸化、遺伝子発現制御、細胞骨格再構築など多層的な調節が行われる(図3)。これによりシナプス機能の可塑性と学習・記憶の基盤を支えている。
シナプス前終末
シナプス後細胞から放出されるNOが逆行性シグナルとして機能し、シナプス前終末内のsGCを活性化することでcGMPの産生を促進する。増加したcGMPはPKGを活性化し、その結果、シナプス小胞のエンドサイトーシスが促進され、小胞の再利用が加速される。この機構はシナプス小胞の枯渇を防ぎ、高頻度のシナプス伝達を維持するために重要である[11]11。PKGの下流ではRhoA(Ras homolog family member A)および ROCK(Rho-associated coiled-coil-containing protein kinase)が機能しており、膜脂質であるPI(4,5)P2の増加を介して小胞エンドサイトーシスを加速する[11][14]11,14が、詳細なメカニズムは未解明である。また、末梢神経系ではPKG Iがイノシトール三リン酸受容体(IP3R1)およびミオシン軽鎖キナーゼ(MLCK)をリン酸化し、シナプス前終末におけるカルシウム動態やアクチン骨格を調節することで、神経伝達物質の放出確率を高める[15]15。
シナプス後細胞
PKGはシナプス伝達の長期増強(LTP)に関与している。グルタミン酸作動性シナプスでは、NMDAR/NO/cGMP経路を介して活性化したPKG IIがAMPA受容体サブユニットGluA1のC末端に結合してS845残基をリン酸化し、細胞表面上のGluA1レベルを増加させることによってLTPに寄与する[16]16。PKGはGABA作動性シナプスにおけるLTPにも関与するが、その詳細な分子機構は未解明である。
PKGは細胞内の転写・翻訳制御にも関与しており、ERK(細胞外シグナル調節キナーゼ)のリン酸化によるERK/MAPKカスケードの活性化を通じてタンパク合成を促進する。この機構は偏桃体外側核での恐怖記憶生成と関連している[17]17。また、PKGはCREB(cAMP応答配列結合タンパク質)を活性化し、転写レベルでのタンパク質合成を制御することで、シナプス可塑性や記憶形成に深く関与している[18]18。加えて、PKGは26Sプロテアソームを活性化することにより、不要または過剰なタンパク質の分解を促し、シナプスタンパク質の動的な制御にも寄与する[19]19。
さらに、PKGはVASP(Vasodilator-Stimulated Phosphoprotein)やRhoAのリン酸化を介してアクチン細胞骨格の再構築を誘導し、樹状突起スパインの構造的可塑性を制御する[20][21][22]20–22。
血管
PKGは血管平滑筋を弛緩させ、血管拡張を誘導する。平滑筋細胞の収縮は、細胞内カルシウム濃度の上昇によるミオシン軽鎖リン酸化酵素(MLCK)の活性化を介した、ミオシン分子とアクチン分子の結合・解離が繰り返すことで生じる。血管内皮細胞からNOが放出されると血管平滑筋細胞内へと拡散し、PKG Iを活性化する。活性化したPKG Iは、カリウムチャネルを介した過分極により細胞内カルシウムイオン濃度を下げ、平滑筋細胞の弛緩をもたらす[13][23]4,23。また、PKG IはMLC脱リン酸化酵素(MLCP)を活性化してミオシン軽鎖を脱リン酸化し、平滑筋細胞を弛緩させる4。その他にVASPやIRAG (IP3 Receptor Associated cGMP Kinase Substrate)、RhoAのリン酸化を介して平滑筋の弛緩を促進する[24][25]24,25。
心臓
心筋では、PKGはTroponin IやTitinのリン酸化を介して心筋細胞の収縮・弛緩バランスを調整している[10]10。NOやNPによるcGMPの増加によりPKGが活性化されると、非選択性カチオンチャネルであるTRPC6(Transient Receptor Potential Canonical 6)がリン酸化され、その活性が低下することで病的心肥大を引き起こす持続的なCa2+流入が抑制される[26] 26。また、トロポニンIやTitinなどの弾性構造タンパク質のリン酸化によって心筋の拡張能が向上することが報告されている[10]10。
腸
腸上皮細胞において、PKG IIはNHE3(Na+/H+ Exchanger 3)をリン酸化し、ナトリウム吸収を抑制し、腸液の分泌及び電解質バランスの調整に寄与している[27]27。また、嚢胞性線維性膜コンダクタンス制御因子(Cystic Fibrosis Transmembrane Conductance Regulator, CFTR)のリン酸化により、塩化物イオンの分泌や腸内環境の維持に関与していることが示唆されている[28]28。
疾患との関わり
PKGの変異は、いくつかの疾患の発症と関連している。例えば、PKG IをコードするPRKG1遺伝子の機能獲得型変異、特にp.Arg177Gln変異は、B型大動脈解離の発症と強く関連しており、変異保持者では発症年齢の若年化が認められ、解離の進展率は非変異群の3倍以上に達することが報告されている[29]29。Arg177はCNB-AドメインのcGMP結合ポケットに位置しており、この変異によりcGMP非存在下における自己抑制構造が不安定化し、基底状態でのPKG活性が異常に上昇することが原因と考えられている[30]30。一方、PKG IIをコードするPRKG2遺伝子のナンセンス変異は、アメリカン・アンガス牛の矮小症(dwarfism)の原因となることが報告されている[31]31。これは、骨端軟骨に発現するPKG IIが機能喪失し、軟骨細胞の成熟障害が起こるためと考えられる。
関連項目
参考文献
- ↑
Huang, G.Y., Kim, J.J., Reger, A.S., Lorenz, R., Moon, E.W., Zhao, C., ..., & Kim, C. (2014).
Structural basis for cyclic-nucleotide selectivity and cGMP-selective activation of PKG I. Structure (London, England : 1993), 22(1), 116-24. [PubMed:24239458] [PMC] [WorldCat] [DOI] - ↑
Kim, C., & Sharma, R. (2021).
Cyclic nucleotide selectivity of protein kinase G isozymes. Protein science : a publication of the Protein Society, 30(2), 316-327. [PubMed:33271627] [PMC] [WorldCat] [DOI] - ↑
Sharma, R., Kim, J.J., Qin, L., Henning, P., Akimoto, M., VanSchouwen, B., ..., & Kim, C. (2022).
An auto-inhibited state of protein kinase G and implications for selective activation. eLife, 11. [PubMed:35929723] [PMC] [WorldCat] [DOI] - ↑
Wolfertstetter, S., Huettner, J.P., & Schlossmann, J. (2013).
cGMP-Dependent Protein Kinase Inhibitors in Health and Disease. Pharmaceuticals (Basel, Switzerland), 6(2), 269-86. [PubMed:24275951] [PMC] [WorldCat] [DOI] - ↑
Vaandrager, A.B., Ehlert, E.M., Jarchau, T., Lohmann, S.M., & de Jonge, H.R. (1996).
N-terminal myristoylation is required for membrane localization of cGMP-dependent protein kinase type II. The Journal of biological chemistry, 271(12), 7025-9. [PubMed:8636133] [WorldCat] [DOI] - ↑
Richie-Jannetta, R., Busch, J.L., Higgins, K.A., Corbin, J.D., & Francis, S.H. (2006).
Isolated regulatory domains of cGMP-dependent protein kinase Ialpha and Ibeta retain dimerization and native cGMP-binding properties and undergo isoform-specific conformational changes. The Journal of biological chemistry, 281(11), 6977-84. [PubMed:16407222] [WorldCat] [DOI] - ↑
Busch, J.L., Bessay, E.P., Francis, S.H., & Corbin, J.D. (2002).
A conserved serine juxtaposed to the pseudosubstrate site of type I cGMP-dependent protein kinase contributes strongly to autoinhibition and lower cGMP affinity. The Journal of biological chemistry, 277(37), 34048-54. [PubMed:12080049] [WorldCat] [DOI] - ↑
Corbin, J.D., Turko, I.V., Beasley, A., & Francis, S.H. (2000).
Phosphorylation of phosphodiesterase-5 by cyclic nucleotide-dependent protein kinase alters its catalytic and allosteric cGMP-binding activities. European journal of biochemistry, 267(9), 2760-7. [PubMed:10785399] [WorldCat] [DOI] - ↑
Smith, J.A., Francis, S.H., Walsh, K.A., Kumar, S., & Corbin, J.D. (1996).
Autophosphorylation of type Ibeta cGMP-dependent protein kinase increases basal catalytic activity and enhances allosteric activation by cGMP or cAMP. The Journal of biological chemistry, 271(34), 20756-62. [PubMed:8702828] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Francis, S.H., Busch, J.L., Corbin, J.D., & Sibley, D. (2010).
cGMP-dependent protein kinases and cGMP phosphodiesterases in nitric oxide and cGMP action. Pharmacological reviews, 62(3), 525-63. [PubMed:20716671] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Eguchi, K., Nakanishi, S., Takagi, H., Taoufiq, Z., & Takahashi, T. (2012).
Maturation of a PKG-dependent retrograde mechanism for exoendocytic coupling of synaptic vesicles. Neuron, 74(3), 517-29. [PubMed:22578503] [WorldCat] [DOI] - ↑
Jehle, A., & Garaschuk, O. (2022).
The Interplay between cGMP and Calcium Signaling in Alzheimer's Disease. International journal of molecular sciences, 23(13). [PubMed:35806059] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Potter, L.R., Yoder, A.R., Flora, D.R., Antos, L.K., & Dickey, D.M. (2009).
Natriuretic peptides: their structures, receptors, physiologic functions and therapeutic applications. Handbook of experimental pharmacology, (191), 341-66. [PubMed:19089336] [PMC] [WorldCat] [DOI] - ↑
Taoufiq, Z., Eguchi, K., & Takahashi, T. (2013).
Rho-kinase accelerates synaptic vesicle endocytosis by linking cyclic GMP-dependent protein kinase activity to phosphatidylinositol-4,5-bisphosphate synthesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(29), 12099-104. [PubMed:23864695] [PMC] [WorldCat] [DOI] - ↑
Luo, C., Gangadharan, V., Bali, K.K., Xie, R.G., Agarwal, N., Kurejova, M., ..., & Kuner, R. (2012).
Presynaptically localized cyclic GMP-dependent protein kinase 1 is a key determinant of spinal synaptic potentiation and pain hypersensitivity. PLoS biology, 10(3), e1001283. [PubMed:22427743] [PMC] [WorldCat] [DOI] - ↑
Serulle, Y., Zhang, S., Ninan, I., Puzzo, D., McCarthy, M., Khatri, L., ..., & Ziff, E.B. (2007).
A GluR1-cGKII interaction regulates AMPA receptor trafficking. Neuron, 56(4), 670-88. [PubMed:18031684] [PMC] [WorldCat] [DOI] - ↑
Ota, K.T., Pierre, V.J., Ploski, J.E., Queen, K., & Schafe, G.E. (2008).
The NO-cGMP-PKG signaling pathway regulates synaptic plasticity and fear memory consolidation in the lateral amygdala via activation of ERK/MAP kinase. Learning & memory (Cold Spring Harbor, N.Y.), 15(10), 792-805. [PubMed:18832566] [PMC] [WorldCat] [DOI] - ↑
Bollen, E., Puzzo, D., Rutten, K., Privitera, L., De Vry, J., Vanmierlo, T., ..., & Prickaerts, J. (2014).
Improved long-term memory via enhancing cGMP-PKG signaling requires cAMP-PKA signaling. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 39(11), 2497-505. [PubMed:24813825] [PMC] [WorldCat] [DOI] - ↑
VerPlank, J.J.S., Tyrkalska, S.D., Fleming, A., Rubinsztein, D.C., & Goldberg, A.L. (2020).
cGMP via PKG activates 26S proteasomes and enhances degradation of proteins, including ones that cause neurodegenerative diseases. Proceedings of the National Academy of Sciences of the United States of America, 117(25), 14220-14230. [PubMed:32513741] [PMC] [WorldCat] [DOI] - ↑
Benz, P.M., Blume, C., Seifert, S., Wilhelm, S., Waschke, J., Schuh, K., ..., & Renné, T. (2009).
Differential VASP phosphorylation controls remodeling of the actin cytoskeleton. Journal of cell science, 122(Pt 21), 3954-65. [PubMed:19825941] [PMC] [WorldCat] [DOI] - ↑
Sunico, C.R., González-Forero, D., Domínguez, G., García-Verdugo, J.M., & Moreno-López, B. (2010).
Nitric oxide induces pathological synapse loss by a protein kinase G-, Rho kinase-dependent mechanism preceded by myosin light chain phosphorylation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(3), 973-84. [PubMed:20089906] [PMC] [WorldCat] [DOI] - ↑
Wang, H.G., Lu, F.M., Jin, I., Udo, H., Kandel, E.R., de Vente, J., ..., & Antonova, I. (2005).
Presynaptic and postsynaptic roles of NO, cGK, and RhoA in long-lasting potentiation and aggregation of synaptic proteins. Neuron, 45(3), 389-403. [PubMed:15694326] [WorldCat] [DOI] - ↑
Ko, E.A., Han, J., Jung, I.D., & Park, W.S. (2008).
Physiological roles of K+ channels in vascular smooth muscle cells. Journal of smooth muscle research = Nihon Heikatsukin Gakkai kikanshi, 44(2), 65-81. [PubMed:18552454] [WorldCat] [DOI] - ↑
Samuel, S., Zhang, K., Tang, Y.D., Gerdes, A.M., & Carrillo-Sepulveda, M.A. (2017).
Triiodothyronine Potentiates Vasorelaxation via PKG/VASP Signaling in Vascular Smooth Muscle Cells. Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology, 41(5), 1894-1904. [PubMed:28376489] [WorldCat] [DOI] - ↑
Ali, S., Solano, A.S., Gonzales, A.L., Thakore, P., Krishnan, V., Yamasaki, E., & Earley, S. (2021).
Nitric Oxide Signals Through IRAG to Inhibit TRPM4 Channels and Dilate Cerebral Arteries. Function (Oxford, England), 2(6), zqab051. [PubMed:34734188] [PMC] [WorldCat] [DOI] - ↑
Nishida, M., Saiki, S., Kitajima, N., Nakaya, M., Sato, Y., & Kurose, H. (2010).
[Regulation of cardiovascular functions by the phosphorylation of TRPC channels]. Yakugaku zasshi : Journal of the Pharmaceutical Society of Japan, 130(11), 1427-33. [PubMed:21048399] [WorldCat] [DOI] - ↑
Cha, B., Kim, J.H., Hut, H., Hogema, B.M., Nadarja, J., Zizak, M., ..., & Donowitz, M. (2005).
cGMP inhibition of Na+/H+ antiporter 3 (NHE3) requires PDZ domain adapter NHERF2, a broad specificity protein kinase G-anchoring protein. The Journal of biological chemistry, 280(17), 16642-50. [PubMed:15722341] [WorldCat] [DOI] - ↑
Li, C., & Naren, A.P. (2010).
CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integrative biology : quantitative biosciences from nano to macro, 2(4), 161-77. [PubMed:20473396] [PMC] [WorldCat] [DOI] - ↑
Shalhub, S., Regalado, E.S., Guo, D.C., Milewicz, D.M., & Montalcino Aortic Consortium (2019).
The natural history of type B aortic dissection in patients with PRKG1 mutation c.530G>A (p.Arg177Gln). Journal of vascular surgery, 70(3), 718-723. [PubMed:30871887] [WorldCat] [DOI] - ↑
Guo, D.C., Regalado, E., Casteel, D.E., Santos-Cortez, R.L., Gong, L., Kim, J.J., ..., & Milewicz, D.M. (2013).
Recurrent gain-of-function mutation in PRKG1 causes thoracic aortic aneurysms and acute aortic dissections. American journal of human genetics, 93(2), 398-404. [PubMed:23910461] [PMC] [WorldCat] [DOI] - ↑
Koltes, J.E., Mishra, B.P., Kumar, D., Kataria, R.S., Totir, L.R., Fernando, R.L., ..., & Reecy, J.M. (2009).
A nonsense mutation in cGMP-dependent type II protein kinase (PRKG2) causes dwarfism in American Angus cattle. Proceedings of the National Academy of Sciences of the United States of America, 106(46), 19250-5. [PubMed:19887637] [PMC] [WorldCat] [DOI]